Курсовая работа: Азотная кислота
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ТВЕРСКОЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет ______________________________
Кафедра________________________________
Курсовая работа
“Азотная кислота”
| Выполнил: | студент Х-Б-Г факультета | |
| Курс: | 1 | |
| Проверил: | Группа: | 16(2) |
| “_____”______________2001г. | Фамилия: | Лапшин Сергей |
Тверь
Содержание:
Содержание:...................................................................................... 2
Структура азотной кислоты............................................................. 3
Безводная азотная кислота............................................................... 3
Дымящая азотная кислота................................................................ 3
Строение кислоты с МВС................................................................. 3
Нитроний-ион.................................................................................... 4
Список литературы:.......................................................................... 7
Структура азотной кислоты
Азотная кислота имеет tпл.=–41,6ºC, tкип=–82,6ºC. Её плотность составляет 1,552 г/см3. С водой смешивается в любых соотношениях, образуя азеотроп (68,4% по массе HNO3 tкип=121,9ºC)
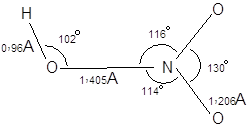 |
В газовой фазе молекула азотной имеет плоское строение. Вращение группы ОН относительно NO2 затруднено. В целом молекулу можно изобразить следующим образом: Безводная азотная кислота
Азотная кислота, не содержащая воды, является безводной. В ней протекают следующие равновесные процессы:
![]()
Чистая азотная кислота самоионизированна:
![]() ,
,
причем
мольная концентрация каждого вида частиц равна 0,51 моль/ л
при -10ºC. В твердом состоянии молекула кислоты представляет собой
гидроксид нитрония: ![]() .Интерес представляет собой взаимодействие азотной и
серной кислот:
.Интерес представляет собой взаимодействие азотной и
серной кислот:
![]() .
.
Отсюда видно, что азотная кислота амфотерна.
Дымящая азотная кислотаАзотную кислоту с концентрацией 97-99% часто называют дымящей. Дымящая азотная кислота при хранении разлагается:
![]()
![]()
Дымящая азотная кислота - сильный окислитель. Она способна поджечь скипидар и другие органические вещества.
Строение кислоты с МВСРассмотрим строение азотной кислоты с позиции метода валентных связей. Для этого посмотрим, какие орбитали принимают участие в образовании молекулы этой кислоты.
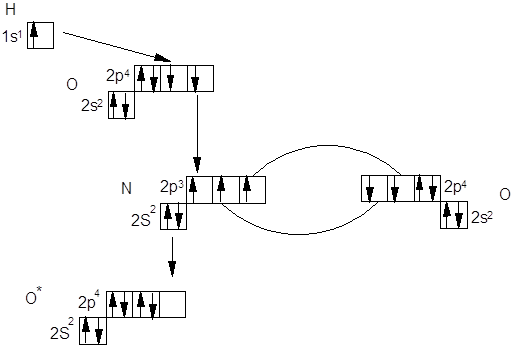
Таким образом азотную кислоту можно
представить в виде:
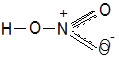 |
Однако современные методы исследования показали, что строение кислоты таково:
Отсюда видно, что молекула азотной кислоты имеет делокализованные связи.
Нитроний-ионЭтот
ион ![]() непосредственно возникает
не только при ионизации самой азотной кислоты, но и в реакциях нитрования или в
растворах окислов азота в этой кислоте и в других сильных кислотах.
непосредственно возникает
не только при ионизации самой азотной кислоты, но и в реакциях нитрования или в
растворах окислов азота в этой кислоте и в других сильных кислотах.
Ранние физические измерения, выполненные известным ученым Ганчем, свидетельствовали об ионизации HNO3 в серной кислоте:
HNO3+2H2SO4=H3NO32++2HSO4-.
Поздние исследования, проведенные Хьюзом, Ингольдом и другими учеными, показали, что предложения Ганча не вполне верно. Так, скорость нитрования бензола возрастает в 1000 раз при переходе от 80%-ных к 90%-ным растворам H2SO4. Подобные кинетические данные по нитрованию в растворах серной кислоты, нитрометана, и ледяной уксусной кислоты были объяснены тем, что атакующей частицей является - ион:
![]()
![]()
![]()
Важность ионизации первого типа подтверждается тем, что добавление ионизированных нитратов к реакционной смеси замедляет реакцию. Процесс нитрования можно представить в виде:
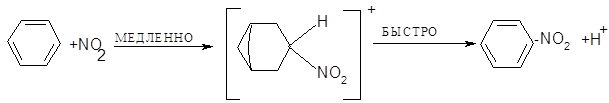
Окончательным подтверждением существования ионов нитрония явилось выделением солей нитрония. Соли содержат линейный катион:
Длина связи N-O составляет 110 пм. Выделение солей нитрония происходит следующим образом:
|
|
(1) |
|
|
(2) |
|
|
(3) |
Реакции
(1) и (2) представляют собой, в действительности, просто реакции обмена,
поскольку N2O5 в
твердом состоянии и в растворе безводных кислот существуют в виде ионов ![]() и
и ![]() . Реакция (3) представляет
собой реакцию ангидрида кислоты
. Реакция (3) представляет
собой реакцию ангидрида кислоты ![]() c
основанием
c
основанием ![]() .
.
Соли
нитрония - кристаллические вещества, термодинамически устойчивы,
но химически очень активны. Они быстро гидролизуются влагой воздуха; кроме
того, ![]() , например, бурно реагирует
с органическими веществами, однако в растворе нитробензола его можно использовать
для нитрования.
, например, бурно реагирует
с органическими веществами, однако в растворе нитробензола его можно использовать
для нитрования.
Соединения, содержащие нитроний-ион являются промежуточными соединениями при нитровании ароматических веществ.
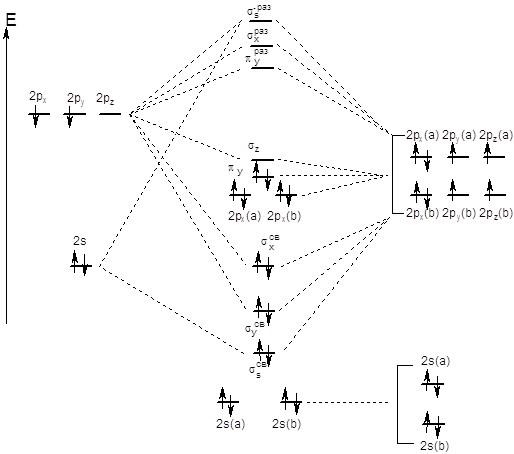
С метода молекулярных орбиталей нитроний-ион
выглядит так:
Список литературы:
1. Ахметов Н.С. Неорганическая химия. М.:Высшая школа 1975.
2. Карапетьянц М.Х. Дракин С.И. Общая и неорганическая химия. М.: Химия1994
3. Коттон Ф. Уилкинсон Дж. Современная неорганическая химия. том.2. М.: Мир.1969.
4. Реми Г. Курс неорганической химии. том 1. М.: Мир.1972.
5. Общая химия./Под редакцией Соколовской Е.М. и Гузея Л.С. М.: Московский университет.1989.
6. Химический энциклопедический словарь/ редакцией И.Л.Кнунянца. М.: Московская энциклопедия. 1983.