Учебное пособие: Активность. Порядок реакций
Раздел: Рефераты по химии
Тип: учебное пособие
1. Активность
Рассмотренные нами соотношения для
идеальных растворов не могут быть непосредственно использованы для вычисления
равновесия, в котором участвуют реальные растворы, в частности в реальных
растворах не выполняется один из основных законов химии – з. действия масс. При
подставлении в выражения для константы равновесия концентрации реагирующих
веществ константа равновесия оказывается не постоянно зависящей от
концентрации. В случае идеальных растворов из измерения одного из свойств
(давление пара) можно рассчитать все другие свойства. Желательно сохранить
такую возможность для реальных растворов. Решение было предложено Льюисом,
который ввел в теорию растворов так называемые т/д активности в качаестве ф-ии,
связывающей свойства равствора друг с другом и заменил концентрацию в реальных
растворах. Подставляя т/д активность в место концентрации, в т/д уравнение,
полученное для идеальных растворов делает последнее пригодным и для реальных
растворов. Т.о. активностью называется величина, подставляя которую вместо
концентрации в т/д уравнение делает последнее применимым для реальных
растворов, а – активность. После введения активного хим. потенциала i
определяется соотношением ![]() Bb+dD↔Mm+rR. Константу
равновесия определяет соотношение
Bb+dD↔Mm+rR. Константу
равновесия определяет соотношение ![]() . З. распределения, если раствор
3-го вещества нельзя считать идеальным
. З. распределения, если раствор
3-го вещества нельзя считать идеальным ![]() . Активность должна быть введена
таким образом чтобы в идеальных растворах она совпадала с концентрацией, а в
реальных растворах она должна характеризовать отклонение их от идеальных. По
Льюису активность выражается соотношением давление пара данного компонента над
реальным раствором к давлению пара этого компонента в некотором стандартном
состоянии
. Активность должна быть введена
таким образом чтобы в идеальных растворах она совпадала с концентрацией, а в
реальных растворах она должна характеризовать отклонение их от идеальных. По
Льюису активность выражается соотношением давление пара данного компонента над
реальным раствором к давлению пара этого компонента в некотором стандартном
состоянии ![]() .
Для растворимости в водных растворах для всех компонентов летучих жидких
смесей. В начале стандартного состояния берут состояние компонентов в чистом
виде и тогда при данной температуре
.
Для растворимости в водных растворах для всех компонентов летучих жидких
смесей. В начале стандартного состояния берут состояние компонентов в чистом
виде и тогда при данной температуре ![]()
![]() . В совершенном растворе
соотношение
. В совершенном растворе
соотношение ![]() =>
в идеальном растворе активность = концентрации
=>
в идеальном растворе активность = концентрации ![]() , в реальном растворе
, в реальном растворе ![]() . Степень
отклонения активности и концентрации определяется величиной коэффициента
активности
. Степень
отклонения активности и концентрации определяется величиной коэффициента
активности ![]() .
В идеальном растворе
.
В идеальном растворе ![]() , в реальном растворе может быть
> и < 1. В разбавленных растворах для растворителя выполняется закона
Рауля, а для растворов вещества з. Генри
, в реальном растворе может быть
> и < 1. В разбавленных растворах для растворителя выполняется закона
Рауля, а для растворов вещества з. Генри ![]() . Для растворённого вещества
стандартное состояние должно быть сделано таким образом, чтобы в растворе любой
концентрации соблюдался закон Генри
. Для растворённого вещества
стандартное состояние должно быть сделано таким образом, чтобы в растворе любой
концентрации соблюдался закон Генри ![]() ,
, ![]()
![]() .
.
Связи м/у активностями компонентов
Уравнение Дюгема-Маргулиса:
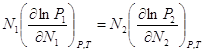 (1). Если раствор является
близким к совершенному, то
(1). Если раствор является
близким к совершенному, то ![]() , а
, а ![]() .
. ![]() ,
, ![]() . Продифиринцируем (
. Продифиринцируем (![]() и
и ![]() =const)
=const) 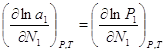 (2),
(2), 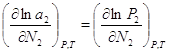 (3). Подставим
(3). Подставим 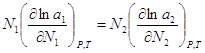 (4). Уравнение
(4) может быть обобщено на раствор, содержащий несколько компонентов:
(4). Уравнение
(4) может быть обобщено на раствор, содержащий несколько компонентов: 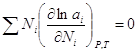 . Если раствор
близок к разбавленному
. Если раствор
близок к разбавленному ![]() для растворённого вещ-ва
для растворённого вещ-ва ![]() . Повторяя
действие, что и здесь справедливо уравнение (4). Для бинарного раствора
уравнение (4) имеет вид:
. Повторяя
действие, что и здесь справедливо уравнение (4). Для бинарного раствора
уравнение (4) имеет вид: ![]() ,
, 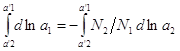 ,
, 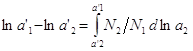 . Если известна зависимость
активности второго компонента от концентрации, а так же активность первого
компонента для какой либо концентрации, то можно активность компонента для
другой концентрации. Зная
. Если известна зависимость
активности второго компонента от концентрации, а так же активность первого
компонента для какой либо концентрации, то можно активность компонента для
другой концентрации. Зная ![]() , можно подсчитать
, можно подсчитать ![]() .
.
Методы определения активности
1) Определение активности по давлению
пара, если компонент летучий; например, раствор олово-цинк близок к
совершенному. Давление пара при 957К ![]() , а давление пара над сплавом
олово-цинк, в котором молярная доля цинка 0,226, составляет
, а давление пара над сплавом
олово-цинк, в котором молярная доля цинка 0,226, составляет ![]() . По определению,
. По определению, ![]() , а для
летучего компонента
, а для
летучего компонента ![]() . Коэффициент активности
. Коэффициент активности ![]()
2) Определение активности на основе
закона распределения. В реальных растворах коэффициент распределения
рассчитывается по формуле: ![]() , где
, где ![]() и
и ![]() - активности распределяющегося
вещества 1-ой и 2-ой фазы. При бесконечном разбавлении, когда количество
введенного 3-го компонента невелико, активности равны соответствующим
концентрациям, определяя которые, вычисляют к.
- активности распределяющегося
вещества 1-ой и 2-ой фазы. При бесконечном разбавлении, когда количество
введенного 3-го компонента невелико, активности равны соответствующим
концентрациям, определяя которые, вычисляют к. ![]() . Если константа распределения
велика, то при увеличении общего количества введенного 3-го компонента 2-й
раствор может оставаться идеальным вплоть до насыщения и тогда закон
распределения может быть представлен в виде:
. Если константа распределения
велика, то при увеличении общего количества введенного 3-го компонента 2-й
раствор может оставаться идеальным вплоть до насыщения и тогда закон
распределения может быть представлен в виде: ![]() . Определяя С2 и зная константу,
рассчитывают а1 , а1=КС2 – активность 3-го компонента в 1-ом растворе.
. Определяя С2 и зная константу,
рассчитывают а1 , а1=КС2 – активность 3-го компонента в 1-ом растворе.
Существуют и другие методы
определения активности, например, криоскопические. Активность определяется по
измеренному понижению температуры замерзания раствора по сравнению с чистым
растворителем: ![]() . Активность можно определить из
изучения химического равновесия, вычисляя Кр.
. Активность можно определить из
изучения химического равновесия, вычисляя Кр.
3) Активность можно вычислить из
электрохимических измерений. Например, по формуле Нернста для металлического электрода
в растворе своей соли: ![]() , где:
, где: ![]() - стандартный электродный
потенциал;
- стандартный электродный
потенциал; ![]() -
потенциал электронов в растворе, измеряемый существующими методами. Зная
-
потенциал электронов в растворе, измеряемый существующими методами. Зная ![]() и
и ![]() рассчитываем
а.
рассчитываем
а.
Необратимые реакции
Для реакции первого порядка ![]() , где С –
концентрация реагирующего исходного вещества. С другой стороны,
, где С –
концентрация реагирующего исходного вещества. С другой стороны, ![]() .
.
![]() ;
;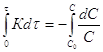 ;
;![]() ;
;![]() (2)
(2)
Из (2) следует, что константа
скорости реакции первого порядка не зависит от способа выражения концентрации и
имеет размерность ![]() :
:
![]() (3)
(3)
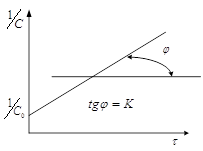
Из уравнения (3) следует, что график
в координатах ![]() будет прямой линией:
будет прямой линией:

Уравнение (2) часто записывают в виде
![]() . Для
характеристики скорости реакции часто пользуются величиной, называемой временем
полупревращения (периодом полураспада), обозначаемой
. Для
характеристики скорости реакции часто пользуются величиной, называемой временем
полупревращения (периодом полураспада), обозначаемой ![]() - это время, в течение которого
испытывает превращение половина взятого исходного вещества. Найдем выражение
для
- это время, в течение которого
испытывает превращение половина взятого исходного вещества. Найдем выражение
для ![]() .
.
В выражение (2) подставляем ![]() :
: 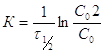 ,
, ![]()
Для реакции 1-го порядка время полупревращения не зависит от начальной концентрации.
Часто в кинетические уравнения
подобного вида вводят величину Х, которая характеризует количество вещества,
вступившего в реакцию, тогда ![]() и
и ![]() .
.
![]() ;
; 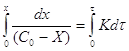
![]()
![]()
Все превращения радиоактивных веществ протекают по первому порядку. Уравнениями первого порядка описываются некоторые другие физические процессы, например, самопроизвольное излучение электронов невозбужденных атомов и молекул. По первому порядку протекает реакция ацетона:
![]()
Необратимые реакции второго порядка
![]()
![]() ;
; ![]() ;
;![]() ;
;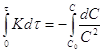 ;
;![]() (1)
(1)
![]() (2)
(2) ![]() (3)
(3)
Из (3) следует, что в координатах ![]() график будет
прямой линией.
график будет
прямой линией.
![]()
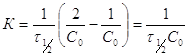
![]() ,
,
т.е. время полупревращения для реакции 2-го порядка обратно пропорционально начальной концентрации.
Рассмотрим более сложный случай: ![]()
Пусть Х – количество вещества А, вступившего в реакцию ко времени τ.
![]()
![]()
![]()
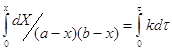
![]()
![]()
Реакциями 2-го порядка являются, например, реакции образования и разложения HI.
![]() ;
;
Омыление этилацетата щелочью и т.д.
Необратимые реакции третьего порядка
Такие реакции встречаются. В газовой
фазе изучены пять таких реакций: взаимодействие оксида азота (II) с водородом,
кислородом, хлором, бромом, йодом. Например: ![]() . В растворах известно большее
количество таких реакций – окислительно-восстановительного характера.
Рассмотрим простой случай, для которого
. В растворах известно большее
количество таких реакций – окислительно-восстановительного характера.
Рассмотрим простой случай, для которого ![]() и
и ![]() , где С – концентрация исходного
вещества.
, где С – концентрация исходного
вещества.
![]() ;
;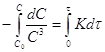 ;
;![]() (1)
(1) 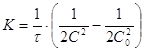 (2)
(2)
Следовательно, константа скорости
реакции третьего порядка имеет размерность ![]() . В зависимости от способа
выражения концентрации выражение (1) можно переписать в виде:
. В зависимости от способа
выражения концентрации выражение (1) можно переписать в виде: ![]() , следовательно, в
координатах
, следовательно, в
координатах ![]() мы
будем иметь прямую линию:
мы
будем иметь прямую линию:
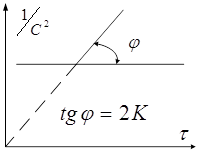
Это используют для графического определения константы скорости.
Выражение дл времени полупревращения
найдем подстановкой в уравнение (2) ![]() :
: ![]() , т.е. время полупревращения
обратно пропорционально квадрату начальной скорости.
, т.е. время полупревращения
обратно пропорционально квадрату начальной скорости.
Р-ии дробного, нулевого
Для необратимой р-ии n–ого порядка
для которой W=KCn. Для р-ии 2-го и 3-го порядка можно записать: ![]() (1).
(1).
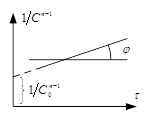
Выражения для времени полупревращения
записывается ![]() (2). Уравнение 1 можно записать в
виде
(2). Уравнение 1 можно записать в
виде ![]() =>
=>
![]()
![]() . Дробный
порядок р-ии указывает обычно на одновременное протекание нескольких этапов
р-ии мало отличающихся друг от друга по скоростям ил на протекание обратимой
р-ии. Часто дробный порядок имеют р-ии с участием атомов: CO+Cl2→COCl2.
. Дробный
порядок р-ии указывает обычно на одновременное протекание нескольких этапов
р-ии мало отличающихся друг от друга по скоростям ил на протекание обратимой
р-ии. Часто дробный порядок имеют р-ии с участием атомов: CO+Cl2→COCl2. ![]()
![]() Нулевой порядок р-ии
имеет место при постоянной скорости р-ии, что возможно при поддержании
постоянной концентрации исходных веществ. Нулевой порядок встречается среди
гетерогенных р-ий. Если х - количество вещества вступившего в р-ию, то
Нулевой порядок р-ии
имеет место при постоянной скорости р-ии, что возможно при поддержании
постоянной концентрации исходных веществ. Нулевой порядок встречается среди
гетерогенных р-ий. Если х - количество вещества вступившего в р-ию, то ![]() ,
, ![]() ,
,  ,
, ![]()
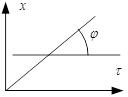
![]() .
.
Методы определения порядка хим р-ии
Методы делятся на дифференциальные и
интегральные. Дифференциальные используют исходное диф. ур ![]() . Интегральные методы
используют уравнения после интегрирования. Среди интегральных методов
используются: 1) подстановки 2) графический 3) определение по времени
полупревращения. 1) получение опытным путём данных по зависимости концентрации
реагир. вещества от времени подстановки в ур. для константы скорости р-ии
различного порядка. Порядок р-ии определяется уравнением-подстановкой, в
которое экспериментальных данных даёт постоянное значение константы скорости
р-ии 2) экспериментальные данные представляются в виде графиков. Если в
координатах
. Интегральные методы
используют уравнения после интегрирования. Среди интегральных методов
используются: 1) подстановки 2) графический 3) определение по времени
полупревращения. 1) получение опытным путём данных по зависимости концентрации
реагир. вещества от времени подстановки в ур. для константы скорости р-ии
различного порядка. Порядок р-ии определяется уравнением-подстановкой, в
которое экспериментальных данных даёт постоянное значение константы скорости
р-ии 2) экспериментальные данные представляются в виде графиков. Если в
координатах ![]() получится
прямая линия, то р-ия 1-го порядка. Р-ия будет иметь 2-ой порядок если прямая
линия получится в координатах
получится
прямая линия, то р-ия 1-го порядка. Р-ия будет иметь 2-ой порядок если прямая
линия получится в координатах ![]() . Для р-ии 3-го порядка линия
зависимости наблюдается в координатах
. Для р-ии 3-го порядка линия
зависимости наблюдается в координатах ![]() . 3) р-ию проводят 2 раза с
разложением начальных концентр. Каждый раз определяют время полупревращения.
Если окажется, что время полупревращения не зависит от начальных концентраций,
значит р-ия первого порядка, т.к.
. 3) р-ию проводят 2 раза с
разложением начальных концентр. Каждый раз определяют время полупревращения.
Если окажется, что время полупревращения не зависит от начальных концентраций,
значит р-ия первого порядка, т.к. ![]() . Если во втором опыте начальная
концентрация была увеличена в 2 раза, а время полупревращения уменьшилось в 2
раза, значит р-ия 2-го порядка, т.к.
. Если во втором опыте начальная
концентрация была увеличена в 2 раза, а время полупревращения уменьшилось в 2
раза, значит р-ия 2-го порядка, т.к. ![]() . Для р-ии 3-го порядка при том же
самом условии время полупревращения уменьшится в 4 раза, т.к.
. Для р-ии 3-го порядка при том же
самом условии время полупревращения уменьшится в 4 раза, т.к. ![]() . В общем случае если
порядок
. В общем случае если
порядок ![]() ,
, ![]() .
.
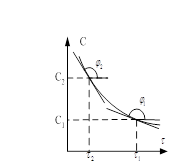
Если начальные концентрации ![]() , то
, то ![]() , если
, если ![]() , то
, то ![]() . Поделив,
получим
. Поделив,
получим ![]() .
Логарифмируя, получим
.
Логарифмируя, получим ![]() ,
, ![]() . Это соотношение сохранится и в
случае определения времени превращения любой доли концентрации
. Это соотношение сохранится и в
случае определения времени превращения любой доли концентрации ![]() . Прежде рассмотрим диф.
метод Вант-Гоффа. В основе метода лежит Ур
. Прежде рассмотрим диф.
метод Вант-Гоффа. В основе метода лежит Ур ![]() . пусть измеряемое
. пусть измеряемое![]() ,
, ![]() ,
, ![]() - текущая концентрация
исходного вещества в момент времени 1 и 2.
- текущая концентрация
исходного вещества в момент времени 1 и 2. ![]() . После логарифмирования
. После логарифмирования ![]() ,
, ![]() (1). Скорость
р-ии при концентрации
(1). Скорость
р-ии при концентрации ![]() и
и ![]() определяется из зависимости
определяется из зависимости![]() .
. ![]() ,
, ![]() Часто
получают не всю кривую
Часто
получают не всю кривую ![]() , а производную определённой
скорости при 2 концентрациях. Принимая, что
, а производную определённой
скорости при 2 концентрациях. Принимая, что ![]() ,тогда
,тогда ![]() .
. ![]() Для определения ΔС измеряем
концентрации вещества в какой-то момент времени и через небольшой промежуток Δτ.
Графический вариант метода Вант-Гофа W=KCn прологарифмируем
Для определения ΔС измеряем
концентрации вещества в какой-то момент времени и через небольшой промежуток Δτ.
Графический вариант метода Вант-Гофа W=KCn прологарифмируем ![]() => является линейной
функцией lgC. Определяя скорость при нескольких концентрациях, строят график
lgW-lgC tgα=n. Скорость р-ии W в различный момент времени определяется как
и в предыдущем случае, но тангенс угла наклона касательной к положительному
направлению оси абсцисс. Определяемый таким образом порядок р-ии называется
временным порядком, он учитывает влияние на порядок продолжительности р-ии.
Если использовать несколько кинетических кривых, то получим истинный порядок
р-ии. Время и концентрация порядка могут не совпадать. Метод изоляции. Получим
выражение для константы скорости р-ии различных порядков и рассмотрим методы
определения порядка р-ии применимые для тех случаев, когда кинетическое уравнение
имеет вид
=> является линейной
функцией lgC. Определяя скорость при нескольких концентрациях, строят график
lgW-lgC tgα=n. Скорость р-ии W в различный момент времени определяется как
и в предыдущем случае, но тангенс угла наклона касательной к положительному
направлению оси абсцисс. Определяемый таким образом порядок р-ии называется
временным порядком, он учитывает влияние на порядок продолжительности р-ии.
Если использовать несколько кинетических кривых, то получим истинный порядок
р-ии. Время и концентрация порядка могут не совпадать. Метод изоляции. Получим
выражение для константы скорости р-ии различных порядков и рассмотрим методы
определения порядка р-ии применимые для тех случаев, когда кинетическое уравнение
имеет вид ![]() .
Пусть скорость хим. р-ии в зависимости от концентрации реагирующих веществ
выражается Ур
.
Пусть скорость хим. р-ии в зависимости от концентрации реагирующих веществ
выражается Ур ![]() . n1, n2,.. – частные порядки р-ии
или порядки р-ии соответствующие по 1-ому, 2-ому и 3-ему веществу. Сумма
частных порядков определяет общий порядок р-ии. Чтобы определение частных
порядков, а следовательно и общий поступают следующим образом: одно из веществ
например 1-ое берут в нормальной концентрации, тогда как все остальные берут в
большом избытке. Тогда концентрация этих веществ можно считать постоянными и
зависимость скорости р-ии от концентрации выражается Ур
. n1, n2,.. – частные порядки р-ии
или порядки р-ии соответствующие по 1-ому, 2-ому и 3-ему веществу. Сумма
частных порядков определяет общий порядок р-ии. Чтобы определение частных
порядков, а следовательно и общий поступают следующим образом: одно из веществ
например 1-ое берут в нормальной концентрации, тогда как все остальные берут в
большом избытке. Тогда концентрация этих веществ можно считать постоянными и
зависимость скорости р-ии от концентрации выражается Ур ![]() . Одним из рассмотренных
методов определён порядок р-ии по 1-ому веществу n1. Затем р-ию проводят снова,
но в избытке берут все вещества, кроме 2-го и т.д.
. Одним из рассмотренных
методов определён порядок р-ии по 1-ому веществу n1. Затем р-ию проводят снова,
но в избытке берут все вещества, кроме 2-го и т.д.