Учебное пособие: Атомно-кристаллическое строение металлов
Министерство образования и науки Украины
Донбасский государственный технический университет
Кафедра ОМД
ЛЕКЦИЯ
по дисциплине Металловедение
на тему
«Атомно-кристаллическое строение металлов»
Ст.преп. Горецкий Ю.В.
Алчевск 2009
«Атомно-кристаллическое строение металлов»
1. Строение металлов в твердом состоянии
Все металлы и металлические сплавы – тела кристаллические, атомы (ионы) расположены в металле закономерно в отличие от аморфных тел, в которых атомы расположены хаотично.
Металлическое состояние возникает в комплексе атомов, когда при их сближении внешние электроны теряют связь с отдельными атомами, становятся общими, т.е. коллективизируются и свободно перемещаются между положительно заряженными и периодически расположенными ионами.
Устойчивость металла определяется электрическим притяжением между положительно заряженными ионами и обобщенными электронами (такое взаимодействие получило название металлической связи).
Сила связи в металлах определяется силами отталкивания и силами притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстоянии друг от друга, чтобы энергия взаимодействия была минимальной (рис. 1)
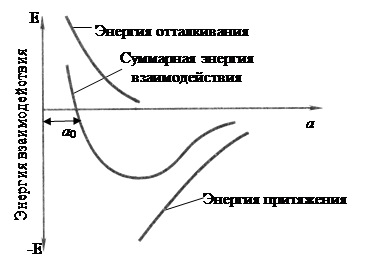
Рисунок 1. Энергетические условия взаимодействия атомов в кристаллической решетке вещества
Величина а соответствует расстояние между атомами в кристаллической решетке, а а0 соответствует равновесному расстоянию между атомами. В связи с этим в металле атомы располагаются закономерно, образуя правильную кристаллическую решетку, что соответствует минимальной энергии взаимодействия атомов.
Металлические состояния характеризуются высокой энергией связи между атомами. Мерой ее служит теплота сублимации (сумма энергии необходимой для перехода твердого металла к парообразному состоянию, для металла – от 20 до 200 ккал/(г·атом)).
2. Атомно-кристаллическое строение металлов
Под атомно-кристаллической структурой понимают взаимное расположение атомов, существующее в кристалле. Атомы в кристалле расположены в определенном порядке, который периодически повторяется в трех измерениях.
Для описания атомно-кристаллической структуры пользуются понятием пространственной или кристаллической решетки.
Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узле которой располагаются атомы (ионы), образующие металл.
Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме, получил название элементарной кристаллической ячейки (решетки).
Для характеристики элементарной ячейки задают шесть величин: три ребра ячейки a, b, c и три угла между ними α, β, γ. Эти величины называют параметрами кристаллической решетки.
Кристаллические решетки бывают простыми (атомы только в вершинах решетки) и сложными.
Металлы образуют одну из следующих высокосимметричных сложных решеток с плотной упаковкой атомов: кубическую объемноцентрированную (ОЦК), кубическую гранецентрированную (ГЦК) и гексагональную (ГПУ) (рис. 2).
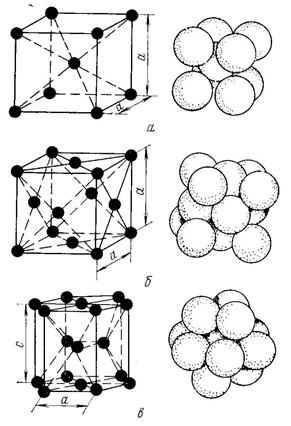
ОЦК: Rb, K, Na, Li, Tiβ, Tlβ, Zrβ, Ta, W, V, Feα, Cr, Nb, Ba, и др.
ГЦК: Cu, Al, Pt, Pb, Ni, Ag, Au, Pd, Rh, Ir, Feγ, Coα, Caα, Ce, Srα, Th, Sc и др.
ГПУ: Mg, Cd, Re, Os, Ru, Zn, Be, Coβ, Caα, Zrα, Laα, Tiα и др.
Рисунок 2. Кристаллические решетки металлов и схемы упаковки атомов
Расстояние между ближайшими параллельными атомными плоскостями, образующими элементарную ячейку, называют периодом решетки, измеряется в нанометрах (1нм = 10-9см = Å= 10-8см).
Периоды решетки металлов находятся в пределах 0,2 – 0,7 нм.
Для ОЦК: a, b, c; a = b = c.
Для ГЦК: a, b, c; a = b = c.
Для ГПУ: а, с; с/а = 1,633 (к Zn не относится)
Число атомов в каждой элементарной ячейке (плотность упаковки – равняется числу атомов, приходящихся на одну элементарную ячейку):
ОЦК:
ПУ (плотноупакованная) = ![]() ;
;
ГЦК:
ПУ = ![]() ;
;
ГПУ:
ПУ = ![]() .
.
Координационное число – под ним понимают число атомов, находящихся на равном и наименьшем расстоянии от данного атома. Чем выше координационное число, тем больше плотность упаковки атомов:
ОЦК:
расстояние (min) между атомами ![]() , на этом расстоянии от рассматриваемого
атома находится 8 соседей – К8 .
, на этом расстоянии от рассматриваемого
атома находится 8 соседей – К8 .
ГЦК:
![]() , К12.
, К12.
ГПУ: Г12 (с/а = 1,633).
Коэффициент заполнения ячейки (плотность укладки) – определяется как отношение объема, занятого атомами к объему ячейки:
ОЦК: 68%
ГЦК: 74%
ГПУ: 74%
Для характеристики величины атома служит атомный радиус, под которым понимается половина расстояния между ближайшими соседними атомами. Атомный радиус возрастает при уменьшении координационного числа.
3. Полиморфные (аллотропические) превращения
Атомы металла – исходя из геометрических соображений, могут образовать любую кристаллическую решетку.
Однако устойчивым, а, следовательно, реально существующим типом является решетка, обладающая наиболее низким запасом свободной энергии.
Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах (т.н. полиморфных (аллотропических) модификациях). В результате полиморфного превращения атомы кристаллического тела, имеющего решетку одного типа, перестраиваются таким образом, что образуется кристаллическая решетка другого типа.
Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать буквой α, при более высокой температуре β, затем γ и т.д.
Полиморфное превращение протекает при постоянной температуре (например, при нагреве идет поглощение теплоты).
Известные полиморфные превращения: Feα ↔ Feβ; Coα ↔ Coβ; Tiα ↔ Tiβ; Mnα ↔ Mnβ ↔ Mnγ ↔ Mnδ; Snα ↔ Snβ, а также для Ca, Li, N, Cs, Sr, Te, Zr, V и др.
Металл с данной кристаллической решеткой должен обладать меньшим запасом свободной энергии.
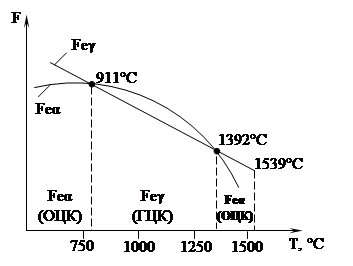
Рисунок 3. Полиморфизм железа и его связь со свободной энергией системы
Полиморфизм железа. Из рис. 3, видно, что в интервале температур 911 – 1392°С устойчивым является γ-железо (К 12) (имеет min свободную энергию), а при температурах ниже 911°С и выше 1392°С устойчиво α-железо (К 8).
В твердом металле полиморфные превращения происходят в результате зарождения и роста кристаллов аналогично кристаллизации из жидкого состояния. Зародыши новой модификации наиболее часто возникают на границах зерна исходных кристаллов.
В результате полиморфного превращения образуется новые кристаллические зерна, имеющие другой размер и форму, поэтому превращение также называют перекристаллизацией.
Полиморфное превращение сопровождается скачкообразным изменением всех свойств металлов и сплавов: удельного объема, теплоемкости, теплопроводности, электропроводности, магнитных свойств, механических и химических свойств и т.д.
Высокотемпературная модификация имеет высокую пластичность.
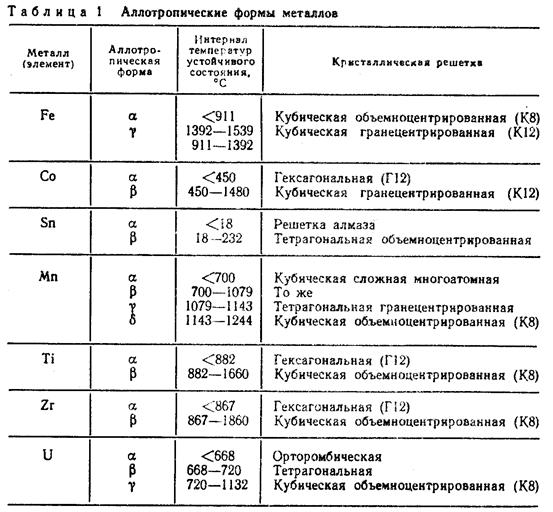
В таблице № 1 показан интервал температур существования различных аллотропических форм некоторых, имеющих практическое значение металлов, у которых обнаружена температурная аллотропия.
4. Анизотропия свойств металлов
Из атомно-кристаллического строения металлов видно, что плотность расположения атомов по различным плоскостям в кристаллических решетках неодинакова (рис. 4).
Вследствие неодинаковой плотности атомов в различных плоскостях и направлениях решетки многие свойства (химические, физические, механические) каждого кристалла зависят от направления решетки. Подобная неодинаковость свойств монокристалла в разных кристаллографических направлениях называется анизотропией.
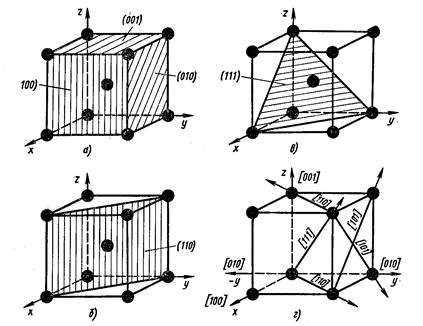
Рисунок 4. Расположение атомов в различных плоскостях и направлениях в кубической решетке (ОЦК)
Кристалл – тело анизотропное в отличие от аморфных тел (стекло, пластмассы и т.д.), свойства которых не зависят от направления.
Технические металлы являются поликристаллами, т.е. состоят из большого числа анизотропных кристаллов. В большинстве случаев, как уже указывалось выше, кристаллы статистически неупорядоченно ориентированы один по отношению к другому, поэтому во всех направлениях свойства более или менее одинаковы, т.е. поликристаллическое тело является изотропным (вернее – квазиизотропным (ложная изотропия)). Такая мнимая изотропность не будет наблюдаться, если кристаллы имеют одинаковую преимущественную ориентировку в каких-то направлениях. Эта ориентированность, или текстура, создается в известной степени, но не полностью в результате значительной холодной деформации; в этом случае поликристаллический металл приобретает анизотропию свойств.
Литература
1. Лахтин Ю.М., Леонтьева В.П. Материаловедение. М., 1972, 1980.
2. Гуляев А.П. Металловедение. М., 1986.
3. Новиков И.И. Дефекты кристаллического строения металлов. М., 1983.
4. Антикайн П.А. Металловедение. М., 1972.
| Общая и неорганическая химия | |
|
Квантово-механическая модель атома. Квантовые числа. Атомные орбитали. Порядок заполнения орбиталей электронами Теория строения атома основана на ... В узлах кристаллической решетки металлов находятся свободные атомы, положительно заряженные коны, а часть валентных электронов, свободно перемещаясь в объеме кристаллической ... В однокомпонентной системе (при наличии полиморфных превращений) возможны 4 вида двухфазных равновесий: жидкость - пар, кристалл - пар, кристалл - жидкость и кристалл - кристалл; 4 ... |
Раздел: Рефераты по химии Тип: учебное пособие |
| Давно ли люди гибнут за металл и как именно закалялась сталь | |
|
Давно ли люди гибнут за металл и как именно закалялась сталь? Содержание Давно ли люди гибнут за металл и как именно закалялась сталь? Вопросы ... Часто выделяют так называемую "триаду железа" - труппу трех металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями ... Для железа характерен полиморфизм, он имеет четыре кристаллические модификации: до +769°C существует ѭ-Fe (феррит) с объемноцентрированной кубической решеткой в температурном ... |
Раздел: Рефераты по истории Тип: книга |
| Программа для поступающих в вузы (ответы) | |
|
Программа по химии для абитуриентов Предмет химии. Явления химические и физические. Атомно-молекулярное учение. Атомы. Молекулы. Молекулярное и ... Химическая связь - взаимодействие, связывающее атомы в молекулы, кристаллы или радикалы, а также ионы в ионные радикалы. На атоме водорода возникает эффективный положительный заряд, что в сочетании с отсутствием внутренних электронных слоев позволяет другому атому сближаться до расстояний, близких к ... |
Раздел: Рефераты по химии Тип: реферат |
| Развитие, становление и основные аспекты фармации | |
|
РАЗВИТИЕ, СТАНОВЛЕНИЕ И ОСНОВНЫЕ АСПЕКТЫ ФАРМАЦИИ Для ветеринарного провизора необходимы знания, с помощью которых можно контролировать качество ... Спектр ЯМР позволяет установить распределение атомов в молекуле водорода, а изучение фрагментации в масс-спектре - положение гетероатомов и наличие атомных групп, претерпевающих ... В результате происходит разрушение органической части молекулы (превращение углерода, водорода и кислорода в диоксид углерода и воду), а атомы серы, фосфора, галогенов, мышьяка ... |
Раздел: Рефераты по медицине Тип: книга |
| Кристаллы и их свойства | |
|
ицей современных технологий управления Реферат по физике Кристаллы и их свойства Выполнил: Проверил: Пенза 2001 Введение Кристаллические тела являются ... Сравнение элементарных ячеек кристаллических решеток различного типа может проводиться по разным параметрам, среди которых часто употребляются атомный радиус, плотность упаковки и ... Отличие реальных кристаллов от идеальных заключается в том, что реальные кристаллы не обладают правильной кристаллической решеткой, а имеют целый ряд нарушений в расположении ... |
Раздел: Рефераты по физике Тип: реферат |