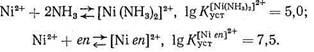Реферат: Бионеорганическая химия
БИОНЕОРГАНИЧЕСКАЯ ХИМИЯ
Введение
Бионеорганическая химия - одно из самых новых направлений неорганической химии. Задачей бионеорганической химии являются выявление неорганических соединений, участвующих в различного рода биологических процессах, их изучение, математическое и химическое моделирование биологических систем с участием этих соединений и, наконец, управление этими системами и их оптимизация. В курсе неорганической химии при систематическом рассмотрении свойств элементов периодической системы необходимо наряду с другими аспектами останавливаться и на проблемах бионеорганической химии, в том числе отмечать биологическую роль тех или иных неорганических соединений.
1. Бионеметаллы и биометаллы
В биологических процессах участвует большое число химических соединений, образованных различными элементами периодической системы. Организмы животных и растений состоят из сложных веществ, включающих в свой состав как элементы-неметаллы, так и элементы с металлическими свойствами. Из неметаллов особенно важную роль играют углерод, водород, кислород, азот, фосфор, сера, галогены. Из металлов в состав животных и растительных организмов входят натрий, калий, кальций, магний, железо, цинк, кобальт, медь, марганец, молибден и некоторые другие.
Для того чтобы оценить соотношение количеств химических элементов, входящих в состав живых организмов, полезно рассмотреть содержание биоэлементов в организме «среднего» здорового человека (вес 70 кг). Установлено, что на 70 кг массы человека приходится 45,5 кг кислорода (т. е. больше половины массы), углерода-12,6, водорода - 7,0, азота - 2,1 кг, примерно столько же фосфора. Кальция в человеке 1,7 кг, калия - 0,25, натрия - 0,07 кг, магния - 42 г, железа - только 5 г (химики шутят, что железа в человеке хватит лишь на один гвоздь), цинка - 3 г. Остальных металлов в сумме меньше, чем 1 г. В частности, меди - 0,2 г, марганца - 0,02 г.

Интересно, что вхождение химических элементов в состав живых организмов не зависит каким-либо простым образом от их распространенности. Действительно, хотя наиболее распространенный на земле элемент - кислород - является важнейшей составной частью соединений, слагающих растительные и животные организмы, такие распространенные элементы, как кремний и алюминий, в их состав не входят, а относительно мало распространенные кобальт, медь и молибден выполняют важную биологическую роль. Следует отметить также, что среди биоэлементов, т. е. элементов, играющих важную роль в построении живого организма и в процессах поддержания его жизни (обмен веществ, метаболизм), находятся очень сильно различающиеся по своим химическим свойствам, размерам частиц и электронному строению металлы и неметаллы. Например, среди биометаллов (их часто называют «металлами жизни») есть элементы, образующие ионы с благородногазовой электронной «подкладкой», несклонные к проявлению переменной валентности (Na+, K+, Mg2+, Са2+). Наряду с этим есть среди биометаллов и элементы с 18-электронной (Zn2+) или недостроенной 18-электронной «подкладкой» (Cu2+, Co2+, Fe2+, Fe3+, Mo(V), Mo(VI)). Последние склонны изменять степень окисления в ходе обмена веществ.
Среди перечисленных биометаллов есть элементы, образующие преимущественно ионные (Na, К) и ковалентные связи (Mo, Zn); сильные комплексообразователи, такие, как Fe3+, Co2+, Cu2+, Zn2+. Однако и менее прочные комплексы, образованные, например, ионами Са2+, Mg2+, Mn2+, играют важную биологическую роль, и даже ионы щелочных металлов (Na+, К + ) в метаболических процессах вовлекаются в образование комплексов (с участием макроциклических лигандов). Установлено, что большое значение имеют размеры ионов металлов, участвующих в процессах метаболизма.
Так, например, не очень большая разница в величинах ионных радиусов Na+ (0,98 А) и К+ (1,33 А) обусловливает очень большую разницу в радиусах гидратированных ионов. Это приводит к неодинаковой роли ионов Na+ и К+ в процессе метаболизма: Na+ - внеклеточный, а К+-внутриклеточный ионы. Именно размеры ионов, а также характерный для данного иона тип химической связи определяют, на какие ионы может замещаться тот или иной ион в процессе метаболизма. Установлено, что ионы К+ могут замещаться в живых тканях на крупные однозарядные катионы щелочных металлов (Rb+, Cs+), а также на сходные по размерам ионы NH4+ и Т1+. Напротив, относительно маленький ион Na+ может замещаться только на Li+. Интересно, что обмен на ионы Cu+ не происходит, видимо, из-за склонности Cu+ к образованию ковалентных связей, хотя размеры Cu+ и Na+ сходны.
Очень важно, что ионы Mg2+ и Са2+ в биосистемах не замещают друг друга. Это связано, как полагают, с большей ковалентностью связи Mg2+ с лигандами по сравнению с Са2+. Еще более ковалентные связи с лигандами образует Zn2+, он не замещается на Mg2+, хотя близок к нему по величине ионного радиуса.
Согласно. К. Б. Яцимирскому, оценку ионности и ковалентности связей ионов биометаллов с лигандами целесообразно проводить следующим образом. Ионность связи пропорциональна отношению квадрата заряда иона к величине ионного радиуса. Это отношение для большинства ионов находится в пределах от 1 до 5. Только для бериллия это отношение аномально велико и составляет 11,7. Именно с этим связывают высокую токсичность иона Ве2+.
Ковалентность связи металл-лиганд, по Яцимирскому, можно оценить как отношение
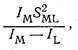
где Iм и Il - потенциалы ионизации (валентных состояний) металла и лиганда соответственно; Sml - интеграл перекрывания орбиталей, взаимодействующих при образовании ковалентной связи. Ковалентность биометаллов, охарактеризованная таким способом, обычно изменяется в интервале 20-135. При малой ковалентности связи наиболее устойчивыми оказываются соединения ионов металлов с кислородом. По мере роста ковалентности все более устойчивыми оказываются соединения со связью металл-азот и, особенно, со связью металл-сера. Такую же корреляцию дает классификация Пирсона, согласно которой «жесткая» кислота соединяется с «жестким» основанием,, а «мягкая» кислота - с «мягким» основанием.
Бионеорганическая химия рассматривает не только те элементы и их соединения, которые присутствуют в нормально функционирующем живом организме, но и те элементы (и их соединения), которые, не являясь составной частью здорового организма, могут оказывать на него то или иное воздействие, попадая в организм извне. Речь идет о взаимодействии живого организма с ядовитыми веществами, попавшими в организм случайно или накопившимися в нем, например, в результате неправильной работы тех или иных органов (производные свинца, кадмия, ртути и др.).
Надо учитывать, что очень важной является дозировка различных элементов и их соединений в живом организме. Доказано, что один и тот же элемент может положительно влиять на организм в целом и одновременно быть сильным ядом в случае его передозировки. Уже упоминалось, что цинк принадлежит к числу важнейших биометаллов: ионы Zn2+ входят в состав нескольких десятков ферментов, катализирующих протекание жизненно важных процессов. В то же время установлено, что при слишком высоком содержании Zn2+ в тканях он оказывает канцерогенное действие.
Примером того же типа может быть селен, который, вообще говоря, не причисляют к биометаллам. Однако в последнее время установлено, что уменьшение содержания селена в пище, потребляемой человеком за день, с 0,3-0,5 мг (Япония) до 0,1-0,2 мг (США, ФРГ) приводит к резкому возрастанию числа раковых заболеваний грудной железы у женщин (более чем в 5 раз). Полагают, что низкое содержание селена в пищевых продуктах, вырабатываемых в странах с высокоразвитой химической промышленностью, связано с большим содержанием в атмосфере соединений серы, вытесняющих селен из природных объектов. В Японии нехватка селена в пище меньше, так как многие пищевые продукты, извлекаемые из моря, содержат большое количество селена.
В задачи бионеорганической химии входит изучение строения и биологической роли неорганических соединений. Эти исследования проводят различными физико-химическими методами, а также методами биологии и биохимии, включающими и математическое моделирование. Бионеорганические исследования имеют первостепенную важность для решения задач медицины, охраны окружающей среды, неорганической технологии. Далее мы кратко рассмотрим свойства и строение некоторых лигандов, играющих важнейшую роль в биологии, в частности соединения, закомплексовывающие биометаллы, а затем перейдем к характеристике свойств важнейших бионеорганических соединений и их роли в процессах жизнедеятельности животных и растений.
2. Важнейшие биолиганды
Биолиганды - это молекулы или ионы, взаимодействующие в организме с биометаллами. Многие из них называются «молекулами жизни». К числу биолигандов относятся главным образом органические соединения. Однако и неорганические лиганды, хотя их существенно меньше, играют в процессах метаболизма важную и незаменимую роль. Это неорганические анионы, такие, как галогенид-ионы (F-, С1-, I-), сульфат - и нитрат-ионы, а также гидроксил-, фосфат - и карбонат-ионы, образование и гидролиз которых вносят немалый вклад в энергетическую «копилку» живого организма. Это, наконец, нейтральные молекулы Н2О, О2, СО2, NH3. Без этих лигандов метаболизм, питание и сама жизнь организма невозможны.
Поэтому исследование взаимодействия с упомянутыми неорганическими веществами ионов биометаллов, а также других катионов, попадающих в организм извне, - важнейшая задача биохимии. Взаимодействия, реализующиеся в биосистемах, не являются специфическими и рассматриваются в рамках обычных курсов неорганической химии. Поэтому ниже будут представлены сведения лишь о лигандах, характерных именно для биосистем или моделирующих эти системы.
Комплексы с полидентатными и макроциклическими лигандами
Основной особенностью биолигандов является их принадлежность к числу полидентатных и (очень часто) макроциклических лигандов.
Как известно, особая устойчивость комплексных соединений, образованных ионами металла с полидентатными лигандами, объясняется образованием одной молекулой (или ионом) лиганда с данным центральным ионом (катионом металла) одного или нескольких хелатных циклов. Согласно правилу Чугаева, наиболее устойчивыми являются пятичленные хелатные циклы (для систем без кратных связей) и шестичленные циклы (для систем с сопряженными двойными связями). Напомним, что энергетическая выгодность замыкания хелатных циклов (хелатный эффект) определяется как энтропийным, так и эн-тальпийным факторами. Рассмотрим в качестве примера комплексообразование Ni2+ с аммиаком и этилендиамином еп:
|
|
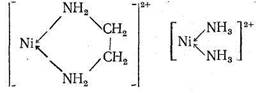
В обоих комплексах ион Ni2+ координирует два атома азота. Большая величина Kуст в случае этилендиаминового комплекса, несомненно, связана с хелатным эффектом: в комплексе [Niеn]2+ имеется пятичленный хелатный цикл, тогда как у комплекса [Ni (NH3)2]2+ - «открытое» строение:
|
|
Координационно насыщенные аммиакаты Ni2+ имеют состав [Ni(NH3)4]2+ или [Ni(NH3)6]2+.
Установлено, что разница в величинах констант устойчивости этих двух комплексов (A lgKуст = 2,5) определяется энтальпийным (∆H= - 1,9 ккал/моль) и энтропийным вкладом (∆S = 6,2 кал/град*моль). Разницу в величинах энтальпии образования этих соединений объясняют тем, что в случае [Nien]2+ двум атомам азота, входящим в координационную сферу Ni2+, не нужно преодолевать взаимного отталкиваия (в отличие от комплекса [Ni (NH3)2]2+). Атомы азота этилендиамина уже включены в состав одной молекулы («сближены» друг с другом). Кроме того, при образовании [Niеn]2+ меньше энергии требуется для дегидратации лиганда, чем в случае [Ni (NH3)2]2+: молекулы аммиака меньше по размеру, чем еп, они сильнее гидратируются.
Разница в величинах энтропийных факторов при образовании хелатного и «открытого» комплексов обусловлена увеличением числа частиц при протекании реакции тогда как при синтезе в водном
![]()
растворе диаммиаката никеля (II) в результате комплексообразования число частиц не меняется:
|
|
что связано с бидентатностью еп и монодентатностью NH3.
Как указывает Яцимирский, кроме хелатного эффекта в природных металлокомплексах, образованных биолигандами, часто осуществляется макроциклический эффект. В качестве примера рассматриваются термодинамические характеристики комплексов меди с лигандами L` и L" одинаковой дентатности и сходной природы, но только в L" цепь замкнута в макроцикл:
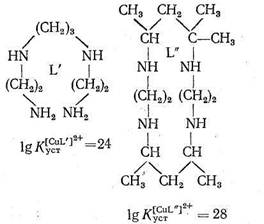
Как видно из приведенных данных, тетрадентатный лиганд L", представляющий собой макроцикл, при прочих равных условиях образует с Cu2+ комплекс, в 104 раз более устойчивый, чем такой же тетрадентатный лиганд L`,имеющий незамкнутое цепочечное строение. Природа макроциклического эффекта в полной мере еще не раскрыта, однако можно полагать, что вхождение центрального иона металла в готовую «полость» макроциклического лиганда приносит существенную энергетическую выгоду по сравнению с ситуацией, когда такой готовой полости нет и ее нужно создавать в процессе комплексообра-зования.
Одним из простейших среди природных макроциклических лигандов является энниатин - 18-членный гексадентатный лиганд, включающий кислотные остатки N-метил-валина и о-гидроксивалериата:
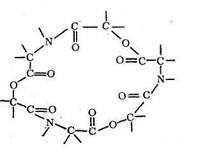
Энниатин и подобные ему макроциклические лиганды выполняют в живых организмах роль «ионофоров»: они включают в свою полость те или иные ионы металлов и в таком закомплексованном виде переносят их через биомембраны, регулируя, таким образом, содержание ионов металлов во внеклеточном пространстве и внутри клеток.
В последнее время выполнены важные работы по моделированию природных систем с металлокомплексами, образованными макроциклическими лигандами. В качестве «модельных» лигандов использовались так называемые «короны» (или краун-эфиры) и «криптаты».
Примером простейших корон, являющихся двухмерными (плоскостными) лигандами, могут служить следующие:

Дициклогексил-14-корона-4 Бензо-18-корона-6
Номенклатура краун-эфиров, как видно из приведенных названий и формул, указывает на общее число атомов в макроцикле и число гетероатомов, формирующих полость короны и выполняющих функции доноров.
Экспериментально установлено, что устойчивость комплексных соединений ионов металлов с коронами определяется соотношением размеров иона металла и полости короны. Наибольшая прочность макроциклических комплексов достигается, когда полость плотно «обхватывает» ион металла. Если полость слишком велика или мала, устойчивость комплексов уменьшается.
Те же закономерности были установлены для систем, в которых комплексообразование ионов металлов осуществляется с помощью макроциклических лигандов - криптатов, представляющих собой трехмерные лиганды с полостью, обрамленной тремя углеродными цепями, включающими гетероатомы. Общая формула криптатов имеет вид:
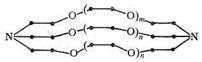
Таким образом, криптаты можно рассматривать как бициклические кислород-донорные лиганды с концевыми атомами, роль которых выполняют третичные атомы азота.
Полагают, что криптаты могут обладать большой избирательностью (селективностью) по отношению к биометаллам, например, природный макроциклический лиганд валиномицин селективен к ионам К+. Ниже приведены значения lgКуст комплексов криптатов и ионов щелочных металлов, образованных лигандами различной дентатности. Число донорных атомов в криптате влияет на размеры полости этого трехмерного макроциклического лиганда и, следовательно, на соотношение размеров комплексообразующего иона металла и полости, а значит и на устойчивость образующегося комплекса:
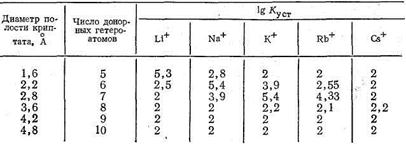
Интересно, что оптимальный лиганд для Li+ содержит в полости макроцикла пять донорных атомов. Увеличение числа донорных атомов и соответственно размеров полости приводит к уменьшению стабильности криптата лития. Для иона Na+ оптимальные размеры полости криптата отвечают 6-дентатному лиганду, для иона К+ - 7-дентатному. Для иона Rb+ устойчивость комплекса в оптимальных условиях ниже, чем для К+, и еще более она падает в случае иона цезия - самого большого по размерам среди ионов щелочных металлов. По-видимому, независимо от размеров полости для большого иона Cs+ прочность связи с лигандом мала из-за уменьшения энергии электростатического взаимодействия Cs+-лиганд.
Итак, исследование криптатов щелочных металлов показывает, что, регулируя состав и геометрию макроциклических лигандов, можно добиться их высокой селективности по отношению к ионам металлов, входящих в состав комплексов.
Состав и строение природных ионофоров, упрощенными моделями которых являются краун-эфиры и криптаты, сложны и многообразны.
Понятно поэтому, что в биосистемах может быть достигнута высокая селективность действия макроциклических лигандов, это и определяет их «узкую специализацию» в процессах метаболизма.
Биополимеры, на основе которых строится комплексообразование в биологических системах
Наиболее важными биополимерами, обеспечивающими процессы обмена веществ в животных и растительных организмах, в том числе процессы, протекающие с участием комплексных соединений металлов, являются полисахариды, белки и нуклеиновые кислоты.
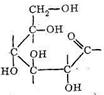
Среди полисахаридов наибольшее значение имеют крахмал, гликоген и целлюлоза. Основным звеном в построении полимерных цепей полисахаридов являются остатки D-глюкозы. Нециклическая D-глюкоза легко циклизуется, образуя две равновесные формы:

При полимеризации α - и β-формы D-глюкопиранозы соединяются в полимерную цепь через кислородные мостики:
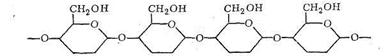
Если полимеризуется α-форма, то цепь полимера оказывается разветвленной - получается крахмал и гликоген. При полимеризации β-формы образуется цепочечный неразветвленный полимер - целлюлоза, которая, как известно, обладает волокнистым строением.
Полисахариды, как видно из приведенных формул, имеют в своем составе кислородные атомы, способные проявлять донорные функции. Таким образом, полисахариды, в виде которых организм запасает углеводы (крахмал, гликоген) и которые используются для построения оболочек растительных клеток (целлюлоза), являются полимерными лигандами.
![]() Другой тип биополимерных лигандов - белки (протеины). Белки
представляют собой
полимерные образования, в которых в том или ином порядке чередуются 23 α-аминокислоты. Строение всех аминокислот может быть описано формулой
Другой тип биополимерных лигандов - белки (протеины). Белки
представляют собой
полимерные образования, в которых в том или ином порядке чередуются 23 α-аминокислоты. Строение всех аминокислот может быть описано формулой
Различаются они только природой радикала R. α-Аминокислоты, вступая в реакцию полимеризации, образуют пептидную цепь:
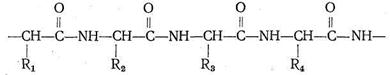
Подобно тому как из 32 букв алфавита путем их различного сочетания можно составить огромное количество слов, так из 23 α-аминокислот посредством их сочленения в том или ином порядке получается все многообразие белковых тел, существующих в природе, образуется так называемая первичная белковая структура. Кроме того, рассматривают вторичную, третичную и четвертичную структуру.
Вторичная структура (α - и β-конформации) возникает в результате взаимодействия полипептидных цепей друг с другом. α-Конформация имеет спиралеобразное строение, каждый виток спирали содержит от трех до семи аминокислотных фрагментов. Взаимодействие между соседними полипептидными цепями в такой спирали осуществляется посредством водородных связей, образованных карбонильным кислородом одной цепи с иминогруппой другой цепи:
![]()
Редко встречающаяся β-конформация содержит вытянутые друг возле друга неспиральные полипептидные цепи.
Третичная структура белка - это глобулы, образованные α-вторичной структурой в результате свертывания полипептидных цепей в клубки. Свертывание α-спиралей в глобулы происходит в результате взаимодействия друг с другом гидрофобных участков спирали, электростатического взаимодействия заряженных участков цепи, образования сульфидных мостиков и водородных связей.
Четвертичная структура возникает в результате объединения глобул в еще более сложную структуру.
Свойства белков как биолигандов определяются содержанием в полипептидных цепях донорных атомов азота и кислорода, которые могут участвовать в образовании хелатных циклов и макроциклических комплексов. Кроме того, к полипептидным цепям через различные функциональные группы могут быть привязаны порфириновые кольца. Порфирин содержит четыре пиррольных ядра (с различными заместителями):
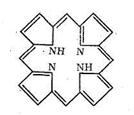
Как видно из схемы, порфирин представляет собой пример макро-циклического лиганда с четырьмя донорными атомами азота, которые координируются ионами металла, если создаются условия для вытеснения двух протонов порфирина и замещения их на ионы металла. Размер полости порфирина составляет около 2Ǻ (диаметр). Порфирин принадлежит к числу «жестких» лигандов, структура которых (и размер полости) мало зависит от природы координируемого иона металла. Порфириновые металлоциклы содержатся в хлорофилле и гемоглобине. Строение порфиринсодержащих комплексов биометаллов будет рассмотрено дальше.
Нуклеиновые кислоты - третий вид наиболее важных биополимерных лигандов. Роль нуклеиновых кислот в биосистемах состоит в хранении и передаче информации о строении синтезируемых организмом белков. Нуклеиновые кислоты состоят из мономеров - нуклеотидов. Каждый нуклеотид содержит фрагменты углевода, гетероциклического основания и остаток фосфорной кислоты. Нуклеотиды соединяются в нуклеиновые кислоты по следующей схеме:
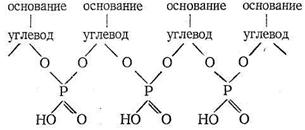
Примером гетероциклических оснований могут служить аденин и урацил:

В качестве углеводного компонента нуклеиновых кислот выступают рибоза и продукт ее восстановления - дезоксирибоза:
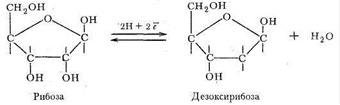
В зависимости от природы углеводного фрагмента нуклеиновые кислоты делятся на две группы: рибонуклеиновые (РНК) и дезоксирибонуклеиновые (ДНК) кислоты. ДНК в растворах имеют строение двойных спиралей. Внутрь спирали обращены гетероциклические основания, скрепленные друг с другом водородными связями, наружу обращены фосфатные группировки. Совершенно ясно, что ДНК и РНК обладают свойствами лигандов: донорные атомы имеются во всех фрагментах нуклеиновых кислот.
Кроме белков, полисахаридов и нуклеиновых кислот в биосистемах обычно присутствует большое число других химических соединений, проявляющих свойства лигандов и обладающих биологической активностью. Среди них особенно важную роль играют различные органические кислоты, как насыщенные, так и ненасыщенные, например аскорбиновая кислота:
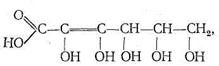
производные фосфорной кислоты (такие, как аденозинфосфаты, липиды) и др.
3 . Биологическая роль неорганических соединений
Биологическая роль неорганических веществ (О2, СО2, N2 и т. д.), а также ионов металлов и соединений, включающих эти ионы и атомы металлов, связанные ковалентно, чрезвычайно важна и многообразна. Один из основных процессов, связанных с участием неорганических соединений, - процесс фотосинтеза. Именно взаимодействие Н2О и СО2 - двух неорганических соединений - приводит (при катализирующем действии хлорофилла - магниевого комплекса порфирина) к синтезу крахмала С6Н12О6 с выделением кислорода:
![]()
Эта реакция проходит через большое число стадий, но суть фотосинтеза состоит все же в соединении неорганических веществ в углевод. Углеводы, синтезируемые в растениях, потребляются травоядными животными. В результате пищеварения и дальнейших сложных превращений в организме травоядных образуются белки и жиры, служащие пищей для хищников и всеядных животных. К числу последних может быть отнесен и человек. Источником энергии, необходимой для жизнедеятельности человека и животных, являются белки, жиры и углеводы, содержащиеся в продуктах питания растительного и животного происхождения. Окисляясь (неорганическим) молекулярным кислородом, эти вещества, вернее продукты их деструкции, дают организму энергию, затрачиваемую на другие жизненно важные химические процессы и превращаемую в механическую энергию (движение), электрическую энергию и др.
Уже упоминалось, что важнейшую роль в процессах метаболизма играют ионофоры, регулирующие содержание акваионов щелочных и щелочноземельных металлов во внеклеточном и внутриклеточном пространстве, а также ферменты. Ферменты - всегда белковые вещества. Они ускоряют или ингибируют важнейшие процессы в организме, способствуют переносу в тканях кислорода и углекислого газа, переносу электронов, ускорению гидролитических процессов.
Роль акваионов металлов и металлсодержащих комплексов в живых организмах состоит в регуляции процессов, связанных с получением, преобразованием и распределением в организме энергии, выделением вредных для организма продуктов реакции.
Рассмотрим на ряде примеров биологическую роль акваионов металлов и их комплексов с биолигандами.
Транспорт ионов металлов и других неорганических компонентов в растительных и животных организмах
Для нормального функционирования живых организмов необходимо строго определенное распределение химических веществ по различным частям организма. В тканях млекопитающих действует система транспорта ионов натрия или калия, получившая название «натриевый (или калиевый) насос». Важнейшую роль играет также транспорт железа и других биометаллов.
Натриевый насос обеспечивает необходимое соотношение концентраций ионов Na+ и К+ во внеклеточном и внутриклеточном пространстве. Установлено, что в большинстве клеток животного организма [К+] составляет 0,12-0,16 моль/л, тогда как [Na+] в тех же клетках не превышает 0,01 моль/л. Во внеклеточной жидкости соотношение обратное: [Na+]≈0,15 моль/л, а [К+] меньше, чем 0,004 моль/л. Таким образом, существует значительный градиент концентраций ионов К+ и Na+ между внеклеточным и внутриклеточным пространством. Такое распределение не может быть самопроизвольным, очевидно, требуется затрата энергии, чтобы ионы К+ накапливались внутри клеток, а ионы Na+ оттуда выводились. Установлено, что «насос», накачивающий ионы К+ в клетки к выкачивающий оттуда ионы Na+, т. е. действующий против концентрационного градиента, работает с помощью фосфатопротеина, который образует с ионами К+ более прочные соединения (в силу соответствия размеров иона К+ и полости ионофора), чем с ионами Na+. В составе комплекса с фосфатопротеином ион К+ проходит через клеточную мембрану. Во внутриклеточном пространстве фосфато-протеин взаимодействует с аденозинтрифосфатом. Новый лиганд образует более прочное соединение с ионами Na+, нежели с ионами К+ и выводит ионы Na+ из клетки во внеклеточное пространство.
Железо в виде ионов Fe2+, Fe3+ и биокомплексов необходимо организму животных и человека для выполнения важнейших жизненных функций, таких, например, как перенос кислорода и катализ окислительно-восстановительных процессов, служащих одним из главных источников энергии. В организме животных и человека железо накапливается и сохраняется в печени, селезенке и костном мозге в виде белковых образований - ферритина и гемосидерина. Белковая часть ферритина представляет собой сферическое образование (внешний диаметр около 120 Ǻ) с внутренней полостью диаметром около 75 Ǻ. В полости ферритина находится мицелла, состоящая из гидратированного и гидролизованного фосфата Fe(III). Масса сухого остатка, содержащего железо, составляет 23% от массы ферритина (в гемосидерине железа еще больше).
Транспорт железа от ферритина к красным кровяным тельцам происходит с помощью белка трансферрина, очень прочно связывающего Fe (III) в хелат. Установлено, что хелаты Fe(III), образованные белками типа трансферрина, переносят железо через биомембраны, тогда как сам по себе фосфат железа, содержащийся в ферритине и гемосидерине, преодолеть этих преград не может.
Транспорт О2 в организме животных и человека осуществляется железосодержащими комплексами - гемоглобином и миоглобином. Оба этих белка содержат «гем-группы», представляющие собой порфириновый комплекс железа:
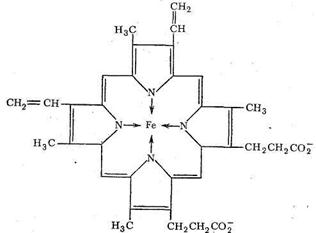
Гемовая группа присоединяется к белковой части молекулы гемоглобина и миоглобина путем координации гистидинового атома азота белка ионом железа гемовой группы. Таким образом, в координационную сферу иона железа входит пять атомов азота (четыре атома азота порфирина, один атом азота белкового гистидина). Шестое координационное место занимает Н2О или О2.
Гемоглобин имеет молекулярную массу 64 500 и включает четыре гем-группы. Миоглобин сходен с гемоглобином по строению, но содержит только одну гем-группу. Гемоглобин почти так же хорошо, как миоглобин, связывает кислород при высоком давлении кислорода, но, когда давление кислорода падает, преимущество в связывании О2 имеет миоглобин. Падение давления О2 наблюдается в тканях мышц, потребляющих кислород. Результатом использования кислорода является накопление в мышцах СО2 и, как следствие, понижение рН. Это еще более способствует высвобождению О2 из гемоглобина и передаче кислорода миоглобину. Таким образом, и гемоглобин, и миоглобин участвуют в переносе кислорода.
Теряя кислород, железо в гемоглобине (форма дезоксигемоглобина, КЧ железа = 5) переходит в высокоспиновое состояние. Ослабление связи с атомами азота порфирина приводит к выходу атома железа из плоскости кольца порфирина (на 0,7-0,8Ǻ). Напротив, вследствие присоединения кислорода к гемоглобину образуется низкоспиновый октаэдрический комплекс, железо в котором находится в плоскости порфиринового кольца (КЧ железа = 6). Хотя связывание молекулярного кислорода гемоглобином и миоглобином сопровождается ослаблением связи O = O в молекулярном кислороде из-за размещения π-дативных электронов железа на разрыхляющих орбиталях О2, этот процесс сам по себе не сопряжен с необратимым переносом электрона, поэтому его обычно не причисляют к ферментативным окислительно-восстановительным реакциям. Отметим, однако, что разрыхление связи O = O в не может не активировать окислительные реакции.
Например, можно рассматривать взаимодействие активированной формы О2 с восстановленной формой субстрата StH2, сопровождающееся переходом его в окисленную (дегидрированную) форму St:
|
|
При этом кислород превращается в Н2О и Н2О2 с выделением энергии.
Металлсодержащие ферменты
Далеко не все ферменты, катализирующие биологически важные процессы в организме животных и растений, содержат ионы металлов. Однако металлсодержащих ферментов только в организме человека несколько сотен, и их биологическая роль чрезвычайно важна. Нарушение структуры или удаление из организма даже одного из них приводит к тяжелым расстройствам функций организма, а затем и к его гибели.
Металлсодержащие ферменты представляют собой координационные соединения, и поэтому их исследованием занимается неорганическая химия или, точнее, координационная химия.
Рассмотрим строение и биологическую роль нескольких металлоферментов.
Каждый фермент состоит из двух частей: кофермента и апофермента. Кофермент - это легко отделяемая часть фермента. В металлоферментах ион металла составляет основную часть кофермента. Апофермент-остальная часть фермента, которая в отсутствие кофермента не проявляет ферментативной активности.
Обычно рассматривают две группы металлоферментов, различающихся по типу катализируемых ими реакций: ферменты, катализирующие реакции гидролиза, и ферменты, катализирующие протекание окислительно-восстановительных реакций.
Ферментативный катализ реакций гидролиза
Реакции, протекающие в организмах животных и растений с участием воды, играют важнейшую роль в процессе обмена веществ и служат одним из основных источников "энергии, запасаемой организмом.
Реакции гидролиза катализируются обычно теми металлоферментами, которые содержат ионы Са2+, Mg2+, Zn2+ и Мn2+. Хотя ион Мn2+ легко вступает в окислительно-восстановительные реакции, в ходе гидролитических реакций он, как и все упомянутые ионы, не меняет степени окисления.
Наиболее хорошо изучены строение и биологическая роль двух из металлоферментов, катализирующих гидролитические процессы, - цинксодержащих ферментов карбоангидразы и карбоксилазы. Отметим, однако, что только в организме человека содержится несколько десятков цинксодержащих ферментов, различающихся по своему строению и функциям.
Карбоангидраза состоит из больших белковых молекул с молекулярной массой 430 000. Каждая из таких макромолекул содержит 260 аминокислотных остатков. Форма молекулы карбоангидразы - эллиптическая, размеры ее (40x45x55) А3. Эллиптическая молекула карбоангидразы имеет полость, причем аминокислоты, составляющие белок апофермента, расположены так, что гидрофобные их части как бы выстилают внутреннюю полость макромолекулы. В одной молекуле фермента содержится только один ион Zn2+, который находится вблизи центра полости карбоангидразы. Координационный полиэдр комплекса, центральным ионом которого является Zn2+, представляет собой искаженный тетраэдр. Три положения в координационной сфере Zn2+ занимают донорные атомы азота из имидазольных групп аминокислоты гистидина:
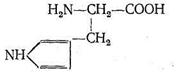
Четвертое координационное место занято молекулой Н2О или ионом ОН-. Фермент карбоангидраза содержится в красных кровяных тельцах. Установлено, что карбоангидраза примерно в 106 раз ускоряет реакцию образования бикарбонат-иона и обратную ей реакцию распада НСО3 -:
![]()
Рассмотрим предполагаемый «концертный» механизм действия карбоангидразы. Ион Zn2+, входя в состав несимметрично построенного координационного соединения (имеющего по этой причине напряженную структуру), обладает высокой реакционной способностью. Столкновение на активном центре карбоангидразы иона Zn2+, СО2 и иона ОН - в полости карбоангидразы приводит к активации всех участвующих в реакции веществ, в результате чего быстро образуется бикарбонат цинка:
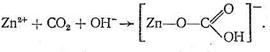
Следующий этап процесса состоит в обмене образовавшегося бикарбонат-иона на Н2О или ОН-, т. е. в высвобождении активного центра фермента для последующих актов катализа.
Установлено, что ингибирование реакции синтеза и распада бикарбонат-ионов достигается введением в координационную сферу иона Zn2+ лигандов, образующих более прочную связь с Zn2+, чем с НСО3-, Н2О или ОН-. Такими являются ионы CN-, N3-, S2O42 - и др. Так как в некатализируемых условиях (в присутствии CN-, N3 - и т. д.) синтез НСО3 - и его распад протекают слишком медленно, физиологические требования не выполняются, нормальное состояние организма нарушается.
Каталитическая активность карбоангидразы не понижается при замене Zn2+ на ион Со2+, в других случаях активность фермента либо падает, либо исчезает.
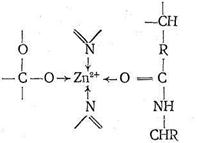
Карбоксипептидаза представляет собой фермент, вырабатываемый поджелудочной железой млекопитающих. Так же как карбоангидраза, этот фермент содержит один ион Zn2+ на одну белковую макромолекулу, молекулярная масса которой 34300. Биологическая роль карбо-ксипептидазы заключается в катализе процесса гидролиза пептидов - разрыве пептидной связи на карбоксильном конце пептидной цепи:
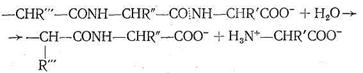
Ион Zn2+ в карбоксипептидазе, так же как в карбоангидразе, находится в полости активного центра фермента, но только два места в его координационной сфере заняты азотом имидазольных остатков гистидина. Третье место занято кислородом другой аминокислоты - глутамина. Четвертое координационное место в координационной сфере Zn2+ принадлежит молекуле воды. Таким образом, и в этом ферменте координационная сфера Zn2+ несимметрична, что, по-видимому, обусловливает напряженность структуры фермента и является обязательным условием каталитической активности комплексных соединений.
|
|
Предполагают, что одной из важных стадий каталитического процесса, протекающего с участием карбоксипептидазы, является координация ионом Zn2+ атома кислорода карбонила пептидной цепи с вытеснением Н2О, занимающей одно место в координационной сфере. Координация цинком карбонильного кислорода ослабляет связь С-N в пептидной цепи, что облегчает ее разрыв, сопровождающийся гидролизом. Гидролиз разорванной цепи приводит к ослаблению координации карбонильного кислорода пептидной цепи ионом Zn2+. Происходит вытеснение молекулой Н2О, затем вновь следует координация ионом Zn2+ карбонильного кислорода неразорванной цепи и т, д, Ферментативная активность карбоксипептидазы сохраняется, если Zn2+ заменить на ион Со2+, так же как в случае карбоангидразы. По-видимому, это связано с очень близкими величинами констант устойчивости (т. е. сходными термодинамическими, характеристиками) аналогичных комплексов Zn2+ и Со2+, а также одинаковыми размерами этих ионов. Замена Zn2+ в карбоксипептидазе на Gd2+, Hg2+, Cu2+, Pb2+ приводит к исчезновению каталитической активности фермента.
К группе ферментов, катализирующих процессы гидролиза, относятся также киназы, ускоряющие перемещение различных фрагментов биолигандов (например, ионы РО3-)от одного биополимера к другому. Все киназы содержат ионы М2+. Аминопептидазы (ионы Mg2+, Zn2+, Mn2+, Ca2+-кофермент) катализируют гидролиз пептидов, при этом каждый из большого числа ферментов, входящих в эту группу, ускоряет разрыв пептидной связи именно для данного сочетания разноименных аминокислот в пептидной цепи. Фосфатазы катализируют гидролиз сложных эфиров на основе ортофосфорной кислоты.
Ферментативный катализ окислительно-восстановительных реакций
Окислительные реакции, протекающие в живом организме с участием молекулярного кислорода, вносят основной вклад в накопление организмом энергии. Окислительно-восстановительные реакции в отсутствие катализатора всегда протекают медленнее, чем реакции обмена ионов (тоже не катализируемые), например реакции гидролиза. Поэтому роль ферментативного катализа в ускорении окислительно-восстановительных процессов, протекающих в живых организмах, является особенно важной. Окислительно-восстановительные реакции в организме катализируются ферментами, содержащими ионы цинка, железа, меди, молибдена, кобальта. Роль металлсодержащих групп в ферментах, катализирующих окислительно-восстановительные процессы, изучена недостаточно. Однако ясно, что ион металла в ф ерменте не всегда входит в активный его центр. В ряде случаев ионы металла определяют лишь третичную и четвертичную структуру белка, образующего апофермент, а сам по себе кофермент ионов металла не содержит. Тем не менее роль металла остается крайне важной - замена ионов одного металла на другой меняет структуру фермента и его активность.
Из металлсодержащих ферментов, катализирующих окислительно-восстановительные процессы, наиболее изучены цинксодержащие дегидрогеназы, а также железосодержащие ферменты.
К числу ферментов, катализирующих окислительно-восстановительные реакции, относятся гемсодержащие ферменты - цитохромы. Атомы железа в цитохромах, так же как в гемоглобине и миоглобине, координируют пять атомов азота (порфирина и гистидина), шестое координационное место занимает атом серы аминокислоты - метионина. Известно 50 видов ферментов этого типа, несколько различающихся по составу органической его части. Железо в цитохромах играет роль переносчика электронов - оно принимает электроны от восстановителя и передает их окислителю. Окислителем может быть и кислород, но он не участвует в координации железа, входящего в состав цитохромов, поскольку железо в цитохроме имеет полностью насыщенную координационную сферу.
Среди гемсодержащих ферментов, катализирующих окислительно-восстановительные реакции, также большое значение имеют гем-белки - каталаза и пероксидаза, ускоряющие распад перекиси водорода. Последняя образуется в результате катализируемого ферментами взаимодействия восстановленных форм субстратов с молекулярным кислородом.
Кроме гемсодержащих ферментов известно большое число металлсодержащих ферментов, имеющих «негемовое» строение. К их числу принадлежат ферредоксины, играющие в живых организмах, подобно цитохромам, роль переносчиков электронов. Ферредоксины имеют молекулярную массу от 6000 до 12 000. Атомы железа в них окружены четырьмя атомами серы:
![]()
Концевые атомы серы принадлежат цистеиновому фрагменту белка. Считают, что важную роль источника (или «ловушки») электронов играет группировка Fe4S4, содержащаяся в каждом из ферредоксиновых белков.
Окислительно-восстановительные реакции катализируются также металлоферментами, включающими медь и другие металлы. Важное значение имеет оксидаза аскорбиновой кислоты, содержащаяся в растениях и микроорганизмах. Молекулярная масса оксидазы 140 000, на одну такую белковую глобулу приходится восемь атомов меди. Как показывает название, оксидаза катализирует переход аскорбиновой кислоты в дегидроаскорбиновую кислоту. Медь также содержится в белке-гемоцианине, который способен связывать молекулярный кислород (О2 на два атома меди). Используется гемоцианин для транспорта кислорода в организмах низших животных.
К числу ферментов, катализирующих перенос электронов, т. е, окислительно-восстановительные процессы, относится нитрогеназа, содержащаяся в азотистых бактериях. Нитрогеназа катализирует связывание атмосферного азота. С использованием меченого азота (15N2) показано, что бактерии восстанавливают N2 в первую очередь до аммиака. Этот процесс происходит только в присутствии Mo, Fe и Mg. Установлено, что нитрогеназа состоит из двух белков (молекулярная масса 250 000 и 70 000), каждый из которых по отдельности не активен.
Только в совместном присутствии эти белки проявляют каталитический эффект. В одном из белков содержится на одну глобулу один-два атома Мо, 15 атомов Fe, большое количество серы; во втором-молибдена нет. имеются два атома железа и два атома серы (неорганической, не входящей в состав белка).
Хлорофилл в зеленых растениях играет важнейшую роль, связанную с энергетическим обеспечением окислительно-восстановительных процессов при фотосинтезе. Установлено, что хлорофилл, т. е. порфириновый комплекс Mg2+, содержащийся в хлоропласте зеленых частей растения, поглощает световую энергию. Длина волны поглощаемого света (~ 700 нм) определяется системой сопряженных связей в порфириновом комплексе. Вхождение Mg2+ в порфириновый комплекс делает лиганд более жестким, что уменьшает рассеяние энергии в результате колебательных движений.
Световая энергия, запасенная хлорофиллом, расходуется на протекание эндотермической реакции, которая называется реакцией фотосинтеза:
![]()
Механизм фотосинтеза в полной мере не изучен. Известно только, что в стадиях фотосинтеза принимают участие комплексы четырех металлов (включая магний хлорофилла). Так, установлено, что в стадии переноса электрона, завершающейся отщеплением молекулярного кислорода, участвует комплекс марганца; на последующих стадиях в реакции вступают комплексы железа (ферредоксин, цитохромы) и меди (пластоцианины).
Таким образом, роль хелатных комплексов металлов в регулировке сложнейших процессов, протекающих в живых и растительных организмах, чрезвычайно важна и многообразна. Отметим еще некоторые из биологически важных процессов, связанных с участием неорганических соединений или ионов.
Другие биологические функции неорганических соединений.
Роль ионов Са2+ в организмах животных и растений сложна. Больше всего кальция содержится в костной ткани. Кристаллы кости имеют приблизительный состав Са10(Р04)6(ОН)2 и, таким образом, относятся к числу гидроксилапатитов. Минеральная часть кости включает, кроме того, карбонаты, фториды, цитраты и гидроокиси металлов, среди которых, кроме Са2+, есть Mg2+, Na+ и К+. Неорганическая часть кости составляет только 0.25 ее массы - остальное органические компоненты.
Среди наиболее важных функций Са2+ - его роль в ферментативных системах, в том числе как регулятора сокращения мышц, передатчика нервного импульса, а также в системе свертывания крови.
В организм кальций вводится в виде среднего фосфата, содержащегося в пище. В пищеварительном тракте под влиянием кислой среды средний фосфат преобразуется в хорошо растворимые кислые фосфаты СаНРО4 и Са(Н2РО4)2. Именно кислые фосфаты всасываются в кишечнике и переходят в плазму крови.
Концентрация ионов Са2+ в крови человека составляет обычно 0,0022-0,0028 моль/л. Примерно половина кальция находится в виде акваионов, способных проходить через мембраны. Другая часть связана с белком (альбумин) и через мембраны не проходит. Интересно, что концентрацию кальция можно определить, используя биологический тест - по частоте сокращения сердца лягушки (или черепахи). Этот способ определения концентрации незакомплексованного Са2+ был использован для определения Куст хелатных комплексов кальция в неорганических исследованиях.
Ионы Са2+ наряду с ионами К+ и Mg2+ влияют не только на частоту сокращения мышц, в том числе сердечной мышцы, но и на действие сердечных гликозидов (типа наперстянки шерстистой - Digitalis). Известно, что при передозировке гликозидов сердце останавливается. Введение при этом ионов К+ и Mg2+ в мышцу сердца ослабляет действие гликозидов, а введение Са2+ - усиливает. Однако ионы Са2+ можно связать в прочный комплекс, например с ЭДТА. Так, если вовремя ввести ЭДТА в мышцу остановившегося сердца, оно вновь начинает биться.
Переизбыток Са2+ оказывает нежелательные воздействия на организм - происходит «образование камней», «отложение солей» и т. д. Так как ионы Са2+ и Mg2+ входят в состав ткани стенок бактериальных клеток, изменение содержания ионов Са2+ в системе может привести к гибели микроорганизма. Такой эффект наблюдается, в частности, если в систему ввести ЭДТА или другой комплексон высокой дентатности. ЭДТА, связывая Mg2+ и Са2+ в прочный комплекс, разрушает стенки бактериальных клеток, что и приводит к гибели микроорганизмов. Вымывание из организма ионов Са2+ и других полезных ионов происходит при использовании комплексонов и хелатообразователей для удаления из организма ионов токсичных металлов, таких, как Hg2+, Pb2+ и др. Чтобы уменьшить вымывание ионов Са2+ при лечении тех или иных заболеваний, в организм вводят ЭДТА в виде кальциевого комплекса СаЭДТА2-.
Ионы щелочных металлов, как уже упоминалось, выполняют в живых и растительных организмах многообразные функции. Это относится не только к ионам Na+ и К+. Установлено, что прием препаратов, содержащих ионы Li+ и Rb+, облегчает состояние больных, у которых обнаружен маниакально-депрессивный синдром.
Передозировка в организме ионов металлов, принадлежащих к числу «металлов жизни», а также случайное введение ионов других металлов (например, Hg2+, Be2+, Cd2+, Pb2+) вызывают тяжелые нарушения жизнедеятельности организма. В эт,их случаях лечение проводят, используя медикаменты (детоксиканты), проявляющие свойства лигандов специфического действия.
Предложено использовать для выведения из организма ионов металлов, проявляющих токсический эффект, следующие лиганды.
Этилендиаминтетраацетат (ЭДТА) - в виде соли кальция - выводит из организма Pb2+, V(IV), V(V). Если ЭДТА применяют дли регулировки свертывания крови, то вводят натриевую соль, чтобы понизить [Са2+].
Ауринтрикарбоксилат или салицилат (натрия) вводят в организм для закомплексовывания бериллия. Комплексы Ве2+ с этими лигандами проходят через биомембраны, и таким образом Ве2+ может быть удален из организма.
D-пеннициламин (HSC(CH3)2-CHNH2-COOH) используют для специфического связывания Сu2+ и выведения меди из организма, в частности, если в результате передозировки или неправильного функционирования организма в печени, мозге и почках накапливается медь (болезнь Вильсона, лейкемия и др.).
Димеркаптал СН2ОН-CHSH-CH2SH закомплексовывает и выводит из организма Hg, As, Те, Tl, Au.
Ферриоксимин-В-полигидроксамовая кислота используется для специфического связывания и выведения из организма избытка железа при заболевании «сидерозис».
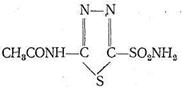
Многие лекарства, применяемые в медицинской практике, представляют собой лиганды, ингибирующие действие активных центров металлов-ферментов путем координационного насыщения ионов металлов. Например, введение в организм диакарба приводит к подавлению ферментативной активности карбоангидразы, катализирующей реакцию связывания воды и СО2в бикарбонат-ион.
|
|
Ингибирование карбоангидразы диакарбом достигается вследствие координации ионом Zn2+ атома серы диакарба. В результате координация Н2О и СО2 цинком прекращается, вода не связывается в НСО3-я выводится из организма - достигается диуретический эффект. К той же группе лекарств относится дисульфурам который блокирует ионы Сu2+ в ферменте, катализирующем окисление ацетальдегида.
|
|
Это лекарство используется при лечении алкоголизма, поскольку накопление ацетальдегида в организме вызывает неприятные ощущения и отвращение к алкоголю.
Многие яды действуют по аналогичному механизму. Например, угарный газ и цианиды блокируют ионы железа в гемоглобине и делают невозможным перенос О2 от легких к периферийным тканям. Организм «обескислороживается» и гибнет.
Действие многих лекарств основано на способности комплексных соединений ионов металлов проходить через биомембраны, тогда как акваионы и лиганды, взятые в отдельности, такой способностью обладают в очень малой степени либо вообще не обладают. Примером могут быть антибиотики, активность которых существенно возрастает в присутствии ионов металлов. То же относится к противогрибковым препаратам типа 8-оксихинолината Fe (III). Установлено, что только совместное присутствие акваионов Fe3+*aq и 8-оксихинолина дает антигрибковый эффект. Очевидно, что образующийся комплекс железа (III) проходит через стенки клеток грибков и вызывает их гибель.
Интересные данные получены в последнее время о катионных комплексах типа Co(NH3)63+, Co(NH3)5O22+ и комплексах железа, рутения и других переходных металлов с нейтральными лигандами типа фенантролина и дипиридила. Оказалось, что эти (вероятно, и другие) катионные комплексы переходных металлов сходны по геометрии и плотности положительного заряда с «головкой» ацетилхолина [(CH3)3N+](CH2)2COOCH3. Ацетилхолин является действующим началом яда кураре, вызывающего паралич нервных окончаний. Указанные катионные комплексы вызывают подобное действие, об этом следует помнить, когда в практикумах по неорганической, аналитической я координационной химии проводится синтез такого рода комплексных соединений.
Изучение биологической активности неорганических соединений только начинается. Интерес к испытанию их биологической активности резко возрос после открытия в 1969 г. противораковой активности соли Пейроне - цис-дихлородиамминплатины(Н). Было замечено, что электролиз раствора NH4CI с использованием платиновых электродов приводит к потере способности воспроизводства у кишечной палочки Е. Соli. Это отнесли к положительному действию соли Пейроне, присутствующеи в растворе. Поскольку антираковое и антимикробное действие симбатны, соль Пейроне была испытана на антираковое действие и показала высокую эффективность. Сейчас проводятся поиски столь же эффективных, но менее токсичных медикаментов. Установлено, что антираковое действие зависит от строения комплексов платины (и других металлов). В частности, транс-изомер дихлородиамминплатины(П) не проявляет антиракового действия. Замена атомов С1 на Вr и I делает неактивными и цис-изомер.
Бионеорганическая химия и охрана окружающей среды
Бионеорганические аспекты экологии имеют большое значение. В частности, внедрение в химическую технологию и сельское хозяйство реагентов, способных закомплексовывать ионы металлов, вызывает нежелательные сдвиги природных равновесий. Можно упомянуть, например, действие комплексонов, сбрасываемых в больших количествах в природные водоемы предприятиями, применяющими эти реагенты для «умягчения» воды: фотопромышленностью, красильной (текстильной и полиграфической) промышленностью, энергетикой (введение в воду паровых потоков и отопительной сети комплексонов для предотвращения осадкообразования), нефтяной и цементной промышленностью (предотвращение солеотложений в трубах, замедление схватывания бетона), сельским хозяйством (для борьбы с хлорозом и анемией вводят железо в почву или в пищу животных в виде комплексонатов, не подвергающихся гидролитическому разрушению и легко усвояемому животными, в отличие от акваионов Fe (II), Fe(III) в растворах простых солей). Комплексоны, попадая в природные водоемы, вызывают растворение осадков токсичных металлов, десятилетиями накапливающихся на дне морей и океанов. Переходя в раствор в виде комплексонатов, ионы Hg2+, Zn2+, Cd2+, Pb2+ и других токсичных металлов проникают через биомембраны и отравляют живые организмы. Присутствие комплексонатов в природных водах вызывает гипоксию (недостаток кислорода), а вследствие этого гибель планктона и в конце концов гибель высших животных, стоящих в конце экологической цепи. Кислород тратится на окисление ионов металлов, например на переведение Fe(II) в Ре(III). Комплексоны этому способствуют, так как стабилизируют высшие степени окисления металлов, которым отвечают наиболее, устойчивые комплексы. Поэтому нельзя не отметить важность работ, посвященных синтезу, исследованию и разработке методов использования комплексообразующих агентов, которые легко бы обезвреживались, попадая в условия сброса. Интерес, на наш взгляд, представляют комплексоны типа этилендиаминдиянтарной кислоты. Эти соединения, обладая высокой комплексообразующей способностью, в природных средах быстро дезактивируются и не смещают установившегося равновесия.
В плане охраны окружающей среды могут рассматриваться и работы по моделированию процесса связывания атмосферного азота. Замена энергоемкого производства синтезом азотсодержащих соединений в мягких условиях (подобно условиям связывания N2 азотистыми бактериями) приведет в конечном итоге к сбережению природных ресурсов и охране биосферы.