Реферат: Гетерогенный катализ
Гетерогенный катализ.
Гомогенно-каталитизируемое превращение протекает в одной фазе, где смешаны и реагенты, и катализатор, и продукты. В гетерогенно-катализируемом превращении катализа-тор образует отдельную фазу, а химический элементарный акт протекает на её поверхности и пространственно как бы отделён от основной массы и реагентов, и продуктов. Поэтому для кинетического моделирования этого сложного превращения его необходимо представить как результат суперпозиции нескольких элементарных процессов. Это:
- 1) Диффузия реагента из объёма к поверхности катализатора (массоперенос).
- 2) Адсорбция реагента на поверхности катализатора.
- 3) Химическое превращение реагента в продукт на поверхности катализатора.
- 4) Десорбция продукта с поверхности катализатора.
- 5) Диффузия продукта от поверхности катализатора в объём (массоперенос).
Эти элементарные процессы удобно математически вначале смоделировать по отдельности:
Диффузия из объёма к поверхности
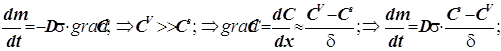 (12.1)
(12.1)
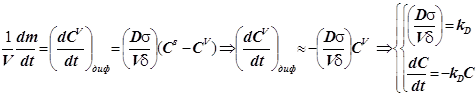 ; (12.2)
; (12.2)
Уравнение массопереноса под влиянием диффузии имеет первый порядок по концентрации. Формально оно не отличается от обычного кинетического уравнения. Диффузия - процесс активационный с относительно небольшой энергией активации - всего около 4-9 кДж/моль.
2) Режим диффузионнный и режим кинетический.
В стационарном режиме скорость химического превращения на поверхности равна скорости диффузии вещества из объёма к поверхности:
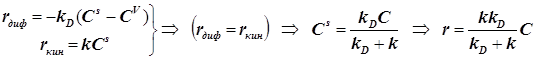 ; (12.3)
; (12.3)
Отсюда появляется две возможности -два возможных режима процесса:
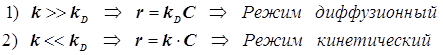 (12.4)
(12.4)
3)Адсорбция на поверхности. Уравнение Лангмюра для одного адсорбата.
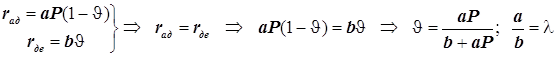
![]() ;
; 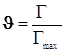 ;
; ![]() ;
(12.5)
;
(12.5)
Кривая Лангмюра в
области начала кривой адсорбции может быть заменено более простым уравнением
Бедекера-Фрейндлиха: ![]()
Рис.24. Кривая адсорбции.
3.1) Адсорбция на поверхности.
Уравнение Лангмюра для нескольких адсорбатов.
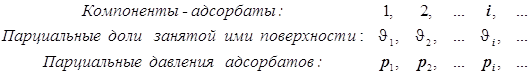
В таком случае
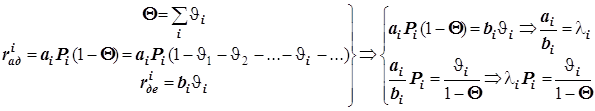
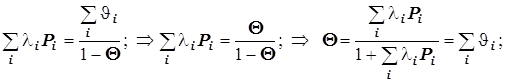
![]()
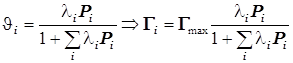 (12.6)
(12.6) ![]() ® (
масса/площадь)
® (
масса/площадь)

Это уравнение полезно для формально-кинетического описания гетерогенно-каталитических реакций
3.2) Активированная адсорбция.
Изобара Тэйлора. Хемосорбция.
Пример высокой энергии активации при адсорбции и её причины. Е*=40-80 кДж/моль. Кривая хемосорбции отражает смешанный механизм поглощения вещества поверхностью и не имеет точного количественного описания.
![]()
|
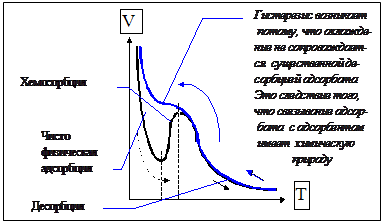
![]() Рис.26. Изобара
Рис.26. Изобара
хемосорбции.
4) Поверхностный гетерогенно-каталитический процесс (общие сведения).
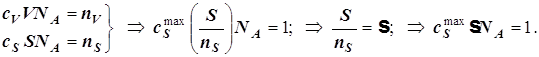 . (12.7)
. (12.7)
![]()
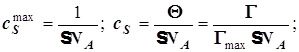 (12.8)
(12.8)
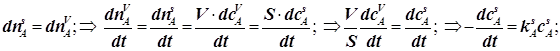
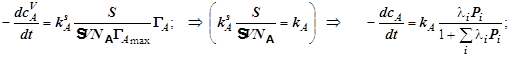 (12.9)
(12.9)
4.1) Поверхностный гетерогенно-каталитический процесс (частная модель).
(Механизм Лангмюра-Хиншельвуда для гетерогенно-каталитической реакции)
Для
гетерогенно-каталитической реакции ![]() формулы 12.9 означают:
формулы 12.9 означают:
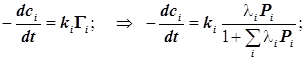 (12.10)
(12.10)
4.2.1) Рассмотрим частные случаи. Для определённости выделим пару реагент-продукт:
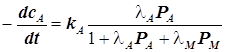 , где
, где 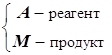 . (12.11)
. (12.11)
Основные случаи следующие:
1) Продукт M адсорбируется слабее реагента A:
![]()
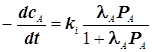
а) ![]()
![]() Наблюдаем:1-й порядок по реагенту A
Наблюдаем:1-й порядок по реагенту A
б) ![]()
![]() Наблюдаем: 0-й порядок по реагенту A
Наблюдаем: 0-й порядок по реагенту A
2) Реагент A
адсорбируется слабее продукта, а продукт M адсорбируется очень сильно: ![]()
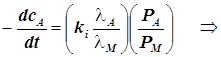 Продукт M тормозит реакцию.
Продукт M тормозит реакцию.
4.3) Приведём несколько различных вариантов протекания гетерогенного катализа в реакциях разложения соединений на металлических катализаторах. (см. А.В. Раковский, Курс физической химии, стр.510-511):
4.3.1. Слабая адсорбция. Молекулы покрывают лишь малую часть катализатора:
Так протекает
разложение 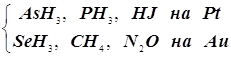 Порядок первый.
Порядок первый.
4.3.2. Средняя
адсорбция реагирующего газа: Разложение ![]() . Порядок дробный - согласуется с уравнением
адсорбции Бедекера- Фрейндлиха.
. Порядок дробный - согласуется с уравнением
адсорбции Бедекера- Фрейндлиха.
4.3.3. Реагирующее вещество адсорбируется слабо, а продукт со средней силой:
![]()
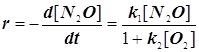
4.3.4. Реагирующий газ адсорбируется слабо, продукт сильно:
![]() на Pt :
на Pt : 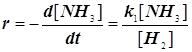
4.3.5. Реагирующий газ адсорбируется сильно:
![]() на W: нулевой порядок по аммиаку.
на W: нулевой порядок по аммиаку.
Рассмотрим классический пример – газофазную реакцию: H2+1/2O 2= H2O
Истинный механизм этой реакции состоит из многих стадий (до 30). Существуют различные подходы к его описанию. Выделим лишь некоторые наиболее характерные стадии, и введём очень упрощённую модельную схему, пригодную для классификации основных элементарных превращений, и с их помощью выделим главные особенности и выявим возможные режимы протекания всего процесса. Они возникают из-за конкуренции стадий разветвления и обрыва. Приводимый ниже механизм реализуется при невысоких давлениях (несколько десятков тор) (см. М.Н. Варгафтик, «Химическая кинетика» кафедральное пособие МИТХТ под ред. акад. Я.К. Сыркина, 1970, стр. 89, а также учебник «Физическая химия» под ред. К.С. Краснова, стр. 608). Основные стадии представим в нижеследующей таблице.
Упрощённый механизм разветвлённой цепной реакцииH2+O2= H2O |
Баланс активных центров на отдельных стадиях |
Скорости элементарных стадий | |||||||
| № |
Элементарные реакции |
Исх. | Кон. |
Скорость |
Природа стадии | ||||
| 1 |
H2 |
+ O2 |
2 HO | |
r1=k1[H2][O2] |
Зарождение |
|||
| 2 | HO |
+ H 2 |
H2O |
+ H | | |
r2=k2[H 2][HO] |
Продолжение | |
| 3 | H |
+ O 2 |
HO | + O | | ( ) |
r3=k3[O2][H] |
Разветвление |
|
| 4 | O |
+ H2 |
HO | + H | ( ) | |
r4=k4[H2][O] |
||
| 5 | H |
+ O2 + M |
HO2 |
+ M | | () |
r5=k5[M][O2][H] |
квадрат. |
Обрыв |
| 6 | H |
+ M |
1/2 H2 |
+ M | |
r6=k6[M][H] |
линейн. |
Стадия 4 считается разветвлением (см. Панченков – Лебедев, стр.261, табл.27), поскольку здесь происходит пространственное разделение двух свободных валентностей; из единого центра возникают два пространственно независимых. Элементарные акты линейного обрыва (стадия 5) происходят на стенке. (На стадии 5, а далее и 6 более строго следовало бы частицы M заменить удельной поверхностью стенки S). Акты квадратичного обрыва происходят в объёме, а на стенке обрыв уже мономолекулярный (стадии 5 и 6).
Теория пределов взрыва приведена у Панченкова и Лебедева, а также у Лейдлера...
В реакционной газовой смеси (в пламени) содержится до 18% атомарного водорода. Для расчёта режимов образования и расходования этих наиболее активных частиц вводится упрощение, называемое методом полустационарных концентраций Н.Н.Семёнова, который состоит в том, что квазистационарное приближение вводится только для менее активных частиц. Концентрация наиболее активных частиц в принципе не может быть стационарной. На этой основе удаётся принципиально упростить схему её расчёта.
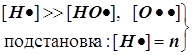
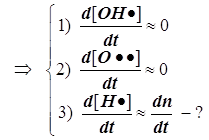
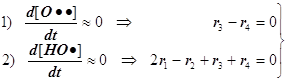
![]()
![]()
![]()
![]()
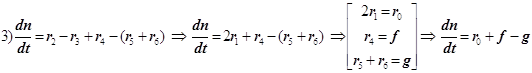 (9.1)
(9.1)
1) Цепной разветвлённый процесс есть результат суперпозиции стадий четырёх типов: зарождения, продолжения, разветвления и обрыва. На стадии продолжения число активных центров остаётся неизменным. Поэтому желательно в уравнении 3) от неё избавиться, и сосредоточиться на трёх основных стадиях, конкуренция которых формирует специфику именно разветвлённого процесса.
2) Поскольку за разветвление
ответственны наиболее активные частицы - атомарный водород, то цель преобразований
состоит в том, чтобы именно его концентрацию ввести всюду в явном виде.
Равенство ![]() позволяет
записать:
позволяет
записать: 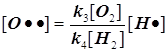 . Благодаря
уравнению 2) из главного в нашей задаче уравнения 3) :
. Благодаря
уравнению 2) из главного в нашей задаче уравнения 3) :
а) исключаем скорость ![]() , и б) заменяем скорость
, и б) заменяем скорость ![]() скоростью
скоростью ![]() , и получаем формулу (9.2).
, и получаем формулу (9.2).
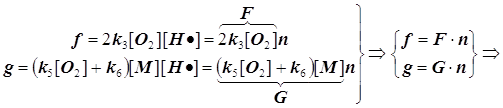
![]() (9.2)
(9.2)
Режимы разветвлённой цепной реакции
Конкуренция разветвления и обрыва
f -скорость разветвления цепи и F - фактор разветвления,
g -скорость обрыва цепи и G - фактор обрыва:
Режимы образования и гашения активных центров n:
![]()
![]()
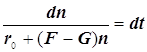
![]()
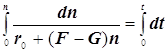
![]()
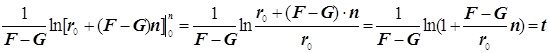
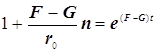
![]()
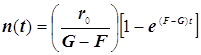 (9.3)
(9.3)
Полученное выражение предсказывает два предельных режима режима изменения концентрации активных центров, (см. рис.): а)-при доминирующем обрыве цепи система стационарно насыщается активными центрами; б)-при доминирующем разветвлении активные центры способны неограниченно накапливаться.
Эти предельные режимы цепной разветвлённой реакции следующие:
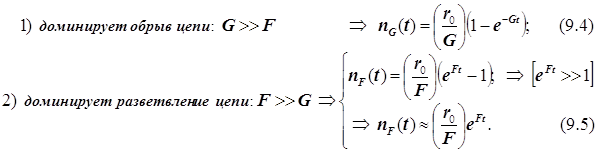
В результате конкуренции разветвления и обрыва возникает специфический механизм цепной разветвлённой реакции, зависящий от многих факторов. В книге Лейдлера (стр.194) рассматриваются взрывные пределы этой реакции. Цитируем: “Реакция водорода с кислородом протекает со скоростями, удобными для измерения между 450 и 600о С; выше этого интервала все смеси взрываются. Если стехиометрическую смесь (H2;O2) держать при (T; p)=(550 оС; 2 тор), то протекает гомогенная реакция. С постепенным повышением давления скорость реакции увеличивается. При некотором критическом давлении, величиною в несколько миллиметров (его точное значение зависит от размеров и формы реакционного сосуда), смесь взрывается. Если смесь выдерживать при p =200 тор, то вновь протекает спокойная стационарная реакция, но, если давление понизить, то при p =100 тор смесь взорвётся. Таким образом при этой температуре имеется некоторый интервал давлений, внутри которого наблюдается взрыв, а выше и ниже его реакция протекает со стационарной скоростью. Выше 600 оС смесь взрывается при всех давлениях, а ниже 400 оС не взрывается совсем. Два взрывных предела называют первым и вторым или верхним и нижним.
Существует также и третий предел при ещё более высоких давлениях. Иногда этот третий предел является просто термическим пределом; и в этих случаях скорости реакций становятся настолько высокими, что условие изотермичности не сохраняется. Такие взрывы, которые происходят за счёт повышения температуры реакционной системы, называют термическими (тепловыми) . Существуют доводы и в пользу того, что взрыв при третьем пределе в системе (H2;O2) не является термическим, а происходит за счёт внезапного повышения концентрации активных центров-свободных радикалов...”.
Заключение.
Предлагаемое пособие не учебник, а лишь краткий конспект. В русской вузовской литературе имеется превосходный пример авторского текста, не претендующего на исчерпывающую полноту изложения, но вскрывающего авторскую репетицию перед решающим аудиторным лекционным представлением. Это блестящий «Конспект лекций по квантовой механике» великого Энрико Ферми, бывшего «собратом по цеху» и оставшегося непревзойдённым образцом для подражания. В химии, насколько мне известно, подобные попытки ещё не предпринимались ... Может быть, в наше информационно - перегруженное время опыт окажется полезным... Во всяком случае, Ваш покорный слуга старался всячески выделить и никоим образом не скрыть основные первоисточники и тех авторов, мыслями которых он беззастенчиво пользовался как своими собственными... За пределами наших возможностей вынужденно остались вопросы ферментного катализа.
К сожалению, стиль неполноты диктуется нынешними мучительными условиями преподавания в вузе вкупе с причудливыми требованиями, которые предъявляют ретивые вожди интеллектуального конвейера. Всероссийские дела на рубеже тысячелетий всё более и более напоминают известный американский роман «Бумага Мэтлока», и трудно ожидать скорого выправления положения. Всё же надежда умирает последней...
В завершение хотелось бы отвлечь читателя от сугубо профессиональной темы и вспомнить простую истину, что столпом высшего образования России всегда было гуманитарное начало. А потому в качестве эпилога можно к нему и обратиться, и предложить читателю кое-что для размышления (или для развлечения) - как хотите! ...
Вспомним только, что грозной ядерной энергетике XX века непосредственно предшествовала созданная в его первой трети в нашей стране великим Н.Н. Семёновым и его блестящими сподвижниками Я.Б. Зельдовичем и Ю.Б. Харитоном кинетика химического (да и ядерного тоже !) горения и взрыва...