Контрольная работа: Гидролиз солей. Особенности почвенного гидролиза
Содержание
Введение
1. Гидролиз солей
1.1 Характеристики гидролиза
1.2 Гидролиз солей слабых кислот и сильных оснований
1.3 Гидролиз солей сильных кислот и слабых оснований
1.4 Гидролиз солей слабых кислот и слабых оснований
1.5 Гидролиз солей многоосновных кислот и оснований
2. Особенности почвенного гидролиза и его значение
Список использованной литературы
Введение
Гидролизом называется взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды. Такое определение охватывает и гидролиз органических соединений - сложных эфиров, жиров, углеводов, белков - и гидролиз неорганических веществ - солей, галогенов, галогенидов, неметаллов и т.д. Настоящая работа посвящена гидролизу солей - одному из важных примеров гидролиза веществ, который наиболее хорошо изучен, а так же особенностям почвенного гидролиза солей и его значению в сельском хозяйстве.
1. Гидролиз солей
В случае реакций нейтрализации, в которых участвуют слабые кислоты и основания, реакции протекают не до конца. Это значит, что при этом в той или иной степени протекает и обратная реакция (взаимодействие соли с водой), приводящая к образованию кислоты и основания. Это и есть гидролиз соли. В реакции гидролиза вступают соли, образованные слабой кислотой и сильным основанием, или слабым основанием и сильной кислотой, или слабой кислотой и слабым основанием. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются; нейтрализация в этом случае сводится к процессу H + + OH - =H2O, а обратная реакция - диссоциация молекул воды на ионы - протекает в ничтожно малой степени: при 25 0С ионное произведение воды
КW = CН+. СОН - = 10-14.
1.1 Характеристики гидролиза
![]() Рассмотрим
гидролиз соли, образованной одноосновной кислотой и одновалентным металлом. Запишем
уравнение гидролиза в общем виде. Пусть НА - кислота, МОН - основание, МА -
образования или соль. Тогда уравнение гидролиза будет иметь вид: МА + Н2О
НА + МОН.
Рассмотрим
гидролиз соли, образованной одноосновной кислотой и одновалентным металлом. Запишем
уравнение гидролиза в общем виде. Пусть НА - кислота, МОН - основание, МА -
образования или соль. Тогда уравнение гидролиза будет иметь вид: МА + Н2О
НА + МОН.
Будем рассматривать достаточно разбавленные растворы. Тогда равновесию реакции (1) при заданной температуре отвечает постоянная величина - константа равновесия
| К = |
СНА. СМОН |
|
СМА. СН2О |
Где Сi - молярные концентрации веществ. Концентрация воды в разбавленных растворах представляет собой практически постоянную величину. Обозначая К. Сн2о = Кг, получим
| Кг = |
СНА. СМОН |
(2) |
|
СМА |
Величина Кг называется константой гидролиза соли. Ее значение характеризует способность данной соли подвергаться гидролизу; чем больше Кг, тем в большей степени (при одинаковых температуре и концентрации соли) протекает гидролиз.
Отношение числа молей соли, подвергшихся гидролизу (Сг), к общему числу молей соли в растворе (СМА), называется степенью гидролиза.
|
|
Сг | (3) |
|
СМА |
Для вещества типа МА величина Сг равна концентрации любого из продуктов гидролиза - реакции (1). Поэтому степень гидролиза может быть определена из соотношений вида:
| = | Сг | = | Смон | . |
|
СМА |
Сма |
Используя такие соотношения и выражение (2) для константы гидролиза, можно легко получить уравнение, связывающее степень и константу гидролиза.
1.2 Гидролиз солей слабых кислот и сильных оснований
Если соль образована слабой кислотой и сильным основанием, то реакцию гидролиза можно схематически изобразить так:
![]() М+ + А
- + Н2О НА + М+ + ОН-. (4)
М+ + А
- + Н2О НА + М+ + ОН-. (4)
Связывания иона гидроксония Н+ анионами слабой кислоты А - приводит нарушению равновесия реакции диссоциации воды
![]() Н2О Н+
+ ОН-
Н2О Н+
+ ОН-
И появлению избыточной концентрации ОН-. При этом Сн+ < Cон - и раствор имеет щелочную реакцию. Константа гидролиза реакции (4)
| Кг= |
СНА * Сон- |
= |
СНА * Сон- |
(5) |
|
СМ+ * СА- |
СА- |
Слабая кислота НА, получающаяся при гидролизе, диссоциирует, хотя и в малой степени, на ионы:
![]()
НА Н+ + А - (6)
В противном случае гидролиз шел бы до конца - вся соль превращалась бы в НА и МОН. Выразив константу диссоциации слабой кислоты - константу равновесия реакции (6) - следующим образом:
| К кисл. = |
СН. СА- |
| СНА |
Можно определить через нее отношение
|
СНА |
= |
Сн+ |
(7) |
|
СА |
К кисл. |
Подставив (7) в (5), получим
| Кг= |
Сн+ * Сон- |
= | Кw | (8) |
| К кисл. | К кисл. |
Константа гидролиза равна отношению ионного произведения
воды к константе диссоциации слабой кислоты. ![]()
Найдем степень гидролиза соли. Концентрация негидролизованной соли равна СМА
(1 - a) ![]() .
Негидролизованная соль в разбавленном растворе полностью диссоциирована на ионы
и поэтому ее концентрация равна концентрации аниона
.
Негидролизованная соль в разбавленном растворе полностью диссоциирована на ионы
и поэтому ее концентрация равна концентрации аниона
СМА - = СМА (1 - a). (9)
При гидролизе образуются эквивалентные количества молекул НА и ионов ОН-. Так как мы рассматриваем соль слабой кислоты, то НА диссоциированна в малой степени. Если пренебречь диссоциацией НА, то можно сказать что, Сон - = СНА. Молекула НА образуется из молекулы соли при гидролизе. Если гидролизовано СМА*a молей, то
Сон - = СНА= СМА*a. (10)
Подставив выражения (9) и (10) в уравнение (5), получим
| Кг= |
С2МА*a2 |
= |
СМА*a2 |
(11) |
|
С МА* (1-a) |
1-a |
Откуда
СМА*a2 + Кг * a - Кг = 0 и
![]() a= -
a= - ![]() +
+
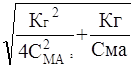
Второй корень уравнения не имеет физического символа, так как a не может быть меньше нуля.
Если степень гидролиза мала (a << 1), то 1-a » 1 и выражение (11) упрощается
Кг » С МА *a2; a
» 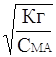 (12)
(12)
Из выражения (12) видно, что увеличение концентрации соли СМА приводит к уменьшению степени гидролиза. Разбавление раствора увеличивает степень гидролиза.
Подставив в уравнение (12) значения Кг из выражения (8), получим
a »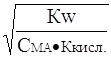 . (13)
. (13)
Сравнение степени гидролиза растворов двух солей одинаковой концентрации дает
a1 »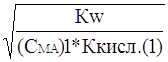 ; a2»
; a2»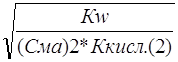 ; и
; и
![]() =
=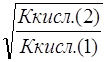 , (14)
, (14)
так как (С МА) 1 = (С МА) 2
Степень гидролиза обратно пропорциональна корню квадратному из константы диссоциации слабой кислоты.
Используя выражение (10), можно записать
Сон+ * Сон - =
Кw; Сон+ = ![]() =
= ![]()
Подставив сюда ![]() из
выражения (13), получим
из
выражения (13), получим
Сн+= 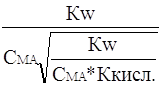 =
= 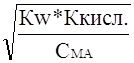 ;
;
После логарифмирования и перемены знаков
lg Сн+ = - ½ lg Кw - ½ lg Ккисл. + ½ lg Сма.
Но - lg Сн + = рН; подобные же обозначения можно употребить и для логарифмов констант равновесия.
Тогда
рН= ½ рКw + ½ рКкисл. + ½ lgСМА. (15)
Из выражения (15) видно, что рН растворов солей слабых кислот и сильных оснований растет с уменьшением константы диссоциации слабой кислоты и с ростом общей концентрации соли. Другими словами, щелочность раствора растет с уменьшением Ккисл. И с ростом СМА.
1.3 Гидролиз солей сильных кислот и слабых оснований
Реакцию гидролиза соли, образованной сильной кислотой и слабым основанием, схематически можно изобразить так:
![]() М+ + А
- + Н2О МОН + Н+ +А - , (16) и константа гидролиза
М+ + А
- + Н2О МОН + Н+ +А - , (16) и константа гидролиза
Кг = ![]() . (17)
. (17)
Раствор имеет кислую реакцию (Сн+>Сон-). Одним из продуктов гидролиза является слабое основание. Диссоциация слабого основания препятствует протеканию гидролиза до конца
![]() МОН М+ + ОН
- ;
МОН М+ + ОН
- ;
К осн. = ![]() ,
,
Откуда ![]() . (18)
. (18)
Подставив выражение (18) в (17), получим
Кг = ![]() .
.
Подобно выводу выражения (12), при гидролизе соли, образованной слабым основанием и сильной кислотой
a » ![]() . (19)
. (19)
Как и в первом случае, увеличение концентрации соли в воде приводит к уменьшению степени гидролиза a. Разбавление раствора увеличивает степень гидролиза. Подставив в уравнение (19) значение Кг, получим
a » 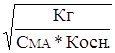 . (20)
. (20)
Степень гидролиза соли обратно пропорциональна корню квадратному из константы диссоциации слабого основания. Рассматривая гидролиз соли слабого основания и сильной кислоты, получим выражение, аналогичное уравнению (15)
РН = ½ рКw - ½рКосн. - ½ lgСМА. (21)
Из выражения (21) видно, что рН уменьшается с уменьшением Косн. и с увеличением Сма, или кислотность раствора возрастает с уменьшением константы диссоциации слабого основания и с ростом общей концентрации соли.
1.4 Гидролиз солей слабых кислот и слабых оснований
Особенно глубоко протекает гидролиз солей, образованных слабой кислотой и слабым основанием. Реакция гидролиза:
![]() М+ + А
- + Н2О МОН + НА. (22)
М+ + А
- + Н2О МОН + НА. (22)
Продукты гидролиза все те же, хотя и слабо, диссоциированы на ионы, вследствие чего гидролиз не доходит до конца. Слабая щелочь диссоциирует следующим образом:
![]() МОН М + +ОН-
МОН М + +ОН-
Косн. =![]() , Откуда
, Откуда
![]() (23).
(23).
Слабая кислота диссоциирует так:
![]() НА Н+ + А-
,
НА Н+ + А-
,
Ккисл. = 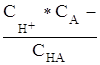 ,
,
Откуда 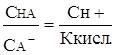 . (24)
. (24)
Подставляя выражения (24) и (23) в (22), получим
Кг = ![]() . (25)
. (25)
Если общая концентрация соли СМА, а степень гидролиза a, то концентрация негидролизованной соли См+ = СА - = Сма (1-a). Соответственно СНА= Смон= СМА* a.
Поэтому из выражения (22) можно получить
Кг=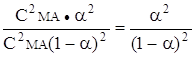 ,
,
или ![]()
и a = 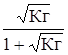 . (26)
. (26)
Из выражения (26) видно, что при гидролизе соли слабого основания и слабой кислоты степень гидролиза не зависит в первом приближении от общей концентрации соли. Если степень гидролиза a мала, т.е. a<< 1, то 1 - X »1 и выражение (26) упрощается
a » 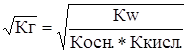
Из выражения (24) получим, принимая во внимание уравнения (25) и (26)
Сн+ = Ккисл. ![]() =
Ккисл.
=
Ккисл. 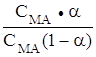 =
=
Ккисл 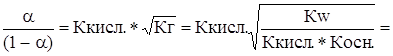
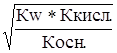 .
.
После логарифмирования и перемены знаков
рН= ½рКw + ½рКкисл. - ½рКосн. (27)
Из выражения (27) видно, что если константы диссоциации
слабой кислоты и слабого основания одинаковы (Ккисл. = Косн), то рН= ½
рКw. Это означает, что раствор имеет нейтральную реакцию, несмотря на гидролиз.
Действительно, в этом случае рН=-lgСн+ = - ½ lgКw,
или Сн+ =![]() = (10-14)
½=10-7 Из выражения (27) далее видно, что если Ккисл. >Коснов., то рН< ½рКw, т.е. рН<
7 и раствор имеет кислую реакцию. Если Ккисл. <
Коснов., то раствор имеет щелочную реакцию и рН >
7.
= (10-14)
½=10-7 Из выражения (27) далее видно, что если Ккисл. >Коснов., то рН< ½рКw, т.е. рН<
7 и раствор имеет кислую реакцию. Если Ккисл. <
Коснов., то раствор имеет щелочную реакцию и рН >
7.
1.5 Гидролиз солей многоосновных кислот и оснований
Рассмотрим теперь гидролиз солей, образованных слабой многоосновной кислотой или слабым основанием многовалентного металла. Гидролиз таких солей протекает ступенчато. Так, первая ступень гидролиза карбоната натрия протекает согласно уравнению
Nа2СО
Nа2СО3 + Н2О ![]() NаНСО3 + NаОН,
или в ионно-молекулярной форме:
NаНСО3 + NаОН,
или в ионно-молекулярной форме:
![]()
![]() + Н2О
+ Н2О ![]() НСО3 - +
ОН-.
НСО3 - +
ОН-.
Образовавшаяся кислая соль в свою очередь подвергается гидролизу (вторая ступень гидролиза)
NаНСО3 + Н2О ![]() Nа2СО3 +
NаОН, Или НСО3 - + Н2О
Nа2СО3 +
NаОН, Или НСО3 - + Н2О ![]() Nа2СО3 +
ОН-.
Nа2СО3 +
ОН-.
Как видно, при гидролизе по первой ступени образуется ион НСО3-, диссоциация которого характеризуется второй константой диссоциации угольной кислоты
НСО3-![]() Н+
+
Н+
+![]() ;
;
К2, кисл. = 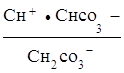
При гидролизе по второй ступени образуется угольная кислота, диссоциацию которой характеризует первая константа ее диссоциации
НСО3 ![]() Н+
+Н
Н+
+Н![]() ;
;
К1, кисл. = 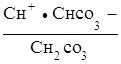 .
.
Поэтому константа гидролиза по первой ступени
Кг,1= 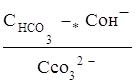
связана со второй константой диссоциации кислоты, в константа гидролиза по второй ступени
Кг,2= 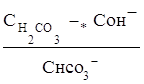
с первой константой диссоциации кислоты. Эта связь выражается соотношениями:
Кг,1= 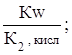 Кг,2=
Кг,2=
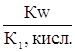 .
.
Поскольку первая константа диссоциации кислоты всегда больше второй, то константа гидролиза по первой ступени всегда больше, чем константа гидролиза по второй ступени: Кг,1> Кг,2. По этой причине гидролиз по первой ступени всегда протекает в большей степени, чем по второй. Кроме того, ионы, образующиеся при гидролизе по первой ступени (в нашем примере - ионы ОН -), способствуют смещению равновесия второй ступени влево, т.е. также подавляют гидролиз по второй ступени.
Аналогично происходит гидролиз солей, образованных слабым основанием многовалентного металла. Например, гидролиз CuCl2, который по первой ступени протекает с образованием гидроксохлорида меди
CuCl2 + Н2О ![]() CuОНCl +НСl или
в ионно-молекулярной форме
CuОНCl +НСl или
в ионно-молекулярной форме
Cu2+ + Н2О ![]() CuОН+
+ Н+.
CuОН+
+ Н+.
Гидролиз по второй ступени происходит в ничтожно малой степени:
CuОНCl+ + Н2О
![]() Cu (ОН) 2 + НСl
Или CuОН+ + Н2О
Cu (ОН) 2 + НСl
Или CuОН+ + Н2О ![]() Cu
(ОН) 2 + Н.
Cu
(ОН) 2 + Н.
Примером гидролиза солей многоосновных слабых кислот и слабых оснований может служить гидролиз ацетата алюминия, протекающий до основных солей - гидроксоацетата дигидроксоацетата алюминия:
Аl (СН3СОО) 3+ Н2О ![]() Аl (ОН) (СН3СОО)
2+ СН3СООН;
Аl (ОН) (СН3СОО)
2+ СН3СООН;
Аl (ОН) (СН3СОО) 2 + Н2О
![]() Аl (ОН) 2 (СН3СОО)
+ СН3СООН.
Аl (ОН) 2 (СН3СОО)
+ СН3СООН.
Рассмотрим для данного случая отдельно гидролиз катиона и гидролиз аниона. Эти процессы выражаются ионно-молекулярными уравнениями:
Аl3++ Н2О ![]() АlОН2 +Н+;
СН3СОО - + Н2О
АlОН2 +Н+;
СН3СОО - + Н2О ![]() СН3СООН
+ОН - .
СН3СООН
+ОН - .
Итак, при гидролизе катиона образуются ионы Н+, а при гидролизе аниона - ионы ОН-. Эти ионы не могут в значительных концентрациях сосуществовать; они соединяются, образуя молекулы воды. Это приводит к смещению равновесия вправо. Иначе говоря, гидролиз катиона и гидролиз аниона в этом случае усиливают друг друга. Если кислота и основание, образующие соль, не только слабые электролиты, но и мало растворимы, или неустойчивы и разлагаются с образованием летучих продуктов, то гидролиз соли часто протекает необратимо, т.е. сопровождается полным разложением соли. Так, при взаимодействии в растворе соли алюминия, например АlCl3, с карбонатом натрия выпадает осадок гидроксида алюминия и выделяется диоксид углерода
2АlCl3 + 3 Nа2СО3+
3Н2О ![]() 2Аl (ОН) 3¯ + 3СО2 +6 NаCl или
2Аl (ОН) 3¯ + 3СО2 +6 NаCl или
2Аl3++ 3СО32-+3Н2О
![]() 2Аl (ОН) 3¯+ 3СО2.
2Аl (ОН) 3¯+ 3СО2.
Протонная теория кислот и оснований рассматривает гидролиз солей как частный случай кислотно-основного равновесия.
2. Особенности почвенного гидролиза и его значение
Почва - уникальная природная система. Главное свойство почвы - неразрывная связь входящих в нее живых и неживых компонентов. Состав почвы весьма сложен. В ней имеется не только твердая фаза, но также жидкая (почвенный раствор) и газовая (почвенный воздух). Почвенные растворы являются растворами целой массы самых разнообразных веществ - электролитов и неэлектролитов, и коллоидов.
Почва образуется и функционирует как система при сочетании взаимообусловленной жизнедеятельности разных групп организмов. Одной из важных химических функций почв является обмен катионов и анионов, благодаря которому минеральные удобрения и микроэлементы становятся доступными для растений. Когда ионы калия (К+), магния (Мg2+), кальция (Са2+) и других металлов вбираются корнями растений, ион водорода обменивается на ион металла, при этом происходит увеличение кислотности почвы:
Почва} Са2+ + 2СО2 + 2Н2О®Почва}Н+, Н+ +Са2+ (корни) + 2НСО3-.
Почва выступает как буфер и сопротивляется изменениям рН. Однако буферная способность существенно зависит от типа почвы. Для почв, бедных известняком, она практически отсутствует; действие кислотных дождей на такие почвы оказывается пагубным, ионообменные процессы нарушаются.
При большом подкислении почвы происходит также переход металлов из оксидов в раствор, а среди них могут быть и такие токсичные для растений металлы, как цинк, железо, марганец и алюминий:
Почва }Н+ , Н+ +ZnО ® Почва }Zn2+ +Н2О.
Повышение кислотности заболоченных почв приводит к выделению Н2S, крайне токсичного для растений и многих полезных микроорганизмов. Реакция катализируется микроорганизмами, а роль восстановителя играют органические вещества:
SО42 - + 2{СН2О} + 2Н+
![]() Н2S +2СО2 +2Н2О.
Н2S +2СО2 +2Н2О.
Понижение кислотности почвы требует затрат и может быть достигнуто введением карбоната кальция:
Почва } Н+ + СаСО3 ®Почва}Са2+ СО2 +Н2О
Н+
Щелочность почвенного раствора вызывается присутствием в почвах не свободных щелочей, а солей слабых кислот и сильных оснований. Из таких солей самое большое распространение имеет имеет в почвах карбонат кальция, но его растворимость, как такового, настолько мала, что о вредном действии его растворов на растения не может быть и речи. Другие щелочные соединения почвы могут быть разбиты на две группы:
1) гуминовокислые щелочи, кремниевокислые щелочи и нормальные карбонаты щелочных металлов,
2) двууглекислые щелочные соли. Соли, входящие в первую группу, имеют то общее, что все они в водных растворах сильно гидролизуются с освобождением иона ОН-.
Поэтому к действию их на растения как таковых присоединяется еще действие сильно ядовитого иона ОН-, который нейтрализуется подкислением почв. Двууглекислые щелочные соли, вследствие очень слабой своей электролитической диссоциации, мало оказывают на растения побочного вредного влияния и этим приближаются к СаСО3.
В главных фосфорных удобрениях фосфорная кислота содержится преимущественно в виде кальциевых солей, причем в апатите, фосфорите, томасшлаке и костяной муке находится трехкальциевый фосфат, а в супер фосфатах - свободная фосфорная кислота, одно - и двухкальциевые фосфаты.
Трехкальциевый фосфат - Са3 (РО4) 2 в воде почти нерастворим, но благодаря тому, что это вещество является солью слабой кислоты и относительно сильного основания, те ничтожные следы, которые оказываются в почвенном растворе, подвергаются гидролизу, вследствие чего равновесие в растворе нарушается, в воду переходит новое количество соли, которое снова гидролизуется и т.д., так что в конце концов в растворе оказывается количественно определимая величина фосфорной кислоты. Гидролиз Са3 (РО4) 2 будет идти до известного предела, а именно до тех пор, пока между ионами Са2+ и РО3-, с одной стороны, и продуктами гидролиза Са2+, ОН-, НРО42-, Н2РО4 - и Н3РО4, с другой стороны, не установится равновесие. Таким образом, увеличивая концентрацию одного из продуктов гидролиза Са3 (РО4) 2, мы тем самым уменьшим количество фосфорной кислоты, переходящей в почвенный раствор из этой соли, и, наоборот, уменьшая концентрацию какого-либо из этих продуктов, мы увеличим это количество. Например, присутствие СаСО3, СаО или Са (ОН) 2 с Са3 (РО4) 2 увеличивает концентрацию в почвенном растворе одного из продуктов гидролиза Са3 (РО4) 2, что влечет за собой уменьшение концентрации фосфорной кислоты в растворе и усвоение фосфорных удобрений растениями. В противоположность этому гидролиз FеРО4 понижает концентрацию ионов ОН-, что увеличивает количество фосфорной кислоты, переходящей в почвенный раствор.
Таким образом, почвенный гидролиз солей - эффективный регулятор количества растворимых форм полезных элементов в почвенном растворе и процессов обмена ионами между почвой и растениями.
Список использованной литературы
1. Коровин Н.В. Общая химия. - М.: Высш. шк., 2007
2. Глинка Н.Л. Общая химия. - М.: Химия, 1998.
3. Скорчеллетти В.В. Теоретическая электрохимия. - Л.: ГХИ, 1983.
4. Добровольский В.В. Основы биогеохимии: Учеб. Пособие, - М.: Высш. шк., 2007.
5. Шустов С.Б., Шустова Л.В. Химические основы экологии: Учеб. Пособие. - М.: Высш. шк., 1995.
6. Что мы знаем о химии? Вопросы и ответы: Справ. Пособие / Под ред. Ю.Н. Кукушкина. - М.: Высш. шк., 2003.
| Общая и неорганическая химия | |
|
Квантово-механическая модель атома. Квантовые числа. Атомные орбитали. Порядок заполнения орбиталей электронами Теория строения атома основана на ... Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% - средними, менее 3% - слабыми электролитами.К сильным электролитам ... В зависимости от константы диссоциации продуктов гидролиза (кислоты и основания) реакция среды растворов таких солей может быть слабокислой, слабощелочной или нейтральной. |
Раздел: Рефераты по химии Тип: учебное пособие |
| Физиология растений | |
|
Куниченко Наталья Александровна, кандидат сельскохозяйственных наук, доцент, заведующая кафедрой защиты растений и экологии Приднестровского ... Концентрация почвенного раствора зависит от количества солей в почве, механического состава почвы, соотношения минеральных и коллоидных частиц в почве. Азот же, находясь в атмосфере, переводится в форму, доступную для автотрофов при синтезе белка, азотфиксирующими микроорганизмами, находящимися в почве, и в результате их ... |
Раздел: Рефераты по биологии Тип: учебное пособие |
| Методы анализа лекарственных препаратов | |
|
Оглавление Вступление Глава 1. Основные принципы фармацевтического анализа 1.1 Критерии фармацевтического анализа 1.2 Ошибки, возможные при проведении ... В водной среде кислотами титруют натриевые соли слабых кислот, так как в их растворе вследствие гидролиза образуется щелочная среда. Возможность и оптимальные условия титрования в неводных средах определяются величиной константы титрования Кт, которую рассчитывают, исходя из величин ионного произведения среды Кi ... |
Раздел: Рефераты по медицине Тип: дипломная работа |
| Программа для поступающих в вузы (ответы) | |
|
Программа по химии для абитуриентов Предмет химии. Явления химические и физические. Атомно-молекулярное учение. Атомы. Молекулы. Молекулярное и ... Гидролиз солей представляет собой реакцию, обратную реакции нейтрализации слабых кислот (оснований) сильными основаниями (кислотами) или слабых кислот слабыми основаниями. 1) анионы бескислородных кислот окисляются до соответствующих элементов, 2) при электролизе солей кислородсодержащих кислот происходит окисление не кислотных остатков, а воды с ... |
Раздел: Рефераты по химии Тип: реферат |
| Изучение влияния соединений тяжёлых металлов на почву и растения (на ... | |
|
Оглавление Введение 1. Тяжёлые металлы в почве и методы изучения их подвижности 1.1 Механизмы поглощения и трансформации ионов тяжёлых металлов ... Гидролитической кислотностью называют ту часть потенциальной кислотности почвы, которая образуется при вытеснении из почвы ионов Н+или Al3+раствором гидролитической щелочной соли ... Экспериментальные данные изучения подвижности ионов Pb (II), Cd (II) под влиянием различных концентраций их в почве и почвенном растворе в зависимости от кислотности почвы ... |
Раздел: Рефераты по ботанике и сельскому хозяйству Тип: дипломная работа |