Курсовая работа: Геоэкологическая характеристика фосфора
РОССИЙСКИЙ УНИВЕРСИТЕТ ДРУЖБЫ НАРОДОВ
ЭКОЛОГИЧЕСКИЙ ФАКУЛЬТЕТ
Курс «ГЕОЭКОЛОГИЯ»
КУРСОВАЯ РАБОТА:
«ГЕОЭКОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ФОСФОРА»
Научный руководитель:
зав. курсом
доц. СТАНИС Е.В.
Работу выполнил:
студент 4 курса
Шарай Д.В.
МОСКВА, 2003 г.
ПЛАН
1. Введение
2. Исторические аспекты вопроса
2.1. История открытия фосфора
2.2. Хронология открытий, связанных с фосфором
3. Свойства фосфора как химического элемента
3.1. Физические свойства
3.2. Распространение в природе
3.3. Аллотропия фосфора
3.4. Получение фосфора
3.5. Химические свойства
3.6. Стехиометрия фосфора. Псевдовращение
3.7. Изотопы фосфора
4. Соединения фосфора
4.1. Неорганические соединения фосфора
4.1.1. Галогениды и оксиды фосфора.
Строение, свойства, получение
4.1.2. Фосфорные кислоты.
Строение, классификация, свойства
4.1.3. Фосфин. Строение, свойства
4.1.4. Фосонитрилхлориды
4.1.5. Боевые отравляющие вещества: газы группы VX
4.2. Фосфорорганические соединения (ФОС)
4.2.1. Значение
4.2.2. Классификация
4.2.3. Распространенность в природе
4.2.4. Физические свойства ФОС
4.2.5. Химические свойства ФОС
4.2.6. Получение ФОС
4.3. АТФ. Строение, роль в живых системах
4.4. Фосфорные удобрения как важнейшая группа
соединений фосфора
4.4.1 Значение фосфорных удобрений
4.4.2. Классификация, способы получения
5. Фосфорное сырье. Фосфородобывающая промышленность
5.1. Исторический ракурс
5.2. Перспективы добычи
Начало суперфосфатной промышленности
5.3. Апатиты Заполярья
6. Фосфор в природе
6.1. Круговорот фосфора
6.2. Фосфор в природных водах
6.3. Фосфор в почвах
6.4. Геоэкологический мониторинг:
определение фосфора и его соединений в воде
7. Значение соединений фосфора в медицине
7.1. Фосфор в пище
7.2. Соединения фосфора как важнейший элемент
биохимических процессов организма.
Окислительное фосфорилирование
7.3. Фосфор в фармакологии
8. Заключение
Геоэкологическое значение фосфора
9. Библиография
1. ВВЕДЕНИЕ
«...Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных, не видывал. Из ее отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана... Страшный пес, величиной с молодую львицу. Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. Фосфор, – сказал я».
Артур Конан-Дойл. «Собака Баскервилей».

Пятая группа Периодической системы включает два типических элемента азот и фосфор – и подгруппы мышьяка и ванадия. Между первым и вторым типическими элементами наблюдается значительное различие в свойствах.
В состоянии простых веществ азот – газ, а фосфор – твердое вещество. Эти два вещества получили большую область применения, хотя когда азот впервые был выделен из воздуха, его посчитали вредным газом, а на продаже фосфора удавалось заработать большое количество денег (в фосфоре ценили способность светиться в темноте).
Фосфор - аналог азота. Хотя физические и химические свойства этих элементов очень различаются, есть у них и общее, в частности то, что эти элементы совершенно необходимы животным и растениям. Академик Ферсман называл фосфор "элементом жизни и мысли", и это определение вряд ли можно отнести к категории литературных преувеличений. Фосфор обнаружен буквально во всех органах зеленых растений: в стеблях, корнях, листьях, но больше всего его в плодах и семенах. Растения накапливают фосфор и снабжают им животных. В организме животных фосфор сосредоточен главным образом в скелете, мышцах и нервной ткани. Тело человека содержит в среднем около полутора килограмм фосфора. Из этого количества 1,4 кг приходится на кости, около 130 грамм - на мышцы и 12 грамм на нервы и мозг. Почти все важнейшие физиологические процессы, происходящие в нашем организме, связаны с превращениями фосфор-органических веществ. В состав костей фосфор входит главным образом в виде фосфата кальция. Зубная эмаль - это тоже соединение фосфора, которое по составу и кристаллическому строению соответствует важнейшему минералу фосфора апатиту. Ca5(PO4)3 (FCl). Естественно, что, как и всякий жизненно необходимый элемент, фосфор совершает в природе круговорот. Из почвы его берут растения, от растений этот элемент попадает в организмы человека и животных. В почву фосфор возвращается с экскрементами и при гниении трупов. Фосфобактерии переводят органический фосфор в неорганические соединения. Однако в единицу времени из почвы выводится значительно больше фосфора, чем поступает в почву, Мировой урожай сейчас ежегодно уносит с полей больше 3 млн. т фосфора. Естественно, что для получения устойчивых урожаев этот фосфор должен быть возвращен в почву, и потому нет ничего удивительного в том, что мировая добыча фосфоритной руды сейчас составляет значительно больше 100 млн. тонн в год.
2. ИСТОРИЧЕСКИЕ АСПЕКТЫ ВОПРОСА
2.1. История открытия фосфора
 Обычно датой открытия фосфора
считается 1669 г., однако имеются некоторые указания, что он был известен и
ранее. Гефер, например, сообщает, что в алхимическом манускрипте из сборника, хранящегося
в Парижской библиотеке, говорится о том, что еще около ХII в. некто Алхид
Бехиль получил при перегонке мочи с глиной и известью вещество, названное им
"эскарбукль". Может быть, зто и был фосфор, составляющий большой
секрет алхимиков. Во всяком случае известно, что в поисках философского камня
алхимики подвергали перегонке и другим операциям всевозможные материалы,
втомчисле мочу, зкскременты, кости и т. д. С древних времен фосфорами называли
вещества, способные светиться в темноте. В XVII в. был известен болонский
фосфор - камень, найденный в горах вблизи Болоньи; после обжига на углях камень
приобретал способность светиться. Описывается также "фосфор
Балдуина", приготовленный волостным старшиной алдуином из прокаленной
смеси мела и азотной кислоты. Свечение подобных веществ вызывало крайнее
удивление и почиталось чудом.
Обычно датой открытия фосфора
считается 1669 г., однако имеются некоторые указания, что он был известен и
ранее. Гефер, например, сообщает, что в алхимическом манускрипте из сборника, хранящегося
в Парижской библиотеке, говорится о том, что еще около ХII в. некто Алхид
Бехиль получил при перегонке мочи с глиной и известью вещество, названное им
"эскарбукль". Может быть, зто и был фосфор, составляющий большой
секрет алхимиков. Во всяком случае известно, что в поисках философского камня
алхимики подвергали перегонке и другим операциям всевозможные материалы,
втомчисле мочу, зкскременты, кости и т. д. С древних времен фосфорами называли
вещества, способные светиться в темноте. В XVII в. был известен болонский
фосфор - камень, найденный в горах вблизи Болоньи; после обжига на углях камень
приобретал способность светиться. Описывается также "фосфор
Балдуина", приготовленный волостным старшиной алдуином из прокаленной
смеси мела и азотной кислоты. Свечение подобных веществ вызывало крайнее
удивление и почиталось чудом.
В 1669 г. гамбургский алхимик-любитель Бранд, разорившийся купец, мечтавший с помощью алхимии поправить свои дела, подвергал обработке самые разнообразные продукты. Предполагая, что физиологические продукты могут содержать "первичную материю", считавшуюся основой философского камня, Бранд заинтересовался человеческой мочой.
Он собрал около тонны мочи из солдатских казарм и выпаривал ее до образования сиропообразной жидкости. Эту жидкость он вновь дистиллировал и получил тяжелое красное "уринное масло". Перегнав это масло еще раз, он обнаружил на дне реторты остаток "мертвой головы" (Caput mortuum), казалось бы ни к чему непригодной. Однако, прокаливая этот остаток длительное время, он заметил, что в реторте появилась белая пыль, которая медленно оседала на дно реторты и явственно светилась. Бранд решил, что ему удалось извлечь из "маслянистой мертвой головы" элементарный огонь, и он с еще большим рвением продолжил опыты. Превратить этот "огонь" в золото ему, конечно, не удалось, но он все же держал в строгом секрете свое открытие фосфора (от греч.- свет и "несу", т.е. светоносца). Однако о секрете Бранда узнал некто Кункель, служивший в то время алхимиком и тайным камердинером у саксонского курфюрста. Кункель попросил своего сослуживца Крафта, отправлявшегося в Гамбург, выведать у Бранда какие-либо сведения о фосфоре. Крафт, однако, сам решил воспользоваться секретом Бранда. Он купил у него секрет за 200 талеров и, изготовив достаточное количество фосфора, отправился в путешествие по Европе, где с большим успехом демонстрировал перед знатными особами свечение фосфора. В частности, в Англии он показывал фосфор королю Карлу II и ученому Бойлю. Тем временем Кункелю удалось самому приготовить фосфор способом, близким к способу Бранда, и в отличие от последнего он широко рекламировал фосфор, умалчивая, однако, о секрете его изготовления. В 1680 г. независимо от предшественников новый элемент был получен знаменитым английским физиком и химиком Робертом Бойлем, который, так же как и Кункель, опубликовал данные о свойствах фосфора, но о способе его получения сообщил в закрытом пакете лишь Лондонскому королевскому обществу (это сообщение было опубликовано только через 12 лет, уже после смерти Бойля), а ученик Бойся – А. Ганквиц изменил чистой науке и вновь возродил «фосфорную спекуляцию» в виде широкой производственной деятельности по изготовлению этого вещества: 50 лет он широко торговал фосфором по весьма высокой цене. В Голландии, например, унция (31,1 г) фосфора стоила в то время 16 дукатов. По поводу природы фосфора высказывались самые фантастические предположения. В XVIII в. фосфором занимались многие крупные ученые и среди них Маргграф, усовершенствовавший способ получения фосфора из мочи путем добавления к последней хлорида свинца (1743).
В 1777 г. Шееле установил наличие фосфора в костях и рогах животных в виде фосфорной кислоты, связанной с известью. Некоторые авторы, впрочем, приписывают это открытие другому шведскому химику Гану, однако именно Шееле разработал способ получения фосфора из костей. Элементарным веществом фосфор был признан Лавуазье на основе его известных опытов по сжиганию фосфора в кислороде. В таблице простых тел Лавуазье поместил фосфор во второй группе простых тел, неметаллических, окисляющихся и дающих кислоты. С XIX в. фосфор получил широкое применение главным образом в виде солей, используемых для удобрения почв.
Итак, более трехсот лет отделяют нас от того момента, когда гамбургский алхимик Геннинг Бранд открыл новый элемент – фосфор. Подобно другим алхимикам, Бранд пытался отыскать эликсир жизни или философский камень, с помощью которых старики молодеют, больные выздоравливают, а неблагородные металлы превращаются в золото. Не забота о благе людском, а корысть руководила Брандом. Об этом свидетельствуют факты из истории единственного настоящего открытия, сделанного им. На первом, пятидесятилетнем этапе истории фосфора, кроме открытия Бойля, лишь одно событие отмечено историей науки: в 1715 г. Генсинг установил наличие фосфора в мозговой ткани. После опытов Маркграфа история элемента, приобретшего много лет спустя номер 15, стала историей многих больших открытий.
2.2. Хронология открытий, связанных с фосфором
В 1715 году Генсинг установил наличие фосфора в мозговой ткани...
 В 1743 году немецкий химик,
почетный член Санкт-Петербургской Академии наук А.С. Маргграф разработал новый
способ получения фосфора.
В 1743 году немецкий химик,
почетный член Санкт-Петербургской Академии наук А.С. Маргграф разработал новый
способ получения фосфора.
![]() В 1769 году Ю.Ган доказал, что в костях содержится
много фосфора. То же самое подтвердил через два года шведский химик К.Шееле,
предложивший способ получения фосфора из золы, образующейся при обжиге костей.
Ещё несколькими годами позже Ж.Л.Пруст и М.Клапрот, исследуя различные
природные соединения, доказали, что фосфор широко распространён в земной коре,
главным образом в виде фосфата кальция.
В 1769 году Ю.Ган доказал, что в костях содержится
много фосфора. То же самое подтвердил через два года шведский химик К.Шееле,
предложивший способ получения фосфора из золы, образующейся при обжиге костей.
Ещё несколькими годами позже Ж.Л.Пруст и М.Клапрот, исследуя различные
природные соединения, доказали, что фосфор широко распространён в земной коре,
главным образом в виде фосфата кальция.
![]()
 1797 году в России
А.А.Мусин-Пушкин получил аллотропную разновидность фосфора – фиолетовый фосфор.
Однако в литературе открытие фосфора ошибочно приписывается И.Гитторфу,
который, используя методику А.А.Мусина-Пушкина, получил его только в 1853 году.
1797 году в России
А.А.Мусин-Пушкин получил аллотропную разновидность фосфора – фиолетовый фосфор.
Однако в литературе открытие фосфора ошибочно приписывается И.Гитторфу,
который, используя методику А.А.Мусина-Пушкина, получил его только в 1853 году.
В 1799 году Дондональд доказал, что соединения фосфора необходимы для нормального развития растений.
В 1839 году другой англичанин, Лауз, впервые получил суперфосфат - фосфорное удобрение, легко усвояемое растениями.
 В 1842 годув Англии было
организовано первое в мире промышленное производство суперфосфата. В России
такие производства появились в 1868 и 1871 годах.
В 1842 годув Англии было
организовано первое в мире промышленное производство суперфосфата. В России
такие производства появились в 1868 и 1871 годах.
![]() В 1848 году австрийский химик А.Шрёттер открыл
аллотропическое видоизменение фосфора - красный фосфор. Этот фосфор он получил
нагреванием белого фосфора до температуры 250 градусов в атмосфере СО (оксида
углерода два). Интересно отметить, что А.Шрёттер первый указал на
В 1848 году австрийский химик А.Шрёттер открыл
аллотропическое видоизменение фосфора - красный фосфор. Этот фосфор он получил
нагреванием белого фосфора до температуры 250 градусов в атмосфере СО (оксида
углерода два). Интересно отметить, что А.Шрёттер первый указал на  возможность
применения красного фосфора при изготовлении спичек.
возможность
применения красного фосфора при изготовлении спичек.
В 1926 Году А.Е.Ферсманом и его сотрудниками были открыты огромные запасы апатиты на Кольском полуострове.
![]() В 1934 году, американский физик П.Бриджмен, изучая
влияние высоких давлений на разные вещества, выделил похожий на графит черный
фосфор.
В 1934 году, американский физик П.Бриджмен, изучая
влияние высоких давлений на разные вещества, выделил похожий на графит черный
фосфор.
3. СВОЙСТВА ФОСФОРА КАК ХИМИЧЕСКОГО ЭЛЕМЕНТА
3.1. Физические свойства
Фосфор (P) – вследствие высокой активности в свободном состоянии в природе не встречается.
Электронная конфигурация 1S22S22P63S23P3
Фосфор – неметалл (то, что раньше называли металлоид) средней активности. На наружной орбите атома фосфора находятся пять электронов, причем три из них не спарены. Поэтому он может проявлять валентности 3–, 3+ и 5+.
Для того чтобы фосфор проявлял валентность 5+, необходимо какое-либо воздействие на атом, которое бы превратило в не спаренные два спаренных электрона последней орбиты.
Фосфор часто называют многоликим элементом. Действительно, в разных условиях он ведет себя по-разному, проявляя то окислительные, то восстановительные свойства. Многоликость фосфора – это и его способность находиться в нескольких аллотропных модификациях.
3.2. Распространение в природе
Фосфор широко распространен в природе и составляет 0,12% земной коры. Он входит в состав белков растительного и животного происхождения. Человеческий скелет содержит примерно 1400 г фосфора, мышцы – 130 г, мозг и нервы – 12 г. Фосфор составляет существенную долю в химическом составе растений и поэтому является важным удобрением. Основным сырьем для производства удобрений служат апатит CaF2Ч3Ca3(PO4)2 и фосфориты, основой которых являются фосфат кальция Ca3(PO4)2. Элементный фосфор получают электротермическим восстановлением при 1400–1600°С из фосфоритов и апатитов в присутствии SiO2. Апатит добывают в России, Бразилии, Финляндии и Швеции. Крупным источником фосфора является фосфоритовая руда, в больших количествах добываемая в США, Марокко, Тунисе, Алжире, Египте, Израиле. Гуано, другой источник фосфора, добывают на Филиппинах, Сейшельских островах, в Кении и Намибии.
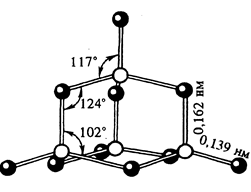
3.3. Важнейшие аллотропные модификации
 Белый фосфор. Пожалуй, самая известная
модификация элемента №15 – мягкий, как воск, белый или желтый фосфор. Это ее
открыл Бранд, и благодаря ее свойствам элемент получил свое имя: по-гречески
«фосфор» значит светящийся, светоносный. Молекула белого фосфора состоит из
четырех атомов, построенных в форме тетраэдра. Плотность 1,83, температура
плавления 44,1°C, кипения 280°С, Белый
фосфор ядовит, чрезвычайно реакционноспособен, легко окисляется. Растворим в
сероуглероде, жидких аммиаке и SO2, бензоле, эфире, летуч. Имеет
резкий чесночный запах. В воде почти не растворяется. Светится в темноте.
Белый фосфор. Пожалуй, самая известная
модификация элемента №15 – мягкий, как воск, белый или желтый фосфор. Это ее
открыл Бранд, и благодаря ее свойствам элемент получил свое имя: по-гречески
«фосфор» значит светящийся, светоносный. Молекула белого фосфора состоит из
четырех атомов, построенных в форме тетраэдра. Плотность 1,83, температура
плавления 44,1°C, кипения 280°С, Белый
фосфор ядовит, чрезвычайно реакционноспособен, легко окисляется. Растворим в
сероуглероде, жидких аммиаке и SO2, бензоле, эфире, летуч. Имеет
резкий чесночный запах. В воде почти не растворяется. Светится в темноте.
 Êðàñíûé
ôîñôîð. Ïðè
íàãðåâàíèè
áåç äîñòóïà
âîçäóõà
âûøå 250°C áåëûé
ôîñôîð
ïðåâðàùàåòñÿ
â êðàñíûé.
Ýòî óæå
ïîëèìåð, íî
íå î÷åíü
óïîðÿäî÷åííîé
ñòðóêòóðû.
Ðåàêöèîííàÿ
ñïîñîáíîñòü
ó êðàñíîãî
ôîñôîðà
çíà÷èòåëüíî
ìåíüøå, ÷åì ó áåëîãî.
Îí íå
ñâåòèòñÿ â
òåìíîòå, íå
ðàñòâîðÿåòñÿ
â
ñåðîóãëåðîäå.
(Âñåãäà
ñîäåðæèò íåáîëüøèå
êîëè÷åñòâà
áåëîãî
ôîñôîðà, âñëåäñòâèå
÷åãî ìîæåò
îêàçàòüñÿ
ÿäîâèòûì.). Ïëîòíîñòü
åãî íàìíîãî
áîëüøå,
ñòðóêòóðà ìåëêîêðèñòàëëè÷åñêàÿ.
Áåç
çàïàõà, öâåò
êðàñíî-áóðûé.
Àòîìíàÿ êðèñòàëëè÷åñêàÿ
ðåø¸òêà
î÷åíü
ñëîæíàÿ, îáû÷íî
àìîðôåí.
Íåðàñòâîðèì
â âîäå è â
îðãàíè÷åñêèõ
ðàñòâîðèòåëÿõ.
Óñòîé÷èâ.
Ôèçè÷åñêèå
ñâîéñòâà
çàâèñÿò îò
ñïîñîáà
ïîëó÷åíèÿ.
Êðàñíûé
ôîñôîð. Ïðè
íàãðåâàíèè
áåç äîñòóïà
âîçäóõà
âûøå 250°C áåëûé
ôîñôîð
ïðåâðàùàåòñÿ
â êðàñíûé.
Ýòî óæå
ïîëèìåð, íî
íå î÷åíü
óïîðÿäî÷åííîé
ñòðóêòóðû.
Ðåàêöèîííàÿ
ñïîñîáíîñòü
ó êðàñíîãî
ôîñôîðà
çíà÷èòåëüíî
ìåíüøå, ÷åì ó áåëîãî.
Îí íå
ñâåòèòñÿ â
òåìíîòå, íå
ðàñòâîðÿåòñÿ
â
ñåðîóãëåðîäå.
(Âñåãäà
ñîäåðæèò íåáîëüøèå
êîëè÷åñòâà
áåëîãî
ôîñôîðà, âñëåäñòâèå
÷åãî ìîæåò
îêàçàòüñÿ
ÿäîâèòûì.). Ïëîòíîñòü
åãî íàìíîãî
áîëüøå,
ñòðóêòóðà ìåëêîêðèñòàëëè÷åñêàÿ.
Áåç
çàïàõà, öâåò
êðàñíî-áóðûé.
Àòîìíàÿ êðèñòàëëè÷åñêàÿ
ðåø¸òêà
î÷åíü
ñëîæíàÿ, îáû÷íî
àìîðôåí.
Íåðàñòâîðèì
â âîäå è â
îðãàíè÷åñêèõ
ðàñòâîðèòåëÿõ.
Óñòîé÷èâ.
Ôèçè÷åñêèå
ñâîéñòâà
çàâèñÿò îò
ñïîñîáà
ïîëó÷åíèÿ.
 Чёрный фосфор - полимерное вещество с
металлическим блеском, похож на графит, без запаха, жирный на ощупь.
Нерастворим в воде и в органических растворителях. Атомная кристаллическая
решётка, полупроводник. t°кип.= 453°С (возгонка), t°пл.= 1000°C (при p=1,8 • 109 Па), устойчив.
Чёрный фосфор - полимерное вещество с
металлическим блеском, похож на графит, без запаха, жирный на ощупь.
Нерастворим в воде и в органических растворителях. Атомная кристаллическая
решётка, полупроводник. t°кип.= 453°С (возгонка), t°пл.= 1000°C (при p=1,8 • 109 Па), устойчив.
Менее известны другие, еще более высокомолекулярные модификации фосфора – фиолетовый и коричневый, отличающиеся одна от другой молекулярным весом и степенью упорядоченности макромолекул. Эти модификации – лабораторная экзотика и в отличие от белого и красного фосфора практического применения пока не нашли.
3.4. Получение фосфора
Фосфор приготовляется в больших размерах на химических заводах с тех пор, как для него найдены значительные технические применения, главным образом для приготовления фосфорных спичек. Материалом для его получения уже не служит более выпаренная моча, а фосфорнокислый кальций костей или тот, который встречается в минеральном царстве.
Как ни велико сродство фосфора к кислороду, оно все-таки менее сродства раскаленного угля. Фосфорный ангидрид, смешанный в надлежащей форме с углем и нагретый до светлокрасного каления, вполне восстановляется им с образованием окиси углерода:
P2O5 + 5C = P2 + 5CO
Если накаливать с углем фосфорнокислый кальций, встречающийся в минеральном царстве или содержащийся в обожженых добела костях, то фосфор не восстанавливается, так как он может быть получен только из свободного фосфорного ангидрида или такого фосфорнокислого кальция, который содержит более элементов фосфорного ангидрида, нежели средняя соль.
Для получения такой соли, обыкновенный средний фосфорнокислый кальций измельчается в тонкий порошок, обливается разведенною серною кислотою и нагревается. При этом получается кислый фосфорнокислый кальций и трудно растворимый в воде сернокислый кальций (гипс):
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
Образовавшийся кислый фосфорнокислый кальций переходит в раствор и отделяется от гипса сливанием и отжиманием.
Этот раствор концентрируется выпариванием в свинцовых сосудах, затем смешивается с измельченным древесным углем и нагревается до слабого каления. При этом происходит выделение воды из кислой фосфорнокислой соли и образуется метафосфорнокислый кальций:
Ca(H2PO4)2 = 2H2O + Ca(PO3)2
Метафосфорнокислый кальций можно рассматривать, как состоящий из среднего фосфорнокислого кальция и фосфорного ангидрида:
3Ca(PO3)2 = Ca3(PO4)2 + 2P2O5
Из этого то последнего соединения и выделяется фосфор при сильном накаливании с углем, а в остатке получается средний фосфорнокислый кальций:
3Ca(PO3)2 + 5C2 = 2P2 + 10CO + Ca3(PO4)2
Накаливание производится в глиняных ретортах, соединенных с глиняными же, наполненными водою приемниками, в которых парообразный фосфор сгущается и собирается под водою. Полученный таким образом сырой продукт еще не чист и очищается перегонкою в чугунных ретортах.
Около 80% от всего производства белого фосфора идет на синтез чистой ортофосфорной кислоты. Она в свою очередь используется для получения полифосфатов натрия (их применяют для снижения жесткости питьевой воды) и пищевых фосфатов. Оставшаяся часть белого фосфора расходуется для создания дымообразующих веществ и зажигательных смесей.
В производстве фосфора и его соединений требуется соблюдение особых мер предосторожности, т.к. белый фосфор – сильный яд. Продолжительная работа в атмосфере белого фосфора может привести к заболеванию костных тканей, выпадению зубов, омертвению участков челюстей. Воспламеняясь, белый фосфор вызывает болезненные, долго не заживающие ожоги. Хранить белый фосфор следует под водой, в герметичных сосудах. Горящий фосфор тушат двуокисью углерода, раствором CuSO4 или песком. Обоженную кожу следует промыть раствором KmnO4 или CuSO4. Противоядием при отравлении фосфором является 2%-ый раствор CuSO4.
3.5. Химические свойства
1. Реакции с кислородом:
4P0 + 5O2 –t°= 2P2+5O5
(при недостатке кислорода: 4P0 + 3O2 –t°= 2P2+3O3)
2. С галогенами и серой:
2P + 3Cl2 = 2PCl3
2P + 5Cl2 = 2PCl5
2P + 5S –t°= P2S5
галогениды фосфора легко разлагаются водой, например:
PCl3+3H2O=H3PO3+3HCl
PCl5 + 4H2O = H3PO4 + 5HCl
3. С азотной кислотой:
3P0 + 5HN+5O3 + 2H2O = 3H3P+5O4 + 5N+2O
4. С металлами образует фосфиды, в которых фосфор проявляет степень окисления - 3:
2P0 + 3Mg = Mg3P2-3
фосфид магния легко разлагается водой
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3(фосфин)
3Li + P =Li3P-3
5. Со щелочью:
4P + 3NaOH + 3H2O = PH3 + 3NaH2PO2
В реакциях (1,2,3) - фосфор выступает как восстановитель, в реакции (4) - как окислитель; реакция (5) - пример реакции диспропорционирования.
3.6. Стереохимические особенности фосфора и его соединений. Псевдовращение.
 îòëè÷èå îò àçîòà ôîñôîð ìîæåò îáðàçîâûâàòü ïÿòü êîâàëåíòíûõ ñâÿçåé ïóòåì ðàñøèðåíèÿ ñâîåé âàëåíòíîé îáîëî÷êè îò îêòåòà äî äåöåòà. Ìîëåêóëû, öåíòðàëüíûé àòîì êîòîðûõ èìååò áîëåå âîñüìè ýëåêòðîíîâ â âàëåíòíîé îáîëî÷êå, íàçûâàþòñÿ ãèïåðâàëåíòíûìè. Ïîäîáíûå ñîåäèíåíèÿ ïðèîáðåòàþò êîíôèãóðàöèþ òðèãîíàëüíîé áèïèðàìèäû, íàïðèìåð:
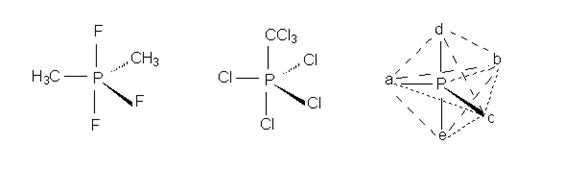
Пять заместителей занимают стереохимически неодинаковое положение: три из них (а, b и с в формуле LXV) называют экваториальными, а два (d и е) - апикальными. Интересно, что молекула LXV с пятью разными заместителями у атома фосфора, в принципе, может существовать в виде 20 хиральных изомеров, составляющих 10 пар энантиомеров. Если два заместителя одинаковы, число изомеров сокращается до 10, среди которых две пары будут энантиомерами.
Молекулы, в которых центральный атом имеет координационное число 4 или 6 обычно сохраняют устойчивую форму тетраэдра или октаэдра. Однако в пентакоординационных соединениях лиганды непрерывно меняют свое положение. По этой причине пятикоординационные соединения фосфора (а также многие другие, отличающиеся аналогичным типом химического поведения) принято называть конфигурационно-неустойчивыми. Для объяснения непрерывной смены положения лигандов в тригональной бипирамиде предложен механизм псевдовращения - обратимый переход между конфигурациями тригональной бипирамиды и тетрагональной пирамиды:
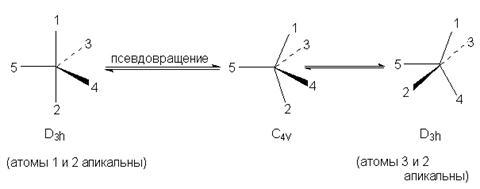
В процессе этого мнимого вращения один из экваториальных заместителей, называемый опорным лигандом (в нашем случае обозначен цифрой 5) остается в экваторальном положении, в то время как другие лиганды формируют собой основание воображаемой тетрагональной пирамиды за счет искажения валентных углов. Валентный угол между связями 1-Р-2 уменьшается от 180 до 1200, а между связями 3-Р-4 увеличивается от 120 до 1800, т.е. апикальные лиганды 1 и 2 в конце концов займут экваториальные, а экваториальные лиганды 3 и 4 - апикальные положения. В результате образуется диастереомер исходной системы, т.е. происходит кажущийся поворот лигандов на 900 относительно опорного лиганда 5.
Псевдовращение происходит потому, что энергетическая разница между конфигурациями D3h и C4v в пентакоординационных соединениях фосфора очень невелика.
3.7. Изотопы фосфора
Природный фосфор в отличие от подавляющего большинства элементов состоит только из одного изотопа 31Р. В ядерных реакциях синтезировано несколько короткоживущих радиоактивных изотопов элемента №15. Один из них – фосфор-30 оказался вообще первым изотопом, полученным искусственным путем. Это его получили в 1934 г. Фредерик и Ирен Жолио-Кюри при облучении алюминия альфа-частицами. Фосфор-30 имеет период полураспада 2,55 минуты и, распадаясь, излучает позитроны («положительные электроны»). Сейчас известны шесть радиоактивных изотопов фосфора. Наиболее долгоживущий из них 33Р имеет период полураспада 25 дней. Изотопы фосфора применяются главным образом в биологических исследованиях.
4. СОЕДИНЕНИЯ ФОСФОРА
4.1. Неорганические соединения фосфора и их свойства
4.1.1. Галогениды и оксиды фосфора
Хлорид фосфора(III) PCl3 – жидкость, кипящая при 75° С. Под действием воды полностью разлагается на HCl и фосфорную кислоту H3PO3.
Хлорид фосфора(V) PCl5 – твердое белое вещество. Получается при пропускании хлора в PCl3. Водой разлагается на HCl и фосфорную кислоту H3PO4.
Аналогичные соединения образуются с бромом, иодом и фтором, но соединение PI5 неизвестно.
Оксид фосфора(III) P2O3 (устар. фосфористый ангидрид) – белое кристаллическое вещество, плавящееся при 23,8° С. Образуется при медленном окислении или горении фосфора при ограниченном доступе кислорода. Молекулярная формула при низких температурах – P4O6. Медленно реагирует с холодной водой с образованием фосфористой кислоты H3PO3, P2O3, и H3PO3 – сильные восстановители.
Химические свойства оксида фосфора III
1. Все свойства кислотных оксидов.
P2O3 + 3H2O = 2H3PO3
2. Сильный восстановитель
O2+ P2+3O3 = P2+5O5
Фосфорный ангидрид P2+5O5 (оксид фосфора (V)).
Белые кристаллы, t°пл.= 570°С, t°кип.= 600°C, r = 2,7 г/см3. Имеет несколько модификаций. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Получение
4P + 5O2 = 2P2O5
Химические свойства фосфорного ангидрида
Все химические свойства кислотных оксидов: реагирует с водой, основными оксидами и щелочами
1) P2O5 + H2O = 2HPO3 (метафосфорная кислота)
P2O5 + 2H2O = H4P2O7 (пирофосфорная кислота)
P2O5 + 3H2O = 2H3PO4 (ортофосфорная кислота)
2) P2O5 + 3BaO = Ba3(PO4)2
3) P2O5 + 6KOH = 2K3PO4+ 3H2O
P2O5 - сильное водоотнимающее средство:
4) P2O5+ 2HNO3 = 2HPO3 + N2O5
P2O5+ 2HClO4 = 2HPO3+ Cl2O7
4.1.2. Фосфорные кислоты
|
Формула |
Название |
|
HPO3 |
Метафосфорная |
|
H3PO2 |
Фосфорноватистая (Диоксофосфорная) |
|
H3PO3 |
Ортофосфористая |
|
H3PO4 |
Ортофосфорная |
|
H3PO5 |
Мононадфосфорная |
|
H4P2O5 |
Пирофосфористая (Дифосфористая) |
|
H4P2O6 |
Фосфорноватная (Гексаоксодифосфорная) |
|
H4P2O7 |
Пирофосфорная |
|
H4P2O8 |
Динадфосфорная |
Свойства основных кислот
HP+5O3 Метафосфорная кислота
![]()
Получение
P2O5+ H2O = 2HPO3
Соли метафосфорной кислоты - метафосфаты (KPO3 – метафосфат калия)
Химические свойства
Характерны все свойства кислот.
H3P+5O3 Фосфористая кислота
![]()
Бесцветное кристаллическое вещество; t°пл.= 74°С, хорошо растворимое в воде.
Получение
PCl3+ 3H2O = H3PO3+ 3HCl
Химические свойства
1) Водный раствор H3PO3 - двухосновная кислота средней силы (соли – фосфиты):
H3PO3+ 2NaOH = Na2HPO3+ 2H2O
2) При нагревании происходит превращение в ортофосфорную кислоту и фосфин:
4H3PO3 = 3H3PO4+ PH3
3) Восстановительные свойства:
H3PO3+ HgCl2+ H2O = H3PO4+ Hg + 2HCl
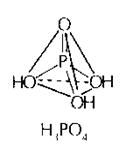 H3P+5O4 Ортофосфорная
кислота
H3P+5O4 Ортофосфорная
кислота
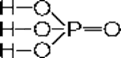
Белое твердое вещество, гигроскопичное, хорошо растворимое в воде; t°пл.= 42°С, r = 1,88 г/см3.
Диссоциация:
H3PO4 ↔ 3H+ + PO4-3
H3PO4+ 3H2O ↔ 3H3O+ + PO43-
H3PO4 ↔ H+ + H2PO4-
H2PO4- ↔ H+ + HPO42-
HPO42- ↔ H+ + PO43-
Ортофосфорная кислота - средней силы, не является окислителем, трехосновная. Она образует средние соли - ортофосфаты (Na3PO4) и два типа кислых солей - дигидрофосфаты (NaH2PO4) и гидрофосфаты (Na2HPO4).
Получение
1)
P2O5+ 3H2O ↔ 2H3PO4
Промышленный способ:
2)
Ca3(PO4)2(твердый) + 3H2SO4(конц.) ↔ 2H3PO4+ 3CaSO4¯
3)
3P + 5HNO3+ 2H2O ↔ 3H3PO4+ 5NO
Химические свойства
Для ортофосфорной кислоты характерны все свойства кислот – неокислителей. При нагревании она превращается в пирофосфорную кислоту:
2H3PO4 –t°↔ H4P2O7 + H2O
Качественная реакция на обнаружение в растворе анионов PO43-
3Ag+ + PO43- = Ag3PO4¯(ярко-желтый осадок)
Ортофосфорная кислота - сильная кислота по первой ступени диссоциации (К1 = 7,6*10-3), довольно слабая (слабее уксусной) по второй (К2 = 6,2*10-8) и очень слабая (слабее угольной) по третьей (К3 = 4,4*10-13).
4.1.3. Фосфин
Фосфин (PH3) – бесцветный газ с запахом чеснока. Очень ядовит. Сгорает с образованием фосфорного ангидрида P2O5. С наиболее сильными кислотами (HClO4, HCl) образует соли фосфония PH4+ – очень непрочные соединения, которые при действии воды разлагаются на фосфин и HCl.
Cуществует несколько водородных соединений фосфора. Наиболее изучены РН3 (фосфин), а также Р2Н4 - жидкий фосфористый водород (дифосфин). Наибольшую известность и практическое значение имеет газообразный РН3. При комнатной температуре он представляет собой бесцветный, тяжёлый (пл.1.53 г/дм), чрезвычайно ядовитый газ с неприятным запахом.
Максимальная концентрация его в воздухе при 8-часовом рабочем дне не должна превышать 0,3 млн-1. Концентрация в 50-100 млн-1 переносима без осложнений лишь очень короткое время, концентрация в 400 млн-1 ведёт к моментальной смерти, что служит серьёзным препятствием для его практического использования . Ниже –87,8o С фосфин - бесцветная жидкость, которая затвердевает при –133,5 о С. Вплоть до температур в несколько сот градусов его диссоциация незначительна. Константа скорости распада при 500о С составляет около 8.10-3 сек-1. Фосфин является сильным восстановителем, самопроизвольно реагирует при комнатной температуре с хлором, образуя хлориды фосфора и НCl. Чистый газ воспламеняется на воздухе при 150о С. Загрязненный примесями газ (следы дифосфина Р2Н4 или тетрафосфора Р4) может самовоспламеняться при комнатной температуре. Условия воспламенения фосфина и кислорода зависят от состава смеси, содержания воды, присутствия инородных газов и температуры. Окисление фосфина происходит по цепному механизму и имеет пределы критического давления:
0: + РН3 РН + НОН
РН + 02 НРО + 0:
Первая стадия проходит быстро, поскольку она экзотермична и, вероятно, включает перенос не спаренного электрона от кислорода к фосфору (p*- уровень кислорода может быть по энергии выше, чем 3d-уровень фосфора). Продукты окисления состоят из различных кислот фосфора (Н3РО2, Н3РО3, Н3РО4 и т.д.) и воды.
Фосфин почти не образует водородных связей и об отсутствии межмолекулярной ассоциации в РН3 свидетельствуют аномальное соотношение температур плавления и кипения РН3 (-133,3о;-87,4o C) и NH3 (-77,75o;-33,35o C). На это указывает также низкая по сравнению с NH3 растворимость фосфина в воде. В 100 мл воды при 17о С растворяется 22,8 мл газообразного РН3. Водный раствор является одновременно и слабой кислотой и слабым основанием. Обмен дейтерия между D2О и РН3 протекает в кислом растворе через РН4+-ион, в основном растворе через РН2--ион. Из кинетических данных и принятого механизма обмена авторы для равновесной постоянной реакции рассчитали:
РН3 + НОН = РН2- + Н3О+, kкисл.= 1,6.10-29;
РН3 + НОН = РН4+ + ОН-, kосн. = 4.10-28
Несколько лучше он растворяется в органических растворителях: бензине, хлороформе и четырёххлористом углероде. Молекула фосфина полярна (m = 0,58) и имеет форму тригональной пирамиды c атомом фосфора в вершине. Все три атома водорода в молекуле равноценны, расстояние Р-Н составляет 1,419 А, высота пирамиды 0,764 А, угол связи Н-Р-Н 93,7, энергия связи Р-Н 77 ккал/моль. Образование связей Р-Н происходит за счёт р-орбиталей фосфора, а не поделенная пара электронов имеет сферическую симметрию и расположена на s-орбитали. Участие d-орбиталей в образовании связей, по-видимому, невелико. Такое строение фосфина чрезвычайно затрудняет образование донорно-акцепторных связей с его участием как донора электронов. Именно затруднение sp3_гибридизации орбиталей атомов фосфора обуславливает слабость донорных свойств фосфина и соответственно его плохо выраженные основные свойства. Этим объясняется малый дипольный момент молекулы РН3, уменьшение основности и способности к координации по сравнению с аммиаком, устойчивость и нейтральность фосфина в обычных условиях. Присоединение протона к РН3 (переход 3р ® 3sр3) сопровождается перестройкой валентных углов и протекает с большой затратой энергии, поэтому соли фосфония известны лишь для немногих кислот (НСIО4, НВr, НI), причём они весьма нестойки.
Фосфин способен осаждать тяжёлые металлы из их солей. Окисление проходит через стадию образования комплексного соединения металл-фосфин. Эффективными окислителями выступают металлы, у которых на d-оболочке больше 5, но меньше 10 электронов. Не поделенная пара электронов фосфора молекулы РН3 может передаваться на ds- орбиталь металла, образуя координационную связь. Согласно теории поля лигандов, среди группы d–орбиталей металла ds–орбитали всегда относятся к наивысшим энергетическим уровням. Поэтому соответствующая ds-орбиталь (dz2, dx2-y2) будет вакантной и способной к координационному связыванию фосфина. Вакантные dp-орбитали фосфора участвуют в образовании p-дативной связи М ® РН3. Комплексы с фосфином сравнительно немногочисленны, а соединения, в которых РН3 единственный лиганд, редки.
Фосфин, первичные и вторичные фосфины образуют комплексы с солями Al, Ti, Cu, Ni, Co, Fe, Pd, Pt и других металлов. Комплексообразование РН3 с различными металлами переменной валентности, проблемы катализа реакций окисления фосфина в отходящих газах химических производств широко освещены в работах .
Жидкий гидрид фосфора Р2Н4 представляет собой бесцветную жидкость с температурой кипения 60оС, самовозгорающуюся на воздухе. На свету происходит самопроизвольный распад Н2Р-РН2:
3 Р2Н4 2 РН3 + Р4Н2 + 2Н2
В отличие от гидразина H2N-NH2 (стехиометрического аналога Н2Р-РН2), жидкий фосфористый водород Р2Н4 не обладает основными свойствами из-за слабости донорных свойств фосфора, проявляющихся даже у РН3. Твёрдый гидрид фосфора Р4Н2 – жёлтое твёрдое вещество, загорающееся на воздухе выше 160оС.
4.1.4. Фосфонитрилхлориды
Самостоятельный класс веществ составили фосфонитрилхлориды – соединения фосфора с азотом и хлором. Мономер фосфонитрилхлорида способен к полимеризации. С ростом молекулярного веса меняются свойства веществ этого класса, в частности заметно уменьшается их растворимость в органических жидкостях. Когда молекулярный вес полимера достигает нескольких тысяч, получается каучукоподобное вещество – единственный пока каучук, в составе которого совсем нет углерода. Дальнейший рост молекулярного веса приводит к образованию твердых пластмассоподобных веществ. «Безуглеродный каучук» обладает значительной термостойкостью: он начинает разрушаться лишь при 350°C.
4.1.5. Боевые ОВ - производные фосфоновой кислоты
В 1952 г. были синтезированы наиболее ядовитые из нервно-паралитических ОВ - фосфорилтиохолины, названные V-газами. Самый ядовитый из них - O-этиловый-S-(N,N-диизопропиламино)этиловый эфир метилфосфоновой кислоты или VX. В общей формуле для VX:
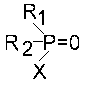
R1 = CH3-; R2 = C2H5O-; X = (i-C3H7)2NCH2CH2S-. Попадание на кожу даже одной мельчайшей капельки (около 3 мг) VX смертельно.
В быту используются аналоги зарина и VX - дезактиваторы холинэстеразы насекомых. Наиболее известны дихлофос (R1 = R2 = CH3O-; X = CCl2=CHO-), хлорофос (R1 = R2 = CH3O-; X = CCl3CH(OH)O-) и карбофос. ПДК паров дихлофоса 0,2 мг/м3, смертельная доза (для крыс) 50 мг/кг. Для хлорофоса и карбофоса ПДК 0,5 мг/м3 .
4.2. ФОСФОРООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ (ФОС)
4.2.1. Значение
О роли фосфорорганических соединений в важнейших биохимических реакциях организма написаны многие тома. В любом учебнике биохимии эти вещества не только многократно упоминаются, но и подробно описываются. Без фосфорорганических соединений не мог бы идти процесс обмена углеводов в ткани мозга. Фосфорсодержащий фермент фосфорилаза способствует не только распаду, но и синтезу полисахаридов в мозгу.
В процессе окисления углеводов в ткани мозга важную роль играют дифосфо-пиридиннуклеотид и неорганический фосфат. Другой важнейший процесс – сокращение мышц поддерживается энергией, выделяющейся при реакциях с участием аденозинфосфатов. При сокращении мышцы молекула аденозинтрифосфата (АТФ) распадается на аденозиндифосфат и неорганическую фосфорную кислоту. При этом освобождается много энергии (8...11 ккал/моль). О важнейшей роли этих веществ свидетельствует и тот факт, что в мышечной ткани всегда поддерживается постоянный уровень АТФ.
Фосфорорганические соединения (ФОС) содержат в молекулах атом Р, связанный с органическими радикалами непосредственно или через гетероатом (O, S, N и др.). Первые ФОС (смесь метилфосфинов) выделены в 1846 Л.Тенаром и Берцелиусом при метилировани фосфида Са.
4.2.2. Классификация ФОС
ФОС можно классифицировать по количеству заместителей у атома Р (координационному числу), которое может быть от 1 до 6. Примеры соединений с различными координационные числом атома Р приведены в таблице 1:
Таблица 1. Примеры ФОС с различными координационными числами
|
Координационное число |
Соединение |
| 1 |
(СH3)3C–CCP |
| 2 |
[(CH3)2N]2C=PH |
| 3 |
P(OCH3)3 |
| 4 |
(C4H9)3PO |
| 5 |
C6H5(CH3)2P(OC2H5)2 |
| 6 |
CF3PHF4– |
По другой классификации, охватывающей наиболее распространенные ФОС, выделяют фосфорсодержащие кислоты и их производные (табл. 2), а также фосфины и родственные соединения.
Таблица 2. Название некоторых кислот фосфора, их эфиров и солей
|
Формула |
Кислоты |
Эфиры и соли |
|
Производные пятивалентного фосфора |
||
|
(HO)3PO |
Ортофосфорная (фосфорная) | Фосфаты |
|
RP(O)(OH)2 |
Фосфоновые кислоты | Фосфонаты |
|
R2P(O)OH |
Фосфиновые кислоты | Фосфинаты |
|
Производные трехвалентного фосфора |
||
|
HP(OH)2 |
Гипофосфористая (фосфорноватистая) | Гипофосфиты |
|
P(OH)3 |
Фосфористая | Фосфиты |
|
RP(OH)2 |
Фосфонистые кислоты | Фосфониты |
|
R2OPH |
Фосфинистые кислоты | Фосфиниты |
К ФОС второго типа относятся первичные RPH2, вторичные R2PH, третичные фосфины R3P, а также окисленные формы последних: фосфиноксиды R3PO, фосфинсульфиды R3PS, фосфинселениды R3PSe, фосфазосоединения R3P=NR и фосфиналкилены R3P=CR2. Ко второму типу принадлежат также фосфониевые соединения R4P+X– и фосфораны R5P. Известны также полифосфины и их производные и металлокомплексы [например, (RО)3Р·СuВr, (R3P)3·RhСl, R3РО·SnR4]. Во всех приведенных формулах радикалы R могут быть одинаковыми или различными.
4.2.3. Распространение ФОС в природе
Разнообразные ФОС содержатся в живых организмах, где выполняют ответственные биологические функции. К ним, например, относятся нуклеиновые кислоты, нуклеотиды, фосфаты моносахаридов (например, глюкозо-1- и глюкозо-6-фосфаты), нуклеозидмоноциклофосфагы (например, аденозинмонофоат циклический), различные типы фосфолипидов и др. К природным ФОС также относят производные фосфоновых кислот – антибиотик фосфомицетин, фосфорные аналоги a- и b- аминокарбоновых кислот и пептиды их основе.
4.2.4. Физические свойства ФОС
ФОС могут быть газами, жидкостями или твердыми веществами. Для идентификации и изучения их используют все основные физико-химимические методы, но в первую очередь спектроскопию ЯМР 31Р. Величины химических сдвигов определяются главным образом электроотрицательностями атомов, связанные атомом Р, и степенью обратного p-дативного взаимодействия с ним. Сигналы ЯМР 31Р располагаются в очень широкой области значений (несколько сотен м.д.) и проявляют при этом выраженную специфичность.
4.2.5. Химические свойства ФОС
1. Таутомерия. Для гидрофосфорильных соединений и тиогидрофосфорильных соединений известен такой вид прототропии:
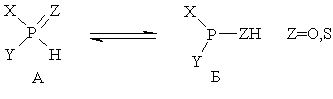
Как правило, равновесие сдвинуто в сторону формы А, однако, при наличии сильных электроноакцепторных заместителей Х и Y [например, (CF3)2POH] – в сторону Б.
Циклические средние фосфиты и амидофосфиты с протонодонорной группой в боковой цепи могут частично или полностью превращаться в гидроспирофосфорановые формы:
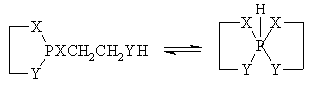
Тиокислоты фосфора характеризуются особым видом прототропии:
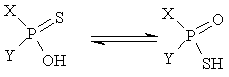
Увеличение электроноакцепторных свойств заместителей Х приводит к накоплению формы Б.
В химии ФОС известны и фосфотропные процессы:
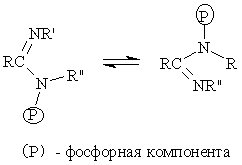
Если радикалы R и R' одинаковые, то процесс является вырожденным. Особый вид таутомерии (псевдовращение) характерен для фосфоранов, которые способны обменивать у атома Р заместители, занимающие аксиальные и экваториальные положения:
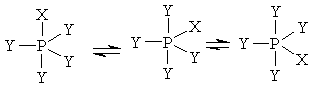
Принцип псевдовращения широко используют для объяснения механизмов реакций ФОС.
2. Диспропорционирование. Производные пяти и особенно трехвалентного Р, в молекулах которых атомы Р связаны с различными электроноакцепторными группами, склонны к межмолекулярному обмену этими группами, например:
2(RO)2P(O)Cl <–> (RO)3P(O) + ROP(O)Cl2
Диспропорционирование обычно катализируется кислотами. Наличие циклических фрагментов в молекуле препятствует диспропорционированию.
3. Фосфорилирование. С помощью ФОС, в молекулах, которых атом Р связям с электроноакцепторной (уходящей) группой, фосфорный можно водить в состав нуклеофилов (осуществлять фосфорилирование). В качестве уходящих групп и обычно выступают галогенениды, алкиокси-, тиоалкоксигруппы и др.
P(O)Cl3 + 3ROH –> (RO)3PO + HCl
Кислоты также используются в качестве фосфорилирующих средств, однако, как правило, после предварительной, активации, т. е. после превращения кислотного гидроксила в легкоуходящую группу:
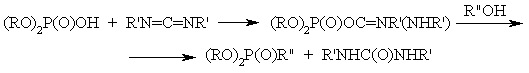
Производныс кислот с трехвалентным атомом Р проявляют более высокую фосфорилирующую активность, чем производные с пятивалентным атомом Р.
4. Важнейшие реакции производных трехвалентного Р. Эти соединения легко окисляются, присоединяют атомы S, Se, Te, Hal, иминируются, алкилируются:
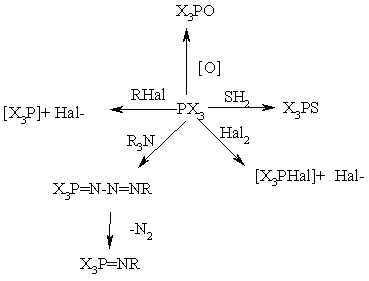
Eсли X=OAlk, SAlk, то первичный продукт взаимодействия PX3 c RHal далее распадается с образованием фосфорильного (тиофосфорильного) соединения (Арбузова реакция). При взаимодействии средних фосфитов с a-галогенкарбонильными соединения может происходить как реакция Арбузова, так и иной процесс, приводящий к фосфовиниловым эфирам (Перкова реакция):
(RO)3P + BrCH2C(O)CH3 –> (RO)2P(O)OC(CH3)=CH2
Многие производные трехвалентного Р присоединяются к сопряженным диенам и другим p,p-сопряженным системам, образующиеся продукты могут выделяться, как целевые вещества либо без выделения вступать в дальнейшие превращения.
Соединения с трехвалентным атомом Р легко обрадуют комплексы с производными переходных металлов.
5. Важнейшие реакции производных пятивалентного Р. Кислород фосфорильной группы в таких ФОС заменяется на серу под действием P2S5. В молекулах третичных фосфиноксидов он элиминируется при восстановлении трихлорсиланом.
Сложные эфиры тионовых кислот при действии алкилгалогенидов или при нагревании претерпевают тион-тиольную перегруппировку:
![]()
В большинстве фосфорильных соединений со связью С–Р a-метиленовые протоны фосфорильной группы подвижны, что приводит к их депротонированию под действием сильных основании. Образующиеся карбанионы при взаимодействии с альдегидами и кетонами образуют олефины (Хорнера реакция):
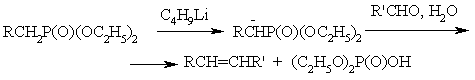
Подобная реакция происходит под действием фосфиналкиленов (Виттига реакция):
Ph3P=CH2 + RCHO –> CH2=CHR + Ph3PO
a-Гидроксифосфонаты при нагревании в присутствии оснований могут превращаться в фосфаты (фосфонат-фосфатная перегруппировка):
RCH(OH)P(O)(OR')2 –> RCH2OP(O)(OR')2
Фосфорильные соединения образуют комплексы с различными переходными и непереходными металлами с участием кислорода фосфорильной группы. Устойчивость комплексов обычно возрастает при хелатировании металла.
4.2.6. Получение ФОС
Общий путь синтеза ФОС включает три последовательные стадии:
· получение элементарного фосфора из минерального сырья.
· превращение фосфора в неорганические производные (Р4О10, РСl3, РСl5, РОСl3).
· получение ФОС взаимодействием. этих производных со спиртами, аминами, альдегидами, олефинами и др. Возможно также превращение фосфора в ФОС, минуя неорганические производные (например, взаимодействие элементного Р с алкилгалогенидами или спиртами).
Среди многочисленных способов синтеза конкретных ФОС выделяют методы позволяющие получать соединения со связью С–Р. Эти методы приведены ниже.
Фосфины и гидрофосфорильные (тиогидрофосфорильные) соединения в условиях гомолитических реакций; легко присоединяются к олефинам с образованием связи С–Р:
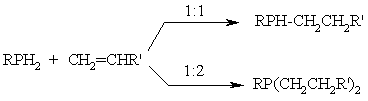
Эти же соединения в условиях гетеролитических реакций присоединяются по связям С=O, С=N, С=S, С=C c образованием разнообразных функционализированных ФОС:

При алкилировании и арилировании средних эфиров кислот трехвалентного фосфора образуется новая связь С–Р (реакция Арбузова).
Аналогично осуществляется реакция с использованием металлических солей гидрофосфорильных соединений (реакция Михаэлиса - Беккера):
(RO)2PONa + R'X –> R'P(O)(OR)2 + NaX
Этот синтез целесообразно проводить в условиях межфазного катализа.
Галогенангидриды органических кислот фосфора образуются присоединении РСl5 и родственных веществ к непредельным соединениям:
2PCl5 + RCH=CH2 –> RCHClCH2PCl4PCl6
При взаимодействии алканов или алкенов с РСl3 и кислородом образуются сложные смеси веществ, основными компонентами которых являются дихлорангидриды фосфоновых кислот (реакция окислительное хлорфосфонирование).
Ароматические соединения легко фосфорилируются РСl3, P2S5 и другими элекрофилами в условиях реакции Фриделя-Крафтса.
Алкилгалогениды в присутствии кислот Льюиса алкилируются PCl3 c образованием связи С–Р:
![]()
При нагревании белого и красного фосфора с арил- или алкилгалогенидами образуется смесь хлорфосфинов. Вариант этой реакции, представляющий практическое значение – алкилирование Р присутствии иода.
Связь С–Р образуется также при взаимодействии. галогенангидридов кислот фосфора с металлоорганическими соединениями, при этом один и несколько атомов галогена обмениваются на углеводородные радикалы:
PCl3 + RLi –> R3P + LiCl
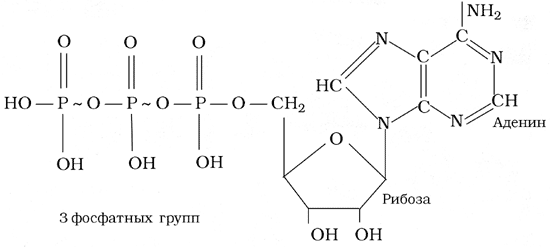
4.3. АТФ
Важнейшая особенность фосфорных кислот - образование полифосфатов:

Подобные структуры являются фрагментами АТФ. Высвобождение и аккумуляция энергии в АТФ обеспечивается за счет обратимого гидролиза трифосфата до дифосфата и наоборот.
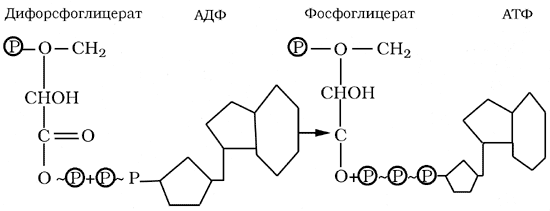
Молекула АТФ - это один своеобразный нуклеотид, который, как и другие нуклеотиды, состоит из трех компонентов: азотистого основания - аденина, углевода - рибозы, но вместо одного содержит три остатка молекул фосфорной кислоты. Связи, обозначенные значком ~, богаты энергией и называются макроэргическими. Каждая молекула АТФ содержит две макроэргические связи.
При разрыве макроэргической связи и отщеплении с помощью ферментов одной молекулы фосфорной кислоты освобождается 40 кДж/моль энергии, а АТФ при этом превращается в АДФ - аденозиндифосфорную кислоту. При отщеплении еще одной молекулы фосфорной кислоты освобождается еще 40 кДж/моль; образуется АМФ - аденозинмонофосфорная кислота. Эти реакции обратимы, то есть АМФ может превращаться в АДФ, АДФ - в АТФ.
Молекулы АТФ не только расщепляются, но и синтезируются, поэтому их содержание в клетке относительно постоянно. Значение АТФ в жизни клетки огромно. Эти молекулы играют ведущую роль в энергетическом обмене, необходимом для обеспечения жизнедеятельности клетки и организма в целом.
4.4. Фосфорные удобрения
«В 1839 г. англичанин Лауз впервые получил суперфосфат – фосфорное удобрение, легко усвояемое растениями».
|
4.4.1. Значение Одним из основных элементов питания растений является фосфор. Правильное его использование ускоряет рост и развитие растений, повышается урожай и качество сельскохозяйственной продукции. Согласно данным полевых опытов агрохимслужбы, внесение 90 кг фосфора на 1 га посевной площади в зависимости от почвы повышает урожайность озимой пшеницы на 400-500 кг/га, ячменя -- 300-600 кг/га, кукурузы -- 400-800 кг/га, подсолнечника -- 150-200 кг/га, сахарной свеклы -- 300-800 кг/га, картофеля -- 150-250 кг/га. Внесение фосфорных удобрений увеличивает содержание крахмала в клубнях картофеля, положительно влияет на накопление сахара в сахарной свекле. |
Прядильные культуры после внесения фосфорных удобрений имеют более длинное, прочное и тонкое волокно. Наряду с этим значительно увеличивается зимостойкость озимых зерновых культур, многолетних трав и плодово-ягодных культур, а также устойчивость растений при засухе. Особенностью фосфорных удобрений является также то, что они способствуют повышению эффективности действия других видов удобрений. На почвах с низким содержанием фосфора на 15-25% снижается эффективность азотных и калийных удобрений.
Большее количество фосфора содержится в товарной части урожая, поэтому значительная его часть отчуждается с продукцией. И если в природе существует кругооборот азота, в котором участвует атмосферный азот, то запасы фосфора в почве могут пополняться только благодаря внесению органических и минеральных удобрений.
Фосфорными удобрениями являются кальциевые и аммонийные соли фосфорной кислоты, а также некоторые другие соединения:
|
Наименование удобрения |
Формула |
Содержание питательных веществ (%) |
||
| Суперфосфат простой, гранулированный и порошковидный |
Ca(H2PO4)2*H2O + H3PO4 + CaSO4 |
14.0-21.0 P2O5 |
||
| Суперфосфат обогащенный |
Ca(H2PO4)2+H3PO4 |
22.5-40.0 P2O5 |
||
| Суперфосфат двойной |
Ca(H2PO4)2*H2O+H3PO4 |
40.0-50.0 P2O5 |
||
| Преципитат |
CaHPO4*2H2O |
27.0-46.0 P2O5 |
||
| Мука фосфоритная |
Ca3(PO4)2*CaF2 |
16.0-35.0 P2O5 |
||
| Шлак фосфорный (томасовский или мартеновский) |
4CaO*P2O5 + 5CaO*P2O5*SiO2 |
14.0-20.0 P2O5 |
||
| Термофосфат |
Na2O*4CaO*P2O5*SiO2 |
20.0-35.0 P2O5 |
||
| Фосфат плавленый |
4(CaMg)O*P2O5 + 5(CaMg)O*P2O5*SiO2 |
20.0-35.0 P2O5 |
||
| Мука костяная |
Ca3(PO4)2*CaCO3 + органические соединения |
30.0 P2O5 |
||
| Фосфат обесфторенный |
3CaO*P2O5 + 4CaO*P2O5*SiO2 |
20-38 P2O5 |
||
| Метафосфат кальция |
Ca(PO3)2 |
65-70 P2O5 |
||
Полифосфат кальция |
CanPnO(3n+1) |
До 60,0 P2O5 23,0-24,0 CaO |
||
|
Комплексные фосфорсодержащие удобрения |
||||
| Аммофос |
|
28-36 P2O5 |
||
| Аммофоска |
|
28-32 P2O5 |
||
| Нитроаммофос |
|
26-36 P2O5 |
||
4.4.2. Классификация фосфорных удобрений.
Способы получения.
Фосфоритная мука
Получают при тонком размоле фосфоритов. Так как она содержит нерастворимую соль Ca3(PO4)2, то усваиваться растениями может только на кислых почвах.
Сырьем для производства фосфорных удобрений, фосфора
и всех фосфорных соединений служат апатитовые и фосфоритовые руды. Состав
апатитов чаще всего выражается формулой Са5(РО4)3F (фторапатит).
Фосфориты отличаются от фторапатитов тем, что в них вместо ионов F- содержатся ионы
ОН- или ![]() . Фосфориты
обычно содержат больше примесей, чем фторапатит.
. Фосфориты
обычно содержат больше примесей, чем фторапатит.
В дореволюционной России были известны и разрабатывались лишь маломощные месторождения фосфоритов низкого качества. Поэтому событием огромного народнохозяйственного значения было открытие в 20-х годах месторождения апатита на Кольском полуострове в Хибинах. Здесь построена крупная обогатительная фабрика, которая разделяет добываемую горную породу на концентрат с высоким содержанием фосфора и примеси – «нефелиновые хвосты», используемые для производства алюминия, соды, поташа и цемента.
Мощные месторождения фосфоритов открыты в Южном Казахстане, в горах Каратау.
При обработке фосфоритов или аппатитов серной или фосфорной кислотой получают растворимые в воде соединения, хорошо усваемые растениями на любых почвах:
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
(Ca(H2PO4)2 простой
суперфосфат
(обычно применяют в виде гранул Æ 2-4 мм))
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
(двойной суперфосфат)
Нейтрализацией гашеной извести фосфорной кислотой получают преципитат:
H3PO4 + Ca(OH)2 = CaHPO4 • 2H2O
Нейтрализацией фосфорной кислоты аммиаком получают аммофос – (NH4)2HPO4 + NH4H2PO4, содержащий N и P. Разновидности: нитроаммофос – NH4H2PO4 + NH4NO3; аммофоска – (NH4)2HPO4 + NH4H2PO4 + KCl.
Агрохимические особенности некоторых удобрений
Удобрение |
Химический состав |
Форма фосфорной кислоты |
Воздействие на почву |
| Суперфосфат простой | Ca(H2PO4)2++2CaSO4+H2O | Водорастворяемая | Уменьшает pH |
| Суперфосфат двойной | Ca(H2PO4)2++H2O | Водорастворяемая |
Уменьшает pH |
| Преципитат | CaHPO4x2H2O | Растворяется в лимоннокислом аммонии | Несколько повышает pH |
5. ФОСФОРНОЕ СЫРЬЕ. ФОСФОРНАЯ ПРОМЫШЛЕННОСТЬ.
5.1. Исторический ракурс
С разведанными запасами фосфорного сырья в нашей стране, как и во всем мире, дело обстоит не совсем благополучно. Академик С.И. Вольфкович с трибуны IX менделеевского съезда по общей и прикладной химии заявил:
«Если сырьевая база азотной промышленности – воздушный океан, вода и природный газ – не ограничивает масштабов нового строительства, а разведанные к настоящему времени залежи калийных солей обеспечивают развитие производства калийных удобрений более чем на тысячелетие, то изученных к настоящему времени запасов отечественного фосфорного сырья при намеченных больших объемах производства удобрений хватит всего на несколько десятилетий».
5.2. Перспективы добычи
Это вовсе не значит, что человечеству грозит голод и урожаи год от года будут уменьшаться. Резервы есть. Много дополнительного фосфора можно будет получить при комплексной переработке минерального сырья, донных морских отложений и более детальной геологической разведке. Следовательно, особых оснований для пессимизма у нас пет, тем более что по учтенным запасам фосфорных руд СССР занимает первое место в мире. Мы располагаем крупнейшими месторождениями апатитов на Кольском полуострове и фосфоритов в Южном Казахстане и ряде других мест.
Но искать новые месторождения, разрабатывать способы получения фосфорных удобрений из более бедных руд необходимо уже сейчас. Это нужно для будущего, потому что фосфор – «элемент жизни и мысли» – будет необходим человечеству всегда.
Начало суперфосфатной промышленности
Первое в мире промышленное производство суперфосфата было организовано в 1842 г. в Англии. В России подобные предприятия появились в 1868 и 1871 гг. До революции в нашей стране было построено всего шесть суперфосфатных заводов, их общая производительность не превышала 50 тыс. т в год. В годы первой мировой войны, иностранной интервенции и гражданской войны четыре завода из шести вышли из строя, и в 1918 г. в нашей стране было выпущено всего 2,8 тыс. т суперфосфата. А всего через 20 лет, в 1938 г., по производству фосфорных удобрений Советский Союз занял первое место в Европе и второе место в мире. Сейчас доля нашей страны в мировом производстве фосфоритной руды и фосфорных удобрений составляет примерно четвертую часть.
Свидетельствует Д.Н. Прянишников:
«...Как бы правильно ни хранился и применялся навоз, он не может вернуть почве того, чего он сам не содержит, т.е. крупной доли фосфора, отчужденного из хозяйства в проданном зерне, костях животных, в молоке и пр.; таким образом, почва постепенно, но неуклонно теряет свой фосфор (или по крайней мере его усвояемую часть), и за известным пределом фосфор попадает в положение того «минимального фактора», которого наиболее недостает для получения хорошего урожая, как это совершенно правильно было подмечено еще Либихом». (Из статьи «О значении фосфатов для нашего земледелия и о расширении возможности непосредственного применения фосфоритов», 1924).
5.3. Апатиты заполярья
В 1926 г. А.Е. Ферсманом и его сотрудниками были открыты огромные запасы апатита на Кольском полуострове. Спустя много лет академик А.Е. Ферсман писал об этом месторождении: «...велений искристый апатит с серым нефелином образует сплошную стену в 100 м. На 25 км протягивается этот замечательный пояс хибинских тундр, огибая их кольцом. Исследования показали, что апатитовая руда уходит в глубину даже ниже поверхности океана, и около двух миллиардов тонн этих ценнейших ископаемых накоплено здесь в Хибинах, не имея себе равных нигде в мире». («Занимательная минералогия», 1937.) На базе этого месторождения был построен горнохимический комбинат «Апатит» им. С.М. Кирова. Незадолго до войны было открыто еще одно очень крупное месторождение фосфорного сырья – фосфориты Кара-Тау в Казахстане. Фосфориты есть и в других районах нашей страны, в частности в Подмосковье. Но лучшее сырье для производства фосфорных удобрений до сих пор дает апатитовый «пояс хибинских тундр».
Как выглядит апатит
Вновь обратимся к «Занимательной минералогии». «Апатит – это фосфорнокислый кальций, но внешний вид его такой разнообразный и странный, что недаром старые минералоги назвали его апатитом, что значит по-гречески «обманщик»: то это прозрачные кристаллики, до мелочей напоминающие берилл или даже кварц, то это плотные массы, неотличимые от простого известняка, то это радиально-лучистые шары, то порода зернистая и блестящая, как крупнозернистый мрамор».
6. ФОСФОР В ПРИРОДЕ
6.1. Круговорот фосфора в природе
Обычно в путешествиях элементов "конечных остановок нет" нет. Как правило, завершение одного маршрута является началом другого. В результате элементы и вещества постоянно движутся по сложной сети потоков, многократно "проезжая" одни и те же "пункты". Такие перемещения называются круговоротами. Именно круговороты способствуют постоянному поддержанию гомеостаза как во всепланетных так и в локальных масштабах.
Во-первых, они не дают планете утонуть в отходах, поскольку эти отходы немедленно становятся пищей для других организмов. Так, мочевина, выделяема животными, очень быстро усваивается растениями; Выдыхаемый углекислый газ в процессе фотосинтеза.
Во-вторых, круговороты не позволяют жизненно важным элементам выйти из биосферы или отдельной экосистемы. Например, ветры постоянно переносят с океанов на сушу хлориды, которые нужны всем живым организмам. Если бы не этот перенос, все хлориды давно бы оказались в океане. Видимо от возможного фосфорного голодания избавиться будут гораздо сложнее, чем от азотного. Этого элемента в земной коре достаточно много, однако он крайне рассеян и малоподвижен.
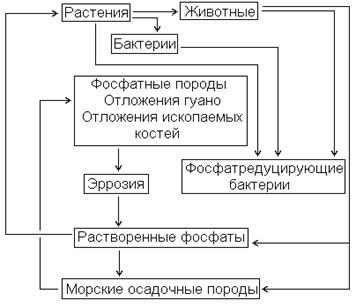
Самое неприятное, что круговорот фосфора практически не замкнут - если азот из биосферы выводится в атмосферу, откуда его можно извлечь, то фосфор из биосферы, пройдя, как и азот, множество локальных круговоротов, оседает на дно океанов. Это связано с тем, что в природе, он существует только в виде фосфатов, и устойчивых летучих соединений у него нет. Вновь попасть на поверхность суши этот фосфор может только в результате геологических процессов, но до этого пройдет очень значительное время, многие-многие миллионы лет.
6.2. Содержание фосфора в природных водах
Так же, как и для азота, обмен фосфором между его минеральными и органическими формами с одной стороны, и живыми организмами - с другой, является основным фактором, определяющим его концентрацию.
Формы фосфора в природных водах
|
Химические формы Р |
Общий |
Фильтруемый (растворенный) |
Частицы |
|
Общий |
Общий растворенный и взвешенный фосфор |
Общий растворенный фосфор |
Общий фосфор в частицах |
|
Ортофосфаты |
Общий растворенный и взвешенный фосфор |
Растворенные ортофосфаты |
Ортофосфаты в частицах |
|
Гидролизируемые кислотой фосфаты |
Общие растворенные и взвешенные гидролизируемые кислотой фосфаты |
Растворенные гидролизируемые кислотой фосфаты |
Гидролизируемые кислотой фосфаты в частицах |
|
Органический фосфор |
Общий растворенный и взвешенный органический фосфор |
Растворенный органический фосфор |
Органический фосфор в частицах |
|
Концентрация общего растворенного фосфора (минерального и органического) в незагрязненных природных водах изменяется от 5 до 200 мкг/дм3 |
Фосфор - важнейший биогенный элемент, чаще всего лимитирующий развитие продуктивности водоемов. Поэтому поступление избытка соединений фосфора с водосбора (в виде минеральных удобрений с поверхностным стоком с полей (с гектара орошаемых земель выносится 0.4-0.6 кг фосфора), со стоками с ферм (0.01-0.05 кг/сут. на одно животное), с недоочищенными или неочищенными бытовыми сточными водами (0.003-0.006 кг/сут. на одного жителя), а также с некоторыми производственными отходами приводит к резкому неконтролируемому приросту растительной биомассы водного объекта (это особенно характерно для непроточных и малопроточных водоемов). Происходит так называемое изменение трофического статуса водоема, сопровождающееся перестройкой всего водного сообщества и ведущее к преобладанию гнилостных процессов (и, соответственно, возрастанию мутности, солености, концентрации бактерий).
Один из вероятных аспектов процесса эвтрофикации - рост сине-зеленых водорослей (цианобактерий), многие из которых токсичны. Выделяемые этими организмами вещества относятся к группе фосфор- и серосодержащих органических соединений (нервно-паралитических ядов). Действие токсинов сине-зеленых водорослей может проявляться в возникновении дерматозов, желудочно-кишечных заболеваний; в особенно тяжелых случаях - при попадании большой массы водорослей внутрь организма может развиваться паралич.
В соответствии с требованиями глобальной системы мониторинга состояния окружающей среды (ГСМОС/GEMS) в программы обязательных наблюдений за составом природных вод включено определение содержания общего фосфора (растворенного и взвешенного, в виде органических и минеральных соединений). Фосфор является важнейшим показателем трофического статуса природных водоемов.
Фосфор органический
Органические соединения фосфора присутствуют в поверхностных водах в растворенном, взвешенном и коллоидном состоянии.
Фосфор минеральный
Соединения минерального фосфора поступают в природные воды в результате выветривания и растворения пород, содержащих ортофосфаты (апатиты и фосфориты) и поступления с поверхности водосбора в виде орто-, мета-, пиро- и полифосфат-ионов (удобрения, синтетические моющие средства, добавки, предупреждающие образование накипи в котлах и т.п.), а также образуются при биологической переработке остатков животных и растительных организмов. Избыточное содержание фосфатов воде, особенно в грунтовой, может быть отражением присутствия в водном объекте примесей удобрений, компонентов хозяйственно-бытовых сточных вод, разлагающейся биомассы.
Основной формой неорганического фосфора при значениях pH водоема больше 6.5 является ион HPO42- (около 90%). В кислых водах неорганический фосфор присутствует преимущественно в виде H2PO4-.
|
Концентрация фосфатов в природных водах обычно очень мала - сотые, редко десятые доли миллиграммов фосфора в литре, в загрязненных водах она может достигать нескольких миллиграммов в 1 дм3. Подземные воды содержат обычно не более 100 мкг/дм3 фосфатов; исключение составляют воды в районах залегания фосфорсодержащих пород. |
Содержание соединений фосфора подвержено значительным сезонным колебаниям, поскольку оно зависит от соотношения интенсивности процессов фотосинтеза и биохимического окисления органических веществ. Минимальные концентрации фосфатов в поверхностных водах наблюдается обычно весной и летом, максимальные — осенью и зимой, в морских водах — соответственно весной и осенью, летом и зимой.
Общее токсическое действие солей фосфорной кислоты возможно лишь при весьма высоких дозах и чаще всего обусловлено примесями фтора.
|
В методике оценки экологической ситуации, принятой Госкомэкологией РФ, рекомендован норматив содержания растворимых фосфатов в воде - 50 мкг/дм3. |
Без предварительной подготовки проб колориметрически определяются неорганические растворенные и взвешенные фосфаты.
Полифосфаты
Men(PO3)n , Men+2PnO3n+1 , MenH2PnO3n+1
Применяются для умягчения воды, обезжиривания волокна, как компонент стиральных порошков и мыла, ингибитор коррозии, катализатор, в пищевой промышленности.
Малотоксичны. Токсичность объясняется способностью полифосфатов к образованию комплексов с биологически важными ионами, особенно с кальцием.
Установленное допустимое остаточное количество полифосфатов в воде хозяйственно-питьевого назначения составляет 3.5 мг/дм3 (лимитирующий показатель вредности - органолептический).
6.3. Фосфор в почвах
Содержание фосфора (Р2О5) во многих почвах составляет 0,03-0,25%. Около половины его находится в минеральной форме, а половина - в форме органических соединений. В слабоокультуренных торфяных почвах на фосфор в органической форме приходится до 70%. Некоторое количество его содержится в поглощенном почвенными коллоидами состоянии. Значительная часть минеральных форм фосфора в кислых подзолистых почвах и красноземах находится в труднодоступных для растений фосфатах железа и алюминия. В нейтральных почвах, например в черноземах, минеральный фосфор представлен более доступными для растений фосфатами кальция и магния.
6.4. Геоэкологический мониторинг:
определение фосфора в воде
ОБЩИЙ ФОСФОР
Соединения фосфора относятся к физиологически важным компонентам химического состава морских вод, определяющим их продуктивность. Существует много форм фосфорных соединений в морской воде: ортофосфаты, детергенты, пестициды, эфиры фосфорной кислоты, полифосфаты, многочисленные органические производные и др. В последнее время их чрезмерная концентрация в ряде районов, главным образом, за счет коммунально-бытовых и сельскохозяйственных стоков, вызывает бурный рост морских растений, разложение остатков которых приводит к повышенному потреблению кислорода. Поэтому в таких случаях соединения фосфора рассматривают как загрязняющие вещества.
Все известные методы определения общего фосфора основаны на окислении его соединений до растворимого ортофосфата с последующим анализом по известной методике Морфи и Райли. Однако при использовании в качестве окислителя концентрированной серной кислоты соединения со связью Р—С не разлагаются. Применяемое иногда для этих целей фотохимическое окисление требует специального оборудования (кварцевые сосуды, УФ-лампа), что затрудняет широкое его внедрение для проведения массовых анализов. Наиболее простой и чувствительный метод — окисление соединений фосфора с помощью надсернокислого калия. Следует отметить, что этим методом можно определить только общий фосфор, находящийся в составе соединений, растворимых в морской воде.
СОЕДИНЕНИЯ ФОСФОРА
Фосфор относится к числу физиологически важных элементов, необходимых водорослям для построения клетки. Его содержание в морских водах является определяющим фактором их продуктивности. В ряде случаев чрезмерно высокие концентрации фосфора в морской воде могут служить показателем их загрязненности коммунально-бытовыми сточными водами.
Наиболее чувствительным методом определения фосфора в виде фосфата, является колориметрический метод, основанный на образований молибденовой гетерополисини. Этот метод широко применяется в различных областях науки и, в частности, в гидрохимии. Из форм неорганического фосфора, существующих в морской воде, данным методом можно определить лишь фосфор” входящий в состав солей ортофосфорной кислоты.
Сущность метода анализа
Хотя особенности химической реакции, положенной в основу метода, не вполне изучены, выполнение анализа не является сложным: раствор молибдата добавляют к фосфату при определенных кислотных условиях, при которых образуется желтая фосфорно-молибденовая гетерополикислота, восстанавливаемая затем до гетерополисини. В качестве восстановителей применяют двуххлористое олово, аскорбиновую кислоту, гидразинсульфат и другие соединения.
В химической океанографии ранее в качестве восстановителя использовалось двуххлористое олово. Методы с применением SnCl2 наиболее чувствительны, но требуют измерения оптической плотности растворов только через строго определенное время после прибавления этого реактива вследствие неустойчивости окраски. На развитие и устойчивость окраски в данном случае большое влияние оказывает температура и соленость исследуемой пробы морской воды. Все это создает дополнительные трудности при ее анализе.
В настоящее время по рекомендации Международного совета по изучению морей во многих странах для определения фосфора применяется метод Морфи и Райли с использованием аскорбиновой кислоты в качестве восстановителя. Окраска водных растворов восстановленных гетерополикислот при применении этого реагента несколько слабее, чем в случае восстановления двуххлористым оловом, однако они устойчивы в течение длительного времени и, кроме того, практически не зависят от температуры и солености морской воды. Для ускорения реакции в качестве катализатора применяется антимонилтартрат калия (калий сурьмяновиннокислый).
7. СИСТЕМА «ФОСФОР – ЧЕЛОВЕЧЕСКИЙ ОРГАНИЗМ»
ЗНАЧЕНИЕ ФОСФОРА И ЕГО СОЕДИНЕНИЙ В МЕДИЦИНЕ
7.1. ФОСФОР В ПИЩЕ
Фосфор - важнейший элемент, входящий в состав белков, нуклеиновых кислот, костной ткани. Соединения фосфора принимают участие в обмене энергии (аденозинтрифосфорная кислота и креатинфосфат являются аккумуляторами энергии), с их превращениями связаны мышечная и умственная деятельность, жизнеобеспечение организма. Фосфор влияет на деятельность сердца и почек.
Потребность взрослого в фосфоре - 1200 мг/сут (1,2 г). Для правильного питания важно не только абсолютное количество фосфора, но и соотношение его с кальцием (2:3). При избытке фосфора может происходить выведение кальция из костей, при избытке кальция - развиваться мочекаменная болезнь.
Относительно много фосфора находится в рыбе, хлебе, мясе, молоке и сыре. Еще больше фосфора находится в фасоли, горохе, овсяной, перловой и ячневой крупах, а также в ягодных культурах, орехах, петрушке, капусте, моркови, чесноке, шпинате.
Значение фосфора и его роль в обменных
процессах организма определяется соединениями, в состав которых он входит.
Неорганический фосфор выполняет структурные функции: входит в состав костной
ткани и фосфолипидов мембранных структур клетки; является компонентом буферной
системы крови, других биологических жидкостей, обеспечивает поддержание
кислотно-щёлочного равновесия.
Органические соединения фосфора входят в состав нуклеиновых кислот и
принимают участие в процессах роста, деления клеток, хранения и использования
генетической информации; являются центральным звеном энергетического обмена (в
результате этерификации неорганического фосфата и его связывания в виде богатой
энергией м-фофосфатной связи АТФ); участвуют в ферментативных процессах,
обеспечивая проявление биохимических функций ряда витаминов, регуляцию обменных
процессов (через цАМФ), проведение нервного импульса и мышечного сокращения.
7.2. Соединения фосфора в биохимических процессах
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
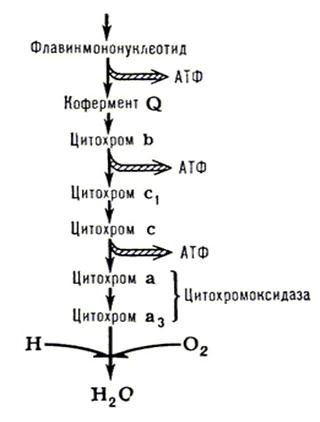 Окислительное фосфорилирование,
осуществляющийся в живых клетках синтез молекул аденозинтрифосфорной кислоты
(АТФ) из аденозиндифосфорной (АДФ) и фосфорной кислот за счёт энергии окисления
молекул органических веществ (субстратов). В результате О. ф. в клетках
накапливается АТФ — важнейшее макроэргическое соединение, расходуемое затем на
обеспечение энергией различных процессов жизнедеятельности. Основные субстраты
О. ф. — органические кислоты, образующиеся в трикарбоновых кислот цикле. О. ф.
было открыто в 1930 советским биохимиком В. А. Энгельгардтом. В 1939 В. А.
Белицер и Е. Т. Цыбакова показали, что О. ф. сопряжено с переносом электронов
по цепи дыхательных ферментов, встроенных (как было установлено позднее) во
внутреннюю мембрану митохондрий. Электроны поступают в дыхательную цепь от
восстановленного никотинамидадениндинуклеотида (НАД · Н) или никотинамидадениндинуклеотидфосфата
(НАДФ · Н) и через кофермент Q (см. схему) последовательно
передаются от соединений с более отрицательным окислительно-восстановительным
потенциалом к соединениям с более положительным потенциалом.
Окислительное фосфорилирование,
осуществляющийся в живых клетках синтез молекул аденозинтрифосфорной кислоты
(АТФ) из аденозиндифосфорной (АДФ) и фосфорной кислот за счёт энергии окисления
молекул органических веществ (субстратов). В результате О. ф. в клетках
накапливается АТФ — важнейшее макроэргическое соединение, расходуемое затем на
обеспечение энергией различных процессов жизнедеятельности. Основные субстраты
О. ф. — органические кислоты, образующиеся в трикарбоновых кислот цикле. О. ф.
было открыто в 1930 советским биохимиком В. А. Энгельгардтом. В 1939 В. А.
Белицер и Е. Т. Цыбакова показали, что О. ф. сопряжено с переносом электронов
по цепи дыхательных ферментов, встроенных (как было установлено позднее) во
внутреннюю мембрану митохондрий. Электроны поступают в дыхательную цепь от
восстановленного никотинамидадениндинуклеотида (НАД · Н) или никотинамидадениндинуклеотидфосфата
(НАДФ · Н) и через кофермент Q (см. схему) последовательно
передаются от соединений с более отрицательным окислительно-восстановительным
потенциалом к соединениям с более положительным потенциалом.
Перенос электронов по цепи завершается восстановлением О2 с помощью сложного ферментного комплекса — цитохромоксидазы. Т. о., процесс окисления субстрата кислородом опосредован серией окислительно-восстановительных реакций; в результате каждой из этих реакций энергия, запасённая в молекуле окисляемого субстрата, освобождается небольшими порциями, что позволяет клетке использовать её более полно. Утилизация высвобождаемой энергии происходит в т. н. пунктах энергетического сопряжения. Синтез АТФ из АДФ и фосфата осуществляется ферментным комплексом АТФ-синтетазой (который может катализировать и обратную реакцию — расщепление АТФ).
7.3. Фосфор в фармакологии
Биофосфонаты – передовой край современной фармакологической науки
Бисфосфонаты представляют собой целый класс потенциальных терапевтических средств для лечения различных заболеваний костей и мягких тканей, сопровождающихся нарушением обмена кальция.
К настоящему времени изучено множество бисфосфонатов. Каждый из них обладает своим собственным характерным спектром активности. Все бисфосфонаты устойчивы к энзиматическому гидролизу, обладают высоким сродством к ионам металлов, образуя как растворимые, так и нерастворимые хелатные комплексы и агрегаты в зависимости от рН раствора. Из плазмы бисфосфонаты ультрафильтруются только частично из-за связывания с белками и возможно с другими компонентами.
Наиболее изученным и применяемым в большинстве стран является этидронат (отечественный ксидифон). Данный препарат был первым синтетическим аналогом естественных пирофосфатов, оказавшимся эффективным при нарушениях обмена кальция в организме. Рекомендации к его применению уже стали классическими при болезни Педжета, прогрессирующем оссифицирующем миозите, при остеопорозах, особенно постменопаузальных Показано, что этидронат (ксидифон) эффективен при остеопорозах, опухолевом остеолизе, а также при гетерогенной оссификации (мышцы, ткани мозга, почки, надпочечники и др.)
Особенно тщательно изучается проблема лечения бисфосфонатами остеопорозов, наиболее тяжелым осложнением которых являются переломы позвонков, в частности, в постменопаузальный период у женщин. Сравнивается эффективность не только разных бисфосфонатов, но и терапевтические дозы, эффективные способы введения, разрабатываются оптимальные схемы, курсы лечения при необходимости их применения в течение длительных периодов (6 мес - 3 года).
Таким образом, бисфосфонаты - новый быстроразвивающийся и непрерывно увеличивающийся класс препаратов, актуальность разработки которых чрезвычайно высока в настоящее время.
8. ЗАКЛЮЧЕНИЕ
Общее значение фосфора и его соединений
Применяют ортофосфорную кислоту в настоящее время довольно широко. Основным ее потребителем служит производство фосфорных и комбинированных удобрений. Для этих целей ежегодно добывается во всем мире фосфоросодержащей руды около 100 млн. т. Фосфорные удобрения не только способствуют повышению урожайности различных сельскохозяйственных культур, но и придают растениям зимостойкость и устойчивость к другим неблагоприятным климатическим условиям, создают условия для более быстрого созревания урожая в районах с коротким вегетативным периодом. Они также благоприятно действуют на почву, способствуя ее структурированию, развитию почвенных бактерий, изменению растворимости других содержащихся в почве веществ и подавлению некоторых образующихся вредных органических веществ.
Немало ортофосфорной кислоты потребляет пищевая промышленность. Дело в том, что на вкус разбавленная ортофосфорная кислота очень приятна и небольшие ее добавки в мармелады, лимонады и сиропы заметно улучшают их вкусовые качества. Этим же свойством обладают и некоторые соли фосфорной кислоты. Гидрофосфаты кальция, например, с давних пор входят в хлебопекарные порошки, улучшая вкус булочек и хлеба.
Интересны и другие применения ортофосфорной кислоты в промышленности. Например, было замечено, что пропитка древесины самой кислотой и ее солями делают дерево негорючим. На этой основе сейчас производят огнезащитные краски, негорючие фосфодревесные плиты, негорючий фосфатный пенопласт и другие строительные материалы.
Различные соли фосфорной кислоты широко применяют во многих отраслях промышленности, в строительстве, разных областях техники, в коммунальном хозяйстве и быту, для защиты от радиации, для умягчения воды, борьбы с котельной накипью и изготовления различных моющих средств.
Фосфорная кислота, конденсированные кислоты и дегидротированные фосфаты служат катализаторами в процессах дегидратирования, алкилирования и полимеризации углеводородов.
Особое место занимают фосфорорганические соединения как экстрагенты, пластификаторы, смазочные вещества, присадки к пороху и абсорбенты в холодильных установках. Соли кислых алкилфосфатов используют как поверхностно-активные вещества, антифризы, специальные удобрения, антикоагулянты латекса и др. Кислые алкилфосфаты применяют для экстракционной переработки урановорудных щелоков.
Красный фосфор в чистом виде применяют в спичечном производстве; в смеси с толченым стеклом и клеем его наносят на боковые поверхности спичечной коробки. Красный и белый фосфор используют при получении йодистоводородной и бромистоводородной кислот. Фосфид цинка Zn3Р2 применяют для борьбы с грызунами. Белый фосфор используют в военном деле для зажигательных бомб, а также для дымообразующих снарядов, шашек и гранат, дающих дымовые завесы. Применение радиоактивного изотопа фосфора Р32 позволило по-новому осветить поведение фосфора в растениях, почве и удобрениях. Исключительная чувствительность определения радиоактивного фосфора дает возможность следить за ходом поступления в растения фосфатов, за их распределением и превращениями внутри растений. Чистую фосфорную кислоту используют в пищевой и фармацевтической промышленности. Техническая фосфорная кислота идет для окрашивания тканей, производства эмалей, зубных пломб, а также для производства фосфорных удобрений.
9. БИБЛИОГРАФИЯ
1. В.А. Фролов, Актовая речь на заседании Ученого совета РУДН
Экологическая патофизиология, М., Изд. РУДН, 2003 г.
2.
Л.Ю. Аликберова,
Н.Г. Завьялов "Актуальная геохимия"
С-Пб., «АСТ-ПРЕСС» 2001г.
3. Д.В. Жилин «Путешествия элементов.
Геохимия».
М., «Аванта+», 2000 г.
4. М.Х. Карапетьянц М.Х. С.И. Дракин
"Общая и неорганическая химия"
издательство «Химия» - 2000 г.
5. Пурдела Д., Вылчану Р. «Химия органических соединений фосфора».
М. Химия, 1990 г.
6. «Энциклопедия неживой природы»
том 4 «Земля», М, «БСЭ», 1989 г.
7. Н.Б. Прокофьева, М.С. Бучаченко «Библиотека химических элементов» (книга первая) М., «Наука» 1988 г.
8. Нентвиг, М. Кройдер, К. Моргенштерн
"Химический тренажер"
М., «Мир» - 1986 г.
9. Гролэс Н, Перхерб В., «Земная кора под лупой»
М., «Мир», 1986 г.
10. Романов Г.В., Рыжикова Т.Я., Подзигун Г.И.
Органические гидриды в природе. - М., Изд. АН СССР, 1985 г.
11. Трофимов Б.А., Арбузова С.Н., Гусарова Н.К.
Фосфин в синтезе фосфорорганических соединений // Успехи химии. – 1984.- Т. 68, №3
12. Руководство по методам химического анализа морских вод.
Л., Гидрометеоиздат, 1979 г.
13. Методы гидрохимических исследований мирового океана.
М.: Наука, 1978 г.
14. Корбридж Д. Фосфор. Основы химии, биохимии, технологии.
М.: Мир, 1972 г.
- Ершов В.А., Смирнова Н.А., Николаева И.А. Актуальные вопросы образования фосфина в промышленном процессе получения фосфора // ЖПХ, 1969 г., №12
| Земледелие | |
|
Содержание Введение........................2 Глава I Краткая характеристика агроклиматических условий Зауралья...3 Глава II Факторы жизни растений и ... Минеральные соединения фосфора представлены очень многими формами, преимущественно труднорастворимыми и слабодоступными растениям фосфатами алюминия, железа и трехкальциевыми ... В СССР для определения нуждаемости почв в фосфорных удобрениях применяют метод Кирсанова, основанный на вытеснении фосфора 0,2 н. соляной кислотой (для подзолистых почв), метод ... |
Раздел: Рефераты по технологии Тип: реферат |
| Общая и неорганическая химия | |
|
Квантово-механическая модель атома. Квантовые числа. Атомные орбитали. Порядок заполнения орбиталей электронами Теория строения атома основана на ... NH4Cl (ион аммония NH4 + и ион хлора Cl-), а также солеобразные органические соединения: алкоголяты соли карбоновых кислот, соли аминов Неполярная ковалентная связь и ионная связь ... Она начинается с того, что молекула кислорода отрывает от молекулы органического соединения атом водорода: |
Раздел: Рефераты по химии Тип: учебное пособие |
| Классификация, количественные определения минеральных удобрений | |
|
Вводная глава Минеральные удобрения - это соединения, способные при внесении в почву растворяться и диссоциировать на ионы в почвенном растворе ... В настоящее время сельское хозяйство ориентируется на использование концентрированных и комплексных удобрений: из азотных удобрений - на аммиачную селитру и карбамид, из фосфорных ... Фосфорные удобрения - это кальциевые и аммонийные соли фосфорной кислоты. |
Раздел: Рефераты по химии Тип: учебное пособие |
| Влияние системы удобрений при поверхностной обработке почвы на ... | |
|
Министерство сельского хозяйства Российской Федерации Федеральное государственное образовательное учреждение высшего профессионального образования ... Продолжительный эффект от фосфорных удобрений можно ожидать при содержании в почве усвояемого фосфора менее 45, от калийных- при содержании усвояемого калия менее 85 кг/га (13). Поэтому при возделывании сои на кислых почвах, недостаток азота, фосфора кальция и молибдена восполняют внесением удобрений и извести (32). |
Раздел: Рефераты по ботанике и сельскому хозяйству Тип: дипломная работа |
| Применение системы удобрений | |
|
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО СЕЛЬСКОМУ ХОЗЯЙСТВУ БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ Факультет: агрономический Кафедра: агрохимии Специальность ... Фосфорные удобрения наиболее энергично используются в течение 4-5 недель роста (фаза кущения). Известкование приводит к лучшему обеспечению растения не только азотом, но и зольными элементами вследствие усиления активности бактерий, разлагающих органические фосфорные ... |
Раздел: Рефераты по ботанике и сельскому хозяйству Тип: курсовая работа |