Курсовая работа: Асептика в аптечному виробництві
Раздел: Рефераты по медицине
Тип: курсовая работа
Зміст
Вступ. 2
1. Асептика. 7
2. Приміщення для виробництва стерильних лікарських засобів. 9
3. Стерильність лікарських форм.. 14
4. Апірогенність лікарських форм. Відсутність домішків. Стабільність та ізотонічність 37
5. Практична частина. 45
Список використаної літератури. 48
Вступ
Хірургія протягом століть була не популярною. Через високу післяопераційну смертність її називали хірургічною інквізицією. Скальпель порівнювали з гільйотиною. Сімпсон (англ. акушер) казав: "Той, хто погоджується на операцію більше ризикує вмерти, ніж солдати в битві під Ватерлоо".
Усе змінилося із введенням антисептики в 1867 році Дж. Лістером. Система антисептичного лікування ран завойовувала клініку за клінікою, державу за державою. Але ще багато основ залишилося для скептиків. Навіть 7 років потому в 1874 р в еру антисептики вчитель Лістера Дж. Еріксен заявив: порожнина черепа, грудна і черевна порожнини для хірургії завжди залишаться недоступними.
Дійсно, накопичений досвід свідчив, що поряд із позитивними методами антисептика має і негативні сторони Так, нерідко спостерігався некроз тканин, особливо клітковини, у рані; досить часто зустрічалися дерматит, кон¢юктивіт. У хмарі карболової кислоти важко було дихати, бували отруєння.
На справді були праві ті, хто говорив: "Хірурги ціляться в мікробів, але попадають у живі тканини організму й убивають його клітини".
Заради справедливості треба сказати, що ці негативні сторони не методу антисептики, а антисептичного розчину карболової кислоти. Сам Лістер у 1871 р переконався, що карболка для організму не байдужа. Тому для удосконалення методу розчин карболки заміняли розчином сулеми 1: 5000 (у Німеччині і називали метод сулемової антисептики), у Росії застосовували йодоформ (М.В. Скліфосовський), деякі шари пов'язки заміняли саліциловою ватою (С.П. Коломнін), використовували саліцилову кислоту 1: 300. Але і ці антисептики не виправдали себе.
У 1880 р Брунс зі спостережень прийшов до висновку: основну небезпеку представляє контактна інфекція, а не мікроби повітря. Так вважав Лістер. Тому Брунс запропонує відмовитися від спрея.
Антисептичний метод Лістера панував у хірургії 15 років. У 80-х роках ХІХ сторіччя підготовлена наукова база і фундамент для нового етапу хірургії - асептики. Так, Луї Пастер на засіданні Паризької академії, звертаючись до хірургів, говорив, що інфекцію в рану вносить усе, що з нею стикається - вода, корпія, інструменти. Завдяки геніальним дослідженням Р. Коха (нім. мікробіолога) і Луї Пастера (фр. хіміка) по вирощуванню чистих культур бактерій, розроблені методи знищення мікробів високою температурою (кип'ятінням, водяною парою).
Установлено, що основний шлях інфікування ран контактний. Стали створювати перешкоди для інфекції. Головний принцип - усе, що стикається з раною, треба очистити від інфекції, це і буде стерильним.
У 1878 р Е. Бухнер запропонував стерилізувати хірургічний інструментарій кип'ятінням.
У 1882 р Ф. Тренделенбург у м. Бонні сконструював апарат для стерилізації матеріалу й інструментів водяною парою.
У 80-х роках (1886-1888) у Москві, Петербурзі, інших містах реконструйовані хірургічні клініки у відповідності до вимог часу (Суботін, Скліфосовський, Дияконов і ін).
Ернст Бергман у Берліні модернізував клініку. Він зі своїм співробітником К. Шимельбушем сконструювали стерилізатори для кип'ятіння інструментів, удосконалили автоклав, металеві барабани "бікси" для стерилізації операційної білизни, перев'язного матеріалу.
Нові вимоги перетворили операційну: фраки були замінені на білі халати, що прали й автоклавували. До речі, білий халат як спецодяг у хірургічних відділеннях, а потім, у цілому, у всіх медичних установах, вперше у світі з'явився у Росії. Це запропонував у 1872 р у Петербурзі професор Л.Л. Лєвшин на засіданні суспільства російських лікарів. Лише пізніше дану пропозицію впровадив у Відні Т. Більрот. Також у Росії вперше у світі в 1879 р почали виготовляти металевий інструментарій без дерев'яних ручок, то є придатним для кип'ятіння ("асептичні" інструменти).
Отже, з раною стикався вже тільки стерильний матеріал і інструменти.
Залишалися не стерильними руки хірурга. У 1885 р Кюмель першим підняв питання про знезаражування рук хірургів дезінфікуючими розчинами. У 1888 р Фюрбрингер запропонував свій спосіб обробки рук. Але незабаром виявилося, що знищити мікроби у всіх порах рук не вдається. Почалися пошуки інших можливостей.
У 1886 р Бладгуд увів гумові рукавички для захисту рук від інфекції.
У 1890 р Холстед у Нью-Йорку, а в Європі в 1892 р Цеге-Мантейфель почали застосовувати гумові рукавички для захисту ран від рук хірургів.
У 1890 р Берлін Х Міжнародний конгрес хірургів. На одному із засідань головував Дж. Лістер. З доповіддю про принципи боротьби з хірургічною інфекцією виступив Е. Бергман (1836-1907), у минулому професор університету в Дерпте, керівник однієї з клінік Берліна. Працюючи в Берліні, Бергман перепланував клініку згідно до вимог часу. Винайшов систему стерилізації усього, що стикається з раною: операційної білизни, інструментарію, дезінфекції рук хірургів і шкіри операційного поля. Основоположником асептики обґрунтовано вважається Бергман. Після доповіді до нього підійшов Лістер, пожав руку і сказав, що радий бути свідком блискучого завоювання в хірургії, що покладе початок нової ери.
Ця система одержали назву асептика (гр. а - без, septicаs - гнійний). У 1890 р асептика одержала офіційне визнання.
Асептика - це система заходів, завдяки якій виключається влучення мікробів у операційну рану. Асептика ґрунтуються на організаційних заходах, фізичних факторах, хімічних засобах, біологічних методах.
З тих пір дотримується основний закон асептики: усе, що стикається з раною - повинно бути стерильним.
Асептика дуже інтенсивно розвивалися і за 10 років витиснула антисептику. Введення асептики в корені перетворило хірургію.
Т. Більрот підсумував: "Нині малодосвідчений хірург, але з чистими руками і чистою совістю може досягти кращих результатів, чим раніше самий знаменитий професор хірургії".
Подією, що затвердила визнання антисептики й асептики, був ХІІ Міжнародний конгрес лікарів у Москві в 1897 р. Найбільше важливою проблемою конгресу було негнильне лікування ран. Було більш 10 тис. делегатів конгресу. лікарі були уражені успіхами лікарської справи в Росії. Саме в ній у 1897 р М.Я. Вен′ямінов вперше у світі було запропонував застосовувати маски під час операції для попередження краплинної інфекції.
Хірурги початку ХХ століття віддавали перевагу асептиці. Так продовжувалося до І Світової війни. На театрі військових дій практично всі хірурги визнали розумним сполучення асептики й антисептики. З цього часу хірургія придбали риси, властиві сучасному її стану.
Установлено, що до середини 60-х років у хірургічних стаціонарах ведуче значення мала стафілококова інфекція. У наш час превалюють грамнегативні мікроби, гриби і віруси.
В фармації та технології ліків застосування асептики також має велике значення. Деякі лікарські форми незалежно від того, піддаються вони подальшій стерилізації чи ні, повинні виготовлятися в асептичних умовах.
Необхідність одержання стерильних і асептично виготовлених лікарських форм викликана особливим способом їх застосування, наприклад, ін'єкції вводяться в організм через порожнисту голку з порушенням цілісності шкірних і слизових покривів. Наявність у них мікроорганізмів може привести до інфікування організму, а отже, до важких наслідків.
До лікарських форм, що повинні виготовлятися в асептичних умовах, відносяться: лікарські форми для ін'єкцій; лікарські форми для лікування очей; лікарські форми з антибіотиками; лікарські форми для дітей.
Усі ці лікарські форми характеризуються тим, що в них не повинно міститися мікроорганізмів та їх спор.
Лікарські форми з антибіотиками вимагають асептичних умов виготовлення, тому що в присутності мікроорганізмів антибіотики втрачають свою активність.
В зв’язку з цим дуже актуальною є технологія виготовлення ліків в асептичних умовах.
1. Асептика
Однією з найважливіших вимог при виготовленні ін'єкційних ліків є дотримання правил асептики.
Асептика - це визначений режим роботи, комплекс організаційних заходів, що дозволяє звести до мінімуму можливість потрапляння мікроорганізмів у лікарську форму, що готується зі стерильних матеріалів.
Сутність асептичного приготування складається в максимальному запобіганні ліків, що готуються, від потрапляння в них мікрофлори. Правила асептики повинні строго виконуватися при готуванні всіх стерильних ліків (ін'єкційних розчинів і очних крапель), у тому числі і тих, що піддаються стерилізації.

Стерилізація ліків, приготовленого без дотримання асептики, не звільняє його від мертвих мікробних тіл і від виділених ними токсинів, які при ін'єкції ліків можуть іноді викликати підвищення температури в хворого й інші побічні явища. Разом з тим одне асептичне приготування ліків без стерилізації не гарантує досягнення повної його стерильності. Тому одним асептичним приготуванням обмежуються тільки в тих випадках, коли ліки для ін'єкції не витримують високої температури, а також при приготуванні очних крапель і примочок, очних мазей, ліків, що містять антибіотики, присипок для ран і деяких інших ліків.
Однак дотримання асептики здобуває особливо важливе значення при виготовленні ліків, що не переносять термічної стерилізації. Такими ліками є, наприклад, розчини з термолабільними речовинами. В однаковій мірі суспензії й емульсії є малостійкими системами, у яких при нагріванні різко підсилюються процеси рекристалізації, флокуляції (суспензії) і коалесценції (емульсії). У цих випадках найсуворіше дотримання асептичних умов - єдиний шлях одержання ліків, по стану дуже близьких до поняття стерильних. По ДФХ це досягається тим, що чи розчинник основу для мазі, інструменти і посуд стерилізують окремо, а термолабільні лікарські речовини асептично зважують і розчиняють у стерильному розчиннику (іноді з додаванням консервантів) чи змішують зі стерильною основою стерильними інструментами і поміщають у стерильний посуд. Нетермолабільні компоненти ліків при цьому також стерилізують.

При асептичному готуванні попередньо всі предмети, що контактують з ліками, що готуються, по можливості стерилізують у загорненому виді. Розчинник, основу для мазі, прилади й інструменти (ваги, шпателі і т.д.), посуд стерилізують окремо. Зважування лікарських речовин, їхнє розчинення в стерильному розчиннику чи змішування зі стерильною основою, перенесення ліків у стерильну тару, а також всі інші операції роблять з дотриманням високої чистоти й умов, що охороняють ліки, що готуються, від потрапляння в них мікрофлори.
Такі ліки виготовляють у спеціальному блоці.
2. Приміщення для виробництва стерильних лікарських засобів
Атмосферні аэрозолі, особливо в промислових центрах і великих містах, являють собою складну, по своєму складу суміш, що постійно змінюється мінерального пилу, промислових димів і туманів, часток органічного і неорганічного походження (вугілля, зола, солі й окисли металів, пилок рослин і т.д.) і мікроорганізмів. Тому забруднення і рухливість повітря в приміщенні відкрита поверхня апаратури і ліків, що готуються, недостатня освітленість приміщення, пил і недотримання працюючими вимог особистої гігієни можуть привести до забруднення ліків, що готуються, і їх зараженню мікроорганізмами.
Фармацевти повинні строго дотримувати правила особистої гігієни. Вони повинні працювати в чистих, стерильних, наглухо закритих халатах із загорненими вище ліктя рукавами і шапочках-ковпаках, перед роботою ретельно вимити милом і щіткою руки, протерти дезинфікуючим розчином і осушити їх стерильним рушником.
Шкіра рук містить дуже багато бактерій, що знаходяться не тільки на її поверхні, але й у численних складках, порах, волосяних мішечках, потових і сальних залозах. Особливо багато мікробів може знаходитися під нігтями. Разом з виділеннями потових і сальних залоз на поверхню шкіри виділяються і бактерії, у результаті чого руки, уже підготовлені для готування ліків для ін'єкцій самоінфікуються. Джерелом інфекції рук під час готування ліків для ін'єкцій може бути також зіткнення з нестерильними предметами.
У медичній практиці прийнято кілька методів обробки рук, заснованих на механічному очищенні шкіри з наступним впливом антисептичними засобами чи дубленням її. Застосування таких дубильних речовин, як розчини таніну, йоду етилового спирту, сприяє ущільненню поверхневих шарів шкіри і закриває наявні на шкірі отвори. У хірургії широко застосовується обробка рук, заснована на використанні дії розчинів аміаку, що розчиняють жири і разом з тим мікроби, що видаляє. Полягає цей метод у наступному: руки миють в теплому 0,5% розчині аміаку два рази по 3 хв, потім висушують стерильною серветкою й обробляють етиловим спиртом протягом 5 хв для дублення шкіри.
Ці методи обробки рук можуть бути застосовані й в аптечних умовах при готуванні стерильних ліків.
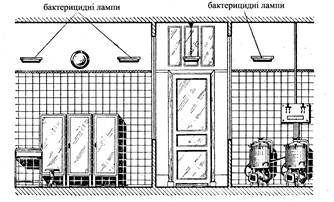
Готування стерильних ліків в аптеках повинне вироблятися в спеціальних приміщеннях для готування ліків в асептичних умовах (стерилізаційних) (рис.1,2)
 |
Рис. 1
Рис. 2
Асептичний блок в аптеках розташовують з урахуванням раціональної організації усього виробничого циклу, але подалі від торгового залу, санітарного вузла і фасувальних, тому що повітря цих приміщень найбільш забруднений.
Асептичні блоки організуються в госпрозрахункових аптеках I-III категорій, центральних районних і міжлікарняних аптеках, а також аптеках лікувально-профілактичних установ на 200 ліжок і більш. Блок повинний складатися з трьох кімнат: асептичної, предасептичної (тамбур) і апаратної. В асептичній роблять безпосереднє готування ліків, в апаратній розміщається тепло - і паровиділяюча апаратура (автоклав, дистиляційні апарати й ін). Асептична й апаратна зв’язані через тамбур, що виконує роль шлюзу, що перешкоджає забрудненню повітря асептичної ззовні. Тамбур використовується для підготовки співробітників до роботи. У ньому обробляють руки, надягають стерильний одяг і респіратор. У перегородці, що відокремлює асептичну від апаратної й асептичну від суміжного з нею приміщення (асистентська), необхідно передбачити вікна-шлюзи, обладнані ультрафіолетовими завісами для передачі приготовлених ліків і необхідних матеріалів.
Якщо устаткування, розміщене в асептичної, займає площа близько 5 м2, то при коефіцієнті 1: 4 площа асептичної повинна складати 20 м2. Площу апаратної можна розрахувати, виходячи з площі, зайнятої устаткуванням (3 м2 * 4 = 12 м2). Площа предасептичної, використовуваної лише періодично, може складати 4 - 5 м2. В асептичній кімнаті, повинне бути достатнє природне освітлення, а також повинна бути обладнана схована електрична проводка. Система притоково-витяжної вентиляції повинна передбачати очищення повітря від пилу і мікроорганізмів шляхом фільтрування його через масляний сітчастий фільтр, що затримує пилові частки, а потім через бактеріологічний фільтр, що затримує аерозолі і мікроорганізми.
Штукатурні карнизи повинні бути найпростішого профілю, що не допускає скупчення пилу. Підлога кімнати варто покрити лінолеумом чи викласти плиткою, а стіни, стеля і меблі пофарбувати білою олійною фарбою. Столи повинні бути покриті пластиком.
У тамбурі апаратної необхідно змонтувати умивальники, що мають підводку холодної і гарячої води. Бажано, щоб конструкція водопровідних кранів дозволяла відкривати і закривати їх без дотику вимитих рук. Крім того, в апаратній повинні бути влаштовані крани для харчування дистиляційного апарата і водоструминного насоса. Необхідно передбачити вбудовані шафи: у тамбурі - для збереження спецодягу, у стерилізаційній - для збереження інвентарю.
Для зручності стерилізації настільні ваги повинні бути з нержавіючої сталі, а ручні ваги повинні мати порцелянові чашечки, підвішені на металевих ланцюжках. Стерильний посуд і прилади варто зберігати під скляними ковпаками.
В асептичному блоці необхідно постійно підтримувати бездоганну чистоту: підлога, стіни й устаткування щодня мити теплою водою з милом. За 1,5-2 години до початку роботи повинні включатися стельові (ПВО) і настінні (НБО) бактерицидні лампи.
В аптеках приготування стерильних ліків
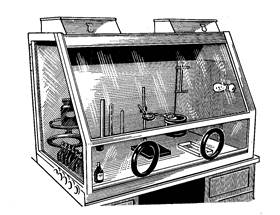
і ліків, що готуються асептично, роблять також у настільних боксах (рис.3).
Рис. 3
Настільні бокси бувають двох типів. Настільний бокс першого типу складається з двухтумбового столу з розташованим на всій його поверхні заскленим футляром із плоским скляним верхом. З лицьової сторони футляр має подвійні розсувні дверцята й усередині - скляні палички на кронштейнах.
Настільний бокс другого типу звичайно являє собою засклений футляр, у якого з однієї сторони є дверцята й у нижній частині отвору для рук.
У стерилізаційному блоці, кімнаті для асептичного готування ліків і боксах установлюють бактерицидні лампи для знезаражування повітря.
У цих приміщеннях необхідно постійно підтримувати бездоганну чистоту. Перед роботою їх варто мити теплою водою з милом і дезінфікувати.
Усі медикаменти треба зберігати в добре закритій тарі, у скляних шафках, що закриваються, чи під скляним ковпаком. Штангласи повинні бути з притертими пробками, захищеними від пилу спеціальними скляними ковпачками. До заповнення препаратами їх варто піддавати стерилізації. Апаратура і прилади також повинні бути захищені від пилу. При готуванні стерильних ліків варто прагнути, щоб усі прилади й апарати якнайменше стикалися з повітрям (накривати скляними ковпаками). Варто уникати зайвого ходіння по кімнаті, що викликає рухливість повітря, і зайвої затримки в роботі над ліками. Необхідні для роботи матеріали варто брати стерильним пінцетом.
До лікарських форм приготовлених у стерильних умовах пред'являються наступні вимоги: відсутність механічних домішок, стерильність, стійкість, апірогенність, а до окремих ін'єкційних розчинів - ізотонічність, що вказується у відповідних статтях чи рецептах.
3. Стерильність лікарських форм
Стерилізація (чи знепліднення) - це процес повного знищення мікроорганізмів та їх спор в лікарських речовинах, лікарських формах, на посуді, допоміжних матеріалах, інструментах і апаратах.
Термін "стерилізація" походить від латинського зіегіііз, що означає безплідний. Стерильність досягається дотриманням асептики і застосуванням методів стерилізації відповідно до вимог ДФ XI - стаття "Стерилізація".
При виборі методу і тривалості стерилізації необхідно враховувати властивості, об'єм чи масу матеріалів, що підлягають стерилізації.
Методи стерилізації можна розділити на: фізичні, механічні, хімічні.
Фізичні методи стерилізації. До них відносяться: термічна чи теплова стерилізація, стерилізація ультрафіолетовими променями, радіаційна стерилізація, стерилізація струмами високої частоти.
З перерахованих методів в умовах аптек застосовуються термічна стерилізація, а також стерилізація ультрафіолетовими променями. Інші методи стерилізації в умовах аптек поки що застосування не знайшли.
Термічна стерилізація. При цьому методі стерилізації відбувається загибель мікроорганізмів під впливом високої температури за рахунок коагуляції білків і руйнування ферментів мікроорганізмів. Найширше в аптечній практиці застосовується стерилізація сухим жаром і парою.
Стерилізація сухим жаром здійснюється сухим гарячим повітрям у повітряних стерилізаторах при температурі 180-200 °С. Ефективність стерилізації залежить від температури і часу. Рівномірність прогріву об'єктів обумовлюється ступенем їх теплопровідності і правильністю розташування всередині стерилізаційної камери для забезпечення вільної циркуляції гарячого повітря. Об'єкти, що стерилізуються, повинні бути розфасовані у відповідну тару, щільно закупорені і вільно розміщені в сушильних шафах, щоб забезпечити швидке і рівномірне проникнення до них гарячого повітря. Завантаження повинне проводитися в не нагріті сушильні шафи або коли температура всередині шафи не перевищує 60 °С. Оскільки гаряче повітря має невисоку теплопровідність, прогрівання завантажених об'єктів відбувається досить повільно. Час, рекомендований для стерилізації, повинен відраховуватися з моменту нагрівання повітря в сушильній шафі до температури 180-200 °С.
Повітряний метод використовується для стерилізації термостійких порошкоподібних лікарських речовин (натрію хлорид, цинку оксид, тальк, біла глина та ін). Порошки масою понад 200 г стерилізують при 180 °С протягом 60 хвилин чи при 200 °С - 30 хвилин. При цьому товщина шару порошку повинна бути не більше 6-7 см. Час стерилізаційної витримки порошків масою менше 200 г відповідно зменшують до 30-40 хвилин при 180 °С і до 10-20 хвилин-при 200 °С.
Мінеральні і рослинні олії, жири, ланолін безводний, вазелін, віск стерилізують гарячим повітрям при 180 °С протягом 30-40 хвилин чи при 200 °С - 15-20 хвилин з урахуванням кількості речовини.
Вироби зі скла, металу, силіконової гуми, порцеляни, установки для стерилізуючого фільтрування з фільтрами і приймачі фільтрату стерилізують при 180 °С протягом 60 хвилин.
Дрібні скляні і металеві предмети (лійки, піпетки та ін) поміщають у сушильні шафи в спеціальних біксах.
Для збереження стерильності посуду, якщо він не використовується відразу ж після стерилізації, його перед стерилізацією щільно закривають скляними чи ватними пробками, обгорненими в марлю. Як виняток, простерилізований посуд можна закривати пробками в асептичних умовах відразу ж після стерилізації, поки флакони і колби гарячі.
Розчини лікарських речовин не можна стерилізувати в сушильних шафах, тому що через погану теплопровідність повітря, що має температуру 100-120 °С, не забезпечує швидке нагрівання розчинів до температури стерилізації. Так, наприклад, розчин натрію хлориду (об'єм 200 мл), поміщений у сушильну шафу з температурою 120 °С, через годину прогрівається усього лише до 60 °С. Гаряче повітря більш високої температури може викликати розкладання лікарських речовин і розрив склянок внаслідок різниці тисків всередині і ззовні флаконів.
Для стерилізації сухим гарячим повітрям в аптеках доцільно використовувати шафи сушильно-стерилізаційні марки ШСС-250П, стерилізатор сухожаровий СС-200, а також повітряні стерилізатори з невеликим обсягом стерилізаційної камери марки ВП-10, ГП-20 і ГП-40. У великих лікарняних аптеках є сушильно-стерилізаційні шафи ШСС-500П і ШСС-1000П.
Стерилізація парою основана на поєднанні високої температури і вологи. Коагуляція білкових речовин в цих умовах починається при температурі 56 °С. У фармацевтичній практиці застосовують кілька методів стерилізації парою, з яких найбільш надійний, швидкий і економічний - стерилізація насиченою водяною парою під тиском 0,11 мПа(1,1 кгс / см2) і температурі 120 °С; 0,20 мПа (2 кгс / см2) і температурі 132 °С. У цих умовах гинуть не тільки вегетативні, але і спорові форми мікроорганізмів.
Паровий метод стерилізації при 120 °С рекомендується для води і водяних розчинів лікарських речовин. Час стерилізаційної витримки не більше 30 хвилин залежно від фізико-хімічних властивостей препарату й об'єму розчину. Розчини об'ємом до 100 мл стерилізують протягом 8 хвилин, об'ємом 101-500 мл - 8-12 хвилин і об'ємом від 501 до 1000 мл - 12-15 хвилин.
Стерилізація води і водних розчинів проводиться в герметично закупорених і попередньо простерилізованих флаконах чи ампулах. Жири й олії в герметично закупорених посудинах стерилізують при 120 °С протягом 2 годин. Цим методом стерилізують також вироби зі скла, порцеляни (фарфору), металу, гуми, перев'язувальні і допоміжні матеріали (вату, марлю, бинти, халати, фільтрувальний папір, гумові пробки, пергамент та ін). Час стерилізаційної витримки 45 хвилин.
Установки для стерилізуючого фільтрування з фільтрами стерилізують 15 хвилин (для фільтрів діаметром 13 і 25 мм), З0 хвилин (для фільтрів діаметром 47, 50, 90 і 142 мм) і 45 хвилин (для фільтрів діаметром 293 мм).
Для стерилізації хірургічних інструментів, перев'язувальних матеріалів, білизни і спецодягу також може бути рекомендований метод стерилізації парою при 132 °С протягом 20 хвилин. Стерилізація зазначених об'єктів повинна проводитися в стерилізаційних коробках чи двошаровій м'якій упаковці з бязі або в пергаментному папері.
Стерилізацію парою під тиском проводять у парових стерилізаторах (автоклавах) різної конструкції. Найзручніші такі парові стерилізатори, у яких автоматично підтримуються задані тиск і температура, а також передбачена можливість просушувати допоміжний матеріал (вату, фільтрувальний папір, марлю та ін) після стерилізації.
Зараз одержали поширення стерилізатори типу ВК-15, ВК-30 (мал.137), ГП-280 та ін. У практиці лікарняних аптек можуть бути використані також стерилізатори типу ГП-400, ГПД-280 і ГПС-500, за будовою і принципом дії аналогічні стерилізатору ГП-280.
Вертикальні парові стерилізатори ВК-30 і ВК-75 відрізняються ємністю стерилізаційної камери. Складаються вони з корпуса зі стерилізаційною і водопаровою камерами, кришки, кожуха, електронагрівальних елементів, електрощита, електроконтактного манометра, мановакуумметра, ежектора, запобіжного клапана, водовказівної колонки і трубопроводу з вентилями. Стерилізаційна і водопарова камери об'єднані в єдину зварну конструкцію, але роз'єднані функціонально, завдяки чому можна перекривати надходження пари в стерилізаційну камеру під час завантаження, ежекції і розвантаження автоклава, а також автоматично підтримувати робочий тиск у водопаровій камері для проведення наступної стерилізації. Обидві камери виконані з нержавіючої сталі. Максимальний тиск пари в стерилізаційній камері 0,25 мПа. Обидва стерилізатори працюють від мережі трифазного змінного струму напругою 220/380 В. Парові стерилізатори ВКО-50 і ВКО-75 відрізняються розмірами стерилізаційної камери, робочий тиск у якій не повинен перевищувати 0,2 мПа. Стерилізацію можна проводити як під тиском, так і текучою парою. Паровий стерилізатор ВКО-16 переносного типу призначений для стерилізації текучою парою. Горизонтальний паровий стерилізатор ГК-100 розрахований на роботу при максимальному тиску пари 0,2 мПа. Основні частини його - стерилізаційна і водопарова камери, пароутворювач з електронагрівальними елементами, кришка, кожух і електрощит. Всередині водопарової камери розташована стерилізаційна. Пара з пароутворювача надходить у парову камеру, а потім у стерилізаційну. Конденсат, що утворюється в процесі роботи, стікає в пароутворювач, оснащений запобіжним клапаном, манометром і водовказівною колонкою з лійкою для заливання води. Заповнення пароутворювача водою може здійснюватися як вручну через лійку, так і від водопровідної магістралі через спеціальний патрубок, оснащений вентилем. Працює стерилізатор від мережі трифазного перемінного струму напругою 220/380 В.
Паровий стерилізатор ГП-280 працює в автоматичному циклі і має чотири режими стерилізації, що відрізняються різною тривалістю (від 20 до 30 хвилин) і тиском пари в стерилізаційній камері (від 0,1 до 0,2 мПа). Стерилізатор складається зі стерилізаційної камери з дверцятами, парогенератора, електронасоса і електрощита. Дверцята камери оснащені центральним затвором і мають блокування мембранного типу, що запобігає можливості її відкривання при надлишковому тиску пари всередині камери. На панелі керування стерилізатора є манометр, вакуумметр, водомірне скло і кнопки керування. Парогенератор виконаний у вигляді казана з теплоізолюючим кожухом, оснащеного запобіжним клапаном, термістором, манометром, датчиком рівня і водовказівною колонкою.
Паровий стерилізатор ГПД-280, на відміну від стерилізатора ГП-280, оснащений двома дверцятами з централізованими затворами і блокуванням. Вбудовується в проріз стіни, яка розділяє асептичний блок і стерилізаційну кімнату. Паровий стерилізатор ГПС-500 живиться від централізованого джерела пари (котельні).
Підготовка апаратів до стерилізації повинна починатися з наповнення водою водопарової камери через лійку водовказівної колонки до верхньої відмітки. При цьому повинні бути відкриті кран, вентиль і кришка стерилізатора. Після завантаження стерилізаційної камери кришку стерилізатора закривають, щільно привернувши її болтами. Вентиль і кран повинні бути закриті. Потім у манометрі встановлюють межі автоматичної підтримки тиску і включають апарат у мережу.
Перед початком стерилізації зі стерилізатора необхідно повністю видалити повітря. Для цього стерилізатор спочатку нагрівають з відкритим краном. Через 10-15 хвилин після того, як пара піде сильним струменем, кран закривають. Для перевірки відсутності повітря в стерилізаторі слід помістити трубку від випускного крана в пробірку з водою, перекинуту в посудину, наповнену водою. При виході зі стерилізатора пари без домішки повітря вода з пробірки витіснятися не буде. Видалення повітря зі стерилізатора вкрай необхідне, тому що повітря, яке залишилось у ньому, різко знижує коефіцієнт теплопередачі пари (теплопровідність пари, що містить 5% повітря, зменшується на 50%), внаслідок чого неможливо забезпечити рівномірний прогрів матеріалів, що стерилізуються, і надійність стерилізації. Установлено, що спори сибірської виразки при стерилізації гинуть у різний час залежно від кількості повітря, що знаходиться в парі. Якщо пара містить 8% повітря, при тиску 0,1 мПа спори гинуть протягом 3 хвилин, при наявності 20% - за 10 хвилин, а при вмісті 37% повітря спори гинуть через ЗО хвилин.
При нагріванні стерилізатора паралельно росту тиску підвищується температура в стерилізаційній камері. Залежність між температурою і тиском повітря виражається в такий спосіб: 0,05 мПа - 110,0 °С, 0,1 мПа - 119,6 °С, 0,15 мПа - 126,8 °С, 0,2 мПа - 132,9 °С.
Час стерилізації повинен відраховуватися з моменту встановлення заданого тиску, що підтримується при стерилізації автоматично. Після закінчення часу стерилізації відкривають вентиль, що з'єднує стерилізаційну камеру з атмосферою, випускають через нього пару і конденсат і після того, як стрілка манометра стане на "0", відкривають кришку і розвантажують стерилізаційну камеру.
В останні роки створені нові парові стерилізатори спеціально для розчинів із примусовим охолодженням об'єктів, що стерилізуються: ГП-400 та ін.
Стерилізаційна камера стерилізатора ГП-400 має парову сорочку й оснащена дверима ковзного типу, а завантажувально-розвантажувальний пристрій виконаний у вигляді візка з рухливо розміщеною кареткою, на якій установлюють касети з герметично закупореними посудинами для крові. Після завантаження флаконів двері стерилізаційної камери герметично закриваються і натисканням кнопок "мережа" і "пуск" послідовно включаються в роботу автономна система паропостачання, система підготовки повітря і здійснюється процес стерилізації.
Нові стерилізатори, призначені спеціально для стерилізації розчинів у герметично закупореній тарі, дозволяють різко скоротити необхідний для цього час за рахунок примусового охолодження.
Другою важливою перевагою новостворених стерилізаторів є те, що наприкінці процесу стерилізації температура рідини у флаконах не перевищує 60-70 °С. Це виключає бій флаконів у стадії розвантаження стерилізатора і гарантує безпеку для обслуговуючого персоналу. Крім того, примусове охолодження вкорочує час впливу підвищеної температури на лікарську речовину, у результаті чого хімічна стійкість ліків у розчинах підвищується. Оскільки стерилізатори - це апарати, що працюють під тиском, за їх справністю стежить інспекція котлонагляду. Особи, що працюють зі стерилізатором, повинні добре знати його влаштування і строго дотримувати правил техніки безпеки. Обслуговування стерилізаторів дозволяється тільки особам, що досягай 18-літнього віку, які закінчили курси з обслуговування автоклавів, пройшли попередній медичний огляд та інструктаж з безпечного обслуговування стерилізаторів.
Стерилізація текучою парою здійснюється насиченою водяною парою температури 100 °С. Стерилізація текучою парою проводиться в стерилізаторах, що представляють собою металеві посудини циліндричної форми, які закриваються кришкою з двома отворами - для термометра і виходу пари. На дно посудини наливається вода, поверх якої знаходиться металева підставка з отворами. Іноді апарат оснащується подвійними стінками, і пара, виходячи з парової камери, направляється в проміжок між ними. Така конструкція забезпечує підтримання сталої температури при стерилізації. В аптечній практиці знаходять застосування стерилізатори С-60 (мал.139), ВКО-16, ВК-75.
Нагрівання текучою парою (по ДФ X) роблять протягом 30-60 хвилин. Тривалість стерилізації залежить від фізико-хімічних властивостей лікарських речовин і об'єму розчину. Установлено, що при нагріванні стерилізатора температура розчину у флаконах відстає від температури парової камери. Для невеликих об'ємів відставання невелике (2-3 хвилини), а для об'ємів більше 500 мл - воно значне. Тому при стерилізації розчинів понад 100 мл збільшується тривалість стерилізації:
ДО 100 МЛ - 30 ХВИЛИН;
від 101 до 500 мл-45 хвилин;
від 501 до 1000 мл-60 хвилин.
Стерилізація розчинів об'ємом більше 1 л забороняється.
Тиндалізація - дробова стерилізація, що полягає в нагріванні при температурі 60-65 °С по 1 годині протягом 5 днів або при температурі 70-80 °С протягом 3 днів. Рідину, що стерилізується, зберігають у проміжках між нагріваннями при температурі 25-37 °С. Цей метод стерилізації використовують для лікарських речовин та їх розчинів, що не витримують нагрівання при 100 °С. При цьому в ході стерилізації гинуть не тільки мікроорганізми, але і їх спори, що проростають в інтервалах між нагріваннями. Метод тиндалізації в аптечній практиці використовується рідко. Частіше його застосовують в заводських умовах при виготовленні ампулованих розчинів. Тиндалізація за ефективністю не поступається автоклавуванню, але триває довше.
Пастеризація - однократне нагрівання розчину при температурі 80 °С протягом 30 З хвилин. Вона дає можливість знищити вегетативні форми мікроорганізмів, але не спори. Спосіб недостатньо надійний. ДФ X дозволяє користуватися цим методом при виготовленні розчинів термолабільних речовин з додаванням антисептиків (0,5% чи фенолу 0,3% трикрезолу). У присутності антисептика знижується вірулентність і життєздатність мікробів, припиняється ріст і розмноження мікробних клітин. Спори мікробів не знищуються, але в присутності антисептиків не проростають. Дія антисептиків значно підсилюється при підвищенні температури розчину.
Пастеризація і тиндалізація допускаються тільки у виняткових випадках відповідно до вказівки власних фармакопейних статей.
Контроль ефективності термічних методів стерилізації здійснюється за допомогою контрольно-вимірювальних приладів, хімічних і біологічних тестів.
Бактеріологічні методи - найбільш точні і здійснюються за допомогою біотесту стерилізації. Біотест стерилізації - об'єкт із установленого матеріалу, засіяний тест-мікро-організмами, призначений для контролю ефективності стерилізації. Як біотест можуть бути використані тест-мікроорганізми: чисті культури спороутворюючих мікроорганізмів різних типів, нанесені на матеріал, що стерилізується.
Хімічний тест стерилізації оснований на властивості ряду речовин змінювати свій фізичний стан чи колір під впливом визначеної температури.
Зазвичай користуються наступними речовинами: сірка (температура плавлення 111-120 °С), антипірин (ПО °С), антифібрин (115 °С), резорцин (ПО °С), кислота бензойна (121-122 °С), (3-нафтол (120-122 °С), сечовина (132 °С), фенацетин (134-135 °С). Для контролю сухожарової стерилізації використовуються: тіосечовина (180 °С), кислота янтарна (180-184 °С), барбітал (190-191 °С) і деякі інші речовини. В останні роки стали застосовувати кольорові термоіндикатори (табл.32), які з великою точністю вказують рівень температури (коливання 1-2 °С).
Стерилізація ультрафіолетовими променями. УФ-випромінювання - могутній стерилізуючий фактор, що здатний убивати вегетативні і спорові форми мікроорганізмів. УФ-промені широко застосовують у різних галузях народного господарства для знезаражування повітря приміщень, води та ін. Застосування їх в аптеках має велике практичне значення й істотні переваги порівняно з застосуванням дезінфікуючих речовин, бо вони можуть адсорбуватися медикаментами, які через це набувають сторонніх запахів.
Ультрафіолетова радіація - невидима короткохвильова частина сонячних променів з довжиною хвилі менше 300 нм. Припускають, що УФ-радіація викликає фотохімічне порушення ферментних систем мікробної клітини, діє на протоплазму клітини з утворенням отруйних органічних перекисів і призводить до фотодимеризації тіамінів. Ефективність бактерицидної дії УФ-випромінювання залежить від ряду факторів: довжини хвилі випромінювача, дози і часу опромінення, виду інактивованих мікроорганізмів, запиленості і вологості середовища. Найбільшу стерилізуючу здатність мають промені з довжиною хвилі 254-257 нм. Залежно від часу впливу розрізняють стадії стимуляції, пригнічення і загибелі мікробних клітин. Вегетативні клітини більш чутливі до УФ-випромінювання, ніж спори. Для знищення спор потрібна доза в середньому у 10 разів вища, ніж для знищення вегетативних клітин. Запиленість і вологість середовища значно знижують ефективність стерилізації УФ-променями.
Як джерела УФ-випромінювання в практиці аптек застосовуються спеціальні лампи БУВ (бактерицидна увіолева). Лампа виготовляється у вигляді прямої трубки зі спеціального увіолевого скла, з електродами з подвійної вольфрамової спіралі, покритої вуглекислими солями барію і стронцію. У трубці знаходяться невелика кількість ртуті й інертний газ аргон під тиском у кілька міліметрів ртутного стовпа. Джерелом УФ-випромінювання є розряд у парах ртуті, що відбувається між електродами при подачі на них напруги. До складу увіолевого скла входить до 72% оксидів кремнію, алюмінію, барію. У порівнянні зі звичайним склом воно містить невелику кількість натрію оксиду. Коефіцієнт пропускання УФ-променів для увіолевого скла 75%. Ці лампи мають сильну бактерицидну властивість, тому що максимум випромінювання близький до максимуму бактерицидної дії (254 нм). В той же час утворення озону й оксидів азоту незначне, оскільки на долю хвиль, що утворюють ці продукти, приходиться 0,5%. Промисловістю випускаються лампи БУВ-15, БУВ-30, БУВ-60 та ін. (табл.33).
У даний час УФ-лампи широко застосовуються в аптеках для стерилізації повітря, води очищеної при подачі її трубопроводом, допоміжних матеріалів і т.п. Для стерилізації повітря доцільно використовувати настінні і стельові бактерицидні опромінювачі, підвішуючи їх на висоті 1,8-2 м від підлоги і розміщаючи по ходу конвекційних потоків повітря рівномірно по всьому приміщенню. У відсутності людей стерилізацію можна проводити неекранованими лампами з розрахунку потужності 3 Вт на 1 м3 приміщення. Час стерилізації 1-1/2 години. Зручно користуватися екранованими лампами, світло яких спрямоване нагору; таким чином УФ-промені не діють на очі і шкірні покриви. Наявність екранованих ламп дозволяє знезаражувати повітря в присутності працюючих. У цьому випадку число ламп визначається з розрахунку потужності 1 Вт на 1 м3 приміщення.
Для стерилізації повітря в аптеках запропоновані пересувні бактерицидні опромінювані великої потужності, що складаються з 6 ламп БУВ-30 і забезпечують велику швидкість стерилізації. Використання цього апарата в приміщенні об'ємом до 100 м3 дозволяє протягом 15 хвилин знизити обсіяність повітря на 90-96%. Другий тип бактерицидного опромінювана оснащений лампою БУВ-30П і відповідним відбивачем, що дозволяє направляти промені. Він призначений для стерилізації приміщення обсягом до 20 м3.
При стерилізації повітря УФ-випромінюванням необхідно дотримувати визначених правил, щоб уникнути небажаного впливу УФ-променів на організм людини. При невмілому користуванні може статися опік кон'юнктиви очей і шкіри, тому категорично забороняється дивитися на включену лампу. При виготовленні ліків у полі УФ-випромінювання треба захищати руки 2% розчином чи 2% маззю новокаїну або парааміно-бензойної кислоти. Необхідно також систематично провітрювати приміщення для видалення утворюваних окислів азоту і озону.
Час опромінення повітря лампами БУВ може бути значно зменшений, якщо до санації додати в повітря аерозоль триетиленгліколю чи інших подібних речовин. При стерилізації повітря УФ-променями необхідно враховувати можливість численних фотохімічних реакцій лікарських речовин при поглинанні випромінювання. Тому всі медикаменти, що знаходяться в приміщенні для виготовлення ліків, які вимагають асептики, доцільно зберігати в тарі, непроникній для УФ-променів (скло, полістирол, пофарбований поліетилен та ін).
Ультрафіолетове випромінювання використовується для стерилізації води очищеної. Для цього застосовуються апарати з зануреними і незануреними джерелами УФ-випромінювання. В апаратах першого типу бактерицидна лампа, покрита кожухом із кварцового скла, міститься всередині водопроводу й омивається водою. В апаратах з незануреними лампами вони містяться над поверхнею опромінюваної води. Оскільки звичайне скло практично непроникне для УФ-променів, водопровід у місцях опромінення робиться з кварцового скла.
Лампи УФ-випромінювання можна використовувати для знезаражування рецептів, що надходять в аптеку, які є одним з основних джерел мікробного забруднення повітря і рук асистента. Становить інтерес апарат для знезаражування рецептів, в основі якого лежить принцип їх опромінення шістьма бактерицидними лампами БУВ-30 із двох сторін. Продуктивність апарата до 180 рецептів у годину.
Ультрафіолетове випромінювання можна застосовувати для стерилізації допоміжних матеріалів і аптечного інвентарю.
Радіаційна стерилізація - високоефективний і перспективний метод стерилізації, який в останні роки набуває все більшого поширення для стерилізації медичної продукції. Вивчається можливість радіаційної стерилізації лікарських засобів (сольові інфузійні розчини, лікувальні очні плівки та ін). Бактерицидний ефект іонізуючого випромінювання виявляється в результаті впливу на метаболічні процеси в клітині. Чутливість мікроорганізмів до іонізуючого випромінювання залежить від багатьох факторів: наявності вологи, кисню, рН середовища, температури та ін.
Для променевої стерилізації використовують гамма-випромінювання від ізотопів 60С та 137С, а також швидкі електрони від лінійних прискорювачів, антимікробна дія яких однакова. Стерилізаційна доза складає 2,5 мрад, але можливі й інші дози в залежності і від конкретних умов на виробництві.
Основні достоїнства методу: високий ступінь інактивації мікроорганізмів, ефективність при низькій температурі, можливість автоматизації процесу, стерилізація виробів в упаковці.
Існує широкий асортимент виробів медичного призначення, що можуть бути простерилізовані цим методом: гігроскопічна вата, перев'язувальний матеріал, вироби з пластмас, частини до різних апаратів і приладів, біологічні і бактеріальні препарати, антибіотики.
Стерилізація струмами високої частоти. Струмами високої частоти називаються струми, які утворюють електромагнітне поле, що міняється з високою частотою, викликає зміну орієнтації молекул і поглинання частини енергії поля речовиною. В результаті відбувається швидке нагрівання речовини та її стерилізація.
Механічні методи стерилізації. Для розчинів лікарських речовин, чутливих до теплових і радіаційних впливів, може бути використаний метод стерилізації фільтруванням через дрібнопористі фільтри. На відміну від інших способів стерилізації, при яких мікроорганізми тільки втрачають життєздатність, при стерилізуючому фільтруванні вони цілком видаляються з розчину, тим самим забезпечуючи його стерильність і апірогенність. Метод стерилізації фільтруванням - різновид фільтрування розчинів (мікрофільтрування). При стерилізуючому фільтруванні більш тонке очищення досягається використанням відповідних фільтруючих середовищ у вигляді глибинних і мембранних фільтрів.
Глибинні фільтри характеризуються сорбційним та інерційним механізмами утримання часток. Велика товщина цих фільтрів приводить до того, що вони утримують частки меншого розміру, ніж розмір пор фільтра. Так, фільтри з максимальним діаметром пор 1,6 мкм за певних умов є стерилізуючими. Через це у глибинних фільтрах за розмір пор зазвичай приймають величину найменших часток, утримуваних даним фільтром у кількості 100%. Однак, володіючи високою здатністю затримувати забруднення з розчинів, глибинні фільтри мають і ряд недоліків. Розмір пор цих фільтрів значно більший величини часток, що уловлюються, тому в процесі фільтрування повинні строго дотримуватися всі необхідні умови (рН середовища, тиск, температура та ін). При тривалому фільтруванні можливе проростання мікроорганізмів, затриманих матрицею, і попадання їх у фільтрат. Крім цього, велика частина глибинних фільтрів складається з волокнистих матеріалів, у зв'язку з чим виникає загроза відриву незакріплених волокон і забруднення фільтрату. Потрапляючи в організм, ці волокна можуть викликати різні патологічні реакції.
В останні роки одержали велике поширення для стерилізуючого фільтрування мікропористі мембранні фільтри, позбавлені цих недоліків. Мембранні фільтри являють собою тонкі (100-150 мкм) пластини з полімерного матеріалу, що характеризуються ситовим механізмом затримки і постійним розміром пор. Прийнято вважати, що середній розмір пор фільтра, що гарантує одержання стерильного фільтрату, складає 0,3 мкм. Щоб уникнути швидкого засмічення, мембрани використовують у сполученні з перед-фільтрами, які мають більші пори. При стерилізації великих об'ємів розчинів раціональне застосування фільтрів обох типів.
За рубежем для фармацевтичних цілей виробляється біля десяти типів мембранних фільтрів (Мілліпор, Сарторіус, Сінпор, Дюрапор та ін). У Казані випускаються мембранні фільтри "Владипор" з ацетату целюлози типу МФА, з регенерованої целюлози типу МФЦ, що можуть бути використані для очищення від механічних домішок і мікроорганізмів розчинів лікарських речовин, які мають рН у межах 1,0-10,0. Фільтри "Владипор" випускаються 10 номерів у діапазоні розмірів пор від 0,05 до 0,95 мкм і більше.
Для стерилізації розчинів лікарських речовин призначені фільтри МФА-3 і МФА-4 із середнім розміром пор відповідно 0,25-0,35 і 0,35-0,45 мкм. Випускаються вони у вигляді пластин і дисків різного діаметра. Фільтри типу МФА можуть бути простерилізовані насиченою водяною парою під тиском при температурі 120 °С, сухим гарячим повітрям при 180 °С, обробкою формальдегідом, етиловим спиртом, водню пероксидом, етилену оксидом, УФ - чи гамма-променями.
Перспективні також полімерні плівки з циліндричними порами - так звані ядерні фільтри; фільтри "Міфіл" з поліамідкапрону ПА-6 з діаметром пор 0,2 мкм.
Стерилізуюче фільтрування виконують в установках, основними частинами яких є фільтротримач і фільтруюче середовище. Використовують два типи тримачів - пластинчасті, у яких фільтр має форму круглої чи прямокутної пластини, і патрони, що містять один трубчастий фільтр чи більше. Перед фільтруванням проводять стерилізацію фільтра у тримачі і ємності для збору фільтрату насиченою водяною парою при 120 °С або гарячим повітрям при 180 °С.
Метод мембранної фільтрації (або стерильної фільтрації) доцільно використовувати для розчинів термолабільних речовин, наприклад, очні краплі "Пропомікс" (випускаються МП "Апітек"). З цією метою успішно застосовується установка фільтраційна (УФ), що виробляється в м. Кириші. Продуктивність УФ при робочому тиску 0,3 МПа (З кгс / см2) на мембрані "Владипор" МФА-А № 2 з фільтротримачем ФД-142 - 0,08 м3/год (80 л / год) і ФД-293 - 0,2 м3/год (200 л / год). Перед початком і наприкінці фільтрування розчину проводять випробування установки на герметичність і цілісність мембранного фільтра.
Використання стерилізації фільтруванням має сенс тільки в тому випадку, якщо сам розлив розчину у флакони здійснюється в строго асептичних умовах з використанням устаткування з ламінарним потоком повітря.
Контроль стерилізації цим методом проводять прямим посівом проб фільтрату на живильні середовища.
Хімічні методи стерилізації. Для виробів з гуми, полімерних матеріалів, скла, корозієстійких металів зараз застосовують хімічні методи стерилізації газами і розчинами. Для газової стерилізації використовують чистий етилену оксид або етилену оксид з різними флегматизаторами (бромистий метил, вуглецю діоксид, фреони та ін). Стерилізацію здійснюють у газових стерилізаторах. Ефективність стерилізації цим методом залежить від стерилізуючого агента, температури, відносної вологості повітря.
Об'єкти стерилізації попередньо упаковують в пакети з поліетиленової плівки чи пергаментний папір. Вироби, простерилізовані газовим методом, витримують у вентильованому приміщенні протягом однієї чи декількох діб у залежності від виду виробів та їх призначення.
Стерилізацію газами можна також застосовувати і для стерилізації повітря в боксах, допоміжних матеріалів (особливо термолабільних), посуду, пробок; перев'язувального матеріалу, предметів догляду за хворими і т.п. Гази легко проникають через пакувальні матеріали (папір, целофан, поліетилен), а після стерилізації легко звітрюються. Необхідно пам'ятати про їх отруйність, подразнюючу дію і при роботі з ними дотримувати міри захисту (спеціальний одяг, маски та ін).
У зарубіжних країнах широке застосування для стерилізації повітря знаходять аерозольні препарати, що представляють собою рідкі фізико-хімічні системи, приготовлені на зріджених газах (фтортрихлорметан, трифтортрихлоретан, двоокис вуглецю та ін). Аерозолі можуть знаходитися тривалий час у повітрі, дезінфікуючи його. Для стерилізації повітря використовують аерозолі етиленгліколю і поліетиленгліколів. Найбільш ефективним вважають аерозоль триетиленгліколю, при розпиленні якого повна стерильність повітря у приміщенні досягається за кілька хвилин.
Вивчається також використання газової стерилізації для лікарських речовин і розчинів (атропіну сульфату, промедолу, кордіаміну, кофеїн-бензоату натрію та ін). У цьому випадку необхідно насамперед з'ясувати можливість взаємодії газів з лікарськими речовинами. У закордонній літературі є повідомлення про можливість стерилізації газами антибіотиків, панкреатину та деяких інших речовин.
Для стерилізації розчинів можна застосовувати (3-пропілолактон - рідину, що кипить при 153 °С. Розчиняючись у воді, він гідролізується до Р-оксипропіонової кислоти. Р-пропілолактон застосовують у концентрації 0,2% за об'ємом і інкубують при 37 °С протягом 2 секунд.
Для хімічної стерилізації розчинами використовують 6% розчин водню пероксиду і надкислоти (дезоксон-1). Стерилізацію роблять у закритих ємностях зі скла, пластмаси чи покритих емаллю. Ефективність стерилізації цим методом залежить від концентрації стерилізуючого агента, часу стерилізації і температури розчину, що стерилізується. При хімічній стерилізації виріб цілком занурюють у розчин, витримують у ньому визначений час, а потім промивають стерильною водою в асептичних умовах.
Одним з різновидів хімічної стерилізації є консервування лікарських форм, тобто запобігання від мікробного псування лікарських препаратів у процесі їх використання шляхом додавання до них різних хімічних речовин.
До консервантів висувається ряд вимог: фармакологічна індиферентність у використовуваній концентрації (відсутність загальнотоксичної та місцевоподразнюючої дії); широкий антимікробний спектр; відсутність хімічної взаємодії з лікарськими речовинами й іншими компонентами лікарських препаратів; відсутність впливу на органолептичні властивості ліків; стійкість при збереженні; підтримка стерильності лікарських форм протягом усього часу їх застосування, тобто надійна антимікробна активність.
Консервуючі речовини застосовуються тільки у вкрай необхідних випадках, коли не можна застосовувати стерилізацію чи інші прийоми для зберігання стерильності через складну фізико-хімічну структуру лікарських препаратів або через неможливість випуску упаковок з одноразовими дозами. Консерванти застосовують також для збереження стерильності при багаторазовому використанні. Проблема консервування лікарських препаратів особливо важлива для стерильних і асептично виготовлених лікарських форм. Тому характеристика консервантів представлена у даному розділі (ці речовини можуть також застосовуватися в технології водних витягів, емульсій, мазей, приготовлених на гідрофільних і емульсійних основах та ін). Консерванти додаються до розчинів для ін'єкцій, які містять речовини, що розкладаються при нагріванні. Консерванти повинні бути зазначені в рецепті чи у власних статтях. їх найменування і кількість пишеться в ППК.
Лікарські засоби для порожнинних, серцевих, очних та ін'єкцій, що мають доступ до спинномозкової рідини, а також при разовій дозі, що перевищує 15 мл, не повинні містити консервантів.
Необхідність консервування лікарських форм зараз зростає ще більше у зв'язку з розширенням асортименту готових лікарських форм, які вимагають тривалого зберігання.
Ю.І. Зеліксоном запропоновано найчастіше використовувані консерванти класифікувати наступним чином:
Неорганічні сполуки.
Металоорганічні сполуки.
Органічні сполуки: спирти, кислоти, ефіри, солі четвертинних амонієвих сполук.
Неорганічні сполуки (препарати срібла, срібна вода та ін) - це в основному солі важких металів, які надають олігодинамічну дію, тобто викликають загибель мікроорганізмів при дуже великих розведеннях (1-10 мкг / л). Застосовують головним чином для консервування очних крапель. Срібна вода використовується для знезаражування питної води на кораблях та в інших спеціальних умовах у США, Франції, Великобританії й інших країнах.
Металоорганічні сполуки - органічні сполуки ртуті, мають велику антимікробну активність і в малих дозах нетоксичні для людини. До таких речовин відносяться: мертіолат (у концентрації 0,001 - 0,02%), метафен (1: 2500), фенілртутні солі (0,001-0,002%),.
Мертіолат - натрієва сіль етилсаліцилату. Порошок кремового кольору, стійкий на повітрі, добре розчинний у воді, спирті. Мертіолат застосовують для консервування ін'єкційних розчинів (0,001%), очних крапель (0,005%), мазей (0,02-0,1%) і емульсій.
Метафен - порошок жовтого кольору без смаку і запаху, нерозчинний у воді, розчинний у лугах. Застосовується для консервування очних крапель у концентрації 1: 2500. Застосування метафену і мертіолату в очних краплях обмежує та обставина, що вони стійкі тільки в лужному середовищі, у той час як більшість алкалоїдів, застосовуваних в офтальмології, найбільш стабільна при низькому значенні рН.
Фенілртутні солі. Фенілртуті ацетат являє собою білий кристалічний порошок, розчинний у воді та, спирті. Для консервування лікарських форм придатні й інші фенілртутні солі: борат, бензоат, хлорид, глюконат і саліцилат.
Із солей фенілртуті найбільш широке застосування має фенілртуті нітрат для консервування ін'єкційних розчинів у концентрації 0,001-0,002%, для очних крапель - 0,004%, емульсійних мазей - (0,007-0,01%).
Ця група сполук - надійні консерванти. їх дія на мікроорганізми основана на блокуванні сульфгідрильних груп ферментів. Органічні сполуки ртуті ефективні проти патогенних мікроорганізмів, що зазвичай зустрічаються в очних розчинах. Деякі автори вважають небажаним застосування цих речовин в офтальмології, тому що, на їх думку, вони викликають алергійні реакції при тривалому застосуванні.
Органічні сполуки. Етиловий спирт використовується для консервування новогаленових препаратів у концентрації до 20%, а також у кількості 10-12% від водної фази для консервування емульсій.
Однак найбільші антисептичні властивості має 70% етиловий спирт, тому, будучи присутнім у галенових препаратах до 20%, він дає слабкий консервуючий ефект.
Фенілетиловий спирт являє собою рідину з запахом троянди. Розчиняється у воді при струшуванні до 2%, утворюючи прозорий розчин у 50% спирті (1:
1). Рекомендується головним чином для консервування очних крапель у концентрації 0,3%. Як консервант очних крапель він прийнятий рядом країн (Англія, США та ін). Але він має той недолік, що неефективний проти багатьох грампозитивних мікроорганізмів.
Бензиловий спирт являє собою рідину з приємним ароматним запахом і пекучим смаком. Розчиняється у воді (1: 25), у 50% спирті (1:
1), змішується з хлороформом. У концентрації 0,5% застосовується для консервування 15% ін'єкційного розчину нембуталу і препаратів радіоактивних ізотопів; у концентрації 0,9% - для очних крапель зі стероїдними препаратами.
Хлорбутанолгідрат - безбарвні кристали з запахом камфори, мало розчинний у воді (1: 250), легко розчинний у 90% спирті, хлороформі, жирних оліях і вазеліновому маслі, гліцерині. Широко використовується в різних країнах, у тому числі й у нас, для консервування ін'єкційних розчинів, очних крапель (0,5%) та ін., тому що він має досить широкий спектр антимікробної дії і незначну сенсибілізуючу здатність. Хлорбутанолгідрат сполучний з багатьма лікарськими речовинами, ефективний у розчинах з кислим значенням рН. Однак консервант цілком інактивується в нейтральному і лужному середовищах, несумісний зі срібла нітратом, сульфатіазолом натрію і деякими іншими речовинами.
Феноли. Розчин фенолу (0,25; 0,3; 0,5%) дуже ефективний для консервування парентеральних розчинів (інсулінових препаратів, вакцин і сироваток). Як консервант фармацевтичних препаратів фенол майже не застосовується. Недолік його в тому, що він має високу токсичність і іноді викликає біль і печіння при ін'єкціях, а також алергійні стани. Погана розчинність у воді не дозволяє використовувати його для консервування водних розчинів.
Хлоркрезол являє собою безбарвні кристали з характерним запахом. Розчинний у 250 г води (краще в гарячій), етанолі, жирних оліях. Хлоркрезол у 10-13 разів активніший фенолу у відношенні бактерій і грибів, у той же час менш токсичний.
Застосовується для консервування очних крапель у концентрації 0,05%, ін'єкційних розчинів - 0,1%, мазей-0,1-0,2%.
Бензойна кислота являє собою білу кристалічну речовину зі слабким характерним запахом.1 г кислоти розчинний у 350 мл води, 3 мл спирту, 8 мл хлороформу. Бензойна кислота - відомий консервант. Найчастіше вона застосовується у вигляді натрієвої солі, добре розчинної у воді (1 г у 1 мл води).
Бензойну кислоту і її солі використовують як харчові консерванти в кількості 0,1-0,2% у більшості країн світу. Вони сильно діють на дріжджі, особливо в кислому середовищі. Як консерванти лікарських препаратів бензойна кислота і її натрієва сіль використовуються для цукрового і лікарського сиропів, емульсій риб'ячого жиру і вазелінового масла, суспензій з антибіотиками та ін. Ці консерванти вводяться в масу для желатинових капсул. В основному вони використовуються при виготовленні лікарських форм для внутрішнього застосування.
Сорбінова кислота - білий дрібнокристалічний порошок зі слабким дратівним запахом і слабокислим смаком, погано розчинний у воді (0,15%), добре розчинний в оліях (0,6-1%) і спирті.
Уперше сорбінова кислота отримана в 1859 р. в результаті лужного гідролізу полісахаридів, виділених із плодів горобини - звідси і її назва. У плодах горобини кислота знаходиться у формі Б-лактону, названого парасорбіновою кислотою, вміст якого складає приблизно 1%.
Зараз її синтезують найчастіше шляхом взаємодії кротонового альдегіду з малоновою кислотою в присутності тугідину.
Сорбінова кислота дозволена в ряді країн світу для консервування харчових продуктів. Вона менш токсична, ніж звичайно застосовувані кислоти-консерванти, і не шкідлива для людини навіть у великих кількостях. Сприяє підвищенню імунобіологічної активності організму, має сильну фунгіцидну активність. Використовується для консервування розчинів (0,1%), цукрового й іншого сиропів (0,7%) іноді в сполученні з натрію бензоатом. Дозволена до застосування для консервування гідрофільних і емульсійних основ (0,2%). У даний час, крім сорбінової кислоти, промисловістю випускаються її калієва і кальцієва солі. Кальцієва сіль (на відміну від калієвої) погано розчинна у воді.
Складні ефіри параоксибензойної кислоти (парабени). У медичній практиці найбільше застосування одержали метиловий і пропіловий ефіри, прийняті як консерванти багатьма закордонними фармакопеями (США, Швеції, Великобританії, Німеччини та ін). Вони мають значно меншу токсичність, ніж багато інших консервантів. Це білі кристалічні речовини без запаху і смаку. Парабени погано розчинні у воді, розчинні в оліях і дуже добре - в органічних розчинниках. Через кращу розчинність метиловий ефір частіше застосовується у водних розчинах, а бутиловий - в олійних.
Однак парабени мають істотні недоліки: невелика розчинність у воді, інактивація великою кількістю речовин (наприклад, неіоногенними поверхнево-активними речовинами), слабка спороцидна дія. Парабени нерідко подразнюють і алергізують шкіру (особливо в людей, що реагують на параароматичні сполуки).
Однак парабени завдяки цілому ряду позитивних властивостей широко застосовуються в косметичній, харчовій і фармацевтичній промисловості нашої країни і за рубежем.
Солі четвертинних амонієвих сполук (ЧАС) - це синтетичні речовини з високою поверхневою активністю і бактерицидною дією. З цієї групи речовин за рубежем найбільше широко застосовується бензалконію хлорид, що представляє суміш хлоридів алкілдиметилбензиламонію. Бензалконію хлорид-кристалічна речовина білого кольору, дуже добре розчинний у воді; водні розчини його безбарвні, стійкі до змін температури, рН середовища.
У концентрації 1: 10000 його застосовують майже у всіх закордонних країнах переважно для консервування очних крапель, крапель для носа, де потрібна відсутність подразнюючої дії і швидкий бактерицидний ефект. Цей консервант сполучний з багатьма лікарськими речовинами, за винятком срібла нітрату, сульфатіазолу натрію, кислоти борної. Він має значну бактеріостатичну і фунгістатичну активність. З інших похідних четвертинних амонієвих сполук використовують бензетонію хлорид у концентрації 1: 4000 для консервування очних крапель і в концентрації 1: 10000 - 1: 20000 для ін'єкційних розчинів, а також цетилпіридинію хлорид для консервування очних крапель (1: 5000).
Сполукою цієї групи, що представляє значний інтерес, є вітчизняний препарат - додецилдиметил-бензиламонію хлорид (ДМДБАХ), що на відміну від закордонного препарату являє собою індивідуальну речовину з додециловим радикалом (С12Н25). За нешкідливістю, антимікробною активністю і стабільністю ДМДБАХ значно перевершує бензалконію хлорид. Це жовтувато-білий порошок з ароматичним запахом, дуже добре розчинний у воді, спирті, ацетоні; у концентрації 0,01% дозволений для консервування мазевих основ. При консервуванні очних крапель ДМДБАХ витримує стерилізацію (100 і 120 °С) і зберігає активність більше півтора років.
Таким чином, як хімічні консерванти для лікарських форм можуть застосовуватися різноманітні речовини. Однак універсального консерванта, який міг би використовуватися для будь-яких фармацевтичних продуктів, не існує. При вирішенні питання про те, який же консервант придатний для даного лікарського препарату, варто враховувати сумісність його з іншими компонентами, перевіряти
його активність саме в цьому лікарському препараті, а також враховувати всі інші вимоги, які висуваються до речовин, що підлягають консервації.
Необхідно відзначити, що розчини лікарських речовин, які мають сильну бактерицидну дію, не мають потреби в стерилізації. До таких речовин відносяться: гексаметилентетрамін, аміназин, дипразин, коларгол, протаргол, імізин, ртуті дихлорид, калію перманганат (0,1% і більше) та ін.
4. Апірогенність лікарських форм. Відсутність домішків. Стабільність та ізотонічність
 |
ВІДСУТНІСТЬ МЕХАНІЧНИХ ДОМІШОК.
Всі ін'єкційні розчини не повинні містити яких-небудь механічних домішок і повинні бути зовсім прозорими. До числа включень, що можуть міститися в ін'єкційному розчині, відносяться частки пилу, волокна матеріалів, використовуваних для фільтрування, і будь-які інші тверді частки, що можуть потрапити в розчин з посуду, у якій він готується. Головна небезпека наявності в ін'єкційному розчині твердих часток - можливість закупорки судин, що може викликати смертельний результат у випадку, якщо закупореними виявляться судини, що харчують серце чи довгастий мозок.
Для звільнення від механічних забруднень ін'єкційні розчини піддають фільтруванню. В аптечних умовах для фільтрування ін'єкційних розчинів найбільше часто застосовують подвійний складчастий фільтр із щільного фільтрувального папера з грудочкою гігроскопічної вати чи мікропористі фільтри. Складання паперового фільтра повинне вироблятися за допомогою шпателя на чистому листі папера, по можливості без дотику рук. Необхідно завжди мати в запасі готові фільтри.
При фільтруванні через подвійний складчастий фільтр першу частину фільтрату, у якій можуть міститися механічні домішки, збирають спочатку в підсобну стерильну склянку, з якої потім знову переливають на фільтр. Фільтрують розчин до повної відсутності в ньому механічних домішок.
У разі потреби фільтрування значних кількостей розчинів для ін'єкцій користуються також фільтрувально-вакуумними установками різної конструкції. Фільтруючою поверхнею в них часто служить скляний фільтр № 4. Застосовуються також фільтрувальні установки карусельного типу продуктивністю 5-8 л рідини в годину і фільтри Конєва, розроблені в Харківському науково-дослідному хіміко-фармацевтичному інституті.
Керамічні свічі працюють під вакуумом.
Свічі вимагають акуратності в роботі; найменша тріщина робить їх непридатними. Через один фільтр можна пропускати тільки однойменні розчини. Унаслідок такої дії фільтрів як засмоктування мікробів усередину свічі необхідне їхнє періодичне очищення-стерилізація сухим жаром при 150-170 °С протягом 1 год.
На відміну від фільтрування для видалення з ін'єкційного розчину механічних домішок основна дія ультрамікропористих перегородок фільтрів, що стерилізують, полягає не в механічній затримці, а в адсорбції мікроорганізмів на великій поверхні, утвореної стінками фільтра.
Хімічні методи стерилізації. Стерилізацію хімічним шляхом здійснюють, впливаючи на мікрофлору хімічними речовинами, що знищують її. Такі хімічні речовини називають антимікробними. Основна вимога до антимікробних речовин, застосовуваним для стерилізації ін'єкційних розчинів, - їхня повна нешкідливість для організму людини.
Хімічну стерилізацію, як і механічну, застосовують для розчинів, що містять термолабільні лікарські речовини. У фармацевтичній практиці з цією метою використовують наступні речовини.
Нипагин - метиловий ефір параоксибензойной кислоти, малорозчинний у воді (0,25% при 20 °С) і дає гарні результати вже в концентрації 0,05%. Застосовується в концентрації 0,25%, у якій його бактерицидність перевищує бактерицидність фенолу в 2,6 рази.
Ніпазол - пропиловый ефір параоксибензойной кислоти, малорозчинний у воді (0,03% при 20 °С). Бактерицидність у 5 разів вище, ніж нипагина. Через малу розчинність у воді рекомендується застосовувати 0,07% розчин суміші-7 частин нипагина і 3 частин нипазола.
Хлорбутанолгідрат (хлоретон) - безбарвна кристалічна речовина з запахом камфори. Застосовується в концентрації до 0,5%.
Трикрезол - метилфенол (суміш усіх трьох ізомерів), що володіє більшою бактерицидністю, чим фенол, і при цьому значно меншою отруйністю. Застосовується в концентрації до 0,3%.
Антимікробні речовини ні в якому разі не можна вводити до складу ін'єкційних ліків довільно. Це робиться тільки за згодою лікаря і по відповідній прописі. На сигнатурі повинні бути зазначені найменування і кількість використаного антимікробного засобу.
Газова ("холодна") стерилізація. Цей вид хімічної стерилізації заснований на застосуванні летючих дезінфікуючих речовин, що видаляються легко зі стерилізуючого об'єкту шляхом слабкого чи нагрівання вакууму. Застосовується для стерилізації чуттєвих до нагрівання лікарських речовин. На практиці використовуються дві речовини - окис етилену і Р-пропіолактон. Їхня антимікробна дія заснована на спонтанному гідролізі, що безпосередньо діють на мікроорганізми.
Метод стерилізації окисом етилену в суміші з вуглекислим газом був включений у Фармакопею США видання 1965 р. і Британську фармакопею видання 1963 р. Рідкий окис етилену кипить при 107 °С, зберігається в стабільних балонах, легко загоряється, має подразнюючу дію на шкіру. У концентрації 0,5 мг на 1 моль окис етилену стає нешкідливої для людини. Для ще більшого зменшення шкідливого впливу застосовується в суміші з вуглекислим газом (9 + 1 частина). Окис етилену використовують для стерилізації як термолабільних речовин, так і інструментів, апаратури, пластмас, перев'язних матеріалів. Обробку здійснюють у спеціальних апаратах з камерами, де по черзі створюють вакуум і тиск, після чого роблять 2-4-кратну обробку стерильним повітрям. Для стерилізації розчинів досить 400-500 мг окису етилену на 1 л при 20 °С; тривалість експозиції 6 год. Для стерилізації розчинів Р-пропіолактоном застосовують 0,2% об'ємну концентрацію газу при 37 °С протягом 2 год.
СТАБІЛЬНІСТЬ. Стабільністю, чи стійкістю, ін'єкційних розчинів (як і інших ліків) називається незмінність властивостей лікарських речовин, що містяться в них.
Стабільність ліків для ін'єкцій досягається строгим дотриманням асептичних умов їхнього готування, підбором оптимальних умов (температура, час) стерилізації, застосуванням припустимих антимікробних засобів, що дозволяють досягати необхідного ефекту стерилізації при більш низьких температурах, і, нарешті, використанням стабілізаторів - речовин, що підвищують хімічну стійкість лікарських речовин в ін'єкційних розчинах. З 165 офіційних (ДФХ) ін'єкційних розчинів 62 (близько 40%) вимагають уведення стабілізаторів для використання інших способів збільшення стабільності.
Стабілізація розчинів речовин, що легко окислюються. До таких речовин відносяться лікарські речовини, що мають у своїй молекулі спиртові, фенольні, карбонільні радикали, аміногрупи й інші функціональні групи з рухливим атомом водню. Під впливом кисню повітря вони легко окислюються, викликаючи розкладання лікарської речовини.
З метою стабілізації розчинів подібних речовин використовують антиоксиданти - речовини, що окислюються значно легше лікарських речовин і попереджують тим самим окислювання останніх. До їхнього числа відносяться натрію сульфіт, натрію бісульфіт, натрію метабісульфіт, ронгаліт, тіосечовина, аскорбінова кислота, параамінофенол, дигідрат двохнатрієвої солі етилендиамінтетраоцтової кислоти (трилон Б), інозитфосфорна кислота, унітіол.
Натрію сульфіт застосовують для стабілізації ін'єкційних розчинів аскорбінової кислоти і стрептоциду; натрію парааміносаліцилат, натрію метабісульфіт - для стабілізації розчинів адреналіну, норадреналіну гідрохлориду, ерготалу, новокаінаміду, ронгаліт - для стабілізації розчину етазолу-натрію; унітіол - для стабілізації розчину тіаміну броміду.
Стабілізація розчинів глюкози. При стерилізації розчинів глюкози для ін'єкцій, особливо в лужному склі, відбуваються окислювання, полімеризація і карамелізація глюкози. Спостерігається пожовтіння, а іноді і побуріння розчинів. Серед продуктів розкладання глюкози виявляються глюконова кислота, сліди оцтової, мурашинової кислот в альдегіду, у тому числі отруйний - оксиметилфурфурол.
Для стабілізації розчинів глюкози використовують стабілізатор, запропонований Вейбелем і складається із суміші 0,26 м натрію хлориду і 5 моль 0,1 н. розчину соляної кислоти на 1 л розчину глюкози.
Для прискорення роботи рекомендується застосовувати заздалегідь приготовлений розчин стабілізатора, отриманий по прописі: 5,2 м натрії хлориду, 4,4 моль розведеної хлористоводневої кислоти (8,3%) і води для ін’єкцій до 1 л. Такого розчину стабілізатора до розчину глюкози додають 5% незалежно від її концентрації. Роль хлористоводневої кислоти в стабілізаторі - нейтралізація лужності скла і зменшення внаслідок цього небезпеки карамелізаціі глюкози.
 |
Стабілізація розчинів солей. До цієї групи лікарських речовин відносяться солі алкалоїдів і інших азотистих основ, у тому числі синтетичних, що мають у водяних розчинах нейтральну чи слабкокислу реакцію. Як стабілізатор таких розчинів використовують, як правило, 0,1 н. розчин хлористоводневої кислоти, що пригнічує гідроліз зазначених лікарських речовин у розчині. Водяні розчини солей слабких кислот і сильних основ (натрію нітрит, кофеїн-бензоат натрію, натрію тіосульфат і ін) легко гідролізуються, здобуваючи слабколужну реакцію. У зв'язку з цим для пригнічення реакції гідролізу потрібно збільшити рН середовища, що досягається додаванням необхідної кількості лугу-зазвичай 0,1 н. розчину їдкого натру.
АПІРОГЕННІСТЬ. Апірогенністю називається відсутність в ін'єкційних розчинах продуктів і метаболізму мікроорганізмів - так званих пірогених речовин, чи пірогенів. Своя назва пірогени (від лат. руг - жар, вогонь) одержали за здатність викликати підвищення температури при введенні в організм.
Пірогені речовини добре розчинні і легко проходять крізь фільтри, величина пор яких перевищує 50 нм. Величина ж самих пірогенів складає 1-50 нм. Вони дають позитивну реакцію на вуглець з реактивом Моліша. Для їхнього повного руйнування необхідно автоклавування при 120 °С на протязі декількох годин.
Відповідно до вимог ДФХ ін'єкційні розчини не повинні містити пірогених речовин. Для забезпечення цієї вимоги ін'єкційні розчини готують на апірогенній воді для ін'єкцій (чи оліях) з використанням медикаментів і інших допоміжних речовин, що не містять пірогенів.
ІЗОТОНІЧНІСТЬ. Особливу групу ін'єкційних розчинів складають ізотонічні, тобто розчини з осмотичним тиском, рівним осмотичному тиску рідин організму: плазми крові, слізної рідини, лімфи і т.д. Ці рідини мають постійний осмотичний тиск, що у нормі тримається на рівні 7,4 атм. При введенні в організм ін'єкційного розчину осмотичний тиск рідин порушується в результаті зрушення осмотичної рівноваги.
Оболонки клітин, що складають фізіологічні рідини, у стані життєдіяльності мають властивість напівпроникності, тобто, пропускаючи воду, у той же час не пропускають розчинені в ній речовини. При введенні розчину з великим осмотичним тиском (гіпертонічний) у результаті різниці осмотичних тисків вода виділяється з контактуючих з розчином клітин, що приводить до їх зморщенню. Уведення розчину з невеликим осмотичним тиском (гіпотонічний) викликає розбухання клітин, унаслідок чого відбувається розрив клітинної оболонки. Два явища супроводжуються сильними болючими відчуттями і становлять небезпеку для організму. Щоб уникнути зазначених несприятливих явищ варто вводити в організм розчин з тиском, рівним осмотичному тиску рідин організму-ізотонічний розчин.
 |
Для приготування ізотонічних розчинів лікарських речовин необхідно попередньо зробити відповідні розрахунки. Один зі способів розрахунку ізотонічної концентрації заснований на законі Вант-Гоффа, за допомогою якого можна розраховувати ізотонічну концентрацію розчину розведеного неелектроліту (недисоційована речовина).
Залежність між осмотичним тиском, концентрацією і температурою такого розчину можна виразити рівнянням Клапейрона, що може бути застосоване до розведених розчинів унаслідок того, що за законом Вант-Гоффа розчинені речовини поводяться аналогічно газам і тому до них з достатнім наближенням застосовні газові закони:
РV = пRТ,
де Р - осмотичний тиск плазми крові (7,4 атм); V - обсяг розчину в л; n - число грам-молекул розчиненої речовини; R - газова постійна (0,082 атм / л); Т - абсолютна температура тіла в °K.
Отже, для того щоб приготувати ізотонічний розчин будь-якого неелектроліту, варто взяти 0,29 г / моль цієї речовини на 1 л розчину.
Наприклад, ізотонічна концентрація розчину коразолу, що має молекулярну масу 138,17, дорівнює 0,29-138,17 = 40, тобто на 1 л розчину варто взяти 40 м коразолу (~4% розчину). Ізотонічна концентрація розчину глюкози, що має молекулярну масу 180, дорівнює 0,29-180 = 52,2, тобто на 1 л розчину потрібно взяти 52,2 м глюкози (5% розчин). До недисоційованих речовин відносяться також гексаметилентетрамін, сахароза, бемегрід і ін.
При розрахунку ізотонічної концентрація електролітів у рівняння Клапейрона вводять поправочний множник, що називається ізотонічним коефіцієнтом. Для розчинів електролітів, дисоційованих цілком, він дорівнює 0,156, для розчинів слабкодисоційованих електролітів - 0,2. Так, ізотонічна концентрація розчину натрію хлориду, що має молекулярну масу 58,5, буде дорівнює 0,156*58,5 = 9,1, тобто на 1 л розчину варто взяти 9,1 м натрію хлориду (0,9% розчин). Ізотонічна концентрація хініну дигідрохлориду, що має молекулярну вагу 397,36, дорівнює 79,4, тобто на 1 л розчину необхідно взяти 79,4 м хініни дигідрохлориду (~8% розчин).
Більш універсальним і точним методом розрахунку ізотонічних концентрацій розчинів є фармакопейний метод, заснований на використанні так званих ізотонічних еквівалентів лікарських речовин по натрію хлориду, докладно описаний у ДФХ.
Ізотонічні концентрації можуть бути визначені й інші методи, наприклад кріоскопічним, заснованим на порівнянні констант депресії температури замерзання плазми крові і розчинів відповідних лікарських речовин.
5. Практична частина
Рецепт № 1
Візьми: Розчин Натрію хлориду 0,9% -100 мл
Простерилізуй!
Видай. Познач: Для в / в крапельного введення.
Recipe: Solutionis Natrii chloridi 0.9% -100 ml
Sterelisa!
Da. Signa: Для в / в крапельного введення.
Фармацевтична експертиза рецепту.
Згідно наказу МОЗ України № 360 рецепт виписується на рецептурному бланку-форми № 1, який оформлений кутовим штампом ЛПЗ, підписом і особистою печаткою лікаря, який виписав рецепт.
Термін дії рецепту - до 1 місяця.
Перевірка доз:
Не проводиться, оскільки ЛР загального списку. НОВ не встановлені.
Висновок: ЛФ може бути виготовлена.
Фізико - хімічні властивості речовин, що входять до
складу лікарської форми.
ДФУ
Натрій хлорид-Natrii chloridum
Це білі кристалічні кристалики або білий кристалічний порошок без запаху та солоний на смак. Розчинний в 3 ч. води, малорозчинний в спирті. Зберігання: в добре закупореній тарі.
Паспорт письмового контролю.
Зворотній бік ППК
Розрахунки:
m (NaCl) = 0.9
V (заг) = 100 ml
Лицевий бік ППК
Дата № рецепту
Взято: Aguae pro injectionibus gvantum sattis
Natrii chloridi 0.9
Aguae pro injectionibus ad 100 ml
V заг = 100 ml
Sterile!
П.:
П.:
В.:
Характеристика ЛФ. Технологія приготування.
Дана ЛФ - розчин для в / в введення до складу якої входить речовина загального списку - натрію хлорид.
Розчин готую масо-об’ємним методом за допомогою мірного посуду.
Готую робоче місце, себе, терези, мірний посуд, флакони та інший допоміжний матеріал згідно наказу № 139. В стерильну мірну колбу відмірюю приблизно 70 мл води для ін’єкцій. На терезах ВР-1 відважую 0,9 натрію хлориду, який висипаю в мірну колбу і розчиняю у воді для ін’єкцій. Розчин доводжу водою для ін’єкцій до об’єму 100 мл, перемішую. Проводжу якісне і кількісне визначення вмісту натрію хлориду в розчині. Фільтрую через стерильний скляний фільтр № 4 в стерильний флакон для відпуску. Закупорюю алюмінієвим ковпачком під обкладку і перевіряю на герметичність. Стерилізую в автоклав при t=120 8 хв. Проводжу вторинний контроль на відсутність механічних домішок і герметичність. Заповняю зворотній бік ППК. Оформляю до відпуску відповідними етикетками: “Стерильно“, “Берегти від дітей”, “Для ін’єкцій” згідно наказів № 583, № 626. Термін придатності - 1 місяць.
Оцінка якості виготовлення ЛФ.
Контроль на стадіях виготовлення: виготовлення лікарської форми проводять в асептичних умовах.
Контроль виготовленої лікарської форми:
аналіз документації: згідно наказів № 96 та № 626. Фармацевтичну експертизу проведено правильно. Речовини в прописі сумісні. № ЛФ рецепту і ППК відповідають, розрахунки зроблено вірно, ППК виписано вірно.
Оформлення: згідно наказів № 96 та № 626. Об’єм флакону відповідає об’єму розчину, флакон щільно закритий, етикетки оформленні вірно.
Органолептичний контроль: згідно наказів № 96 та № 626. Безбарвна прозора рідина, механічні домішки відсутні.
Фізичний контроль: відхилення в масі вкладається в норму допустимих відхилень V (заг) =100 мл, нехай V=101 мл. Розрахунки: 100*1/100=1% - відповідає нормам допустимих відхилень згідно наказу № 276.
Список використаної літератури
1. Александров І.Д., Субботин В.М. Справочник по технологии приготовления лекарственных форм. Ростов на Дону: "Феникс", 2000 - 192с.
2. Государственная фармакопея СССР. - 11-е изд. - М.: Медицина, 1987. - Т.1. - 336с. - Т.2. - 40с.
3. Государственная фармакопея СССР. - 10-е изд. - М.: Медицина, 1968. - 1079с.
4. Государственная фармакопея СССР. - 9-е изд. - М.: Медгиз, - 1961. - 911с.
5. Грецкий В.М., Хоменок В.С. Руководство к практическим занятиям по технологии лекарственных форм. - М.: Медицина, 1991.
6. Кондратьева Т.С., Иванова Л.А. Технология лекарственных форм в 2-х томах. - Т.1. - М.: Медицина, 1991. - 496с.
7. Руководство к лабораторным занятиям по аптечной технологии лекарсвенных форм Т.С. Кондратьева, Л.А. Иванова Ю.И. Зеликсон М. Медицина 1986.
8. Р.Б. Косуба, В.І. Кучер Основи медичної рецептури. м. Чернівці, 2000.
9. Машковський М.Д. Лекарственные средства. - М.: Медицина, 2000. - Т.1-2.
10. Муравъев И.А. Козьмин В.Д. Кудрин А.Н. Несовместимость лекарственных веществ М. Медицина 1978.
11. Муравьев И.А. Технология лекарственных форм. - М.: Медицина, 1988. - 497с.
12. Перцев І.М., Шевченко Л, Д., Чаговець Р.К. Практикум з аптечної технології ліків. - Харків: Прапор, 1995. - 303с.
13. Перцев И.М., Чаговец Р.К. Руководство к лабораторным занятиям по аптечной технологии лекарственных форм. - К.: Вища школа, 1987. - 290с.
14. Півненко Г.П., Чаговець Р.К., Перцев Г.М. Практикум з аптечної технології ліків. - К.: Вища школа, 1972.
15. Синев Д.Н. Гуревич И.Я. Пособие для фармацевтов аптек.М. Медицина 1982
16. Справочник фармацевта. / Под ред. А.И. Тенцовой - 2-е изд. - М.: Медицина, 1981. - 184с.
17. Тихонов О.І., Ярних Т.Г. Аптечна технологія ліків. - Харків: Оригінал, 1995. - 600с.
18. Тихонов О.І., Ярних Т.Г. Аптечна технологія ліків. - Вінниця: Нова книга, 2004. - 638с.
19. Тихонов О.І. Ярних Т.Г. Навчальний посібник з аптечної технології ліків.Х. Основа, 1998.
20. Н-з № 44 від 16.03.93р. Про організацію зберігання в аптечних установах різних груп ЛЗ.
21. Н-з № 96 від 03.04.91р. О контроле качества ЛС, изготовляемых в аптеках.
22. Н-з № 197 від 7.09.93р. Про затвердження інструкції по приготуванню в аптеках ЛФ з рідким дисперсним середовищем.
23. Н-з № 233 від 25.07.97 р. Перелік безрецептурних ЛЗ.
24. Н-з № 275 від 05.05.06 р. “Про затвердження інструкції із санітарно-протиепідемічного режиму аптечних закладів”.
25. Н-з № 276 від 27.09.91р. О нормах отклонения, допустимых при изготовлении ЛС.
26. Н-з № 356 від 18.12.97 р. Про затвердження Порядку обігу наркотичних засобів...
27. Н-з № 360 від 19.07.05 р. Про затвердження правил виписування рецептів та вимог-замовлень на лікарські засоби і вироби медичного призначення, порядку відпуску лікарських засобів і виробів медичного призначення з аптек та їх структурних підрозділів, Інструкції про порядок зберігання, обліку та знищення рецептурних бланків та вимог-замовлень. Зміни до наказу № 360 - наказ № 440 від 04.07.06 р.
28. Н-з № 583 від 19.07.72р. Единственные правила оформления лекарств, изготовляемых в аптеках.
29. Н-з №626 від 15.12. 2004 р. „Про затвердження правил виробництва (виготовлення) ЛЗ в умовах аптеки”.
| Принципи підбору основ для м'яких лікарських форм | |
|
Зміст Зміст. 3 Вступ. 4 1. Основи для приготування лікарських форм для місцевого застосування. 7 2. Вимоги ДФ до основ для мазей. Показники якості 8 3 ... Поліетиленові гелі (наприклад, аеросилу 4 ч., олії вазелінової 84 ч., парафіну 6 ч., поліетилену високого тиску 15 ч.) входять до складу захисних мазей (для захисту шкіри від дії ... Отриманий сплав енергійно змішують з теплим (60 °С) водним розчином натрію лаурилсульфату до одержання однорідної маси. її можна використовувати для виготовлення мазей із ... |
Раздел: Рефераты по медицине Тип: курсовая работа |
| Охорона праці | |
|
КОНСПЕКТ ЛЕКЦІЙ ДЛЯ СТУДЕНТІВ ТЕФ з навчальної дисципліни "БЕЗПЕКА ЖИТТЄДІЯЛЬНОСТІ та ОХОРОНА ПРАЦІ" розділ 2 "ОХОРОНА ПРАЦІ" Розділ 2. ОХОРОНА ПРАЦІ ... Приміщення, де розміщені виробництва з виділенням шкідливих та агресивних речовин (кислоти, луги, ртуть, бензол, сполуки свинцю та ін.), повинні мати стіни, стелю та конструкції ... Посудини з швидкозмінними затворами повинні мати запобіжні пристрої проти включення посудини під тиск при відкритих швидкознімних пристроях і відкривання цього пристрою за ... |
Раздел: Рефераты по безопасности жизнедеятельности Тип: учебное пособие |
| Вода очищена як розчинник в аптечній практиці | |
|
Зміст 1. Характеристика розчинників, які застосовуються для приготування рідких лікарських форм.. 2 2. Вимоги ДФ Х до розчинників. 10 4. Методи ... До 20 мл що залишилася омиленої рідини додають 0,5 мл розчину фенолфталеїну і по краплях соляну кислоту до зникнення червонуватого забарвлення, після чого колбу занурюють на 10 ... Розчини для ін'єкцій для амбулаторних хворих оформляються основною етикеткою синього кольору "Для ін'єкцій" (на ній повинні бути зазначені номер аптеки, склад, спосіб застосування ... |
Раздел: Рефераты по медицине Тип: курсовая работа |
| Технологія і устаткування для переробки бензолу | |
|
ТЕХНОЛОГІЯ Й УСТАТКУВАННЯ ДЛЯ ПЕРЕРОБКИ СИРОГО БЕНЗОЛУ Технологічні схеми і режим переробки сирого бензолу Сирий бензол являє собою багатокомпонентну ... Таким чином, робітник поглинальний розчин повинний містити приблизно 16 г/л А52ПРО3, 12-14 г/л КагСОя, не більш 300 г/л баластових солей, в основному, гипосульфита і роданида ... Щоб уникнути конденсації з газу в розчин пар поды, олій, смолистих речовин поглинальний розчин перед подачею на скрубери підігрівають до 40-42"С. |
Раздел: Промышленность, производство Тип: реферат |
| Вплив структури аліфатичних карбонових кислот та третинних амінів на ... | |
|
... УНІВЕРСИТЕТ ХІМІЧНИЙ ФАКУЛЬТЕТ МАГІСТЕРСЬКА РОБОТА на тему: ВПЛИВ СТРУКТУРИ АЛІФАТИЧНИХ КАРБОНОВИХ КИСЛОТ ТА ТРЕТИННИХ АМІНІВ НА КАТАЛІТИЧНИЙ Вже протягом декількох десятиліть не вгасає інтерес до реакції епіхлоргідрину з органічними кислотами [1-4] з метою отримання оксіхлорпропільних похідних карбонових кислот, які є ... До розчину, що енергійно перемішується, через бічне горло доливають із крапельної воронки 97,4 г брому протягом 30-40 хвилин (температура повинна підтримуватися в межах -5 ° +5°С ... |
Раздел: Рефераты по химии Тип: дипломная работа |