Курсовая работа: Синтез этилового эфира 4-бромбенозойной кислоты
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
«САМАРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Инженерно-технологический факультет
Кафедра органической химии
Спирты,
синтез этилового эфира 4-бромбенозойной кислоты
Курсовая работа
Выполнил студент____курса, _____группы_______________________
(фамилия, имя, отчество)
__________________________
Научный руководитель___________________________
(ученая степень, ученое звание)
___________________________
(фамилия, инициалы)
___________________________
Работа защищена«___»________________200_г.
Оценка____________________
Зав. кафедрой___________________________
(ученая степень, ученое звание)
___________________________
(фамилия, инициалы)
___________________________
САМАРА 200__
Содержание:
1) Введение………………………………………………………………….…3
2) Литературный обзор……………………………………………………….4
2.1) Электронное строение и физико-химические свойства спиртов……….4
2.2) Химические свойства спиртов……………………………………………..7
3) Обсуждение результатов………………………………………………....13
4) Экспериментальная часть………………………………………………..15
5) Выводы………………………………………………………………….....16
6) Список литературы……………………………………………………....17
Введение
Цель работы состоит в составление литературного обзора по спиртам и синтеза этилового эфира 4-бромбензойной кислоты.
Спиртами называются органические вещества, молекулы которых содержат одну или несколько функциональных гидроксильных групп, соединенных с радикалом. Они могут рассматриваться, поэтому как производные углеводородов, в молекулах которых один или несколько атомов водорода заменены на гидроксильные группы.
В зависимости от числа гидроксильных групп спирты подразделяются на одно-, двух-, трехатомные и т. д. Двухатомные спирты часто называют гликолями по названию простейшего представителя этой группы – этиленгликоля (или просто гликоля). Спирты, содержащие большее количество гидроксильных групп, обычно объединяют общим названием многоатомные спирты.
Область применения спиртов обширна. Спирты – древесный, винный и сивушные масла – служили источником для производства ациклических соединений. Простейшие спирты применяются как растворители в лакокрасочном производстве, а высшие спирты, начиная с бутилового, - в виде эфиров фталевой, себациновой и других двухосновных кислот – как пластификаторы.
Из метанола получают формальдегид, из которого готовятся синтетические смолы, используемые в производстве феноло-формальдегидных пластических материалов, служит полупродуктом для производства многих красителей, фармацевтических препаратов, душистых и др. веществ.
Литературный обзор
2.1. Электронное строение и физико-химические свойства спиртов.
Пространственное и электронное строение, длины связей и валентные углы в спирте приведены ниже.
 |
Валентные углы в 109о и 110о указывают на sp3-гибридизацию атома углерода, две не поделенные пары электронов кислорода расположены на sp3-гибридных орбиталях. По сравнению с водой первые потенциалы ионизации спиртов заметно ниже, что указывает на большую доступность НЭП атома кислорода спирта в химической реакции.
![]()
![]()
![]()
![]()
Замена атома
водорода гидроксигруппы на алкильную группу у атома кислорода и увеличение
алкильной группы отчетливо снижает первый потенциал ионизации спирта, повышая
при этом его электродонорные свойства. Молекула спирта в общем характеризуется
3 реакционными центрами:![]() 1) О-Н - связь: реакция с
разрывом О-Н – связи определяют кислотность спирта; 2) НЭП атома кислорода
определяет основность и нуклеофильность молекулы спирта; 3) С-О – связь: Разрыв
этой связи характерен для реакции нуклеофильного замещения.
1) О-Н - связь: реакция с
разрывом О-Н – связи определяют кислотность спирта; 2) НЭП атома кислорода
определяет основность и нуклеофильность молекулы спирта; 3) С-О – связь: Разрыв
этой связи характерен для реакции нуклеофильного замещения.
Физические свойства спиртов существенно зависят от строения углеводородного радикала и положения гидроксильной группы. Первые представители гомологического ряда спиртов – жидкости, высшие спирты – твердые вещества.
Метанол, этанол и пропанол смешиваются с водой во всех соотношениях. С ростом молекулярной массы растворимость спиртов в воде резко падает, так, начиная с гексилового, одноатомные спирты практически нерастворимы. Высшие спирты не растворимы в воде. Растворимость спиртов с разветвленной структурой выше, чем у спиртов с имеющих неразветвленное, нормальное строение. Низшие спирты обладают характерным алкогольным запахом, запах средних гомологов сильный и часто неприятный. Высшие спирты практически не имеют запаха. Третичные спирты обладают особым характерным запахом плесени.
Низшие гликоли – вязкие бесцветные жидкости, не имеющие запаха; хорошо растворимы в воде и этаноле, обладают сладким вкусом.
С введением в молекулу второй гидроксильной группы происходит повышение относительной плотности и температуры кипения спиртов. Например, плотность этиленгликоля при 0°С – 1,13, а этилового спирта – 0,81.
Спирты обладают аномально высокими температурами кипения по сравнению со многими классами органических соединений и чем можно ожидать на основании их молекулярных весов (Табл.1).
Таблица 1.
Физические свойства спиртов.
| Отдельные представители | Физические свойства | ||
| название | структурная формула | т. пл., °С | т. кип., °С |
| Одноатомные | |||
| Метанол (метиловый) | СН3ОН | -97 | 64,5 |
| Этанол (этиловый) | СН3СН2ОН | -115 | 78 |
| Двухатомные | |||
| Этандиол-1,2 (этиленгликоль) | НОСН2СН2ОН | -17 | 199 |
| Трехатомные | |||
| Пропантриол-1,2,3 (глицерин) | НОСН2СН(ОН)СН2ОН | 20 | 290 |
Это объясняется особенностями строения спиртов – с образованием межмолекулярных водородных связей по схеме:

Спирты разветвленной структуры кипят ниже, чем нормальные спирты того же молекулярного веса; первичные спирты кипят выше вторичных и третичных их изомеров.
Способы получения:
1) Гидротация алкенов
Алкены присоединяют воду
в присутствие кислот![]() или гетерогеного катализатора
(например
или гетерогеного катализатора
(например ![]() )
)

2) Гидроборирование алкенов:
Гидроборирование алкенов и последующее окисление ведут к получению спиртов. При этом присоединение гидроксигруппы идет против правила Марковникова. Реакция протекает по двойной углерод-углеродной связи:
![]()
3) Гидролиз галогенпроизводных алканов:
Дейтсвием водны или растворов щелочи многие галогенпроизводные образуют спирты
![]()
4)Взаимодействие реактивов Гриньяра с карбонильными соединениями:
Синтезы на основе реактивов Гриньяра или литийорганических соединений
![]()
5) Восстановление карбонильных соединений:
Альдегиды, кетоны, сложные эфиры карбоновых кислот хорошо восстанавливаются до спиртов


![]()
![]()
![]()
![]()
Сложные эфиры восстанавливают так же по реакции Буво-Блана, нагревая их с натрием в этаноле

![]()
![]()
![]()
2.2. Химические свойства спиртов.
Как у всех кислородосодержащих соединений, химические свойства спиртов определяются, в первую очередь, функциональными группами и, в известной степени, строением радикала.
Характерной особенностью гидроксильной группы спиртов является подвижность атома водорода, что объясняется электронным строением гидроксильной группы. Отсюда способность спиртов к некоторым реакциям замещения, например, щелочными металлами. С другой стороны, имеет значение и характер связи углерода с кислородом. Вследствие большой электроотрицательности кислорода по сравнению с углеродом, связь углерод-кислород также в некоторой степени поляризована с частичным положительным зарядом у атома углерода и отрицательным – у кислорода. Однако, эта поляризация не приводит к диссоциации на ионы, спирты не являются электролитами, а представляют собой нейтральные соединения, не изменяющие окраску индикаторов, но они имеют определенный электрический момент диполя [3,4].
Спирты являются амфотерными соединениями, то есть могут проявлять как свойства кислот, так и свойства оснований.
1.2.1. Взаимодействие спиртов с щелочными металлами.
Спирты как кислоты взаимодействуют с активными металлами (K, Na, Ca). При замещении атома водорода гидроксильной группы металлом образуются соединения, называемые алкоголятами (от названия спиртов – алкоголи):
|
|
Названия алкоголятов производят от названий соответствующих спиртов, например,
![]() 2С2Н5ОН + 2Na 2С2Н5 – ONa + H2
2С2Н5ОН + 2Na 2С2Н5 – ONa + H2
|
|||
|
Низшие спирты бурно реагируют с натрием. С ослаблением кислотных свойств у средних гомологов реакция замедляется. Высшие спирты образуют алкоголяты лишь при нагревании [4].
Алкоголяты легко гидролизуются водой:
![]() С2Н5 – ONa + HОН
С2Н5 - ОН + NaОН
С2Н5 – ONa + HОН
С2Н5 - ОН + NaОН
Этиловый спирт
В отличие от спиртов, алкоголяты – твердые вещества, хорошо растворимые в соответствующих спиртах [1].
Известны алкоголяты и других металлов, кроме щелочных, но они образуются косвенными путями. Так, щелочноземельные металлы непосредственно со спиртами не реагируют. Но алкоголяты щелочноземельных металлов, а также Mg, Zn, Cd, Al и других металлов, образующих реакционноспособные металлоорганические соединения, можно получить действием спирта на такие металлоорганические соединения.
1.2.2. Замещение гидроксильной группы спирта галогеном.
Гидроксильная группа спиртов может быть замещена на галоген действием на них галогенводородных кислот, галогенных соединений фосфора или тионилхлорида, например:
![]() R – OH + HCl RCl + HOH
R – OH + HCl RCl + HOH
|
|
Данная реакция протекает с расщеплением ковалентной связи, что можно представить равенством
![]()
|
|
|
|
Скорость этой реакции возрастает от первичных к третичным спиртам, причем она также зависит от галогена: наибольшей она является для иода, наименьшей – для хлора.
1.2.3. Дегидратация спиртов (отщепление воды).
В зависимости от условий дегидратации образуются олефины или простые эфиры.
Олефины (этиленовые углеводороды) образуются при нагревании спирта (кроме метилового) с избытком концентрированной серной кислоты, а также при пропускании паров спирта над окисью алюминия при 350° - 450°. При этом происходит внутримолекулярное отщепление воды, то есть Н+ и ОН – отнимаются от одной и той же молекулы спирта, например:
|
|
![]() СН3-СН2-СН2ОН
СН3-СН=СН2+Н2О
СН3-СН2-СН2ОН
СН3-СН=СН2+Н2О
Простые эфиры образуются при осторожном нагревании избытка спирта с концентрированной серной кислотой. В этом случае происходит межмолекулярное отщепление воды, то есть Н+ и ОН – отнимаются от гидроксильных групп разных молекул спирта, как это показано на схеме:
|
|
|
![]() 2С2Н5ОН С2Н5-О-С2Н5+Н2О
2С2Н5ОН С2Н5-О-С2Н5+Н2О
Первичные спирты дегидратируются труднее вторичных, легче отнимается молекула воды от третичных спиртов [5].
1.2.4. Дегидрогенизация спиртов и окисление.
Образование разных продуктов в реакциях дегидрогенизации и окисления является важнейшим свойством, позволяющим отличить первичные, вторичные и третичные спирты.
При пропускании паров первичного или вторичного, но не третичного спирта над металлической медью при повышенной температуре происходит выделение двух атомов водорода и первичный спирт превращается в альдегид, вторичные спирты дают в этих условиях кетоны.
|
|
|
|
третичные спирты в тех же условиях не дегидрируются.
Такое же различие проявляют первичные и вторичные спирты при окислении, которое можно проводить "мокрым" путем, например, действием хромовой кислоты, или каталитически, причем катализатором окисления служит также металлическая медь, а окислителем кислород воздуха:
RCH2OH + O ® R-COH + H2O
 |
 |
CHOH + O ® C=O + H2O
1.2.5. Замещение гидроксильной группы спирта водородом.
Спирты устойчивы к действию химических восстановителей. Они не восстанавливаются и водородом над катализатороми. Поэтому спирты применяют в качестве растворителей или доноров при восстановлении других соединений.
Метод непрямого восстановления спиртов действием йодистоводородной кислоты:
![]()
1.2.6 Окисление.
Окисление первичных спиртов в альдегиды и вторичных спиртов в кетоны является одним из важнейших превращений функциональных групп и оценкой избирательного действия реагента, используемого в качестве окислителя.

Третичные спирты не окисляются, а в жестких условиях окисление сопровождается деструкцией углеродного скелета. Наиболее широкое применение для окисления спиртов нашли реагенты на основе переходных металлов - хрома (VI), марганца (VII), марганца (IV).
1.2.7 Образование сложных эфиров спиртов .
Механизм реакции этерификации:
1) Присоединение протона, образование гидроксониевого иона:

2) Катион взаимодействует с молекулой спирта по не поделенной электронной паре атома кислорода, образуя оксониевый ион:

3) Происходит перегруппировка оксониевого иона:

4) Оксониевый ион последовательно выделяет молекулу воды и протон, давая сложный эфир:

При действии кислородных минеральных и органических кислот на спирты образуются сложные эфиры, например,
![]() С6Н5ОН+СН3СООН
С6Н5СООСН3+Н2О
С6Н5ОН+СН3СООН
С6Н5СООСН3+Н2О
 |
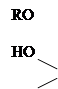 |
ROH + SO2 SO2+H2O
Такого рода взаимодействие спирта с кислотами называется реакцией этерификации. Скорость этерификации зависит от силы кислоты и природы спирта: с увеличением силы кислоты она возрастает, первичные спирты реагируют быстрее вторичных, вторичные спирты – быстрее третичных. Этерификация спиртов карбоновыми кислотами ускоряется при добавлении сильных минеральных кислот. реакция обратима, обратная реакция называется гидролизом. Сложные эфиры получаются также при действии на спирты галогенангидридов и ангидридов кислот.
Превращение одного сложного эфира в другой под действием соответствующего спирта в присутствии катализатора (кислоты или основания) называют переэтерефикацией.

![]()
Хотя реакция обратимая, равновесие можно смещать, например, отгонять низкокипящий спирт (чаще метанол, этанол).
Обсуждение результатов
Получение этилового эфира 4-бромбензойной кислоты возможно:
1) Ацилированием спиртов с хлорангидридами кислот:

Данная реакция протекает необратимо в отличие от реакции этерификации. Но, для того чтобы провести синтез, необходима дополнительная реакция получения хлорангидрида кислоты. Так как реакция протекает бурно, отвод тепла труден.
2) Ацилирование спиртов ангидридами кислот:

Синтез можно проходит без введения катализатора, но также требуется дополнительная реакция для получения ангидрида 4-бромбензойной кислоты.
3) Реакция Вильямсона:

Этот синтез тоже требует дополнительной реакции для получения калиевой соли кислоты.
4) Реакция переэтерефикации (алкоголиз сложных эфиров):

Применяется в случае спиртов, которые имеют разветвленный углеродный скелет, так как в процессе реакции получается большое число побочных продуктов.
5) Реакция этерефикации:

Реакция 4-бромбензойной кислоты с этиловым спиртом в присутствии кислоты наиболее проста в технологическом использование, хотя и обратима.
Экспериментальная часть
Реактивы:
4-бромбензойная
кислота М.м.=202, ![]() ,“пушистое” белое вещество;
,“пушистое” белое вещество;
этиловый
спирт(95%) М.м.=46,1, ![]() ,
, ![]() ,
, ![]() ;
;
серная кислота(d=1.84) М.м.=98.08, ![]() ,
, ![]() ,
, ![]()
Схема прибора:

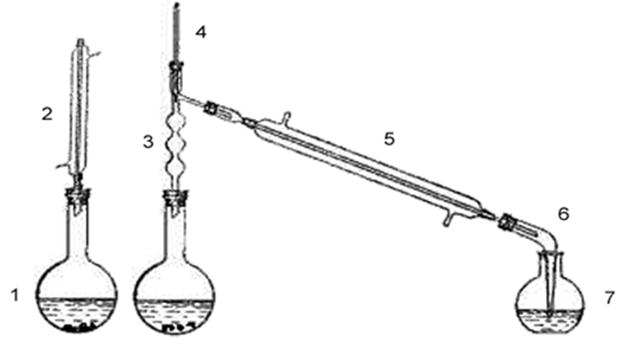
1- Круглодонная колба на 50 мл.
2- Обратный холодильник
3- Дефлегматор
4- Термометр
5- Нисходящий холодильник
6- Алонж
7- Приемник
8- Делительная воронка
Описание хода синтеза:
В круглодонную колбу на 50 мл. помещаем 4-бромбензойную кислоту 4г., этиловый спирт 25 мл., серную кислоту 1мл. Смесь нагревам на воздушной бане с обратным холодильником. Затем заменяем обратный холодильник на нисходящий и полно отгоняем избыток спирта. Остаток выливаем в 20 мл. холодной воды и нейтрализуем углекислым натрием. Затем отделяем при помощи делительной воронки эфирный слой и сушим его хлористым кальцием.
Выход продукта: m=2.8 г., 70 %
Этиловый эфир 4-бромбензойной кислоты
М.м.=230
![]()
![]() мм.рт.ст.
мм.рт.ст.
РФ эфира 0,8(дихлорэтан)
РФ кислоты 0,05(дихлорэтан)
Выводы:
В ходе проведенной курсовой работы:
1) Собран и обобщен литературный обзор по теме “химические свойства и синтез спиртов”
2) Проведены реакции и наработаны образцы:
по реакции этерификации получен этиловый эфир 4-бромбензойной кислоты
![]() и выход 70 %
и выход 70 %
Список литературы
1. Глинка Н.Л. Общая химия. – Л.: Химия, 1978. – 720 с.
2. В.Ф. Травень Органическая химия 1,2. – В.: ИКЦ «Академкнига», 2004. –583 с.
3. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – СПб.: «Иван Федоров», 2002. – 624 с.
4. http://www.chemnet.ru/ - «Портал химического образования России.»
5. http://ru.wikipedia.org/- «Портал химии»
| Физиология растений | |
|
Куниченко Наталья Александровна, кандидат сельскохозяйственных наук, доцент, заведующая кафедрой защиты растений и экологии Приднестровского ... В глиоксилатном цикле ацетилКоА, также как и в цикле Кребса, вступает в реакцию с щавелевоуксусной кислотой, образуя лимонную кислоту, но в цепи дальнейших превращений разлагается ... При этом процесс окисления начинается с декарбоксилирования жирной кислоты под действием пероксидазы и при участии перекиси водорода, в результате образуется альдегид, содержащий ... |
Раздел: Рефераты по биологии Тип: учебное пособие |
| Химический состав молока | |
|
ВВЕДЕНИЕ Химия и физика как наука начала свой отсчет в прошлом веке, в тот период она начинала с изучения химического состава молока. В нашей стране ... Далее пировиноградная кислота превращается в конечные продукты брожения - масляную кислоту, пропион, уксусы, масляные, спирт и др. соединения. Первые образуют в основном молочную кислоту (более 90%) и незначительное количество побочных продуктов. Гетероферментативные бактерии около 50% глюкозы превращают в молочную ... |
Раздел: Биология и химия Тип: курсовая работа |
| Синтез изобутилового эфира уксусной кислоты реакцией этерификации | |
|
Федеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования Самарский государственный ... Однако в тех случаях, когда большие количества серной кислоты не оказывают влияния на карбоновую кислоту, из которой получают эфир, эту кислоту, метиловый спирт и серную кислоту ... Следовательно, в молекуле кислоты разрывается связь между ацилом и гидроксилом, а в молекуле спирта - связь водорода с кислородом. |
Раздел: Рефераты по химии Тип: курсовая работа |
| Органическая химия | |
|
Контрольная работа №1 1 Приведите проекционные формулы оптических изомеров соединений Определите, число изомеров и укажите, какие из них являются ... Большинство органических соединений можно рассматривать как кислоты, поскольку в них содержатся поляризованные связи атома водорода с различными элементами (О, N, S, С ... В качестве растворителя при кристаллизации наиболее часто применяют воду, этиловый спирт, метиловый спирт, бензин, бензол, петролейный эфир, этиловый эфир, уксусноэтиловый эфир ... |
Раздел: Рефераты по химии Тип: контрольная работа |
| Лекарственные вещества, угнетающие центральную нервную систему | |
|
ОМСКИЙ ГОСУДАРСТВЕННЫЙ ИНСТИТУТ ВЕТЕРИНАРНОЙ МЕДИЦИНЫ Реферат по ветеринарной фармакологии тема: "Лекарственые вещества, угнетающие центральную ... Препарат, состоящий из этилового эфира с-бромизовалериановой кислоты (2%), фенобарбитала (1,82%), натрия едкого (2-3%), масла перечной мяты (0,14%), воды и спирта (до 100%) Замещение одного водорода в бензоле гидроксильной группой ведет к появлению новых свойств соединения, одним из которых является про-тиволихорадочное действие. |
Раздел: Рефераты по медицине Тип: курсовая работа |