Контрольная работа: Скорость химических реакций. Катализ и химическое равновесие
По химии
Скорость химических реакций. Катализ и химическое равновесие
Цель работы
1) ознакомление с основными закономерностями протекания химических реакций и факторами, влияющими на скорость реакции;
2) ознакомление с катализаторами, химическим равновесием и факторами, влияющими на химическое равновесие.
І. Скоростью реакции называется число актов химического взаимодействия, происходящих в единицу времени в единице объёма при гомогенных процессах или на единице поверхности при гетерогенных процессах.
![]()
О средней скорости химической реакции судят по изменению молярной концентрации реагирующих веществ за определённый интервал времени:
![]() ,
,
где ![]() -
средняя скорость химической реакции; c1 – молярная концентрация вещества в момент τ1,
c2 – молярная концентрация вещества в момент τ2.
Истинной скоростью химической реакции в данный момент называется первая
производная концентрации по времени:
-
средняя скорость химической реакции; c1 – молярная концентрация вещества в момент τ1,
c2 – молярная концентрация вещества в момент τ2.
Истинной скоростью химической реакции в данный момент называется первая
производная концентрации по времени:
![]() .
.
В гомогенной системе скорость химической реакции зависит от природы реагирующих веществ, их концентрации, температуры, наличия катализатора, присутствия примесей и природы растворителя.
В гетерогенной системе взаимодействие осуществляется на поверхности раздела реагирующих веществ, поэтому зависит от диффузии вещества к поверхности (диффузионный режим), а если диффузия не влияет на скорость реакции (кинетический режим), то при прочих равных условиях увеличение поверхности раздела повышает скорость гетерогенной химической реакции.
Зависимость скорости реакции от концентрации определяется законом действующих масс (закон Гульдберга-Вааге):
если химическая реакция идёт в соответствии со стехиометрическим уравнением, то скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции записанной в общем виде, т.е.: nA+mB→qR+pD,
скорость реакции в соответствии с законом действующих масс выразится следующим образом:
(1): ![]() .
.
Здесь [A] и [B] – молярные концентрации реагирующих веществ в данный момент времени;
n и m - стехиометрические коэффициенты при реагирующих веществах. Например, для реакции:
![]()
прямая и обратная скорости:
![]()
На практике приходится иметь дело со сложными процессами, состоящими не из одной, а из множества простых стадий, называемых элементарными актами, для каждой из которых можно записать своё выражение для скорости на основании закона действующих масс. В таком случае число молекул, участвующих в элементарном акте, определяет молекулярность взаимодействия. Для приведённого выше примера прямая реакция тримолекулярна, а обратная бимолекулярна.
В большинстве случаев показатели степени при концентрациях в уравнении закона действующих масс отличаются от числа молекул в уравнении реакции. Это происходит оттого, что уравнение реакции отражает лишь общий итог процесса. Показатели m и n в математическом уравнении (1) называют в таком случае порядком реакции по каждому из реагирующих веществ A или B, а их сумму (m+n) – общим порядком реакции. В каждом конкретном процессе в зависимости от условий может быть различный порядок реакции.
Коэффициент k называется константой скорости реакции и зависит от природы реагирующих веществ, температуры и катализатора. Численно константа скорости химической реакции равна скорости реакции при концентрациях реагирующих веществ, равных 1 моль/л. Однако реакции идут, как правило, по отдельным стадиям и общую скорость процесса определяет наиболее медленно развивающаяся стадия. Поэтому показатели степеней при концентрациях реагирующих веществ не совпадают с их стехиометрическими коэффициентами, а концентрации некоторых из реагирующих веществ вообще могут не входить в выражение скорости химических реакций.
Зависимость константы скорости реакции от температуры может быть выражена уравнением Аррениуса:
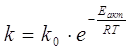 ,
,
где Eакт – энергия активации;
k – константа скорости;
T – температура, К;
k0 – константа;
R – газовая постоянная.
Энергией активации называется то количество энергии, которое надо сообщить молю реагирующих веществ для приведения его в реакционноспособное состояние. Энергия активации в реакции не исчезает и увеличивает тепловой эффект реакции.
При низких температурах можно считать, что скорость реакции возрастает при нагревании на 10˚ в 2…4 раза (правило Вант-Гоффа):
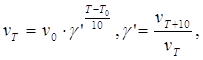
здесь γ΄ - температурный коэффициент Вант-Гоффа.
ІІ. Катализатором называется вещество, изменяющее скорость химической реакции, но в результате её само остающееся химически неизменным.
Каталитические процессы сводятся к двум типам: гомогенному и гетерогенному. При гомогенном катализе реагирующие вещества и катализатор составляют однофазную систему. При гетерогенном катализе реагирующие вещества и катализатор составляют систему из двух фаз, и каталитический процесс протекает на границах раздела. Скорость взаимодействия в этом случае пропорциональна поверхности раздела фаз.
Все химические реакции можно разделить на необратимые, направление которых не зависит от внешних условий, и обратимые, направление которых может изменяться в зависимости от температуры, концентрации и давления. Большинство реакций обратимо. Они протекают одновременно в двух направлениях, так как во всякой реакции по мере образования продуктов реакции возникает возможность взаимодействия между ними с образованием исходных веществ.
Рассмотрим обратимую реакцию в общем виде: aA+bB↔cC+dD.
Применив закон действующих масс к прямой и обратной реакциям, получим:
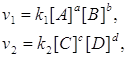 (2)
(2)
где v1 и v2 – скорости прямой и обратной реакций.
По мере протекания реакции концентрация исходных веществ уменьшается, и скорость прямой реакции уменьшается, а скорость обратной увеличивается вследствие увеличения концентрации полученных веществ.
Через некоторое время наступает состояние, когда скорость обратного процесса становится равной скорости прямого: v1=v2.
Состояние, при котором скорость
прямой реакции равна скорости обратной, называется химическим равновесием, а концентрации всех четырёх веществ
– равновесными концентрациями. Тогда из соотношений (2) имеем: ![]()
Отсюда следует
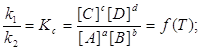 (3)
(3)
k1 и k2 для данной реакции при одной и той же температуре являются величинами постоянными, а значит, их отношение постоянно: Kc – величина постоянная и называется константой равновесия. Для реакций между газообразными веществами вместо концентраций можно использовать парциальные давления газов в смеси. При этом константу равновесия обозначают через Kp. Если концентрации выражены в мольных долях, то константа равновесия обозначается через KN. Между Kc, Kp и KN существуют следующие зависимости:
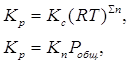
где ∑n – алгебраическая сумма стехиометрических коэффициентов. Константа равновесия зависит от температуры и природы реагирующих веществ, но не зависит от катализатора, так как последний ускоряет и прямую, и обратную реакции.
Уравнение (3) вытекает из закона действующих масс для обратимых реакций. Его можно сформулировать так: Отношение произведения равновесных концентраций в степени их стехиометрических коэффициентов есть величина, постоянная при данной температуре.
Смещение равновесия в зависимости от изменения концентраций реагирующих веществ, температуры, давления (в случае газовых реакций) в общем случае определяется правилом Ле-Шателье: если в системе, находившейся в равновесии, изменить одно из условий (t, p, c), то происходит смещение равновесия в направлении той реакции, которая препятствует произведённому изменению.
Применяя принцип Ле-Шателье к разным случаям, можно сделать следующие выводы:
1) при увеличении равновесной концентрации одного из веществ система химического равновесия смещается в сторону той реакции, которая понижает концентрацию этого вещества;
2) при увеличении давления равновесие смещается в сторону образования меньшего числа молекул газа;
3) нагревание смещает равновесие в сторону эндотермической реакции, охлаждение – в сторону экзотермической реакции.
Практическая часть
Скорость химических реакций в гомогенной системе изучается на примере взаимодействия растворов серной кислоты и серноватистокислого натрия (тиосульфата):
Na2S2O3 + H2SO4 → Na2SO4 + S↓ + SO2↑ + H2O
Сера, выделяющаяся в тонкораздробленном состоянии, даёт помутнение раствора. Момент исчезновения из поля зрения линеек или шрифта на бумаге, подложенной под стакан с реагирующим веществом, соответствует выделению определённого количества серы. Так как степень помутнения зависит от толщины слоя, то все опыты следует проводить в одном и том же стакане, чтобы объём жидкости и соответственно высота слоя были одинаковы.
Время, необходимое для выделения данного количества серы обратно пропорционально средней скорости процесса. Началом реакции считаем момент смешения растворов, условным концом реакции – выделение одного и того же количества серы.
Опыт 1. Зависимость скорости реакции от температуры
В ходе опыта смешали 20 мл раствора 0,5%-ного раствора серной кислоты и 20 мл 0,5%-ного раствора серноватистокислого натрия, предварительно измерив температуру растворов. Стаканчик со смесью был поставлен на лист линованной бумаги. В результате реакции: Na2S2O3 + H2SO4 → Na2SO4 + S↓ + SO2↑ + H2O наблюдалось помутнение смеси. Был отмечен отрезок времени до условного окончания процесса.
Затем опыт был проделан ещё два раза, но температура растворов была поднята на 10˚C и 20˚C относительно первоначальной. Результаты измерений занесены в таблицу 1.
Табл. 1.
| № опыта | Температура растворов, ˚C |
V(H2SO4), мл |
V(Na2S2O3), мл |
Время, с |
Условная скорость реакции |
| 1 | 20 | 20 | 20 | 90 | 1,11 |
| 2 | 30 | 20 | 20 | 20 | 5 |
| 3 | 40 | 20 | 20 | 10 | 10 |
По данным таблицы можно рассчитать температурный коэффициент Вант-Гоффа для данных реакций:
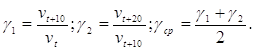
![]() ;
;
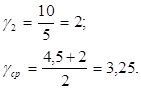
Вывод: Температурный коэффициент Вант-Гоффа для реакции разложения пероксида водорода равен 3,25.
Опыт 2. Зависимость скорости химической реакции от концентрации реагирующих веществ при постоянной температуре
В один стаканчик налили 10 мл 0,5%-ного раствора серной кислоты. В другой налили 10 мл раствора серноватистокислого натрия и 20 мл дистиллированной воды. К раствору кислоты одновременно прилили воду и раствор соли и отметили по часам продолжительность опыта. Далее опыт был повторен с изменением концентрации соли: 20 мл раствора на 10 мл воды, 30 мл раствора соли.
Результаты измерений занесены в таблицу 2.
Табл. 2.
| № опыта |
H2SO4, мл |
Na2S2O3, мл |
H2O, мл |
Время, с |
Усл. скорость реакции v |
| 1 | 10 | 10 | 20 | 110 | 0,909 |
| 2 | 10 | 20 | 10 | 50 | 2 |
| 3 | 10 | 30 | - | 35 | 2,857 |
По данным измерений можно определить порядок реакции n по скоростям, соответствующим двум различным концентрациям (метод Вант-Гоффа).
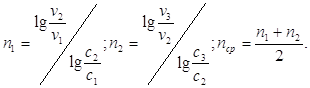
В результате вычислений получилось:
n1 = 1,1375; n2 = 0,8797; nср = 1,008 ≈ 1.
Вывод: порядок реакции n по скоростям, соответствующим двум концентрациям близок к 1.
Опыт 3. Скорость химических реакций в гетерогенных системах
В две пробирки налили соляную кислоту. Затем в одну из них положили кусочек мрамора, а в другую – такой же кусочек, растёртый в порошок. В обеих пробирках проходила реакция:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑.
Наблюдалось выделение газа. В пробирке, в которую был насыпан порошок, реакция проходила быстрее. Это объясняется тем, что площадь поверхности, на которой происходило взаимодействие веществ, была больше, чем в пробирке с цельным кусочком мрамора.
Вывод: в гетерогенных системах скорость реакции зависит от площади поверхности реагирующих веществ.
Опыт 4. Гетерогенный катализ.
а) Разложение пероксида водорода H2O2 происходит и при комнатной температуре, но довольно медленно:
H2O2 → H2O + ½O2.
Процесс разложения можно ускорить введением катализатора MnO2.
В 2 мл 3%-ного раствора H2O2 всыпали щепотку оксида марганца (IV). Скорость реакции существенно возросла, наблюдалось бурное выделение пузырьков газа.
б) В пробирку налили серной кислоты, прилили раствор перманганата калия KMnO4. Полученную смесь разделили по трём пробиркам поровну. В каждую пробирку опустили по кусочку гранулированного цинка. В первую пробирку добавили несколько кристаллов KNO3, во вторую – в 2-3 раза большее количество нитрата калия, третью оставили для сравнения.
Наиболее быстро обесцвечивание раствора происходило во второй пробирке, в первой обесцвечивание проходило медленнее, в третьей – обесцвечивание было малозаметным. Аналогичным образом происходило и выделение пузырьков газа.
2KMnO4 + 3H2SO4 + 2Zn → ZnSO4 + K2SO4 + MnSO4 + 3H2↑
![]()
Вывод: MnO2 – катализатор в реакции разложения перекиси водорода. KNO3 – катализатор во взаимодействии цинка, серной кислоты и перманганата калия.
Опыт 5. Гомогенный катализ. В предыдущем опыте реакцию разложения пероксида водорода ускоряли гетерогенным катализатором – твёрдым оксидом марганца MnO2.
H2O2 → H2O + ½O2.
Эта реакция ускоряется также при помощи гомогенного катализатора – комплексного иона – тетра-аммиаката меди [Cu(NH3)4]2+. Этот катализатор является комплексным, поэтому необходимо исследовать влияние составляющих его компонентов – иона меди и аммиака. С этой целью в одну пробирку нужно налить 2 мл раствора CuSO4 и 0,5 мл H2O2, во вторую – 2 мл водного раствора аммиака и 0,5 мл H2O2. В обеих пробирках наблюдается образование мелких пузырьков кислорода в результате слабого каталитического действия составляющих комплексное соединение компонентов.
В третью пробирку необходимо прилить 2 мл раствора CuSO4 и добавить водного раствора аммиака до появления комплексного соединения темно-синего цвета:
CuSO4 + 4NH3∙H2O → 4H2O + [Cu(NH3)4]SO4.
К полученному раствору катализатора нужно прилить 2 мл 3%-ного H2O2. Именно в третьей пробирке будет наблюдаться наиболее интенсивное выделение газа. При этом можно заметить, что катализатор во время реакции не расходуется, а лишь ускоряет течение процесса.
Вывод: [Cu(NH3)4]SO4 также является катализатором при разложении пероксида водорода.
Опыт 6. Сдвиг химического равновесия в гомогенной системе.
Влияние концентрации исходных веществ и продуктов реакции на химическое равновесие в гомогенной системе можно исследовать на примере реакции:
FeCl3 + 3NH4CNS ↔ Fe(CNS)3 + 3NH4Cl.
Смешаем в пробирке несколько миллилитров хлорида железа (III) и цианида аммония.
В результате содержимое пробирки окрашивается в тёмно-красный цвет. Полученную смесь разделили на 4 пробирки.
В первую добавили 2-3 капли роданистого аммония. Во вторую прилили немного концентрированного раствора хлорида железа (III). В третью всыпали немного кристаллического хлорида аммония и энергично встряхнули. Изменения цвета отмечены в таблице 3.
Табл. 3.
| Номер пробирки | Добавленное вещество | Изменение цвета раствора | Сдвиг равновесия |
| 1 |
NH4CNS |
темнеет |
→ |
| 2 |
FeCl3 |
не меняется |
- |
| 3 |
NH4Cl (тв.) |
светлеет |
← |
В первой пробирке vпр > vобр, во второй - vпр = vобр, в третьей - vпр < vобр.
По реакции с добавлением NH4CNS роданид железа образуется, что приводит к увеличению его концентрации и потемнению раствора, по реакции с добавлением NH4Cl (тв.) роданид железа расходуется, что приводит к уменьшению его концентрации и осветлению раствора.
NH4CNS сдвигает равновесие в сторону прямой реакции, а NH4Cl (тв.) в сторону обратной.
Выражение для константы химического равновесия:
![]()
Вывод: добавление цианида аммония сдвигает химическое равновесие в сторону прямой реакции, твёрдого хлорида аммония – в сторону обратной реакции, хлорида железа (III) не влияет на химическое равновесие.
Опыт 7. Влияние температуры на химическое равновесие
В пробирку налили 2 мл раствора аммиака и добавили 2 капли фенолфталеина. Пробирку нагрели. В результате изменения температуры раствор посветлел. Из-за повышения температуры часть раствора аммиака испарилась, следовательно, его концентрация уменьшилась. Нагревание сдвинуло равновесие в сторону обратной реакции.
Вывод: Нагревание сдвинуло химическое равновесие в сторону обратной реакции.
Осн овные выводы:
В результате проделанных опытов мы убедились в том, что на скорость химических реакций оказывают влияние множество факторов, таких как температура, давление, концентрация реагирующих веществ, наличие катализатора, площадь поверхности и т.д. Кроме того, вышеперечисленные факторы способны влиять на смещение химического равновесия в сторону прямой или обратной реакции.
1. Составить уравнения скоростей реакций:
2N2O3 + O2 ↔ 2N2O4;
vпр =k1a2b; vобр =k2c2.
2Me + O2 → 2MeO;
v =k·a2b.
2. Как изменится скорость реакции CO +H2O → CO2 + H2, протекающей в закрытом сосуде при T=313˚С, если давление увеличить в четыре раза.
Решение:
увеличение давления в 4 раза равносильно увеличению молярных концентраций веществ в 4 раза.
v1 = k·(4a)(4b)=16v.
Скорость реакции возрастёт в 16 раз.
3. Реакция окисления NO выражается следующим уравнением:
2NO + O2 → 2NO2.
Начальная концентрация NO равна 0,3 моль/л, а кислорода – 0,15 моль/л. Как изменится скорость реакции, если увеличить концентрацию NO до 1,2 моль/л, а кислорода – до 0,6 моль/л.
Решение:
Скорость реакции до изменения параметров:
v1 = k (0,3)2(0,15) = 0,0135.
Скорость реакции после изменения параметров:
v2 = k(1,2)2(0,6) = 0,864.
v2/v1 = 64.
Скорость реакции возрастёт в 64 раза.
4. При нагревании водорода и йода в закрытом сосуде до 444˚С обратимо протекает реакция по уравнению H2 + I2 ↔ 2 HI.
Равновесная смесь при этой температуре содержит 5,64 моль HI, 0,12 моль I2 и 5,28 моль H2. Вычислим константу равновесия реакции и исходные концентрации водорода и йода.
Решение:
Так как реакция проходит в закрытом сосуде, можно записать:
с1:c2:c3 = N1:N2:N3.
![]()
По закону сохранения массы:
0,12 моль·2 г/моль + 5,28 моль·254 г/моль +5,64 моль·2·128 г/моль = X·2 г/моль +Y·254 г/моль.
0,12/X=5,28/Y,
где X – количество водорода, Y – количество йода.
Решив систему уравнений, получим:
X=0,25 моль, Y=10,96 моль.
Концентрации соответственно равны 0,25 моль/л и 10,96 моль/л.
5. Константа равновесия реакции
CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O
при некоторой температуре равна 4. Определить состав смеси при равновесии, если в реакцию введены 1 моль кислоты и 2 моль спирта.
На основании закона сохранения массы:
60 г/моль·1 моль+ 34 г/моль·2 моль = 60 г/моль·A моль + 34 г/моль·2·B моль + 88 г/моль·C моль+18 г/моль·D моль, где А, В, С, D – количества веществ после реакции.
На основании данных задачи:
4 = AB/CD; B =2A;
88/C = 18/D.
Решив систему уравнений, получим:
A = 0,6 моль; B = 1,2 моль; C = 1,34 моль; D = 0,274 моль.
Ответ: 0,6 моль CH3COOH, 1,2 моль C2H5OH, 1,34 моль CH3COOC2H5, 0,274 моль H2O.
6. Константа равновесия Kp реакции синтеза аммиака
N2 + 3H2 ↔ 2NH3
при 350˚С равна 2,32·1013. Вычислить Kc при этой температуре.
Решение:
T = 623 K;
Kc = Kp/(RT)6 = 2,32·1013/(8,314·623)6 = 1,2·10-9.
Ответ: Kc = 1,2·10-9.
7. При 550˚С и 1,01325·105 Па степень диссоциации фосгена на оксид углерода и хлор равна 77%. Реакция протекает по уравнению
COCl2 ↔ CO +Cl2.
Определить Kp и Kc, если исходная концентрация фосгена 1 кмоль/м3.
Решение:
T = 823 K.
После реакции концентрация фосгена стала равной 0,23 кмоль/м3, а концентрации углекислого газа и хлора стали равными 0,77 кмоль/м3.
Следовательно, Kp = (0,23 + 0,77 + 0,77)· 1,01325·105 = 1,79·105;
Kc = Kp/(8,314·823)3 = 5,59·10-7.
Ответ: Kc = 5,59·10-7; Kp = 1,79·105.