Реферат: Спектральные методы анализа
Спектральные методы анализа. Спектры, способы их получения, особенности, классификация и использование для аналитических целей. Основные элементы спектральных приборов и их назначение
Спектральные методы анализа - это методы, основанные на определении химического состава и строения веществ по их спектру.
Спектром вещества называют упорядоченное по длинам волн электромагнитное излучение, испускаемое, поглощаемое, рассеиваемое или преломляемое веществом. Методы, основанные на получении и изучении спектров испускания (эмиссии) электромагнитного излучения (энергии), называют эмиссионными, поглощения (абсорбции) - абсорбционными, рассеяния - методами рассеяния, преломления - рефракционными.
Спектр вещества получают, воздействуя на него температурой, потоком электронов, световым потоком (электромагнитной энергией) с определённой длиной волны (частоты излучения) и другими способами. При определённой величине энергии воздействия вещество способно перейти в возбуждённое состояние. При этом происходят процессы, приводящие к появлению в спектре излучения с определённой длиной волны (табл.2.2.1).
Излучение, поглощение, рассеяние или рефракция электромагнитного излучения может рассматриваться как аналитический сигнал, несущий информацию о качественном и количественном составе вещества или о его структуре. Частота (длина волны) излучения определяется составом исследуемого вещества, а интенсивность излучения пропорциональна числу частиц, вызвавших его появление, т.е. количеству вещества или компонента смеси.
Каждый из аналитических методов обычно использует не полный спектр вещества, охватывающий диапазон длин волн от рентгеновских излучений до радиоволн, а только определённую его часть. Спектральные методы обычно различают по диапазону длин волн спектра, являющемуся рабочим для данного метода: ультрафиолетовые (УФ), рентгеновские, инфракрасные (ИК), микроволновые и т.д.
Методы, работающие в УФ, видимом и ИК диапазоне называют оптическими. Они больше всего применяются в спектральных методах вследствие сравнительной простоты оборудования для получения и регистрации спектра.
Спектры оптического диапазона являются результатом изменения энергии атомов или молекулах.
Таблица 2.2.1
| Вид излучения | Атомные и молекулярные процессы | Источники возбуждения | Детекторы излучения | |
| , нм | название | |||
| 10-3 | -излучение | Ядерные | Циклотроны | Счётчики Гейгера, |
| 10-2 | Рентгеновское | реакции | сцинциляционные счётчики, фотопластины | |
| 10-1 | Переходы внешних | Рентгеновские трубочки | ||
| 100 | электронов | |||
| 101 | УФ ваккумное | |||
| 2·102 | УФ дальнее | Переходы внешних электронов | Рентгеновские трубочки, искра, пламя, дуга | Фотоэлементы, фотоматериалы |
| 3·102 | УФ ближнее | |||
| 375-750 | Видимое | Глаз, фотоэлемент | ||
| 104 | ИК ближнее | Колебания молекул | Нагретые металлические нити | Вакуумные термопары, |
| 105 | Дальнее | Вращение молекул | боллометры |
В результате изменения энергии атома или молекулы они переходят из основного состояния с минимально возможной внутренней энергией Е0 в возбужденное состояние с энергией Е1. Внутренняя энергия является величиной дискретной (квантовой), поэтому переход атома или молекулы из основного состояния в другое всегда сопровождается скачкообразным изменением энергии, т.е. получением или отдачей порции (кванта) энергии.
Квантами электромагнитного излучения являются фотоны, энергия которых связана с частотой и длиной волны излучения известным соотношением
Е = h ·
= ![]() ,
,
где Е = Е1 - Е2, Е1 - энергия начального, а Е2 - энергия конечного состояния атома или молекулы, между которыми происходит переход; h - постоянная Планка; с - скорость света; - частота; - длина волны электромагнитного излучения.
При возбуждении атома происходит перемещение электронов с внешних заполненных уровней на незаполненные более высокие энергетические уровни.
В возбуждённом состоянии атом не может долго находиться. Он стремится отдать полученную избыточную энергию и возвратиться в невозбуждённое состояние. Через очень короткое время (10-8 - 10-7с) атом самопроизвольно возвращается из возбуждённого состояния в основное или промежуточное.
При переходе электрона с верхнего уровня на нижний выделяется фотон - квант излучения с определёнными и .
Схематично электронные переходы в атомах между различными состояниями, сопровождающиеся испусканием и поглощением квантов электромагнитного излучения, можно представить в виде схемы (рис.2.2.1).
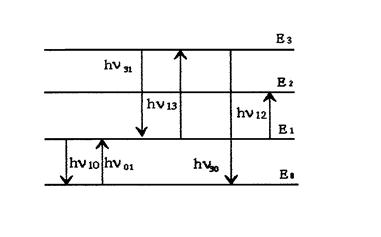
Горизонтальными линиями на рис.2.2.1. изображены уровни энергии различных состояний атома. Уровень Е0 это уровень основного состояния; Е1, Е2, Е3 - уровни возбуждённых состояний в порядке возрастания их энергии. Вертикальные стрелки соответствуют испусканию (стрелка вниз) или поглощению () фотона. Очевидно, что
01 = 10, 13 = 31 и т.д.
Совокупность фотонов, испускаемых или поглощаемых при каком
- либо одном электронном переходе атома, создающая излучение с одной длиной
волны, называется спектральной линией. Длина волны спектральной линии может
быть определена из соотношения = ![]() . Совокупность спектральных линий,
относящихся к определённому атому (молекуле), образует спектр данного атома
(молекулы).
. Совокупность спектральных линий,
относящихся к определённому атому (молекуле), образует спектр данного атома
(молекулы).
Спектр, обусловленный переходом при Е1 Е2, называется спектром испускания, а при Е1 Е2 - спектром поглощения. Переходы и соответствующие спектральные линии, проходящие с основного энергетического уровня или на него, называются резонансными.
Для возбуждения спектральной линии необходима определённая энергия, называемая потенциалом возбуждения. Если сообщить атому слишком большую энергию, то может произойти полное удаление электрона, т.е. ионизация атома. Необходимая для этого энергия называется потенциалом ионизации. Резонансные линии самые яркие и характеризуются наименьшим потенциалом возбуждения.
Изменение энергии молекулы сопровождается изменением как энергии колебаний и вращений, т.е. у молекулы нет чисто электронных переходов, а возможны только электронно-колебательно-вращатель-ные (ЭКВ) переходы. Число возможных ЭКВ переходов у молекулы значительно больше, чем у атомов, поэтому, как правило, спектры молекул сложнее и состоят из большего числа спектральных линий в оптическом диапазоне длин волн. Принципиальную схему энергетических уровней молекулы можно представить следующим образом (рис.2.2.2).
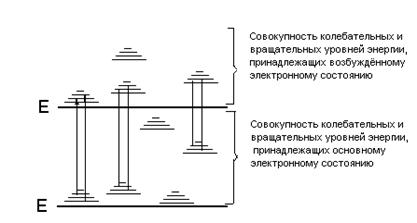
Рис.2.2.2. Схема энергетических уровней молекулы
Как для молекул, так и для атомов проявляются не все мыслимые переходы. Переходы регламентируются так называемыми правилами отбора: разрешенными являются переходы, при которых квантовое число меняется на единицу (например, S p, p d и т.д.).
Для аналитических целей можно использовать как эмиссионные, так и абсорбционные спектры, поскольку они взаимосвязаны. Например, свет, излучаемый раскалёнными парами металлического натрия, пропущенный через призму, даёт две очень близкие желтые линии с длинами волн 589,0 и 589,6 мкм. Это так называемые D - линии натрия. С другой стороны, если пропускать полихроматический белый свет (т.е. Совокупность пучков света со всеми длинами волн) через пары натрия, а затем разложить его на составляющие цвета в стеклянной призме, то на фоне непрерывного спектра будут обнаружены две чёрные линии как раз на месте D - линий. Следовательно, пары натрия поглощают излучение именно с теми длинами волн, какие они испускают при возбуждении.
Это - общая закономерность, поэтому спектральный анализ можно проводить как по спектру испускания, так и по спектру поглощения. Первый способ удобен для анализа материалов, в которых легко возбуждается спектр испускания составляющих веществ, например металлов и газов, а второй - более удобен при анализе материалов, в которых трудно вызвать возбуждение составляющих веществ (например, растворы).
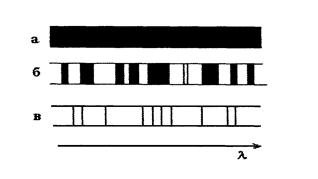
Эмиссионные спектры делятся на сплошные, полосатые, линейчатые (рис.2.2.3). Сплошные (или непрерывные) спектры содержат все длины волн в определённом интервале.
|
|
жидкие или твёрдые тела. Полосатые спектры возникают при излучении ионизированных и неионизированных молекул, состоящих из двух и более атомов, если эти молекулы удалены друг от друга настолько, что не взаимодействуют с соседними молекулами. Линейчатые спектры испускают атомы или ионы, |
Их испускают раскалённые которые находятся на таких расстояниях друг от друга, что их излучение можно считать независимым. Газы и пары металлов имеют линейчатые спектры.
Линии в спектрах атомов расположены не беспорядочно, а объединяются в группы, называемые сериями. Расстояния между линиями в серии закономерно убывают по мере перехода от более длинных волн к более коротким.
Бальмеером для простейшего линейчатого спектра водорода было обнаружено, что частоты спектральных линий в сериях, расположенных в различных областях электромагнитного излучения, находятся в определённой закономерной связи друг с другом, которую в общем виде для всех элементов выразили зависимостью
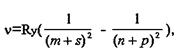
или в определённых случаях
![]()
где - частота, соответствующая каждой из рассматриваемых линий; Ry - постоянная Ридберга, равная 3,2898·1015 Гц;
m и n - целые числа (m - постоянное для каждой отдельной серии, а n - переменное);
s, p, d, f - малые десятичные дроби порядка 0,1…0,6.
Таким образом, частота любой спектральной линии может быть представлена разностью двух членов:
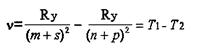
называемых спектральными термами или просто термами (от латинского terminus - пограничный знак). Оказалось, что различные термы могут попарно комбинироваться, давая начало новым сериям. Однако не все термы могут таким образом комбинироваться. Ограничения на комбинирование регламентируются правами отбора.
Физический смысл терма становится ясен, если умножить левую и правую части уравнения для на постоянную Планка h (равную 6,626 10-34 Дж с). Тогда левая часть уравнения h - энергия фотона, а правая - разность энергий. Следовательно, члены уравнения hТ1 и hТ2 - есть не что иное, как разность энергий энергетических уровней атома, получившего фотон при переходе из одного энергетического состояния в другое.
Любая серия спектральных линий обусловлена переходом электронов из ряда высших энергетических уровней на один определённый более низкий уровень (постоянный терм, первый член в правой части уравнения). Индивидуальные особенности атомов элементов, проявляющиеся в их спектрах, сказываются в поправочных членах серийных формул - s, p, d, f.
Атом каждого элемента характеризуется определённой системой энергетических уровней и, следовательно, определённым набором спектральных линий в спектре испускания. Поэтому спектры атомов могут быть использованы для их распознавания, т.е. Для качественного анализа.
Помимо величины длины волны спектральная линия имеет ещё одну важную характеристику - интенсивность. Интенсивность спектра испускания (эмиссии) связана с энергией, испускаемой возбуждёнными атомами или молекулами вещества.
Интенсивности спектров зависят от вероятностей переходов, от заселённости уровней, начальных для этих переходов.
Для спектров испускания величину интенсивности () спектральной линии можно представить в виде
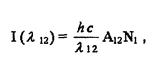
где 12 - длина волны спектральной линии, соответствующей переходу из состояния (1) в состояние (2);
А12 - коэффициент Энштейна, определяющий вероятность перехода из состояния (1) в состояние (2) с испусканием фотона;
N1 - число атомов или молекул в состоянии (1).
Из формулы следует связь интенсивности линии с числом возбуждённых атомов или молекул. Чем больше число возбуждённых атомов (молекул), тем больше интенсивность спектральной линии. Поэтому, измеряя интенсивность спектральной линии, можно определить число возбуждённых атомов (молекул), т.е. решить задачу количественного анализа.
Спектры испускания обусловлены переходами, при которых происходит уменьшение энергии атома (молекулы). Такие переходы происходят самопроизвольно - любая система стремится иметь минимальный запас потенциальной энергии.
Спектры поглощения связаны с переходами, при которых происходит увеличение энергии поглощающих излучение атомов (молекул). Такие переходы называются вынужденными, так как они возможны только при взаимодействии атомов (молекул) с фотонами, поэтому интенсивность спектральных линий в спектре поглощения зависит не только от числа поглощающих излучение частиц и вероятности такого поглощения, но и от числа фотонов, которые могут быть поглощены.
Интенсивность спектральных линий в спектре поглощения может быть записана так:
![]()
где В21 - коэффициент Эйнштейна, определяющий вероятность электронного перехода из состояния (2) в состояние (1) при взаимодействии атома (молекулы) с фотоном;
N2 - число атомов (молекул) в единице объёма в состоянии (2);
(21) - плотность излучения данной длины волны, т.е. Энергия фотона в единице объёма
![]()
где n(21) - число фотонов длины волны 21.
В такой записи интенсивность спектральной линии соответствует количеству энергии, поглощаемой N2 атомами (молекулами) в единице объёма в единицу времени.
Для определения положения (длин волн) спектральных линий и их интенсивностей необходимо использовать приборы, позволяющие выделять из всего спектра отдельные монохроматические (одноцветные) составляющие и измерять количество переносимой ими энергии.
Для монохроматизации часто используют светофильтры, т.е. устройства, изменяющие спектральный состав или энергию падающего на него излучения. Основной характеристикой светофильтра является его пропускание. Если в определённом интервале пропускание не зависит от длины волны, то такой светофильтр называется нейтральным, или серым, в противном случае - селективным. Селективные фильтры используют либо для выделения узкой спектральной области (узкополосные), либо для отделения широкой области спектра. Лучшие узкополосные фильтры имеют полосу пропускания ~0,1нм, однако количество пропускаемого ими излучения невелико, поэтому основное назначение светофильтров при спектральных исследованиях - грубая монохроматизация или неселективное ослабление излучения.
Для более полной монохроматизации излучения используют спектральные приборы, действие которых основано на преобразовании диспергирующим элементом пучка неразложенного излучения в совокупность пучков различных длин волн. В качестве диспергирующих элементов применяют призмы и дифракционные решетки. Принципиальная схема спектрального прибора приведена на рис.2.2.4.
Спектральный прибор состоит из входной щели 1, освещаемой спектрально неразложенным светом, объектива коллиматора 2, назначение которого - формирование спектрально неразложенного света в параллельный пучок и направление его на диспергирующий элемент 3 объектива камеры 4, назначение которого - фокусирование пучков различных длин волн (1, 2 и т.д.) в различных местах фокальной плоскости 5. Поскольку входная щель, расположенная в фокусе объектива коллиматора, является источником света для спектрального прибора, то в фокальной плоскости объектива камеры формируются её монохроматические изображения. Выходная щель, поставленная в фокальной плоскости, вырезает из всего спектра интервал длин волн . Такой прибор называется монохроматизатором.
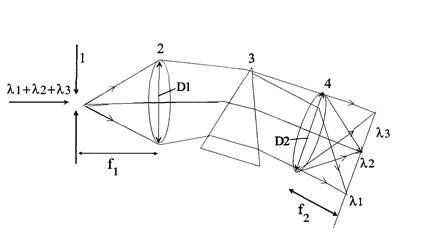
Рис.2.2.4. Принципиальная схема спектрального прибора: 1 - входная
щель; 2 - объектив коллиматора (D1-его диаметр, f1-фокусное расстояние); 3 - призма;
4 - объектив камеры (D2 - диаметр, f2 - фокусное расстояние); 5 - фокальная плоскость
объектива коллиматора.
Приёмником излучения может служить глаз, но его возможности простираются на приблизительно от 400 до 700 нм. Глаз не даёт возможности проводить количественную оценку мощности раздражи-теля, однако достаточно хорошо улавливает небольшие различия в интенсивности почти одинаковых источников, поэтому визуальные исследования применяют в качественном анализе и практически не используют в количественном спектральном анализе.
Большое распространение в качестве приёмников излучения получили фотоэлементы и фотоумножители, устройства преобразующие энергию светового потока в электрический ток.
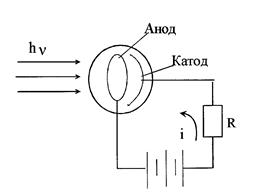
Фотоэлемент (рис.2.2.5) представляет собой вакуумную колбу, на одну из стенок которой нанесён фоточувствительный слой (фотокатод) и внутри располагается анод.
| При попадании электромагнитного излучения на фотокатод в цепи возникает электрический ток (i), создающий на сопротивлении R разность потенциалов, которая может быть измерена разными способами. Обычно выбирают такой режим, чтобы фототок линейно зависел от интенсивности падающего излучения. Для исследования малых световых потоков используют фотоэлектронные умножители (ФЭУ). ФЭУ - фотоэлементы, усиливающие фототок до 106 раз, регистрируемый затем гальванометром. |
|
| Рис.2.2.5. Принципиальная схема фотоэлемента. |
Наряду с фотоэлементами и ФЭУ в качестве приемников излучения применяют также фотоматериалы (фотопластинки, фотоплёнки), позволяющие задокументировать спектр излучаемого вещества.