Реферат: Химическая кинетика и равновесие
Химическая кинетика
Химическое равновесие
Химическая кинетика – раздел химии, который изучает скорость химической реакции и факторы влияющие на неё.
О принципиальной осуществимости процесса судят по значению изменения энергии Гиббса системы. Однако оно ничего не говорит о реальной возможности реакции в данных условиях, не даёт представления о скорости и механизме процесса.
Изучение скоростей реакций позволяет выяснить механизм сложных химических превращений. Это создаёт перспективу для управления химическим процессом, позволяет осуществлять математическое моделирование процессов.
Реакции могут быть:
1. гомогенными – протекают в одной среде (в газовой фазе); проходят во всём объёме;
2. гетерогенными – протекают не в одной среде (между веществами, находящимися в разных фазах); проходят на границе раздела.
Под скоростью химической реакции понимают число элементарных актов реакции, проходящих в единицу времени в единице объёма (для гомогенных реакций) и на единицу поверхности (для гетерогенных реакций).
Так как при
реакции изменяется концентрация реагирующих веществ, то скорость обычно
определяют как изменение концентрации реагентов в единицу времени и выражают в ![]() . При этом нет необходимости
следить за изменением концентрации всех веществ, входящих в реакцию, поскольку
стехиометрический коэффициент в уравнении реакции устанавливает соотношение
между концентрациями, т.е. при
. При этом нет необходимости
следить за изменением концентрации всех веществ, входящих в реакцию, поскольку
стехиометрический коэффициент в уравнении реакции устанавливает соотношение
между концентрациями, т.е. при ![]() скорость
накопления аммиака вдвое больше скорости расходования водорода.
скорость
накопления аммиака вдвое больше скорости расходования водорода.
![]()
![]() ,
, ![]() ,
т.к.
,
т.к. ![]() не может быть
отрицательной, поэтому ставят «–».
не может быть
отрицательной, поэтому ставят «–».
![]()
![]()
![]()
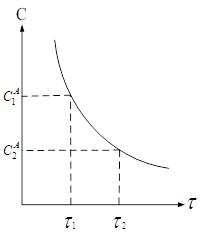
Скорость в
интервале времени ![]() – истинная
мгновенная скорость – 1‑ая производная концентрации по времени.
– истинная
мгновенная скорость – 1‑ая производная концентрации по времени.
Скорость химических реакций зависит:
1. от природы реагирующих веществ;
2. от концентрации реагентов;
3. от катализатора;
4. от температуры;
5. от степени измельчения твёрдого вещества (гетерогенные реакции);
6. от среды (растворы);
7. от формы реактора (цепные реакции);
8. от освещения (фотохимические реакции).
Основной закон химической кинетики – закон действующих масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в реакции
![]() :
: ![]() ,
,
где ![]() – постоянная скорости химической
реакции
– постоянная скорости химической
реакции
Физический
смысл ![]() при
при ![]() .
.
Если в
реакции участвуют не 2‑е частицы, а более ![]() ,
то:
,
то: ![]() ~
~![]() в степенях, равных
стехиометрическим коэффициентам, т.е.:
в степенях, равных
стехиометрическим коэффициентам, т.е.: ![]() ,
где
,
где
![]() – показатель порядка
реакции в целом (реакции первого, второго, третьего … порядков).
– показатель порядка
реакции в целом (реакции первого, второго, третьего … порядков).
Число частиц, участвующих в этом акте реакции определяет молекулярность реакции:
![]() мономолекулярная (
мономолекулярная (![]() )
)
![]() бимолекулярная (
бимолекулярная (![]() )
)
![]() тримолекулярная.
тримолекулярная.
Больше 3‑х не бывает, т.к. столкновение более 3‑х частиц сразу – маловероятно.
Когда реакция
идёт в несколько стадий, то общая ![]() реакции
=
реакции
= ![]() наиболее медленной стадии
(лимитирующей стадии).
наиболее медленной стадии
(лимитирующей стадии).
Зависимость
скорости реакции от температуры определяется эмпирическим правилом
Вант-Гоффа: при увеличении температуры на ![]() ,
скорость химической реакции увеличивается в 2 – 4 раза:
,
скорость химической реакции увеличивается в 2 – 4 раза: ![]() .
.
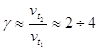
![]() ,
,
где ![]() – температурный коэффициент
скорости химической реакции
– температурный коэффициент
скорости химической реакции 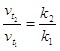 .
.
Не всякое
столкновение молекул сопровождается их взаимодействием. Большинство молекул
отскакивают как упругие шарики. И только активные при столкновении взаимодействуют
друг с другом. Активные молекулы обладают некоторой избыточной ![]() но сравнению с неактивными
молекулами, поэтому в активных молекулах связи между ними ослаблены.
но сравнению с неактивными
молекулами, поэтому в активных молекулах связи между ними ослаблены.
Энергия для
перевода молекулы в активное состояние – энергия активации ![]() . Чем она меньше, тем
больше частиц реагируют, тем больше скорость химической реакции.
. Чем она меньше, тем
больше частиц реагируют, тем больше скорость химической реакции.
Величина ![]() зависит от природы
реагирующих веществ. Она меньше
зависит от природы
реагирующих веществ. Она меньше ![]() диссоциации
– наименее прочной связи в реагентах.
диссоциации
– наименее прочной связи в реагентах.
Изменение ![]() в ходе реакции:
в ходе реакции:
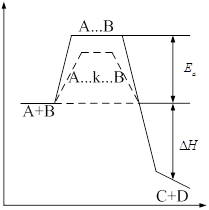
![]() выделяется (экзотермическая)
выделяется (экзотермическая)
С увеличением
температуры число активных молекул растёт, поэтому ![]() увеличивается.
увеличивается.
Константа ![]() химической реакции связана
с
химической реакции связана
с
![]() :
: ![]() ,
,
где ![]() – предэкспоненциальный
множитель (связан с вероятностью и числом столкновений).
– предэкспоненциальный
множитель (связан с вероятностью и числом столкновений).
В зависимости от природы реагирующих веществ и условий их взаимодействия, в элементарных актах реакций могут принимать участие атомы, молекулы, радикалы или ионы.
Свободные
радикалы чрезвычайно реакционноспособны, ![]() активных
радикальных реакций очень мала (
активных
радикальных реакций очень мала (![]() ).
).
Образование свободных радикалов может происходить в процессе распада веществ при температуре, освещении, под действием ядерных излучений, при электроразряде, сильных механических воздействиях.
Многие реакции протекают по цепному механизму. Особенность цепных реакций состоит в том, что один первичный акт активации приводит к превращению огромного числа молекул исходных веществ.
Например: ![]() .
.
При обычной
температуре и рассеянном освещении реакция протекает крайне медленно. При
нагревании смеси газов или действия света, богатого УФ лучами (прямой солнечный
свет, свет от горящего ![]() ) смесь
взрывается.
) смесь
взрывается.
Эта реакция
протекает через отдельные элементарные процессы. Прежде всего, за счёт
поглощения кванта энергии УФ лучей (или температуры) молекула ![]() диссоциируется на
свободные радикалы – атомы
диссоциируется на
свободные радикалы – атомы ![]() :
: ![]() , затем
, затем ![]() , затем
, затем ![]() и т.д.
и т.д.
Естественно,
возможно столкновение свободных радикалов и друг с другом, что приводит к обрыву
цепей: ![]() .
.
Кроме температуры на реакционную способность веществ существенное влияние оказывает свет. Воздействие света (видимого, УФ) на реакции изучает раздел химии – фотохимия.
Фотохимические процессы весьма разнообразны. При фотохимическом действии молекулы реагирующих веществ, поглощая кванты света, возбуждаются, т.е. становятся реакционноспособными или распадаются на ионы и свободные радикалы. На фотохимических процессах основана фотография – воздействие света на светочувствительные материалы (фотосинтез).
Одним из наиболее
распространённых в химической практике методов ускорения химических реакций
является катализ. Катализаторы – вещества, изменяющие ![]() химической реакции за счёт
участия в промежуточном химическом взаимодействии с компонентами реакции, но
восстанавливающие после каждого цикла промежуточного взаимодействия свой химический
состав.
химической реакции за счёт
участия в промежуточном химическом взаимодействии с компонентами реакции, но
восстанавливающие после каждого цикла промежуточного взаимодействия свой химический
состав.
Увеличение ![]() каталитической реакции
связано с меньшей
каталитической реакции
связано с меньшей ![]() нового пути
реакции. Т.к. в выражении для
нового пути
реакции. Т.к. в выражении для ![]()
![]() входит в отрицательный показатель
степени, то даже небольшое уменьшение
входит в отрицательный показатель
степени, то даже небольшое уменьшение ![]() вызывает
очень большое увеличение
вызывает
очень большое увеличение ![]() химической
реакции.
химической
реакции.
Существуют 2 вида катализаторов:
гомокатализаторы;
гетерокатализаторы.
Биологические катализаторы – ферменты.
Ингибиторы – вещества, замедляющие ![]() химической реакции.
химической реакции.
Промоторы – вещества, усиливающие действие катализаторов.
Реакции, которые протекают только в одном направлении и идут до конца – необратимые (образование осадка, выделение газа). Их мало.
Большинство
реакций – обратимые: 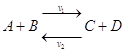 .
.
Согласно
закону действия масс: ![]()
![]()
![]() – химическое
равновесие.
– химическое
равновесие.
Состояние
системы, в которой ![]() прямой реакции =
прямой реакции =
![]() обратной реакции, называется
химическим равновесием.
обратной реакции, называется
химическим равновесием.
![]()
![]()
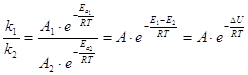 .
.
С увеличением
температуры, ![]() : для эндотермической
реакции возрастает, для экзотермической реакции убывает для
: для эндотермической
реакции возрастает, для экзотермической реакции убывает для ![]() остаётся постоянным.
остаётся постоянным.
Влияние различных факторов на положение химического равновесия определяется принципом Ла-Шателье: если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в системе усиливаются процессы, стремящиеся уменьшить это воздействие.
В состоянии
равновесия ![]() .
.