Реферат: Получение алкилгалогенидов действием на спирты тионилхлорида
Функциональная группа спиртов содержит электроотрицательный атом кислорода с двумя неподеленными парами электронов. В молекуле спиртов можно выделить следующие реакционные центры:
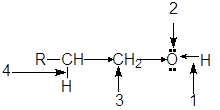
1. ОН-кислотный центр, обусловливающий возможность отщепленя протона вследствие высокой полярности связи О-Н;
2. нуклеофильный и n-основный центр - атом кислорода, имеющий неподеленные пары электронов;
3. электрофилный центр - a-атом углерода, на котором дефицит электронов вызван -I-эффектом соседней гидроксильной группы;
4. b-С-кислотный центр, в котором поляризация связи С-Н также обусловлена электроноакцепторным влиянием гидроксильной группы.
1. Получение алкилгалогенидов действием на спирты
тионилхлорида
Одним из лучших лабораторных способов превращения спиртов в алкилхлориды является их взаимодействие с тионилхлоридом. Тионилхлорид превращает первичные и вторичные спирты в алкилхлориды с выходом 70-90%. Образующиеся наряду с продуктом замещения хлороводород и диоксид серы газы, что облегчает выделение целевого продукта. Следует различать две разновидности этой реакции: в присутствии или в отсутствии основания (пиридина С5Н5N или триэтиламина Et3N и других третиичных аминов). Амин играет двоякую роль. Прежде всего, он способствует образованию алкоксид-аниона. Кроме того, он связывает выделяющийся хлороводород:
Реакция (S)-2-бутанола с тионилхлоридом в присутствии пиридина проходит с обращением конфигурации:
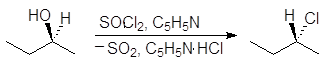
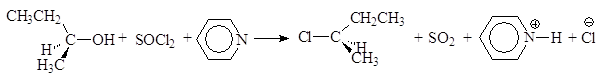 (56)
(56)
(S)-2-бутанол (R)-2-хлорбутан пиридинийхлорид
Механизм:
На первой стадии реакции с сохранением конфигурации образуется хлорсульфит:
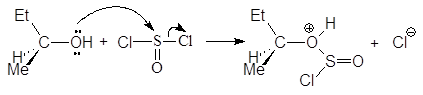 (М 11)
(М 11)
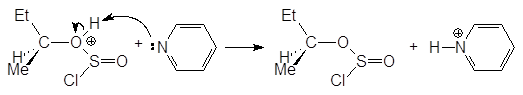
втор-бутилхлорсульфит
На второй стадии хлорсульфитная группа замещается на хлор по механизму SN2 с обращением конфигурации. В присутствии основания выделяющийся на первой стадии хлороводород превращается в соль:
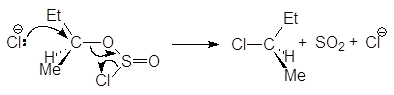
Замещение гидроксильной группы первичных и вторичных спиртов на хлор под действием тионилхлорида в присутствии пиридина сопровождается перегруппировками, например:
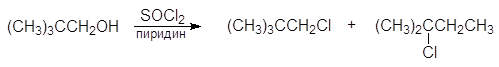 (57)
(57)
неопентиловый спирт неопентилхлорид 2-метил-2-хлорбутан
Реакция (S)-2-бутанола с тионилхлоридом в отсутствии пиридина проходит с рацемизацией:
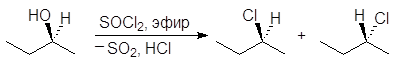 (58)
(58)
Дело в том, что в отсутствии основания хлорсульфит превращается сначала в ионную пару. Ионная пара далее превращается в алкилгалогенид и диоксид серы. При этом образуются продукты, как с сохранением, так и с обращением конфигурации.
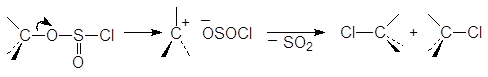 (М 12)
(М 12)
ионная пара
Третичные спирты в этих условиях превращаются в алкены.
2. Образование алкилсульфонатов
Еще один путь превращения гидроксильной группы спиртов в хорошую уходящую группу - превращение их в мезилаты и тозилаты. Например, спирты реагируют с метансульфонилхлоридом (мезилхлоридом Ms¾Cl) или с п-толуолсульфонилхлоридомом (тозилхлоридом Тs¾Cl) превращаясь соответственно в алкилмезилаты или алкилтозилаты:
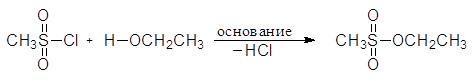 (59)
(59)
метансульфонилхлорид этилметансульфонат
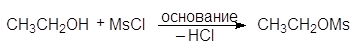
мезилхлорид этилмезилат
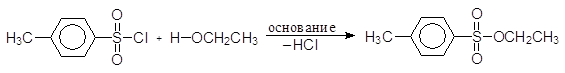 (60)
(60)
п-толуолсульфонилхлорид этил-п-толуолсульфонат
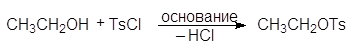
тозилхлорид этилтозилат
Превращение спиртов в алкилсульфонаты позволяет осуществлять с ними реакции нуклеофильного замещения. Стадия превращения спирта в алкилсульфонат идет с сохранением конфигурации, а вот стадия взаимодействия алкилсульфоната с нуклеофилом проходит с обращением конфигурации:
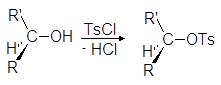
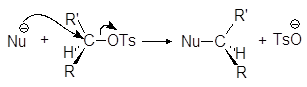 (М 13)
(М 13)
Алкилсульфонаты вступают во все реакции, характерные для галогенуглеводородов. Из них, например, могут быть получены различные галогензамещенные углеводороды. Для этого спирты сначала превращают в алкилсульфонаты, например в тозилаты, которые легко могут быть выделены и очищены. Далее сульфонатную группу замещают на другую функциональную группу. Подобного рода превращения иллюстрируются упражнениями 17-21.
Упр.17. Какова конфигурация 2-бутанола, образующегося в результате превращения (R)-2-бутанола в тозилат и с последующей реакцией тозилата со щелочью по механизму SN2?
Ответ:
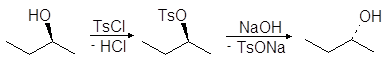
Упр.18. Каким образом через тозилат может быть осуществлено следующее превращение?
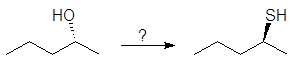
3. Дегидратация
Дегидратация спиртов подробно осуждалась в главе 8 Алкены (см. реакции 5-10, м 1-5 и упр 8.1 и 8.2). При нагревании спиртов с концентрированной серной кислотой они отщепляют воду. В случае вторичных и третичных спиртов отщепление воды протекает согласно эмпирическому правилу Зайцева: протон отщепляется предпочтительно от наименее гидрогенизированного b-атома углерода. Иными словами, двойная связь образуется у наиболее замещенного атома углерода:
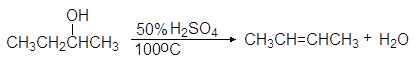 (61)
(61)
Легкость элиминирования возрастает при переходе от первичных спиртов к третичным, что нашло отражение в условиях проведения реакций. Так первичные спирты дегидратируются в довольно жестких условиях - 170 - 200оС с использованием концентрированной серной кислоты:
![]() (62)
(62)
Дегидратация вторичных спиртов происходит при температур 100 - 150оС с менее концентрированными кислотами:
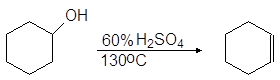 (63)
(63)
Еще легче отщепляют воду третичные спирты - 80 - 100оС в присутствии более мягких дегидратирующих агентов (разбавленная серная кислота, щавелевая или п-толуолсульфоновая кислота):
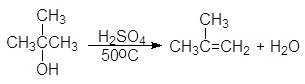 (64)
(64)
Дегидратация вторичных и третичных спиртов протекает по механизму Е1.
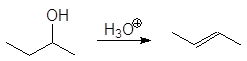 (65)
(65)
Механизм:
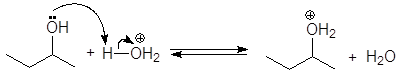 (М 14)
(М 14)
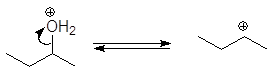
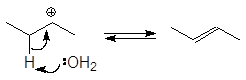
Реакция
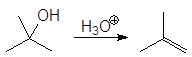 (66)
(66)
проходит по механизму:
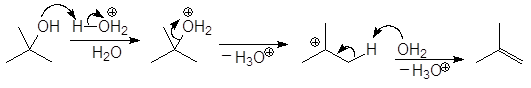 (М 15)
(М 15)
Первичные спирты дегидратируются по механизму E2,
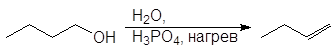 (67)
(67)
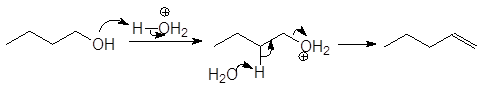
(М16)
Дегидратация первичных и вторичных спиртов часто сопровождается перегруппировками, например:
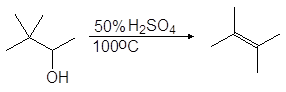 (68)
(68)
Упр.22. Опишите механизм реакции (68).
Упр.23. Опишите механизмы реакций:
(а) 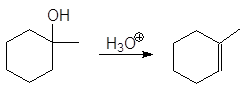 (б)
(б)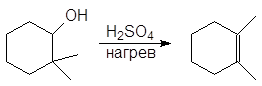
(в) 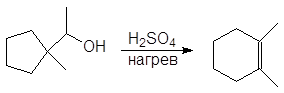
Ответ:
(а)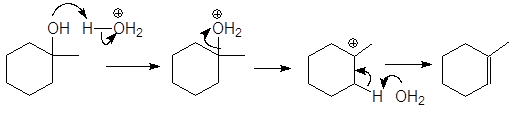
Упр. 24. Напишите реакции:
(а)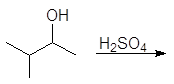 (б)
(б) 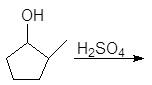
(в)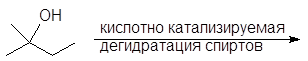
(г)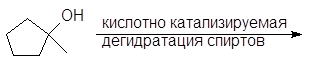
и опишите их механизмы.
Упр. 25. Завершите реакции:
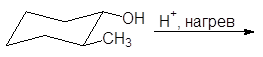 |
|||
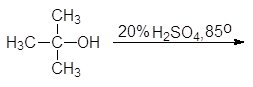 |
|||
(а) (б)
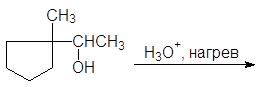 |
|||
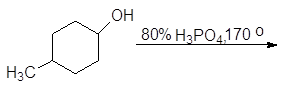 |
|||
(в) (г)