Учебное пособие: Основные параметры технологических процессов
Лекция 1.
Процессы окисления этилена. Режимы, продукты, принципиальные типы и конструкции реакторов. Катализаторы процессов окисления этилена
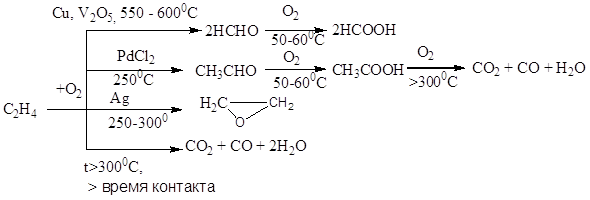
Требования на сырье: высокая концентрация, осушка, очистка от примесей, интервалы вне пределов взрываемости (3-30% по С2Н4; 3-80% по оксидам). Конверсия низкая, проблема с выделением товарных продуктов.
Приведите основные типы промышленных реакций с участием СО, назовите режимы их осуществления, охарактеризуйте продукты, их назначение. Назовите катализаторы процессов.
Гидроформилирование олефинов (оксосинтез)
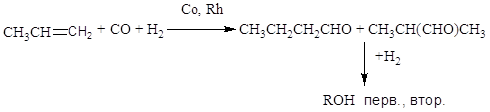
Соотношение продуктов н- и изо-строения.
Гидрокарбоксилирование олефинов
![]()
Карбонилирование спиртов
![]()
Окислительное карбонилирование спиртов
![]()
Синтез метанола
![]()
Синтезы Фишера-Тропша
![]()
Приведите примеры основных типов промышленных реакций окисления олефинов, основные режимы их осуществления. Охарактеризуйте продукты, их назначение. Катализаторы процессов.
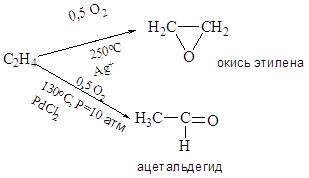
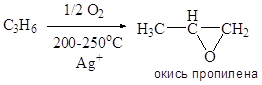
![]()
![]()
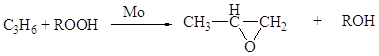
Газофазные каталитические процессы; в интервале температур 150-300оС; P до 10-20 атм.
Лекция 2.
Способы получения капролактама из первичного сырья (нефти, газа, угля). Технико-экономическое сравнение с учётом современной конъюнктуры на сырьё и энергоресурсы. Проблема переработки побочных продуктов

HOOC(CH2)2COOH – янтарная кислота, HOOC(CH2)3COOH – глутаровая кислота, OOC(CH2)4COOH – адипиновая кислота
Как объяснить необходимость создания малотоннажных производств в хлорорганическом синтезе? Привести примеры промышленных процессов, использующих совмещение по сырью и продуктам; по энергиям. Привести параметры процессов и описать химизм. Способы утилизации хлоротходов.
1. Образование больших количеств хлорорганических отходов: газообразных, жидких, твердых. HCL – абсорбция; абгазная соляная кислота, загрязнена органическими примесями. ЖХО – не горят; образуются диоксины; процессы токсичны; взрывоопасны.
2. 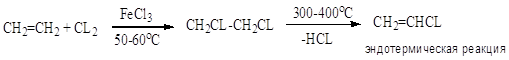
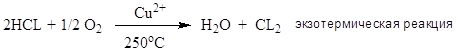
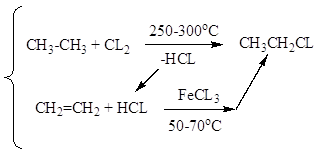
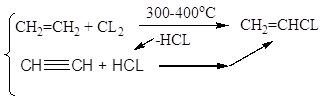
3. Абсорбция HCl; оксихлорирование (реакция Дикона); хлоринолиз -
![]()
Заместительное хлорирование углеводородов: алканов, алкенов, ароматических и алкилароматических. Продукты и их назначение. Механизм процессов, основные режимы. Способы управления селективностью.
1.
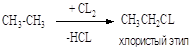
Т = 250-300oC; хлорирование в объеме или с использованием насадки. Механизм цепной радикальный; инициирование термическое; УФ – облучение, вещественное, индуцированное хлорирования СnH2n+2, где (n> 10).
2.
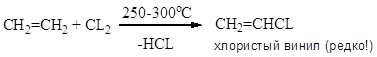
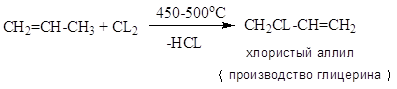
Селективность не более 60 %; конверсия 40-50 %. Хлорирование в объеме; очень высокая экзотермичность, механизм цепной радикальный.
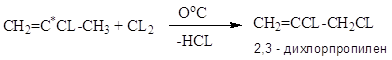
Механизм молекулярный, наличие четвертого углеродного атома.
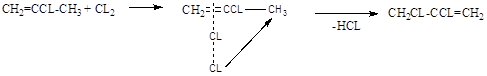
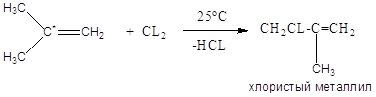
3. Замещение в ядро
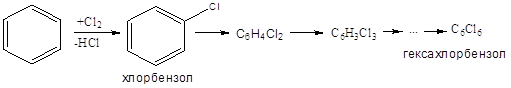
Катализаторы: апротонные кислоты (FeCl3, AlCl3); температура больше 1000С.
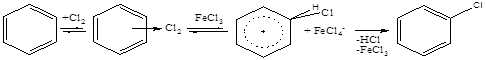
Правила ориентации: электроно-донорные группы (СН3-, НО- _ направляют в орто-, пара-положение; акцепторные (NO2-, Cl-) – в мета-положение.
Дезактивирующее влияние хлора. Продукты: хлорбензол, дихлорбензолы, гексахлорбензол – растворители, инсектициды, фунгициды и т.д.
Хлорфенолы
Технология: процесс жидкофазный, РИС, температура 70-1000С.
Лекция 3.
Окисление алкилароматических соединений. Назначение продуктов. Теоретические основы: химизм, механизм, реакционная способность, катализаторы. Технологические особенности оформления реакционных устройств
Производство гидропероксидов
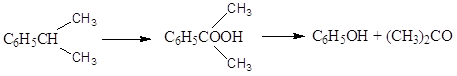
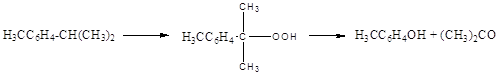
Активность к окислению:
-CH3 < - CH2-CH3 < -CH2-CH2-CH3 < -CH (CH3)2
Особенности: повышение селективности, понижение температуры, уменьшение конверсии (XA), добавка Na2CO3 или NaOH (нейтрализация муравьиной кислоты, предотвращающей кислотное разложение и дегидратацию карбинолов)
Механизм окисления: цепной, радикальный.
Реакторы: колонны противоточные; каскад реакторов.
Производство карбоновых кислот:
Активность к окислению в карбоновые кислоты:
CH3 > - CH2-CH3 > - CH (CH3)2
C6H5CH3 ® C6H5COOH; C6H4 (CH3)2 ® C6H4(COOH)2
Способы защиты второй алкильной группы.
Хлорзамещённые олефины: хлористый винил, трихлорэтилен, перхлорэтилен, хлоропрен, 2,3-дихлорпропилен. Применение и способы получения. Способы инициирования в процессах заместительного хлорирования, технологические особенности процессов.
CH2=CHCL – хлористый винил;
CHCL=CCL2 – трихлорэтилен;
CCL=CCL2 – перхлорэтилен;
CH2=CCL-CH=CH2 – хлоропрен
хлоркаучук!
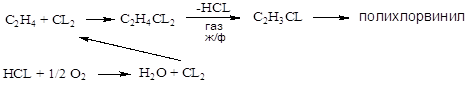
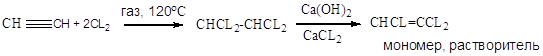
Хлоринолиз:
![]()
![]()
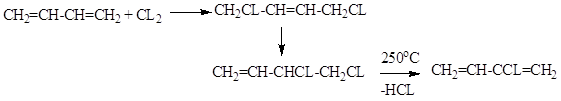
CH2=CCL-CH2CL – 2,3 – ДХП – побочный продукт при хлорировании пропилена:
![]()
Способы инициирования: термическое, вещественное, УФ-облучение, индуцированное.
Процессы газофазные (получение хлористого аллила, 2,3 –дихлорпропана, хлористого винила и т.д.) – температура 250-5000С; конверсия низкая (около нуля).
Процессы жидкофазные – съем тепла, инициирование, температура ниже 150-2000С.
Лекция 4.
Процессы дегидрохлорирования в хлорорганическом синтезе. Характеристика основных продуктов. Теоретические основы процесса, механизм, катализаторы, условия. Технологические особенности процессов
Получение хлоролефинов: хлорвинил, хлоропрен, дихлорэтилен.
Термическое дегидрохлорирование: температура 250-5000С; механизм цепной радикальный; низкая селективность; примеси в целевом продукте. Реактор: в объеме; инертная насадка.
Жидкофазное дегидрохлорирование: температура 50-1200С; щелочной агент; механизм нуклеофильный; количественный выход целевого продукта; недостатки гетерофазного процесса; большое количество стоков.
Каталитический жидкофазный процесс: использование катализаторов межфазного переноса; механизм (преимущества и недостатки). Использование принципа совмещения процессов в реакторе жидкофазного дегидрохлорирования (объединение реактора и ректификационной колонны).