Реферат: Тяжёлые металлы. Источники поступления в окружающую среду. Действие на организм человека
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ФАКУЛЬТЕТ ФИЛОСОФСКИХ И СОЦИАЛЬНЫХ НАУК
РЕФЕРАТ
по дисциплине: "Экология"
на тему:
«Тяжёлые металлы. Источники поступления
в окружающую среду. Действие на организм человека».
| Житкевич И.Н., студентки |
| 1 курса заочного обучения ФФСН |
| Проверил: Румянцев И.Ю. |
Минск, 2001
ВВЕДЕНИЕ
Одним из сильнейших по действию и наиболее распространенным химическим загрязнением является загрязнение тяжелыми металлами.
К тяжелым металлам относятся более 40 химических элементов периодической системы Д.И. Менделеева, масса атомов которых составляет свыше 50 атомных единиц.
Эта группа элементов активно участвует в биологических процессах, входя в состав многих ферментов. Группа "тяжелых металлов" во многом совпадает с понятием "микроэлементы". Отсюда свинец, цинк, кадмий, ртуть, молибден, хром, марганец, никель, олово, кобальт, титан, медь, ванадий являются тяжелыми металлами.
Источники поступления тяжелых металлов делятся на природные (выветривание горных пород и минералов, эрозийные процессы, вулканическая деятельность) и техногенные (добыча и переработка полезных ископаемых, сжигание топлива, движение транспорта, деятельность сельского хозяйства). Часть техногенных выбросов, поступающих в природную среду в виде тонких аэрозолей, переносится на значительные расстояния и вызывает глобальное загрязнение.
Другая часть поступает в бессточные водоемы, где тяжелые металлы накапливаются и становятся источником вторичного загрязнения, т.е. образования опасных загрязнений в ходе физико-химических процессов, идущих непосредственно в среде (например, образование из нетоксичных веществ ядовитого газа фосгена).
Тяжелые металлы накапливаются в почве, особенно в верхних гумусовых горизонтах, и медленно удаляются при выщелачивании, потреблении растениями, эрозии и дефляции - выдувании почв.
Период полуудаления или удаления половины от начальной концентрации составляет продолжительное время: для цинка - от 70 до 510 лет, для кадмия - от 13 до 110 лет, для меди - от 310 до 1500 лет и для свинца - от 740 до 5900 лет.
В гумусовой части почвы происходит первичная трансформация попавших в нее соединений.
Тяжелые металлы обладают высокой способностью к многообразным химическим, физико-химическим и биологическим реакциям. Многие из них имеют переменную валентность и участвуют в окислительно-восстановительных процессах. Тяжелые металлы и их соединения, как и другие химические соединения, способны перемещаться и перераспределяться в средах жизни, т.е. мигрировать.
Миграция соединений тяжелых металлов происходит в значительной степени в виде органо-минеральной составляющей. Часть органических соединений, с которыми связываются металлы, представлена продуктами микробиологической деятельности. Ртуть характеризуется способностью аккумулироваться в звеньях "пищевой цепи" (об этом шла речь ранее). Микроорганизмы почвы могут давать устойчивые к ртути популяции, которые превращают металлическую ртуть в токсические для высших организмов вещества. Некоторые водоросли, грибы и бактерии способны аккумулировать ртуть в клетках.
Ртуть, свинец, кадмий входят в общий перечень наиболее важных загрязняющих веществ окружающей среды, согласованный странами, входящими в ООН. Остановимся подробнее на этих веществах.
§ 1. РТУТЬ.
Кроме свинца наиболее полно по сравнению с другими микроэлементами изучена ртуть.
Ртуть крайне слабо распространена в земной коре (-0,1 х 10-4 %), однако удобна для добычи, так как концентрируется в сульфидных остатках, например, в виде киновари (НgS). В этом виде ртуть относительно безвредна, но атмосферные процессы, вулканическая и человеческая деятельность привели к тому, что в мировом океане накопилось около 50 млн.т этого металла. Естественный вынос ртути в океан в результате эрозии 5000 т/год, еще 5000 т/год ртути выносится в результате человеческой деятельности.
Первоначально ртуть попадает в океан в виде Нg2+, затем она взаимодействует с органическими веществами и с помощью анаэробных организмов переходит в токсичные вещества метилртуть (СН3Нg)+ и диметилртуть (СН3-Нg-СН3),
Ртуть присутствует не только в гидросфере, но и в атмосфере, так как имеет относительно высокое давление паров. Природное содержание ртути составляет ~0,003-0,009 мкг/м3.
Ртуть характеризуется малым временем пребывания в воде и быстро переходит в отложения в виде соединений с органическими веществами, находящимися в них. Поскольку ртуть адсорбируется отложениями, она может медленно освобождаться и растворяться в воде, что приводит к образованию источника хронического загрязнения, действующего длительное время после того, как исчезнет первоначальный источник загрязнения.
Мировое производство ртути в настоящее время составляет более 10000 т в год, большая часть этого количества используется в производстве хлора. Ртуть проникает в воздух в результате сжигания ископаемого топлива. Анализ льда Гренландского ледяного купола показал, что, начиная с 800 г. н.э. до 1950-х гг., содержание ртути оставалось постоянным, но уже с 50-х гг. нашего столетия количество ртути удвоилось. На рис.23 представлены пути цикловой миграции ртути.
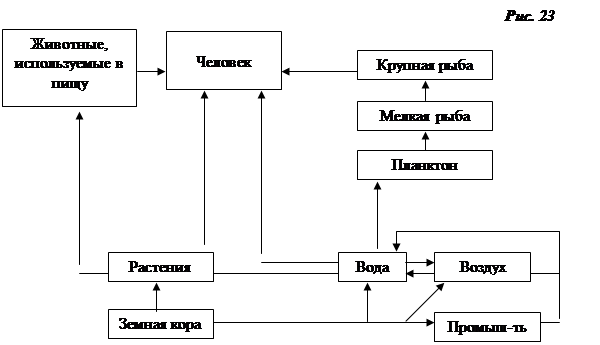
Ртуть и ее соединения опасны для жизни. Метилртуть особенно опасна для животных и человека, так как она быстро переходит из крови в мозговую ткань, разрушая мозжечок и кору головного мозга. Клинические симптомы такого поражения - оцепенение, потеря ориентации в пространстве, потеря зрения. Симптомы ртутного отравления проявляются не сразу. Другим неприятным последствием отравления метилртутью является проникновение ртути в плаценту и накапливание ее в плоде, причем мать не испытывает при этом болезненных ощущений. Метилртуть оказывает тератогенное воздействие на человека. Ртуть относится к I классу опасности.
Металлическая ртуть опасна, если ее проглотить и вдыхать ее пары. При этом у человека появляется металлический вкус во рту, тошнота, рвота, колики в животе, зубы чернеют и начинают крошиться. Пролитая ртуть разлетается на капельки и, если это произошло, ртуть должна быть тщательно собрана.
Неорганические соединения ртути практически нелетучи, поэтому опасность представляет попадание ртути внутрь организма через рот и кожу. Соли ртути разъедают кожу и слизистые оболочки тела. Попадание солей ртути внутрь организма вызывает воспаление зева, затрудненное глотание, оцепенение, рвоту, боли в животе.
У взрослого человека при попадании внутрь около 350 мг ртути может наступить смерть.
Загрязнение ртутью может быть уменьшено в результате запрещения производства и применения ряда продуктов. Нет сомнения, что загрязнение ртутью всегда будет острой проблемой. Но с введением строгого контроля за отходами производства, содержащими ртуть, а также за пищевыми продуктами можно уменьшить опасность отравления ртутью.
§ 2. СВИНЕЦ.
Содержание свинца в магматических породах позволяет отнести его к категории редких металлов. Он концентрируется в сульфидных породах, которые встречаются во многих местах в мире. Свинец легко выделить путем выплавки из руды. В природном состоянии он обнаруживается в основном в виде галенита (РbS).
Свинец, содержащийся в земной коре, может вымываться под воздействием атмосферных процессов, переходя постепенно в океаны. Ионы Рb 2+ довольно нестабильны, и содержание свинца в ионной форме составляет всего 10 –8 %. Однако он накапливается в океанских осадках в виде сульфитов или сульфатов. В пресной воде содержание свинца гораздо выше и может достигать 2 х 10 –6 %, а в почве примерно такое же количество, что и в земной коре (1,5 х 10 –3 %) из-за нестабильности этого элемента в геохимическом цикле.
Свинцовые руды содержат 2-20 % свинца. Концентрат, получаемый флотационным способом, содержит 60-80 % Рb. Его нагревают для удаления серы и выплавляют свинец. Такие первичные процессы крупномасштабны. Если же для получения свинца используют отходы, процессы выплавки называют вторичными. Ежегодное мировое потребление свинца составляет более 3 млн. т, из них 40 % используют для производства аккумуляторных батарей, 20% -для производства алкила свинца - присадки к бензину, 12% применяют в строительстве, 28 % для других целей.
Ежегодно в мире в результате воздействия атмосферных процессов мигрирует около 180 тыс. т свинца. При добыче и переработке свинцовых руд теряется более 20 % свинца. Даже на этих стадиях выделение свинца в среду обитания равно его количеству, попадающему в окружающую среду в результате воздействия на магматические породы атмосферных процессов.
Наиболее серьезным источником загрязнения среды обитания организмов свинцом являются выхлопы автомобильных двигателей. Антидетонатор тетраметил - или тетраэтилсвинеп - прибавляют к большинству бензинов, начиная с 1923 г., в количестве около 80 мг/л. При движении автомобиля от 25 до 75% этого свинца в зависимости от условий движения выбрасывается в атмосферу. Основная его масса осаждается на землю, но и в воздухе остается заметная ее часть.
Свинцовая пыль не только покрывает обочины шоссейных дорог и почву внутри и вокруг промышленных городов, она найдена и во льду Северной Гренландии, причем в 1756 г. содержание свинца во льду составляло 20 мкг/т, в 1860 г. уже 50 мкг/т, а в 1965 г. - 210 мкг/т.
Активными источниками загрязнения свинцом являются электростанции и бытовые печи, работающие на угле.
Источниками загрязнения свинцом в быту могут быть глиняная посуда, покрытая глазурью; свинец, содержащийся в красящих пигментах.
Свинец не является жизненно необходимым элементом. Он токсичен и относится к I классу опасности. Неорганические его соединения нарушают обмен веществ и являются ингибиторами ферментов (подобно большинству тяжелых металлов). Одним из наиболее коварных последствий действия неорганических соединений свинца считается его способность заменять кальций в костях и быть постоянным источником отравления в течение длительного времени. Биологический период полураспада свинца в костях - около 10 лет. Количество свинца, накопленного в костях, с возрастом увеличивается, и в 30-40 лет у лиц, по роду занятий не связанных с загрязнением свинца, составляет 80-200 мг.
Органические соединение свинца считаются ещё более токсичными, чем неорганические.
Главным источником, из которого свинец попадает в организм человека, является пища, наряду с эти важную роль играет вдыхаемый воздух, а у детей – и заглатываемая ими свинецсодержащая пыль и краски. Вдыхаемая пыль примерно на 30-35 % задерживается в легких, значительная доля её всасывается потоком крови. Всасывания в желудочно-кишечном тракте составляют в целом 5-10 %, у детей – 50 %. Дефицит кальция и витамина Д усиливает всасывание свинца.
Острые свинцовые отравления встречаются редко. Их симптомы – слюнотечение, рвота, кишечные колики, острая форма отказа почек, поражение мозга. В тяжёлых случаях – смерть через несколько дней.
Ранние симптомы отравления свинцом проявляются в виде повышенной возбудимости, депрессии и раздражительности. При отравлении органическими соединениями свинца его повышенное содержание обнаруживают в крови.
Вследствие глобального загрязнения окружающей среды свинцом он стал вездесущим компонентом любой пищи и кормов. Растительные продукты в целом содержат больше свинца, чем животные.
§ 3. КАМДИЙ И ЦИНК.
Камдий, цинк и медь являются наиболее важными металлами при изучении проблемы загрязнений, так они широко распространены в мире и обладают токсичными свойствами. Камдий и цинк (так же ка свинец и ртуть) обнаружены в основном в сульфидных осадках. В результате атмосферных процессов эти элементы легко попадают в океаны. В почвах содержится приблизительно 4,5х10 –4 %. Растительность содержит различное количество обоих элементов, но содержание цинка в золе растений относительно высоко –0,14;, так как этот элемент играет существенную роль в питании растений.
Около 1 млн. кг камдия попадает в атмосферу ежегодно в результате деятельности заводов по его выплавке, что составляет около 45 % общего загрязнения этим элементом. 52 % загрязнений попадают в результате сжигания или переработки изделий, содержащих камдий. Камдий обладает относительно высокой летучестью, поэтому он легко проникает в атмосферу. Источники загрязнения атмосферы цинком те же, что и камдием.
Попадание камдия в природные воды происходит в результате применения его в гальванических процессах и техники. Наиболее серьёзные источники загрязнения воды цинком – заводы по выплавке цинка и гальванические производства.
Потенциальным источником загрязнением камдием являются удобрения. При этом камдий внедряется в растения, употребляемые человеком в пищу, и в конце цепочки переходят в организм человека. Камдий и цинк легко проникают в морскую воду и океан через сеть поверхностных и грунтовых вод.
Камдий и цинк накапливаются в определённых органах животных (особенно в печени и в почках).
Цинк наименее токсичен из всех вышеперечисленных тяжёлых металлов. Тем не менее все элементы становятся токсичными, если попадаются в избытке; цинк не является исключением. Физиологическое воздействие цинка заключается в действии его как активатора ферментов. В больших количествах он вызывает рвоту, эта доза составляет примерно 150 мг для взрослого человека.
Камдий намного токсичнее цинка. Он и его соединения относятся к I классу опасности. Он проникает в человеческий организм в течение продолжительного периода. Вдыхание воздуха в течение 8 часов при концентрации камдия 5 мг/м3 может привести к смерти.
При хроническом отравлении камдием в моче появляется белок, повышается кровяное давление.
При исследовании присутствия камдия в продуктах питания было выявлено, что выделения человеческого организма редко содержат столько же камдия, сколько было поглощено. Единого мирового мнения относительно приемлемого безопасного содержания камдия в пище сейчас нет.
Одним их эффективных путей предотвращения поступления камдия и цинка в виде загрязнений состоит в введении контроля за содержанием этих металлов в выбросах плавильных заводов и других промышленных предприятий.
Кроме металлов, рассмотренных ранее (ртуть, свинец, камдий, цинк), имеются и другие токсичные элементы, попадание которых в среду обитания организмов в результате деятельность людей вызывает серьёзное беспокойство.
§ 4. СУРЬМА, МЫШЬЯК, КОБАЛЬТ.
Сурьма присутствует вместе с мышьяком в рудах, содержащих сульфиды металлов. Мировое производство сурьмы составляет около 70 т в год. Сурьма является компонентом сплавов, используется в производстве спичек, в чистом виде применяется в полупроводниках.
Токсическое действие сурьмы подобно мышьяку. Большие количества сурьмы вызывают рвоту, при хроническом отравлении сурьмой наступает расстройство пищеварительного тракта, сопровождаемое рвотой и понижением температуры.
Мышьяк в природе присутствует в виде сульфатов. Его содержание в свинцово-цинковых концентратах около 1 %. Вследствие летучести он легко попадает в атмосферу.
Самыми сильными источниками загрязнения этим металлом являются гербициды (химические вещества для борьбы с сорными растениями), фунгициды (вещества для борьбы с грибными болезнями растений) и инсектициды (вещества для борьбы с вредными насекомыми).
По токсическим свойствам мышьяк относится к накапливающимся ядам. По степени токсичности следует различать элементарный мышьяк и его соединения. Элементарный мышьяк сравнительно мало ядовит, но обладает тератогенными свойствами. Вредное воздействие на наследственный материал (мутагенность) оспаривается.
Соединения мышьяка медленно поглощаются через кожу, быстро всасываются через лёгкие и желудочно-кишечный тракт. Смертельная доза для человека – 0,15-0,3 г.
Хроническое отравление вызывает нервные заболевания, слабость, онемение конечностей, зуд, потемнение кожи, атрофию костного мозга, изменения печени. Соединения мышьяка являются канцерогенными для человека. Мышьяк и его соединения относятся ко II классу опасности.
Кобальт не является широко применяемым. Так, например, его используют в сталелитейной промышленности, в производстве полимеров. При попадании внутрь больших количеств кобальт отрицательно влияет на содержание гемоглобина в крови человека и может вызвать заболевания крови. Предполагают, что кобальт вызывает базедову болезнь. Этот элемент опасен для жизни организмов ввиду его чрезвычайно высокой реакционной способности и относится к I классу опасности.
§ 5. МЕДЬ И МАРГАНЕЦ.
Медь обнаруживают в сульфидных осадках вместе со свинцом, камдием и цинком. Она присутствует в небольших количествах в цинковых концентратах и может переноситься на большие расстояния с воздухом и водой. Аномальное содержание меди обнаруживается в растениях с воздухом и водой. Аномальное содержание меди обнаруживается в растениях и почвах на расстоянии более 8 км от плавильного завода. Соли меди относятся ко II классу опасности. Токсические свойства меди изучены гораздо меньше, чем те же свойства других элементов. Поглощение больших количеств меди человеком приводит к болезни Вильсона, при этом избыток меди откладывается в мозговой ткани, коже, печени, поджелудочной железе.
Природное содержание марганца в растениях, животных и почвах очень высоко. Основные области производства марганца – производство легированных сталей, сплавов, электрических батарей и других химических источников тока. Присутствие марганца в воздухе сверх нормы (среднесуточная ПКД марганца в атмосфере – воздухе населённых мест – составляет 0,01 мг/м3) вредно влияет на организм человека, что выражается в прогрессирующем разрушении центральной нервной системы. Марганец относится ко II классу опасности.
| Развитие, становление и основные аспекты фармации | |
|
РАЗВИТИЕ, СТАНОВЛЕНИЕ И ОСНОВНЫЕ АСПЕКТЫ ФАРМАЦИИ Для ветеринарного провизора необходимы знания, с помощью которых можно контролировать качество ... Препарат используют как противотоксическое (антидотное) и десенсибилизирующее средство при отравлениях цианидами, ртутью, мышьяком, таллием, свинцом и при аллергических состояниях. Микроэлементы (марганец, мышьяк, кобальт, цинк, медь и др.) входят в состав ферментов, витаминов, гормонов и активно участвуют в различных биохимических процессах. |
Раздел: Рефераты по медицине Тип: книга |
| Сорбционные свойства мха по отношению к микроорганизмам и тяжелым ... | |
|
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 2.1. Методы исследований 2.1.1. Получение микробной суспензии Питательный агар, который готовится согласно прописи ... Главная форма миграции соединений марганца в поверхностных водах - взвеси, состав которых определяется в свою очередь составом пород, дренируемых водами, а также коллоидные ... Низкие концентрации тяжелых металлов могут стимулировать рост микроорганизмов [3,4]. Действительно, в ряде случаев такие тяжелые металлы, как Co, Cu, Fe, необходимы для питания ... |
Раздел: Рефераты по биологии Тип: реферат |
| Свинцовое загрязнение окружающей среды Российской Федерации и его ... | |
|
... Соловьевым Александром, гр. 702 СибАГС, 1997 г. Содержание. 1. Характеристика проблемы свинцового загрязнения окружающей среды в России 1.1 Производство хрустальной посуды, оптического стекла типа "тяжелый флинт", деталей кинескопов, специальных свинцовых стекол для спайки с металлами и другими стеклами следует ... По степени воздействия на живые организмы свинец отнесен к классу высокоопасных веществ наряду с мышьяком, кадмием, ртутью, селеном, цинком, фтором и бенз(а)пиреном (ГОСТ 17.4.1.02 ... |
Раздел: Рефераты по экологии Тип: курсовая работа |
| Экологическое состояние морей России | |
|
... 3 Глава 1. Моря России как крупные природные комплексы.........5 Глава 2. Характеристика степени загрязнения морских вод России 2.1. Источники ... Тяжелые металлы (ртуть, свинец, кадмий, цинк, медь, мышьяк) относятся к числу распространенных и весьма токсичных загрязняющих веществ. Наиболее высокие концентрации тяжелых металлов в Карском море приурочены к зонам выноса рек Оби и Енисея, причем отмечается тенденция к росту практически всех контролируемых ... |
Раздел: Рефераты по экологии Тип: дипломная работа |
| Свинец и экология | |
|
2. Введение. Загрязнение окружающей среды свинцом и его соединениями является для России наиболее острым и опасным. Свинец поставляет цветная ... В результате получают черновой свинец, из которого выделяют медь, серебро, железо, олово, мышьяк и сурьму, висмут остается вместе со свинцом. В среднем на каждый кв. метр приходится по одному аккумулятору; очевиден процесс массового загрязнения окружающей среды тяжелыми металлами, концентрированными электролитами и ... |
Раздел: Рефераты по экологии Тип: реферат |