Дипломная работа: Дослідження антагоністичних властивостей сучасних пробіотиків
Анотація
Звіт про магістерську роботу “Дослідження антагоністичних властивостей сучасних пробіотиків”: об`єм сторінок, 6 рисунків, 69 літературних джерел.
О`єкт дослідження - пробіотичні препарати: “Колибактерин” та “Бактисубтил”.
Мета роботи - дослідження антагоністичних властивостей біопрепаратів.
Ціль роботи - провести порівняльну характеристику їх дії, обґрунтувати дію біологічних препаратів до стандартних тест-штамів та клінічних штамів в сучасних умовах.
Проведено порівняльне вивчення специфічної активності біопрепаратів колибактерин та бактисубтил, основою яких є виробничі штами E.coli M17 та B.cereus IP 5832. Антагоністичну активність визначали по відношенню до 65 штамів патогенних та умовно патогенних мікроорганізмів.
При проведені дослідів використовували тест-штами, які використовуються при контролі пробіотиків: Shigella sonnei 2802, 5063 Shigella flexneri 337, 170; Escherichia coli 157; Proteus vulgaris 177; Proteus mirabilis 24а, 249; Staphylococcus aureus 209 та клінічні штами - представники родів Escherichia, Staphylococcus, Klebsiella, Pseudomonas, Enterobacter, Proteus.
Встановлено, що пробіотичні препарати характеризуються вираженою антагоністичною активністю щодо широкого спектра музейних тест-штамів мікроорганізмів і трохи меншою по відношенню до клінічних штамів.
Аннотация
Отчет о магистерской работе “Исследование антагонистических свойств современных пробиотиков ”: объем –страниц, 6 рисунков, 69 литературных источников.
Оъeкт исследования - пробиотические препараты: “Колибактерин” и “Бактисубтил”.
Направление работы - исследование антагонистических свойств биопрепаратов.
Цель работы - провести сравнительную характеристику их действия, охарактеризовать действие биологических препаратов к стандартным тест-штаммам и клинических штаммов в современных условиях.
Проведено сравнительное изучение специфической активности биопрепаратов колибактерин и бактисубтил, основой которых есть производственные штаммы E.coli M17 и B.cereus IP 5832. Антагонистическую активность определяли по отношению к 65 штаммам патогенных и условно патогенных микроорганизмов.
При проведенные опытов использовали тест-штаммы, которые используются при контроле пробиотиков: Shigella sonnei 2802, 5063 Shigella flexneri 337, 170; Escherichia coli 157; Proteus vulgaris 177; Proteus mirabilis 24а, 249; Staphylococcus aureus 209 и клинические штаммы - представители родов Escherichia, Staphylococcus, Klebsiella, Pseudomonas, Enterobacter, Proteus.
Установлено, что пробиотические препараты характеризуются выраженной антагонистической активностью относительно широкого спектра музейных тест-штаммов микроорганизмов и немного меньшей по отношению к клиническим штаммам.
The summary
The report about graduation paper " Research of antagonistic properties of modern probiotics": a volume –85 рages, 6 illustrations, 69 sources of the literature.
Object researches - probiotics preparations: "Kолибактерин" (Colibacterinum siccum) and "Бактисубтил" (Bactisubtil).
Direction of work - research of antagonistic properties of biological products.
The purpose of work - carry out the comparative characteristic of their action to characterize action of biological preparations to standard the test-strains and clinical strains in modern conditions.
Biopreparations " Colibacterinum siccum ” and "Bactisubtil" based industrial E.coli M17 strains and B.cereus IP 5832 strains have been comparatively studied for their specific activity. Antagonistic activity has been determined in relation to 65 strains of pathogenic and conditionally pathogenic microorganisms.
At carried out spent experiences used the test - strains which is used at the control probiotics: Shigella sonnei 2802, 5063 Shigella flexneri 337, 170; Escherichia coli 157; Proteus vulgaris 177; Proteus mirabilis 24à, 249; Staphylococcus aureus 209 and clinical strains - representatives of the Escherichia, Staphylococcus, Klebsiella, Pseudomonas, Enterobacter, Proteus genus.
It has been established, that probiotics preparations is characterized by expressed antagonistic activity in respect to wide range museum the test - strains of microorganisms and a little smaller in relation to clinical strains.
ЗМІСТ
Список скорочень
Вступ
Розділ 1. Літературний огляд
1.1 Роль бактеріальної флори кишечника людини та її фізіологічні функції
1.1.1 Склад кишкової мікрофлори людини
1.1.2 Причини і наслідки порушення мікрофлори людини
1.2 Антагоністичні властивості пробіотичних препаратів
1.3 Використання пробіотиків для підтримання нормобіоценозу людини
1.3.1. Біопрепарати для корекції мікрофлори організму людини
1.3.2. Застосування у ветеринарній практиці
Розділ 2. Матеріали та методи досліджень
2.1 Матеріали досліджень
2.2 Методи дослідження культурально-біохімічних властивостей
штамів
2.3 Метод визначення антагоністичної активності мікроорганізмів
2.4 Методи математичної обробки отриманих результатів досліджень
Розділ 3. Експериментальна частина
3.1 Культурально-біохімічні властивості штамів продуцентів
3.1.1 Штам E.coli M 17
3.1.2 Штам B.cereus IP 5832
3.2. Дослідження антагоністичної активності пробіотичних
штамів по відношенню до стандартних тест-штамів та клінічних ізолятів
Розділ 4. Обговорення результатів
Висновки
Список літератури
Список скорочень
ДНК- дезоксирибонуклеїнова кислота
Ig- імуноглобулін
ІФН - інтерферон
КУО- колонієутворюючі одиниці
МК – мікробні клітини
МКБ- молочнокислі бактерії
УПБ- умовно патогенні бактерії
УПМ- умовно патогенні мікроорганізми
ШКТ- шлунково-кишковий тракт
Вступ
В сучасний період вивчення нормальної мікрофлори привертає до себе все більшу увагу як в загальнобіологічному плані, так і у клінічному напрямку в зв`язку із тим, що накопичується все більше даних, шо зміни у нормальній мікрофлорі є проявом порушення гомеостазу макроорганізму, яке патогенетично повязане із виникненням різних патологічних станів (кишкові, госпітальні інфекції та ін.).
Організм людини і тварин піддається взаємодії цілого комплексу несприятливих факторів, які впливають на нормальне функціонування основних систем життєдіяльності. З однієї сторони це широке використання пестицидів, різноманітних харчових добавок, консервантів, барвників, недостатнє, нераціональне харчування більшості населення країни, а з іншої – масове безконтрольне застосування хіміотерапевтичних препаратів, в тому числі антибіотиків. З цим і рядом інших факторів повязують збільшення частоти виникнення дисбактеріозів у людей різних вікових груп. Про це говорить ріст гастроентерологічних захворювань[1].
Нормальна мікрофлора складає конкуренцію для патогенів, і механізми пригнічення їх росту досить різноманітні: вибіркове зв'язування поверхневих рецепторів клітин, особливо епітеліальних; виражений антагонізм, направлений проти патогенних видів. Подібні властивості виражені у біфідобактерій і лактобактерій, цей антибактеріальний потенціал утворює секреція кислот, спиртів, бактеріоцинів, лізоцима і т.д. Окрім того, висока концентрація вказаних продуктів інгібує виділення токсичних субстанцій патогенними видами.
Вивчення мікрофлори кишечника почалось з 1886 року, коли один із початківців вчення про кишкові інфекцїї F.Esсherich вперше описав кишкову паличку (Bacterium coli communae). Неоцінимий вклад у вивчення кишкового мікробіоценозу і можливостей його корекції вніс І.І.Мечніков, який в 1907р. висунув положення, що причиною виникнення багатьох захворювань являється дія на тканини і клітини макроорганізму різноманітних токсинів і метаболітів, які продукуються мікробами, більшість яких знаходиться в травному тракті. За його думкою, тривалість життя може суттєво збільшуватись, а швидкість старіння організму зменшуватись при елімінації із кишечника за допомогою антагоністично активних молочнокислих бактерій (МКБ) (наприклад, болгарської палички) гниттєвої мікрофлори і припинення всмоктування в кров її токсичних метаболітів. В 1955 роках. Л.Г. Перетц показав, що кишкова паличка здорових людей являється одним із основних представників нормальної мікрофлори і відіграє позитивну роль завдяки сильним антагоністичним властивостям по відношенню до патогенних мікробів. Він розрізняв кишкову паличку по ступені її антагоністичної активності і виділив високоактивний штам Esсherichіа coli M17, який до нашого часу являється основою для виготовлення пробіотиків. В подальшому позитивна роль нормальної мікрофлори кишечника для організму була доведена багатьма вченими [2].
Наш час вчені називають “наступаючою епохою пробіотиків”, біопрепарати широко використовуються в медицині та ветеринарії для корекції мікрофлори ШКТ. Практика застосування пробіотиків із різних штамів і видів представників індигенної мікрофлори показала в цілому іх позитивний вплив на відновлення кишкового мікробіоценозу, збільшення загальної резистентності організму.
Ще зовсім недавно спектр пробітичних продуктів обмежувався продуктами лікувально-профілактичного призначення на основі моноштамових культур біфідобактерій і Lactobacillus acidophilus і стерилізованого молока. В останні ж роки значно розширилась сфера виробництва збагачених продуктів масового призначення.
Для виготовлення пробіотиків і продуктів харчування на основі живих мікроорганізмів зараз використовуються представники різних видів(Bacillus subtilis, Bifidobacterium adolescentis, Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium infantis, Bifidobacterium longum, Enterococcus faecalis, Enterococcus faecium, Escherichia coli, Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus delbrueckii subsp. bulgasricus, Lactobacillus felventicus, Lactobacillus fermentum, Lactobacillus lastic, Lactobacillus rhamnosus, Lactobacillus salivarius, Lactobacillus plantarum, Lactococcus, Leuconostoc, Streptococcus cremoris, Streptococcus lactis та ін.). Проводиться направлений відбір штамів мікроорганізмів, які повинні володіти адгезивною здатністю та антагоністичною активністю до патогенних та УПМ, не повинні пригнічувати представників нормофлори, повинні продукувати корисні для людини біологічно активні речовини [3].
Все це вимагає ретельного дослідження антагоністичних взаємовідносин між мікроорганізмами, з однієї сторони складових кишкової мікрофлори, а з іншої – складових сучасних біопрепаратів. Хоча ґрунтовні роботи з цього приводу проводились, однак, на сучасному етапі це питання потребує подальшого вивчення.
Чисельні дослідження в цій галузі стосуються, в основному, в дослідженні антагоністичної активності пробіотиків до стандартних тест-штамів. У той же час практично відсутні експерементальні дані про порівняльну характеристику сучасних пробіотиків, їх антагоністична дія на клінічні штами, збудників гострих кишкових інфекцій. Викладене вище надає актуальності проблемі взаємодії мікроорганізмів нормальної мікрофлори та пошуку методів корекції різних патологічних порушень.
В роботі було проведено дослідження пробіотичних препаратів, їх порівняльна характеристика до патогенних та умовно патогенних клінічних штамів, збудників кишкових інфекцій. Встановлено, що складові досліджених пробіотичних препаратів володіють антагоністичною активністю шляхом продукування (метаболітів) певних хімічних компонентів різної молекулярної ваги. Ті, що мають білкову природу та кодуються плазмідами, належать до бактеріоцинів. Крім того, антагоністична дія цих бактерій визначається також виділенням ними органічних кислот та низькомолекулярних метаболітів типу пептидів. Вони також мають здатність вибірково пригнічувати ріст патогенних клінічних штамів - сальмонел шигел, ентеробактерів, клебсіел, стафілококів, ешерихій, протеїв та псевдомонад. Цим визначається актуальність та наукова новизна роботи.
Мета роботи: На основі досліджень по визначенню антагоністичних властивостей біопрепаратів провести порівняльну характеристику їх дії, обгрунтувати дію біологічних препаратів до клінічних свіжовиділених та музейних штамів, стандартних тест-штамів в сучасних умовах.
Задачі дослідження:
Дослідити фізіолого-морфологічні властивості виробничих штамів Escherichia coli M17, Bacillus cereus IP5832.
Провести порівняльну характеристику антагоністичних властивостей сучасних пробіотичних препаратів.
Об`єкт дослідження: пробіотичні препарати – “Колибактерин”, “Бактисубтил”.
Предмет дослідження: культури стандартних тест-штамів мікрооганізмів, які використовуються при контролі пробіотиків, клінічні штами збудників гострих кишкових інфекцій (Shigella, Salmonella, Klebsiella, Staphylococcus та ін.), та музейні колекційні штами.
Методи досліджень:
мікробіологічні методи – використанні при визначенні деяких біолого-морфологічних властивостей виробничих та клінічних штамів мікроорганізмів, для встановлення рівня антагоністичої активності бактерій із пробіотичними властивостями.
статистичні методи – застосували для математичної обробки результатів, отриманих мікробіологічним методом дослідження для визначення вирогідності виявлених змін, зв`язків між показниками.
Розділ 1. Літературний огляд
1.1 Роль бактеріальної флори кишечника людини та її фізіологічні функції
Відповідно дослідженням ВООЗ, кожен рік збільшується кількість людей, які страждають на різні патологічні стани, так званими “хворобами цивілізації”, до них відносять патологію серця і судин, рак, алергічні захворювання, гепатити різноманітної етіології, ожиріння, остеохондроз, остеопороз, діабет, артрити та ін.
Замислюючись над питанням, яка ж причина багатьох із перечислених захворювань, не можна не звернути увагу на фізіологічне значення мікрофлори людини.
Внаслідок наукових досягнень останніх років в галузі експериментальної та клінічної медичної мікробної екології різко зросла увага вчених до ідей Мечнікова про ведучу роль мікроорганізмів людини та тварин у підтримці здоров`я та виникнення різних захворювань. Встановлено, що атеросклероз, вторинні імунодефіцити, деякі новоутворення, алергічні реакції та інші захворювання в деякій мірі пов'язані з порушеннями в екосистемі “хазяїн-мікрофлора”[1].
Майже сто років тому назад І.І.Мечніков перший науково обґрунтував та привернув увагу дослідників до використання антагоністичних властивостей молочнокислих бактерій в боротьбі з гнильною мікрофлорою травного тракту. Він вважав, що всмоктування продуктів життєдіяльності гнильних мікроорганізмів, які знаходяться в кишковому тракті людини, таких як індол, фенол, скатол отруює організм, викликаючи передчасну старість. Та висунув ідею про заміну шкідливої флори кишечника на корисну, яка повинна продовжувати життя людині та вважав, що це може бути здійснено за рахунок використання молока, збродженого ацидофільними бактеріями, Bacillus bulgaricus, Lac. Delbrueckii та іншими, які можуть пригнічувати ріст патогенних мікробів. Рекомендоване ним системне вживання кисломолочних продуктів на основі болгарської палички було одним з найбільш перспективних шляхів медицини XX століття і дало поштовх для розробки ряду бактерійних препаратів, які використовуються для корекції і нормалізації мікрофлори кишечника [2,3].
Згідно сучасним уявленням, нормальна мікрофлора – сукупність корисних мікроорганізмів, які заселяють шлунково-кишковий тракт (ШКТ), та являється суттєвим фактором фізіологічного стану людини. Відповідно теорії збалансованого харчування, заселення бактеріальною флорою травного тракту – небажаний і в певній мірі шкідливий побічний ефект. Однак бактеріальна флора ШКТ не тільки не шкідлива, але й необхідна для нормального розвитку фізіологічних функцій макроорганізму, та його філогенетичний і онтогенетичний розвиток тісно пов`язаний з біоценозом мікрорганізмів.
Великий вплив має мікрофлора кишечника на структурні характеристики та функціональні особливості самого кишечника і інших органів. Не можна не переоцінити роль мікрофлори в регулюючому її впливі на секреторні і сорбційні процеси в слизистій оболонці кишечника, а також на транспортні механізми, які реалізують надходження нутрієнтів із ентерального у внутрішнє середовище організма. Встановлено, що бактеріальні ентеротоксини суттєво підсилюють кишкову проникненість. Продукти життєдіяльності бактерій кишечника, особливо біфідобактерій, лактобактерій, ентерококів та деяких інших, сприяють всмоктуванню кальцію, заліза, води, газів, вітаміну D. Цим самим можна пояснити дефіцит ряду вітамінів і мінеральних речовин у хворих із певними дисбактеріозами кишечника.
R.Freter вважав, що в захисті макрооорганізму від кишкових інфекцій є два основні механізми: місцевий клітинно-гуморальний імунітет і захисна роль нормальної мікрофлори.
Захисна здатність нормальної кишкової мікрофлори багатогранна, але найбільш важливі при цьому такі її особливості. Перша з них має пряме відношення до формування місцевого імунітету слизистої оболонки кишечника, перш за все товстого кишечника. В присутності аутохтонної (головної, особистої, облігатної, постійної) мікрофлори кишечника відбувається інгібування адгезії бактерій до кишкового слизу. При цьому колонії мікроорганізмів здійснюють контроль кількості певних бактеріальних популяцій, які локалізовані на поверхні кишкової слизистої оболонки, за рахунок присутності в цій області антибактеріальних антитіл. При нестачі в товстому кишечнику, наприклад, біфідобактерій, навіть при нормальному фагоцитозі, у мікро- та макрофагів гідроліз ними антигенів сповільнюється [4]. Окрім участі в синтезі IgA і активації фагоцитозу, нормальна кишкова мікрофлора забезпечує потенціювання продукції інтерферонів, в першу чергу α-інтерферону, цитокінів, лізоциму – активних регуляторних учасників реакції імунної відповіді. Мікрофлора кишечника синтезує ряд біологічно активних речовин, сприяє руйнуванню алергенів, а також бактерії мають рецептори та деякі інші антигенні властивості.
Окрім, механізмів місцевого імунітету, який регулює мікрофлору кишечника, існує ще один дуже важливий механізм контролю – бактеріальний антагонізм. Цей важливий захисний процес здійснюється за рахунок цілого ряду функціональних реакцій умовно-патогенної мікрофлори. Під впливом бактеріальної флори в травному апараті утворюються деякі токсини – бактеріоцини, які відносяться до антибіотикоподібних речовин, які в свою чергу витісняють із середовища проживання конкурентні мікроорганізми. Більш того, до продуктів життєдіяльності облігатної мікрофлори кишечника відносяться оцтова, молочна, деякі інші кислоти, які створюють оптимальне для мікрорганізмів кисле середовище (біфідобактерії – рН до 5.0, лактобактерії – рН до 4.0), яке затримує проліферацію патогенної і газоутворюючої мікрофлори. Також існує бактеріальна флора пов`язана із слизистою оболонкою тонкого кишечника. Здатність бактерій постійної мікрофлори знаходитися в тісному контакті із структурами кишкової поверхні, забезпечує їх успішну конкуренцію з іншими бактеріями за сайти адгезії на ентероцитах, цим самим створюючи захисну мікроплівку на поверхні слизистої оболонки кишечника, яка складається із єкзополісахаридного глiкокалікса і муцина ентероцитів.
Анаеробні мікроорганізми в процесі свого метаболізму утворюють велику кількість різноманітних органічних кислот, які мають виражену протимікробну дію. У кількісному відношенні у прямій кишці найбільш важливими є оцтова, пропіонова та масляна кислоти, які знаходяться в макроорганізмі як в адгезованому до поверхні кишок стані, так і у вигляді вільних кислот. Летючі жирні кислоти можуть не тільки протидіяти колонізації кишечника патогенними бактеріями, але й регулювати чисельність аеробних та бути промоторами росту деяких анаеробних мікроорганізмів з числа нормальної мікрофлори, тобто приймають безпосередньо участь в підтриманні балансу мікробної екосистеми[9].
Деякі представники нормальної мікрофлори (мікрококи, лакто- і біфідобактерії) продукують перекис водню і таким чином здійснюють антагоністичну дію на патогенні бактерії in vivo [5].
Важлива роль аутохтонної мікрофлори в її здатності приймати участь в нейтралізації нітратів, ксенобіотиків екзогенного походження, інактивації гістаміна, припиненню утворення токсичних продуктів білкового обміну. Отже, бактеріальна флора ШКТ являється своєрідним трофічним гомеостазом [5], який забезпечує руйнування надлишкових компонентів їжі і утворення недостатніх продуктів. Тому підтримання нормальної бактеріальної флори в організмі стає однією із найважливіших задач оптимізації харчування і життєдіяльності людини.
Закінчуючи підрозділ, присвячений фізіологічним особливостям кишкової мікрофлори, необхідно виділити ряд найбільш значущих положень. По-перше, кишковий мікробіоценоз слід розглядяти як один із важливих і невід`ємних компонентів завершуючого етапу травлення, функціонально пов`язаного із усіма попередніми процесами ферментативного гідроліза їжі. По-друге, мікробіоценоз кишечника слід розглядати як один із важливих місцевих регуляторних механізмів функціональної дієздатності, морфологічної цілосності. По-третє, регуляторна роль бактеріальної флори кишечника виходить далеко за межі ШКТ. Її участь в синтезі великої кількості гормонів і біологічно активних речовин визначає фізіологічну доцільність впливу кишкового мікробіоценозу на більшість органів і організму в цілому. По-четверте, кишкова бактеріальна флора представляє собою важливу систему захисту організма (конкурентна боротьба із патогенною мікрофлорою, інактивація токсичних для організма речовин в кишечнику та ін.).
Короткий огляд лише деяких, але найбільш важливих положень фізіології мікробіоценоза кишечника розглянутий для того, щоб ще раз підкреслити її суттєву роль у функціонуванні та життєзабезпеченні багатьох процесів організма, а не тільки ШКТ.
1.1.1 Склад кишкової мікрофлори людини
В залежності від особливостей організму кожної людини, віку, рівнів метаболізму, фізіологічних даних, умов праці, екологічного стану довкілля може змінюватися співвідношення різних представників нормальної мікрофлори індивідума, але існують загальні закономірності, які дозволяють визначити норму для кожного біотопу, зокрема кишок [6].
В
нормі склад мікрофлори кишечника відносно постійний, представляє собою
збалансовану мікроекологічну систему (мікробіоценоз), який склався в процесі
філогенетичного розвитку людини. Макроорганізм і його мікрофлора знаходяться в
стані динамічної рівноваги. Біомаса мікробів, які заселяють кишечник людини,
складає приблизно 5% від загальної маси. В кишечнику людини знаходиться від 400
до 500 видів різноманітних мікроорганізмів, сумарна кількість облігатних
анаеробних бактерій сягає 10![]() -10
-10![]() , що на 1-2 порядки перевищує
кількість еукаріотичних клітин у всіх тканин і органів людини разом узятих.
[7].
, що на 1-2 порядки перевищує
кількість еукаріотичних клітин у всіх тканин і органів людини разом узятих.
[7].
Для різних представників кишкової мікрофлори характерні певні закономірності розподілення по різним відділам ШКТ. Завдяки бактерицидній дії шлункового соку, його вміст натощак стерильний або загальна кількість мікробів в шлунку складає не більше 10³ клітин в 1 мл. В шлунку здорових людей є бактерії, які стійкі до дії соляної кислоти: L.fermentum, L.acidophilus, L.brevis, дріжджі, стрептококи.
В літературі можна зустріти різні класифікації нормальної мікрофлори кишечника. Якщо в якості основних критеріїв використовувати кількісні взаємовідносини, то виділяють головну, до складу якої входить більш 90% всіх мікробів (біфідобактерії, бактероїди), супутню (біля 10% від загального числа мікробів- молочнокислі бактерії, штами кишкової палички і ентерококи) та залишкову (менше 1% від загальної кількості мікроорганізмів – стафілококи, гриби, протей) флору. Також широко використовується розділення нормальних кишкових мікрофлор на облігатні (найбільш постійні) і факультативні. До факультативних мікробів відносять більшість умовно-патогенних форм, які у випадку зниження резистентності макроорганізма набувають патогенні властивості [4]. Якісний і кількісний склад основної мікрофлори товстого кишечника у дорових людей представлено в таблиці 1.1.
Таблиця 1.1 Склад мікрофлори товстого кишечника здорової людини
| Склад мікробіоценоза |
Кількість (КУО в 1г фекалій) |
|
Облігатна (постійна) мікрофлора Біфідумбактерії Бактероїди Лактобактерії Кишкова паличка, в тому числі із слабо вираженими властивостями Ентерокок (фекальний стрептокок), в тому числі лактозонегативний Факультативна (непостійна) мікрофлора Мікрококи Стрептококи Пептострептококи Стафілококи Кампілобактер Протей Дріжджо-подібні гриби і ін. Транзиторна (випадкова) мікрофлора Клостридії Синегнойна паличка Гриби роду кандіда і ін. 4. Патогенна мікрофлора |
10 10 10 10 До 10% 10³-10 До 5% 0-10 (в сумі) Менше 10³ Менше 10² Одиничні і непостійні мікроколонії Не повинно бути |
| Загальна кількість кокових форм |
0-10 |
Домінуючою групою у складі мікрофлори фекалій здорових людей є анаеробні бактерії – представники родів Eubacterium, Bifidobacterium, Bacteroides, Peptosteptococcus i Ruminococcus. До найбільш розповсюджених родів анаеробних бактерій належать також і Clostridium. Рід Lactobacillus, представлений 15 видами, яких L.аcidophilus і L.fermentum є видами зазвичай присутніми в кишечнику. Незважаючи на менший порівняно з анаеробами, кількісний вміст лактобактерій, вони мають непересічне мікроекологічне значення. Представництво стрептококів також налічує близько 15 видів, з яких облігатними вважаються S.faecalis, S.faecium, S.bovis, S.salivarius, S.equinus. Tакож досить широко можуть бути представлені члени родини Enterobacteriaceae, облігатним представником якої є E.coli. В кишковій мікрофлорі також присутні, хоча і в меншій кількості, і інші бактерії, як то Staphylococcus sp., Pediococcus sp., Bacillus cereus, Pseudomonas sp., Aerococcus viridans, Aeromonas hidrophila, Corinebacterium sp., Nocardia sp. [6].
Окрім індигенної флори, з фекалій здорових людей висіваються представники транзиторної групи мікроорганізмів, частка яких складає 0,01 – 4 % від загальної кількості. До них належать умовно патогенні мікроорганізми – стафілококи, дріжджеподібні гриби, синьогнійні бактерії, ентеробактерії, деякі види клостридій та ін.[6,8,9].
Склад нормальної мікрофлори кишечника досить індивідуальний, він формується з перших днів життя дитини. Нормальна дитина народжується із стерильним травним трактом, далі напротязі перших діб органи поступово заселяються різними мікрорганізмами, спектр яких визначається видом вигодовування.
Доведено, що джерелом мікробної контамінації кишечника новонароджених є в першу чергу мікрофлора родових шляхів матері та мікроорганізмів, які присутні в найближчому оточенні дитини в післяпологовому періоді. У випадку родорозв’язання за допомогою кесарєвого розтинання становлення нормальної мікрофлори кишечника новонароджених проходить набагато повільніше, порівняно з дітьми, які народжуються природнім шляхом. Показано, що мікрофлору кишечника цих дітей можна корегувати, використовуючи штами біфідобактерій, ізольованих із кишечника матері [7].
Заселення організму новонародженого нормальною мікрофлорою розцінюється як своєрідна інфекція, яка носить характер симбіозу, а саме збереження балансу організму хазяїна і екологічного балансу серед мікробних популяцій [4].
В більшості спектр мікробів залежить від характеру харчування. У осіб, які довгий час перебували на вегетаріанській дієті із більшою кількістю клітковини, підвищується вміст лактобактерій, ентерококів, коліморфних бактерій. При перевазі в раціоні м`ясних продуктів відмічається збільшення титра ешерихій, клостридій, зменшення вмісту ацидофільних бактерій. Надлишкове вживання алкоголю визиває загибель біфідобактерій. Склад флори кишечника змінюється також протягом доби, у всіх людей після вживання їжі число мікроорганізмів в кишечнику помірно збільшується, а через декілька годин повертається до вихідного значення.
Стан кишкової мікрофлори являється відображенням загального статусу організма, і перш за все, його травного тракту.
Наведені в даному розділі огляду дані показують, що вивчення нормальної мікрофлори кишок дуже складне і багатогранне, включає велике число різних аспектів, потребує подальшого глибокого дослідження. Аналіз літературних даних свідчить, що і на сьогодні всі аспекти взаємовідносин між організмом людини і його мікрофлорою далекі від вирішення.
1.1.2 Причини і наслідки порушення мікрофлори кишечника
Нормальна мікорфлора покриває шкіру та слизові оболонки, оскільки вона більш резистентна до дії зовнішніх фізичних, хімічних та біологічних факторів, регулюючи взаємовідносини між макроорганізмом та навколишнім середовищем, досить часто проявляє себе як природний сорбент, акумулюючи на собі значну кількість різних токсичних речовин, включаючи метали. Проявляючи антагоністичну активність по відношенню до патогенних та гнилостних мікроорганізмів, вона є найважливішим фактором, який перешкоджає розвитку інфекції в макроорганізмі.
Така рівновага мікробної екосистеми та організму може бути змінена або порушена під впливом факторів зовнішнього середовища, перш за все антимікробними та протипухлинними препаратами, а також при патологічних процесах у макроорганізмі, імунодефіцитних станах, онкологічних захворюваннях. Початком розвитку дисбіотичного стану кишечника є пригнічення індигенних анаеробних мікробів, таких як біфідобактерії та лактобактерії. Надмірне розмноження умовно-патогенних мікроорганізмі (ентеробактерій, стафілококів, стрептококів, клостридій, грибів) обтяжує перебіг основного захворювання і в результаті може призвести до інфекційних ускладнень.
Вперше поняття “дисбактеріоз” (kolondysbacterie) застосував ще у 1916 році німецький лікар A.Nissle, який розумів під цим терміном тільки зниження антагоністичної активності кишкової палички, її якісні та кількісні зміни. Л.Г.Перетц також основне значення приділяв кишковій паличці. Він визначав дисбактеріоз як патологічний стан кишкової мікрофлори (зменшення загальної кількості кишкової палички і зміни її властивостей), збільшення кількості гнилісних, гноєрідних, спороносних та інших видів мікробів [10].
Поняття “дисбактеріоз” з роками все розширювалось. Почали враховувати зміни не тільки в аеробній, але й анаеробній мікрофлорі. Більшість авторів при визначенні дисбактеріозу спирались на бактеріологічні показники, виходячи з уявлень про норму мікрофлори товстої кишки, виведену на підставі власних досліджень або літературних даних. Так, Р.В.Епштейн-Литвак і Ф.Л.Вільшанська у поняття дисбактеріоз вкладають виявлення таких асоціацій мікроорганізмів, які якісно чи кількісно відрізняються від нормального складу мікрофлори фекалій за рахунок зникнення чи зниження числа облігатних її представників з одного боку і з іншого – збільшення кількості ентеробактерій, які в нормі зустрічаються в невеликій кількості [11].
Однак, в останні роки поняття “дисбактеріоз” стає все більш дискусійним. В більшості країн світу термін “дисбактеріоз” чи характеристика мікробного стану кишок не використовується [12]. Не існує і відповідного клінічного діагнозу, використовується як суто бактеріологічне поняття [12,13,14,15,16]. У зарубіжній літературі для позначення порушення якісного і кількісного складу кишкової мікрофлори застосовують термін “синдром надлишкового росту бактерій” (bacterial overgrowth sydrome), під яким розуміють зміну складу мікрофлори в тонкій кишці.
Аналізуючи визначення терміну “дисбактеріоз”, бачимо, що бактеріологи та клініцисти характеризують його, в основному, на базі бактеріологічних даних. Однак, частина класифікацій беруть за основу етіологічну ознаку, тобто провідний вид мікроорганізму, що “викликає” дисбактеріоз. В.Н.Красноголовець розрізняє стафілококовий, протейний, кандидозний, асоційований дисбактеріози [17]. О.Я.Бабак і І.Є.Кушнір додають ще клебсієльозний, бактероїдний, клостридіозний [18,19].
М.В.Панчишина і С.Ф.Олійник [20] за причинами, що їх викликають, розрізняють такі види дисбактеріозу:
І. Дисбактеріоз у практично здорових людей:
1 – віковий;
2 – сезонний;
3 – харчовий;
4 – професійний;
ІІ. Дисбактеріоз у хворих:
при захворюваннях травного каналу неінфекційної природи;
при хворобах печінки;
при інфекційних захворюваннях травного каналу, включаючи протозойні і гельмінтні;
при атеросклерозі;
при злоякісних новоутвореннях;
ІІІ. Дисбактеріоз медикаментозний;
ІV. Дисбактеріоз після дії радіоактивного випромінювання;
V. Дисбактеріоз змішаної пироди.
Оцінюючи ряд наведених класифікацій, можна сказати, що деякі з них більше увагу акцентують на мікробіологічних характеристиках, інші - на клінічних проявах [21].
Існує велика кількість різних факторів, які призводять до порушення нормобіоценоза, спробуємо перерахувати найбільш важливіші. В першу чергу це необґрунтована та нераціональна антибіотикотерапія із призначенням препаратів низької якості, неправильного дозування або режиму введення препаратів напротязі доби, самолікування антибіотиками, що приводить до набутих кишковою флорою патогенних та інвазійних властивостей, розвитку стійкості до антибіотиків. Звичайно, впровадження антибіотиків у лікувальну практику було могутнім заходом у боротьбі з інфекційними хворобами, однак, з часом виявилися і негативні сторони дії цих препаратів.
Окрім антибактеріальних препаратів, до розвитку дисбактеріозу можуть приводити силіцилати, котрі стимулюють ріст гемолізуючих паличковидних і кокових форм, Campylobacter; кортикостероїди, які збільшують ріст грибів роду Candida; цитостатики, які викликають атрофію кишкового епітелію і зниження синтезу секреторного IgA, церукал, антисекреторні психотропні, адсорбенти, послаблюючі препарати.
На превеликий жаль, ми мало уваги приділяємо аліментарним факторам. В той же час тривале неповноцінне або незбалансоване харчування із пріоритетом будь-яких речовин (надлишок білків або жирів, або вуглеводів), вживання рафінованих із низьким вмістом харчових волокон, ферментів, вітамінів або нетрадиційних продуктів, штучне або змішане вигодовування дітей прісними адаптованими або неадаптованими сумішами без біфідогенних властивостей, голодування, неправильний режим харчування приводять до певних змін мікробного спектра кишечника.
Наступною причиною формування дисбактеріозу являються різні кишкові інфекції, такі як дизентерія, сальмонелез, холера, вірусні враження і інші.
Різного роду ферментопатії із вродженими або набутими дефектами функцій слизистої оболонки кишечника: лактазна недостатність (непереносимость молока), трегелазна недостатність (непереносимость грибів) іт.д. в результаті розвивається синдром мальабсорбції, який приводить до стійких порушень мікробного складу кишечника.
Хронічні захворювання і порушення функцій органів травлення, такі як хронічний холецистит, панкреатит, гепатит приводять до розвитку кишкового дисбактеріозу.
Мікробіоценоз кишечника вважають екологічною системою, яка чутлива до несприятливих змін навколишнього середовища, тому склад кишкової флори змінюється при зміні кліматогеографічних умов, тобто при нових умовах проживання, наприклад, при попаданні арктичні та антарктичні простори, космос, глибини океану. Також мікробіологічні зміни відбуваються при порушенні екології, обумовленою будуванням електростанцій, водосховищ, забруднення біосфери промисловими викидами, різними хімічними речовинами (розчинники, пестициди, сполуки хрому).
Навіть такі фактори, як фізичний та психологічний стреси при їх тривалому протіканні, також можуть порушувати мікробіоценоз кишечника [4].
Кишкова мікрофлора, яка являється частиною мікроекологіної системи організму, в нормальних умовах характеризується відносною постійністю видового складу. При дії зазначених вище несприятливих факторів відбувається порушення в нормальній мікрофлорі, які супроводжуються розвитком дисбактеріозів. Дисбактеріози в кишечнику в свою чергу призводять до цілого ряду розладів, причому не лише травної, але імунної і ендокринної систем.
Аналіз багаточисленної літератури показує, що лікування дисбактеріозу кишечника повинно бути комплексним і включати наступні направлення:
- дієтотерапія;
- зменшення патогенної анаеробної та факультативно-анаеробної мікрофлори;
- нормалізація кишкової мікрофлори з використанням пробіотиків;
- адсорбція і виведення токсичних речовин із кишечника;
- відновлення травлення;
- корекція імунного статусу;
- нормалізація обміну речовин [22].
Отже, не дивлячись на різноманітні причини, які лежать в основі порушення динамічної рівноваги мікробних асоціацій кишечника, їх розвиток все-таки характеризується рядом спільних ознак: збільшення кількості патогенних та умовно-патогенних мікрорганізмів із набуттям патогенних властивостей, та зменшення вмісту мікробів молочнокислого бродіння.
Таким чином, загальною проблемою сьогодення є вивчення симбіотичних асоціацій, які складають нормальну мікрофлору людини та вивчення впливу ряду препаратів на нормобіоценоз організму.
1.2 Антагоністичні властивості пробіотичних препаратів
Пробіотичні бактерії зустрічаються протягом всього ШКТ людини. Їх фізіологічне значення багатогранне, але в першу чергу вони беруть активну участь у забезпеченні захисної функції мікрофлори кишечника [23].
Серед молочнокислих бактерій, що найчастіше використовуються в пробіотичних препаратах для вживання людиною, G.W.Tannock наводить такі види, як: L.acidophilus, L.delbrueckii ss. bulgaricus, S.salivarius ss. thermophilus, B. adolescentis, B.bifidum, B.breve, B.longum, B.infantis [24].
Для пробіотичних препаратів використовують також бацили та гриби, більшість з яких традиційно пов`язані з травним каналом [25,26].
Молочнокислі бактерії своєю присутністю створюють антагоністичне середовище, направлене проти патогенних мікробів – грамнегативних та газоутворюючих анаеорбів. У кишковому тракті вони блокують рецептори щеплення хвороботворних мікроорганізмів і створюють умови для розвитку та росту корисних бактерій типу Е.соІі.
Молочнокислі бактерії представляють собою нерухомі мікроорганізми, які не утворюють спор, каталазонегативні, грампозитивні, не утворюють пігменту, не відновлюють нітратів до нітритів [27,28]. Вони є однією з розповсюджених у біосфері груп мікроорганізмів. Встановлено, що природним середовищем мешкання молочнокислих бактерій є ґрунт та ризосфера рослин [23,28]. Дослідження показали, що в травному тракті вивчених тварин містяться кількісно та якісно різні види молочнокислих бактерій, які змінюються в залежності від віку, засобів живлення та середовища існування тварин і людини. [29].
Біфідобактерії являються строгими анаеробами. Являючись частиною мікрофлори кишечника людини вони відіграють важливу роль в життєдіяльності макроорганізма за рахунок підтримання певного рН (3.8 - 4.0) в товстому кишечнику, виділенню молочної, оцтової і масляної кислот, які запобігають росту багатьох патогенних та умовно-патогенних бактерій. Ці бактерії зброджують глюкозу до оцтової та L(+)-молочної кислот в молярному співвідношенні 3:2, з невеликою кількістю мурашиної та янтарної кислот. Біфідо- та лактобактерії приймають участь в синтезі і всмоктуванні вітамінів групи В, К, фолієвої і нікотинової кислот, сприяють синтезу незамінних амінокислот, кращому засвоюванню вітаміну D і солей Са. Метаболіти біфідо- та лактобактерій володіють також антиалергічною дією. Крім набору кислот ці бактерії також продукують вітаміни, причому вітаміни групи В (В1, В2) виробляються в більших кількостях, ніж в процесі життєдіяльності кишкової палички [4]. Біфідобактерії включені до складу більше 70 різних продуктів харчування і до ряду терапевтичних препаратів, які застосовуються при порушеннях кишкового травлення у дітей, при ентероколітах, цирозах печінки, після застосування антибіотиків і для покращення кишкової перистальтики.
Продукти життєдіяльності молочнокислих бактерій, мабуть, були одними з перших антисептиків мікробного походження. У народній медицині кисломолочні сполуки здавна застосовувались для лікування опіків та ран, при порушенні функції ШКТ.
Спочатку антагоністичну дію молочнокислих бактерій по відношенню до інших мікроорганізмів пояснювали лиш пригнічуючою дією органічних кислот (в першу чергу – молочної), які вони продукували. Пізніше вдалося виявити, що антагоністичні властивості бактерій грунтуються не тільки на утворенні органічних кислот, але й на утворенні специфічних антибіотичних речовин (їх називають бактеріоцинами або мікроцини, коліцини). Так, наприклад, S.lactis виділяє нізин, Str.cremoris-диплококцин, L.acidophilus - ацидофілін і лактоцидин, L.brevis- бревін, L.plantanum - лактолін. Всі ці білогічно-активні речовини малостійкі і не мають високої антибіотичної активності.
Вивченню антибіотичних властивостей молочнокислих паличковидних бактерій була присвячена велика кількість робіт. Особливу увагу привертала ацидофільна паличка. Вона здатна приживатись в кишковому тракті, сприятливо діє на організм, пригнічує патогенну мікрофлору кишечника, сприяє виздоровленню від шлунково-кишкових захворювань. Ацидофільна паста використовується в акушерській практиці, дерматології та хірургії (лікування опіків, язв). Вважають, що антагоністичні властивості ацидофільної палички обумовлені як молочною кислотою, яку вона продукує, так і антибіотичними речовинами (Полонская 1952, 1959).
Після того, як було встановлено, що необхідним компонентом захисної мікрофлори кишечника є молочнокислі бактерії, вони стали найбільш вживаними мікроорганізмами для створення пробіотичних препаратів [30,31,32,33]. R.Fuller, вважає, що пробіотичний ефект введення лактобактерій здійснюється лише за умов збереження інших компонентів захисної флори та дефіциту лактобактерій. При відсутності цих умов ефективність лактобацил як пробіотиків сумнівна. Також не всі штами даного роду чи видів еквівалентні як пробіотики, так само як різний їх вплив на органолептичні властивості ферментованого продукту [31].
Широке використання лактобактерій повязано з довготривалим історичним досвідом їх безпечного застосування в продуктах, в звязку з чим їх відносять до групи звичайно безпечних – “generally regarded as safe (GRAS)”. Звичайно має значення і те, що велика кількість молочнокислих бактерій вже широко використовується в харчовій промисловості [34].
До теперішнього часу достеменно не відомо шлях, яким пробіотики здійснюють свій біологічний ефект, однак, відомі окремі фактори впливу на мікробну екосистему кишечника. Одним з механізмів дії пробіотиків є прямий антагоніз шляхом продукції певних хімічних компонентів різної молекулярної ваги. Ті, що мають білкову природу та кодуються плазмідами, належать до бактеріоцинів. Описано цілий ряд бактеріоцинів, які продукуються молочнокислими бактеріями. Крім того, антагоністична дія цих бактерій визначається також виділенням ними органічних кислот та низькомолекулярних метаболітів типу пептидів. Так само, жирні кислоти, що виробляються такими анаеробами як Bacteroides, можуть пригнічувати ентеротоксигенні E.coli та шигели. Спектр їх антагоністичної дії дуже широкий. Від низькомолекулярного метаболіту L.reuteri, який в очищеному вигляді – реутерин, пригнічує зростання всіх тест мікроорганізмів. До дуже специфічної антагоністичної активності певних штамів лактобацил по відношенню до Clostridium ramosus [35].
Для підвищення антагоністичної активності молочнокислих бактерій використовують різні мутагенні фактори – ультрафіолетове опромінення, хімічні агенти: етиловий ефір, уретан, етиленіміни [28]. Дослідження показали, що під дією цих факторів антибіотичні властивості молочнокислих бактерій значно підсилюються. Різноманітні види молочнокислих бактерій здатні вступати між собою не тільки в антагоністичні, але й симбіотичні взаємовідносини.
Наприклад, при виключенні деяких факторів росту (вітамінів групи В і амінокислот), необхідних для двох штамів, обидва організма могли рости в симбіозі, так як кожний з них продукував біологічно активні речовини, потрібні один одному. Так, L.arabinosus 17-5 (потребує фенілаланін) і Str.faecalis R (потребує фолієву кислоту, треонін, серин, гистидин або гліцин) ростуть в симбіозі, коли фенілаланін, треонін і фолієва кислота не внесені в середовище.
Тривалість життя молочнокислих бактерій без пересівів багаторазово підвищується у присутності дріжджів. Розвиваючись спільно, вони утворюють “захисне суспільство”, не допускаючи до нього сторонніх мікроорганізмів [28,36,37]. Відомо, що лактобацили більш стійкі до антагоністичного впливу патогенних мікроорганізмів, ніж інші бактерії [36]. Лактобацили виділені із кишечника людей, що мали тривалий контакт з антибіотиками, характеризуються значною перехресною лікарською стійкістю, але їх антибіотикорезистентність – не є стабільною.
За сучасним уявленням позитивна дія є багатокомпонентною і включає: пригнічення потенціальних патогенних мікроорганізмів за рахунок продукції антибактеріальних речовин, конкуренції за лімітуючі харчові сполуки; вплив пробіотиків на ферментну активність шкідливих кишкових мікроорганізмів; стимуляцію імунної системи макроорганізму; здатність лактобактерій асимілювати холестерол і таким чином знижувати вміст цього ліпіду в сироватці периферичної крові.
Крім значної антагоністичної активності лактобацил важливу роль відіграє їх висока адгезивність [7,38], з чим пов’язана здатність молочнокислих бактерій приживлятись на слизових оболонках різних порожнин макроорганізму. Такі властивості є як у нормальної так і патогенної мікрофлори ШКТ. Мікроорганізми з високими адгезивними властивостями отримують селективну перевагу в конкуренції з менш пристосованими бактеріями. Кишкові молочнокислі бактерії є мукозасоційованими мікроорганізмами і саме це в значній мірі вносять вклад в феномен колонізаційної резистентності кишечника. Звідси слідує, що одним із основних критеріїв пошуку перспективних штамів лакто- та біфідобактерій є їх високі адгезивні властивості. Слід зазначити, що більшість бактерій не можуть приживлятися у кишечнику хворого на довгий час, тому лікувальна дія цих пробіотиків буде транзиторною. Взаємодія патогенних мікроорганізмів з епітелієм слизової оболонки травного тракту може бути обмежена завдяки присутності на ній популяцій сапрофітних чи молочнокислих бактерій, при руйнуванні якої можливий розвиток патологічних змін в організмі. У більшості видів лактобацил адгезивні властивості корелюють із високою антимікробною дією та лізоцимною активністю [28]. Необхідно зауважити, що отримати антибіотики із молочнокислих бактерій у чистому вигляді до цього часу не вдалося, так як вони під час виділення втрачають свою активність.
Мікрофлора кишечника (в основному анаеробні бактерії) за допомогою адгезинів прикріплюється до епітелію слизової оболонки. Адгезини (ліганди) бактерій – це біополімери, які складаються з унікальних для кожного виду субодиниць білкової, гліколіпідної або глікопротеїнової природи. Вони можуть бути лектинами, і у такому випадку вибірково зв'язуються з вуглеводневими детермінантами глікопротеїнів і гліколіпідів, при цьому кожному лектину відповідає певний вуглеводний залишок. Це приблизно можна порівняти з взаємодією антиген –антитіло.
Біологічна плівка, яка утворюється виконує бар`єрну роль, вона затуляє рецептори слизової та підслизової оболонок від патогенних мікроорганізмів. Вона має негативний заряд і служить бар`єром на шляху проникнення катіонів деяких антибіотиків, патогенних та умовно-патогенних мікроорганізмів. Вона захищає на тільки слизову оболонку, а і самі автохтонні бактерії від дії антибіотиків і антитіл. Лактобактерії володіють більшою адгезивністю, завдяки наявності у глікокаліксі відносно великої кількості моносахаридів на відміну від бацил [39,40].
Отже, антагоністичні властивості лактобацил та їх здатність колонізувати епітелій КШТ, закріпляючись на його ворсинках, є основою для застосування цих мікроорганізмів у лікуванні дисбактеріозів, гастритів, язв КШТ. Такого стану можна досягти шляхом штучної колонізації кишечника бактеріями, які можуть впливати на мікроекологічну систему кишечника та організму хазяїна в цілому.
Ще однією з найважливіших функцій молочнокислих бактерій є їх участь у формуванні імунологічного статусу та функціонуванні імунної системи організму[41].
Дані щодо різнобічного впливу молочнокислих бактерій на імунну систему організму є найбільш новітніми. Встановлено, що лактобактерії можуть діяти як адюванти гуморальної імунної відповіді у людей та експериментальних тварин [42,43]. Показана безпосередня активізуюча дія пробіотиків на Т-кілери та В-лімфоцити [13]. Живі, вбиті нагріванням та компоненти клітинних стінок лактобактерій, а також препарати з бацил виявились добрими активаторами печінкових і перитонеальних макрофагів і мононуклеарних фагоцитів.
Пробіотикам притаманна функція індукторів α- і β– інтерферону, що встановлено в дослідах in vitro і в експерименті на тваринах.
Одним
із механізмів дії пробіотичних препаратів, який тісно пов`язаний з їх
імуномодулюючим впливом на макрооргaнізм, є явище транслокації бактерій з
перорально введених препаратів в кров`яне русло. Це явище було встановлено і
всебічно вивчено вітчизняними дослідниками під керівництвом академіка
В.В.Смірнова [26,45,46]. Автори встановили, що вже через дві хвилини після
введеня мишам пробіотичних препаратів або культур мікроорганізмів з їх складу,
частину бактерій виявляли в крові, легенях та печінці, а трохи згодом – і в
інших паренхіматозних органах з наступним поступовим зниженням числа
життєздатних клітин. Явище транслокації спостерігали постійно при введені дози,
яка пребільшувала 1*10![]() живих МК, при цьому в кров
надходила лише незначна чиатина – близько 0,01% введених бактерій.
живих МК, при цьому в кров
надходила лише незначна чиатина – близько 0,01% введених бактерій.
Відомо, що хімічний склад клітинної стінки багатьох молочнокислих бактерій досить постійний, на нього не впливає зміна складу середовища чи умов, у яких мікроорганізми вирощуються. Найважливіші клітинні агенти бактерій зосереджені саме в їх стінках. Методом хроматографії гідролізатів клітинних стінок ряду молочнокислих бактерій, показано, що амінокислотний склад їх більш за все характеризує рід, а якісний склад та кількість сахарів гексозамінів відбивають різницю між видами всередині самого роду.
Наприклад, встановлено, що стінки L.plantarum утримують аспарагінову кислоту, аланін, глутамінову кислоту, лізин, глюкозаміни та гексозаміни. L.delbrueckii, L.casei мають більш складний, ніж інші види роду хімічний склад клітинних стінок. Імуностимулюючу дію виявляють препарати із різних живих. Висушених, заморожених або убитих шляхом нагрівання. Ці властивості є й у дезінтегрованної біомаси бактерій. В експерименті на лабораторних тваринах встановлено, що молочнокислі бактерії, такі як L.delbrueckii, L.casei, L.acidophilus та Str.thermophilus стимулюють лімфоїдний апарат, синтез імуноглобулінів та активність інтерферону, посилюють мононуклеарну та фагоцитарну активність, активність натуральних кілерів, підвищують лізоцимальну та протимікробну дію, стимулюють реакції Т-клітинного імунітету [47]. Внутрішньочеревні ін'єкції живих бактерій L.delbrueckii, subsp.bulgaricus мишам стимулювали утворення інтерферону вже через 6 годин після їх введення.
1.2 Антагоністичні властивості пробіотичних препаратів
Поряд із підсиленням протиінфекційного імунітету молочнокислі бактерії виявляють також і протипухлинну активність. Протипухлинна активність пробіотиків та їх вплив на кишкову моторику є результатом непрямої дії. Одним із напрямків є руйнування ферментів, таких як азотредуктаза, нітроредуктаза, які переводять проканцерогени в канцерогени [48]. Інша точка зору полягає в тому, що живі або вбиті нагріванням лактобактерії індукують в організмі зростання активності макрофагів, лімфоцитів, виключаючи синтез ендогенних цитотоксинів та пухлино-некротизуючого фактору (TNF). Таким чином, дія на пухлину може здійснюватись як за рахунок прямої цитотоксичної діїї, так і щляхом стимуляції імунних механізмів. Нарешті, пробіотичні штами знижують рівень мутагенів у фекаліях, можливо шляхом зв`язування або сорбції мутагенів на бактеріальних клітинах [49].
І.Г. Богдановим одним із перших in vivo на мишах з саркомою 180, карциномою Ерліха, меланомою В-16 та аденокарциномою АСОТОЛ установленні протипухлинні властивості L.delbrueckii, коли введення культурального фільтрату призводило до повного зникнення пухлин майже у 50% лабораторних тварин [49,50]. Ним було запропоновано декілька лікарських засобів із L.bulgaricus. Із клітинної фракції лактобацил було виділено три глікопептиди: 1,2 та 10кД. Один з найбільш активних препаратів отримав назву бластолізин.
Протипухлинну дію встановлено також і при використанні інших видів лактобактерій, наприклад, L.casei. Субстанцією цих бактерій особливо успішно лікували мишей за введенням її підшкірно в область лімфатичних вузлів, які дренували пухлину.
При лікуванні хворих з різними локалізаціями злоякісних пухлин хіміо- чи променевою терапією рекомендується використовувати молочнокислі бактерії, які значно покращують загальний стан хворих та знижують побічні дії лікарських засобів.
Епідеміологічні дослідження багатьох країн світу показали, що виникнення раку товстого кишечника спостерігається більше в популяції людей, які споживають західні рафіновані дієти, порівняно з тим, що вживають вегетаріанські та молочнокислі продукти. Було відмічено, що у пацієнтів з раком товстої кишки в фекаліях знаходиться в середньому на порядок менше молочнокислих бактерій. У людей з високим ризиком рака товстої кишки переважали Bifidumbacterium, Peptococcus, Clostridium, а в людей з малим ризиком виникнення раку товстої кишки домінували Bac.pneumoniae, Lactobacilus[51].
На значній виробці хворих виявлено, що ризик виникнення раку молочної залози позитивно корелював з частотою вживання жирних сирів та молока корів і негативно – з частотою вживання йогуртів з живими лактобацилами.
В останні роки спороутворюючі бактерії роду Bacillus як найбільш відомі представники екзогенної мікрофлори привертають увагу дослідників. Досить великий арсенал видів цього роду використовувався в якості терапевтичних речовин при лікуванні гострих і хронічних інфекцій: B.cereus, B.polymyxa, B.brevis, B.megaterium, B.pumilus, B.coagulans та ін. Однак найбільш розповсюдженні і вивчені види B.subtilis i B.licheniformis [52].
Ці мікроорганізми завдяки високим адаптивним властивостям широко розповсюдженні в природі і зокрема в тих об`єктах, з якими людина контактує найбільш близько. Завдяки цьому бацили постійно і в значній мірі кількості потрапляють в організм людини і, оскільки є стійкими до літичних і травних ферментів, зберігають життєдіяльність напротязі всього ШКТ.
Серед різних представників екзогенної мікрофлори бацили характеризуються рядом переваг, які дозволяють вважати їх найбільш ефективними в якості нових біопрепаратів:
ці бактерії (окрім B.anthracis і B.cereus), як правило, є нешкідливими для макроорганізму навіть у концентраціях, які значно перевищують рекомендовані для вживання;
при пероральному вживанні ці мікроорганізми істотно підвищують неспецифічну резистентність макроорганізм;
антагоністична активність їх більш виражена і проявляється до більш широкого спектру патогенних і умовно-патогенних мікроорганізмів, ніж у інших представників екзогенної і ендогенної мікрофлори.
бацили характеризуються високою ферментативною активністю, яка дозволяє їм регулювати і стимулювати травлення, виявляти протиалергійну і антитоксичну дію;
ці мікроорганізми стабільні при зберіганні;
вони екологічно безпечні [53, 54, 55].
Бацили не формують біоплівок, оскільки їх адгезивні властивості слабо виражені. Їх активність проявляється в кишечнику і пов'язана перед усім не з конкурентними взаєминами за місця прикріплення до слизової, а з високою антагоністичною активністю у відношенні до багатьох патогенних бактерій. В той самий час бактерії роду Bacillus не виявляють антагоністичної дії на представників нормальної мікрофлори, що створює умови для безконкурентного відновлення мікрофлори [55].
Антимікробна активність аеробних спороутворюючих бактерій роду Bacillus може бути обумовлена літичними ферментами, які вони синтезують. Так, деякі вчені виділили із B. subtilis еластазу, яка надає літичної дії на грамнегативні та грампозитивні мікроорганізми.
Завдяки високій і різноманітній ферментативній активності бактерій роду Bacillus, які входять до складу біопрепаратів-пробіотиків, можуть відігравати суттєву роль в стимуляції і збагаченні травної системи хазяїна необхідними ферментами [56,57]. Так, наприклад, бацили характеризуються вираженою амілолітичною активністю, причому деякі амілази відрізняються тим, що при гідролізі крохмалю, який каталізують ці ферменти, утворюються сахара α–конфігурації і олігосахара не більше мальтотетрози. Характерною для бацил являється висока протеолітична активність. Із культуральної рідини B.subtilis виділили протеолітичний фермент, який володіє властивістю стимулювати регенераційні процеси. Інший протеолітичний фермент із бацил являється тромболітичним препаратом, який проявляє свою активність навіть при пероральному вживанні. Цікаво, що деякі ферменти бацил зберігають активність навіть в неживих клітинах.
Позитивну роль відіграє здатність бацил продукувати в значних кількостях екзоцелюлярні амінокислоти, в тому числі і незамінні (треонін, аланін, тирозин, гистидин, валін та ін.). Важливою також являється вітамінсинтезуюча активність бактерій роду Bacillus.
Наявність бацил в пробіотичній суміші мікроорганізмів сприяло значно ефективніше зниженню холестерина в крові тварин, чим при їх відсутності. На дослідах також спостерігали більш виражену здатність зв'язувати жирні кислоти і зменшувати утворення холестеринових міцел при наявності бактерії роду Bacillus[58].
Отже, аеробні спороутворюючі бактерії роду Bacillus - перспективна група мікроорганізмів для створення нових високоефективних біопрепаратів. По-перше, вони характеризуються найбільш вираженою антагоністичною активністю по відношенню до патогенних і умовно-патогенних мікроорганізмів. По-друге, відомо, що на основі аеробних спороутворюючих бактерій можна отримувати штами із заданими властивостями, оскільки ці бактерії являються досить гарно вивченою системою для клонування.
Ряд робіт присвячено пробіотикам на основі представників роду Aerococcus [59], а також про використання дріжджів для виробництва пробіотиків. Так, лікування препаратом, до складу якого входили Saccharomyces boulardii, виявилось ефективним при кишкових інфекціях обумовлених Clostridium dificile. Виражений клінічний ефект отримали також при використанні Saccharomyces cerevisiae.
Вище викладене свідчить, що спектр мікроорганізмів складових пробіотичних препаратів досить широкий. Звичайно, найбільш поширеними серед них є молочнокислі бактерії, як одна із широко розповсюджених у біосфері груп мікроорганізмів. Вивчення молочнокислих бактерій як антагоністів патогенної та умовно-патогенної мікрофлори, грибів та вірусів має велике значення для підтримки гомеостазу організму людини, який в значній мірі обумовлений станом мікрофлори, створеної по ходу еволюційного процесу симбіонтного та природного відбору.
Дослідження по визначенню антимікробної активності молочнокислих бактерій дозволяють виявити індивідуальні особливості кожної культури, що представляється значимим для подальшого вивчення природи і механізму дії бактеріоцинів. Знання антагоністичних властивостей кожної культури, оптимальних умов для їхнього максимального прояву необхідне при складанні рецептури лікувально-дієтичних продуктів із заданими властивостями. Участь симбіонтів біопрепаратів у формуванні імунологічного статусу відкриває перспективи застосування їх при хворобах інших систем організму, окрім кишкового тракту.
1.3. Використання пробіотиків для підтримання нормобіоценозу людини
Фундаментальні дослідження сучасної біологічної та медичної наук дозволили розробити і впровадити в практику біопрепарати, домінуюче положення в яких займають препарати з живих непатогенних бактерій – представників нормальної мікрофлори – пробіотики (еубіотики). Піонером цього напрямку був І.І.Мечніков, який обгрунтував споживання ферментованого молока, виділив і застосував для ферментації лактобацилу, яка дійшла до нашого часу як Bulgarian bacillus. Після наукового обгрунтування І.І.Мечніковим позитивного впливу на організм людини ферментованого молока та простеження антагоністичного ефекту між штамами бактерій, в мікробіології розпочався етап використання мікробів для посилення захисту від інфекійних хвороб. Останні десятиріччя, враховуючи зростаючий інтерес в суспільстві до здорового способу життя, повязанні з вивченням ферментованих продуктів як пробіотичних препаратів, а використання живих мікроорганізмів - із створенням стратегії пробіотиків.
Термін “пробіотик” був введений в 1965 році Lilley, Stillwell. R.Parker в 1974р. використав цей термін для обозначення живих мікроорганізмів. Пізніше R.Fuller сформулював це поняття як “добавка до корму, що містить живі мікроорганізми, яка позитивно діє на організм тварин, внаслідок чого виздоровлює мікрофлора кишечника”. Це визначення було застосовано й до організму людини і отримало широке розповсюдження в якості збірного поняття, що об`єднує живі мікроорганізми, які поступають в ШКТ та покращують життєдіяльність хазяїна за рахунок нормалізації його мікробної екосистеми [4].
Неперетравленні харчові добавки іншого походження, які мають позитивну дію на організм хазяїна через селективну стимуляцію росту і/або активності представників нормальної мікрофлори кишечника, R.Fuller пропонує називати пребіотиками. В якості пребіотиків розглядаються біфідобактерії, рідше – Lactobacillus, а по даним деяких авторів – і E.faecium [44]. Автор концепції пред`являє до пребіотиків наступну вимогу, вони не повинні гідролізуватись і абсорбуватись у верхніх відділах ШКТ.
Шендеров проаналізувавши речовини, які здатні стимулювати ріст нормальної мікрофлори, і запропонував розділити пребіотики на наступні групи:
моносахариди і спирти (ксилоза, ксилобіоза, рафіноза, сорбіт);
олігосахариди (лактулоза, фруктоолігосахарид, галактоолігосахарид,
ксилоолігосахарид);
полісахариди (пектини, декстрин, інуліні ін.);
ферменти (β-галактозидаза мікробного походження, протеази сахароміцетів і ін.);
пептиди (соєві, молочні);
антиоксиданти (вітаміни групи В, вітамін Е, аскорбінова кислота), а також інші біологічно активні добавки – амінокислоти, рослинні екстракти, органічні кислоти і т. д. [52]
Більшість спеціалістів і дослідників відносять до бактерій-пробіотиків в основному так звані еубіотики (представники нормальної мікрофлори шлунку) і частіше всього біфідобактерії і молочнокислі мікроорганізми роду Lactobacillus, називаючи їх класичними пробіотиками. Це пов’язано з тим, що найбільша кількість позитивно впливаючих на здоров’я людини бактерій, виділено саме із кишечника людини, і саме ці бактерії, заповнюючи КШТ беруть на себе основну захисну функцію, в той час як інші мікроорганізми яляються транзитними. Пробіотичними властивостями володіють молочнокислі палички та коки, яких немає в кишечнику людини, а також інші мікроорганізми – B.subtilis, B.licheniformis, B.cereus, L.acidophilus, L.delbrueckii, L.plantarum, L.fermentum, L.salivarius, L.casei, L.rhamnosus, L.reuteri, B.bifidum, B.longum, B.adolescentis, E.coli, Ent.faecium, Str.saliverius subsp. thermophilus, Saccharomyces boulardii) [52].
Крім
того, автори використовують різні сполучення цих мікрорганізмів, а також форми
застосування. В нашій країні традиційно склалося ділення препаратів, що містять
живі бактерії, на медичні препарати і харчові добавки. При цьому зазначається,
що “терапевтичним мінімумом” вважається 10![]() живих мікробних клітин в 1г
продукту. Саме зберігання достатньої кількості життєздатних клітин є однією з
найбільш проблематичних сторін використання пробіотиків. Крім того, введені
бактерії мають ще прижитись в кишечнику людини і виробляти in situ активні
речовини.
живих мікробних клітин в 1г
продукту. Саме зберігання достатньої кількості життєздатних клітин є однією з
найбільш проблематичних сторін використання пробіотиків. Крім того, введені
бактерії мають ще прижитись в кишечнику людини і виробляти in situ активні
речовини.
Залежно від природи складових компонентів і форми використання, можна виділити такі основні групи пробіотиків:
-препарати, котрі містять живі мікроорганізми (монокультур або їхні комплекси);
-препарати, котрі містять структурні компоненти мікроорганізмів – представників нормальної мікрофлори або їхніх метаболітів;
-препарати мікробного або іншого походження, котрі стимулюють ріст та активність мікроорганізмів - представників нормальної мікрофлори;
-препарати, котрі є комплексами живих мікроорганізмів, їхніх структурних компонентів та метаболітів у різних поєднаннях, а також сполук, що стимулюють ріст представників нормальної мікрофлори;
-препарати на основі живих генно-інженерних штамів мікроорганізмів, їхніх структурних компонентів і метаболітів із заданими характеристиками;
-продукти функціонального харчування на основі живих мікроорганізмів, їхніх метаболітів, інших сполук мікробного, рослинного або тваринного походження, здатних підтримувати та відновлювати здоров’я шляхом корекції мікробної екології організму людини) [44]. Класифікація пробіотичних препаратів залежно від складових компонентів представлена в таблиці 1.2.
Таблиця 1.2 Класифікація пробіотичних препаратів
| Монокомпонентні |
|
Які містять кишкову паличку: Колібактерин (E.coli М17) Мутафлор Коліфлорал Які містять лактобактерії: Лактобактерин (L.fermenti 90 TC-4) Нормофлор (L.acidophilus) Ацилакт (3 штама L.acidophilus) Лактинекс (L.acidophilus + L.bulgsricus) Які містять біфідумбактерії: Біфідумбактерин (B.bifidum 1,791) Біфідин сухий (B.adolescentis MC-42) Які містять ентерококи: Біофлорин (Ent.faecium 68) |
| Самоелімінуючі |
|
Бактисубтіл (B.cereus) Флонівін (Bacillus spp.) Споробактерин (B.subtiles) Біоспорин (B.subtilis + B.licheniformis) Субалін (Штам-мутант JP5832) Перентерол (S.boulardii) Ентерол (S.boulаrdii) |
| Полікомпонентні |
|
Біфі-форм (B.longum + Ent.faecium) Біфіцид (B.adolescentis B1 + L.acidophilus AT-41) Лібелін Лінекс (B.infantis v.liberorum + L.acidophilus + S.faecium SF-68) Біфікол (B.bifidum + E.coli M-17) Ліобіфідус Примадофілус (Bifidobacterium sp. + Lactobacterium sp.) |
|
Комбіновані (містять мікроорганізми і інші компоненти) |
|
Біфідумбактерин-форте (Bifidobacterium sp.+ кісточкове активоване вугілля) Аципол (L.acidophilus NK1, NK2, NK5, NK12 + Kefir grevis) Кипацид (L.acidophilus + комплексний імуноглобуліновий препарат) Нутрилон-В (L.sporogenes + тіаміна мононітрат + рибофлавін+ нікотинамід) Гастрофарм (L.bulgaricus + протеїн + сахароза) Біфіліз (B.bfidum + лізоцим) Біфілакт (B.bfidum + Lactobacillus sp. + лізоцим) Карболевур (Saccharomyces cerevisiae + кремній-органічний сорбент) |
|
Рекомбінантні (не містять живих мікроорганізмів) |
|
Хілак Хілак-форте Нормазе Дуфалак Фродо Порталак Інулін |
1.3.1 Біопрепарати для корекції мікрофлори організму людини
Пробіотики на основі компонентів мікробних клітин або метаболітів реалізують свій позитивний вплив на гомеостаз, безпосередньо впливаючи на метаболічну активність клітин відповідних органів і тканин або опосередковано – регулюючи активність мікрофлори на слизовій оболонці кишечнику.
Більшість пробіотиків, які маємо на теперішньому фармацевтичному ринку, застосовують для лікування та профілактики дисбактеріозів ШКТ. Одиничні розробки пробіотиків для санації ротової порожнини та урогенітальної системи. Розглянемо перелік основних із них.
Кишкові палички почали застосовувати в якості основи біопрепаратів ще з 1918 року в складі мутафлора. Ефективність препарату пов'язували із різким зменшенням утворення в кишечнику токсичних речовин під впливом нормалізованої кишкової мікрофлори. В СРСР для розробки нового пробіотика використали штам E.coli М17, який вирощували на молоці. “Коліпростокваша” мала короткий термін зберігання і тому не отримала широкого розповсюдження. В 1961р. було отримано ліофільно висушенний препарат – сухий колібактерин, котрий по ефективності не поступав рідкій молочній формі.
В наш час розробленні нові форми колібактерина – таблетки, капсули, свічки. Кишкові палички являються основою і інших препаратів – нормофлорина, коліфлорана, севакола, мутафлора, нормофлора [52,69].
Першим із пробіотиків, як було вказано вище, був створений колібактерин, пізніше - лактобактерин, біфідумбактерин та біфікол. Ці препарати містять ослаблені живі штами нормальної мікрофлори кишечника.
Колібактерин представляє собою живі бактерії кишкової палички М17 по 10-30 млрд мікробних клітин в одній дозі. Форма випуску – ампули і таблетки.
Біфідумбактерин
– містить ліофільно висушені живі клітини штамів B.bifidum №1, 791. В одній
дозі препарату не менше 10![]() живих клітин. Випускається в
таблетках, капсулах, пакетах, флаконах [19].
живих клітин. Випускається в
таблетках, капсулах, пакетах, флаконах [19].
Лактобактерин – препарат із L.fermenti 90 TC-4, в одній дозі 5млн. живих мікробів. Цей препарат відрізняється високим антагонізмом по відношенню до ешеріхій, ентерококів, протея та грибів.
А-бактерин
– входить до групи бактерійних препаратів із представників нормальної
мікрофлори людини. У складі препарату використана ліофілізована культура
виробничого штаму №167 Aerococcus viridans, виділеного із грудного молока.
Препарат у вигляді порошка. 1 доза – 2*10![]() живих клітин аерококів.
Застосовується при лікуванні гнійних інфекцій стафілококової, протейної,
ешерихіозної етіології, а також перорально з цілю корекції мікрофлори
кишечника.
живих клітин аерококів.
Застосовується при лікуванні гнійних інфекцій стафілококової, протейної,
ешерихіозної етіології, а також перорально з цілю корекції мікрофлори
кишечника.
Препарат “Лактінекс” (виробництво США) містить комбінацію штамів L.acidophilus і L.bulgаricus та використовується для профілактики діареї мандрівників, викликаної ентеропатогенною кишковою паличкою. В препараті “Lactobacillus gg” використовуються живі клітини L.casei із тією ж ціллю.
Біолактон – представляє собою висушену ліофільним способом культуру ацидофільної палички штаму 12Б, яка володіє високою антибактеріальною і ферментативною активністю.
“Мальтідофілюс”- пробіотик містить висушені при низьких температурах живі активні клітини L.acidophilus, L.bulgаricus, B.bifidum на основі мальтодекстрина. Представляє собою порошок, який містить в 1 г 3*10:9 КУО. Випускається в капсулах.
У групі монокомпонентних виділяють такі препарати як нормофлор (L.acidophilus), біофлорин (Ent.faecium 68), аеробакт та ін.
Виділяють ще групи полікомпонентних, комбінованих, рекомбінантних та самоелімінуючих препаратів.
Наприклад, такий препарат як лінекс, який містить сублімаційно висушені біфідобактерії, лактобактерії та фекальний стрептокок (S.faecium), забезпечує бактерицидну та антидіарейну дію.
Серед
полікомпонентних препаратів слід відмітити також біфіформ - пробіотик компанії
“Ферросан” (Данія) призначений для профілактики і лікування дисбактеріозу
кишечника. Випускається в капсулах, кожна із яких містить 10![]() B.longum, 10
B.longum, 10![]() E.faecium.
Препарат володіє широким спектром антагоністичної активності по відношенню до
патогенних та умовно-патогенних мікрооорганізмів. Завдяки спеціальній, стійкій
до шлункового соку оболонки, бактерії вивільняються із капсули безпосередньо в
кишечнику, і тим самим не піддаються дії кислому середовищу шлунка. Приймають
до 4 капсул на добу [57].
E.faecium.
Препарат володіє широким спектром антагоністичної активності по відношенню до
патогенних та умовно-патогенних мікрооорганізмів. Завдяки спеціальній, стійкій
до шлункового соку оболонки, бактерії вивільняються із капсули безпосередньо в
кишечнику, і тим самим не піддаються дії кислому середовищу шлунка. Приймають
до 4 капсул на добу [57].
Біфікол сухий – комплексний препарат, який представляє собою суміш живих біфідобактерії штам №1 і кишкові палички штам М17. Випускається у флаконах [19].
Можна виділити, ще таку групу препаратів як самоелімінуючі. Особливістю цих біопрепаратів являється те, що не вступаючи в конфлікт з іншими мікроорганізмами, бактерії, які входять до їх складу, займають свою екологічну “нішу” і сприяють нормалізації біоценозу кишечника, відновлюють процеси синтезу вітамінів, регулюють бродильні процеси.
До цих пробіотиків відноситься флонівін (Bacillus spp.), субалін (Штам-мутант JP5832), біоспорин (B.subtilis + B.licheniformis), ентерол (S.boulardii) та інші препарати. Ці препарати особливо ефективні при лікуванні дисбактеріоза кишечника, який обумовлений використанням антибіотиків.
Препарат субалін має не тільки виражену стабілізуючу дію на мікрофлору кишечника, але й володіє інтерфероногенними властивостями, впливає на клітинний імунітет і неспецифічну резистентність організму. Для його отримання автори використали один із штамів, який входив до складу пробіотика біоспорину, а саме B.subtilis 3. В новий рекомбінантний штам B.subtilis2335/105 був вставлений ген антивірусної активності, який відповідав за продукцію універсального антивірусного агента α-інтерферона. Штам продукує інтерферон у вигляді гібридного білку із сигнальним –амілазним пептидом, котрий обумовлює екскрецію інтерферона через клітинну стінку. Таким чином новий штам на фоні високої антибактеріальної активності, які присутня материнському штаму, володіє противірусними властивостями. Поєднання таких властивостей робить субалін досить перспективним для лікування вірусних і змішаних інфекцій[52,69].
Одним із перших бацилярних пробіотиків, які з`явилися на фармацевтичному ринку, являється “Бактисубтил”. Його синоніми – Bacitracin, Orobicin, Subticetin. В основі цього препарату штам ІР B.cereus 5832. В 1 капсулі міститься 1 млрд спор бактерій культури B.subtilis IP 5832. B.subtilis, попадаючи в кишечник, протягом декількох годин перетворюється у вегетативну форму. Вегетативні форми бактерій володіють вираженою антагоністичною дією по відношенню до патогенної і умовно-патогенної мікрофлори, селективно стимулюють ріст лакто- і біфідофлори, вивільняють ферменти, які розщеплюють жири, білки, вуглеводи, покращують синтез вітамінів груп Р і К. Препарат рекомендований не тільки для лікування діарей різної етіології, він надає лікувальну дію і при піелонефритах, визваних ентеробактеріями або протеєм, при лікуванні інфікованих варикозних ран. Всі автори відмічають високу безпечність при застосуванні.
Високу лікувальну ефективність при терапії діарей у дітей продемонстрував препарат “Cereobiogen”, основу якого складає B.cereus. Автори вважають, що бактеріальний штам являється стимулятором росту біфідобактерій кишкової мікрофлори і саме з цим пов'язують отриманні клінічні результати. В той же час B.cereus являється умоно-патогенним мікроорганізмом [52,69].
В 1989 р. був створений, а в 1992 введений в практику новий пробіотик – біоспорин. До складу препарату входять два штами спороутворюючих бактерій - B.subtilis №3 та B.licheniformis №31, які знаходяться в вегетативній і споровій формах. Штами доповнюють один одного по антагоністичній активності та ефективні по відношенню до клінічних штамів бактерій родів Salmonella, Staphylococcus, Klebsiella, Citrobacter, Campylobacter, Proreus, Yersinia, патогенній E.coli і грибам роду Candida. Препарат використовують для профілактики і лікування дисбактеріозів та гострих кишкових інфекцій. Виявлена його активність і при лікуванні після радіаційних ускладнень. Випускається біоспорин в ампулах, застосовується по 1-2 дози 3-4 рази на день. Курс лікування 10-14 днів[19].
Єдиним дріжджовим препаратом, який є на Європейському фармацевтичному ринку, являється Перентерол (Бельгія), в якому міститься Saccharomyces boulаrdii. Цей пробіотик випускається у ліофілізованній формі.
Лабораторія “Біокодекс” (Франція) випускає цей дріжджовий пробіотик під назвою Ентерол-250. Його випускають в пакетиках або капсулах, кожний із яких містить 282,5 мг ліофілізованих Saccharomyces boulаrdii (250 мг дріжджів і 32,5 мг лактози). Ентерол антагоністично діє на клостридії, шигелли, стафілококи, кишкові палички, сальмонели, а також на простіші (амеб, лямбій), антитоксично діє по відношенню до цитотоксину Cl.dificile, підсилює місцевий імунний захист кишечника внаслідок збільшення вироблення IgA і його секректорного компонента, лізоциму, збільшує активність дисахаридаз тонкого кишечника (лактази, сахарози, мальтози), покращує переносимість молока і молочних продуктів. Швидко виводиться із організму, не затримуючись в шлунково-кишковому тракті. Можна застосовувати разом із антибіотиками [52,69].
З ціллю корекції глибоких порушень мікробіоценоза кишечника, коли фіксуються не типові форми мікрорганізмів-симбіонтів, використовуються комбіновані мікробні препарати, які містять цілий комплекс підібраних штамів, однотипних за механізмом своєї дії. Серед них виділяють такі, як кипацид (L.acidophilus + комплексний імуноглобуліновий препарат), гастрофарм (L.bulgaricus + протеїн + сахароза), біфіліз (Bifobacterium + лізоцим), карболевур (S.cerevisiae + кремній-органічний сорбент), біфілакт (B.bіfidum + Lactobacillus sp. + лізоцим) та ін.
Біфідумбактерин-форте
– ліофільно висушенні живі клітини біфідобактерій, іммобілізовані на сорбенті
(кісточкове активоване вугілля). В одній дозі не менше 10![]() КУО. Іммобілізовані
біфідобактерії забезпечують високу локальну колонізацію слизистих оболонок, швидше
відновлюють нормофлору кишечника.
КУО. Іммобілізовані
біфідобактерії забезпечують високу локальну колонізацію слизистих оболонок, швидше
відновлюють нормофлору кишечника.
Такий
препарат як нутролін В (лактобацили із комплексом вітамінів групи В)
випускаються у двох лікарських формах – капсули і сироп. Кожна капсула містить
Lactobacillus Sporogenes 4*10![]() МК (грампозитивні молочнокислі
бактерії – представники нормальноїкшкової флори, які сприяють виробленню
вітаміна В в кишечнику і пригнічують ріст патогенних бактерій і грибів), а
також тіаміна моноцитрат, нікотинамід, рибофлвін.
МК (грампозитивні молочнокислі
бактерії – представники нормальноїкшкової флори, які сприяють виробленню
вітаміна В в кишечнику і пригнічують ріст патогенних бактерій і грибів), а
також тіаміна моноцитрат, нікотинамід, рибофлвін.
Препарати на основі лактобактерій, біфідобактерій, кишкової палички та інших мікрорганізмів мають ряд недоліків пов`язаних з тим, що при запальних захворюваннях кишечника формуються несприятливі умови, які знижують їх ефективність. Крім того на них впливає рН середовища і ферментів, чутливих до антибіотиків, хіміо- та променевої терапії. Бактерійні лікарські речовини потребують особливих умов зберігання. На думку С.М.Захаренко [60], препарати метаболітного типу (хілак, дуфалак та ін.) мають ряд переваг щодо живих бактерій. Вони містять продукти обміну грампозитивних і грамнегативних бактерій лактозу, амінокислоти, жирні кислоти і інші біологічно активні речовини, які сприяють створенню оптимального рН в кишечнику і при цьому не чутливі до дії антибіотиків і хіміопрепаратів. Отже, маємо ще одну групу - рекомбінантних пробіотиків (які не містять живих мікроорганізмів). До них відносять хілак, хілак-форте, дуфалак, інулін,фродо, нормазе, порталак та ін.
Виділяють групу препаратів, виготовлених на основі мультисорба - екстралакт, біфілакт-екстра, біфідумбактерин-екстра. Мультисорб унікальний завдяки високому вмісту лігніна – біополімера, який може сорбувати жовчні кислоти, підсилювати розпад холестерина і виводити токсини і шлаки із організму.
Біфідус
флора Форс – біологічно активна добавка до їжі, яка відновлює мікрофлору
кишечника, нормалізує синтез вітамінів Е і К, захищає організм від
гелікобактеріоза та вірусної інфекції. Випускається компанією NSP, форма
випуску – капсули, кожна із яких містить L.acidophilus – 25*10![]() і B.longum – 1,0*10
і B.longum – 1,0*10![]() КУО. Приймають
по 1 капсулі 3 рази на день.
КУО. Приймають
по 1 капсулі 3 рази на день.
Біофлор – препарат складається із екстрактів овочів, трав і прополіса, які частково ферментовані живими бактеріями E.coli (шт. М17). Препарат починає діяти одразі після вживання. В кишечнику створюється конкурентноздатна концентрація E.coli. Саме за рахунок цього досягається витіснення умовно-патогенної мікрофлори, відбувається активізація захисних сил організму під дією біологічно активних екстрактів.
Окарін сухий – представляє суміш мікробних культур E.coli і Ent.faecium, ліофілізованих в середовищі культивування із добавленням цукрово-желатинового середовища. Випускається у флаконах від 1 до 5 порцій і має вид кристалічної або пористої маси рожевого кольору. Застосовується при дисфункціях різної етіології, при авітамінозі (нестача вітамінів В, С, К), при онкологічних і туберкульозних станах, а також в якості радіопротекторної речовини; крім того, ефективний з ціллю профілактики маститу і при аденомі.
“Біококтейль К плюс” автори відносять до пробіотиків нового покоління. В його складі живі клітини E.coli штаму М17 у активній формі в комплексі із екстрактом сої, буряку, петрушки, м'яти, часнику і приполісу, які ферментовані по певній технології. Випускається у флаконах. Ефективний при гастритах, колітах, цукровому діабеті, дерматитах, анеміях, порушеннях жирового і мінерального обміну і т. д.[52,69].
В наш час пробіотики використовуються досить широко і джерелами надходження їх в організм людини різноманітні. В першу чергу це фармацевтичні форми біологічних препаратів та біологічно активні добавки (БАД) до їжі. По друге – природні харчові продукти на молочній та рослинній основі, виготовленні біотехнологічним способом із використанням різних мікроорганізмів. Особливе місце серед них для забезпечення пробіотичного ефекту займають лікарські кисломолочні продукти [24].
Препарати та БАД, як було розглянуто вище, містять мікроорганізми як у вигляді чистих монокультур (в захисних поживних середовищах або без них), так і в комбінаціях, частіше всього в ліофільно висушеному стані в капсулах, порошках, таблетках для перорального вживання, в ректальних та вагінальних свічках, жувальних цукерках і гумках, рідше – в рідкому вигляді. Комбінації можуть включати поєднання культур (декілька штамів одного роду або виду, різних таксономічних груп).
За кордоном зараз досить популярні препарати, які складаються із 6-8 пробіотиків. В літературі з`явилися навіть відповідні терміни – “симбіотики” (від слова симбіоз), “мультипробіотики”. Деякі автори висловлюють ідею, згідно якій кожний штам мультипробіотика в кишечнику знаходить для себе найкращі умови і займає властиву йому мікроекологічну нішу - біотоп. Тому для створення препаратів повинно відбирати штами, перевірені на симбіотичість та селекційовані до виживання в несприятливих умовах.
Отже, в сучасний період застосування пробіотиків і пребіотиків, в звязку із встановленням позитивної дії останніх на організм людини, набуває все більшого поширення. Значно збільшується число пробіотичних мікроорганізмів і препаратів на їх основі та розширюється спектр їх використання з профілактичною та лікувальною ціллю. В таблиці 1.3. представлено перелік пробіотичних препаратів, які найчастіше використовуються в клінічній практиці.
Таблиця 1.3 Пробіотики та пребіотики, які використовуються в клінічній практиці в Україні.
|
Торгова назва, фірма-виробник |
Лікарська форма |
Склад, доза | |
| Мікроорганізми | інші інгрідієнти | ||
|
Бактисубтил Hoechst Marion Roussel |
Капс. |
B. cereus 1*10 |
Кальцію карбонат, біла глина, желатин, титану оксид |
|
Біфідумбактерин сухий Біофарма |
Суха речовина в флак. 5 доз |
B.bifidum 1*10 |
- |
|
Біфідумбактерин сухий Алерген |
Суха речовина в флак 5 доз |
Той же | |
|
Біфідумбактерин сухий Біолік |
Суха речовина в амп. 5 доз |
Той же | |
|
Біфідумбактерин сухий Біомед |
Суха речовина в амп. 5 доз |
Той же | |
|
Біфікол сухий Біолік |
Суха речовина в флак 5 доз |
B.bifidum E.coli M 17 |
- |
|
Біфікол сухий Біомед |
Суха речовина в амп. 5 доз |
Той же | |
|
Біфі-форм Ferrosan |
Капс. |
Bifidobacterium 1*10 Enterococcus 1*10 |
- |
|
Вагілак Pharmascience |
Капс. |
L.acidofilus 18 мг L.bifidus Культура йогурту (Str.thermophilus,L.delbrukil subsp.bulgaricus) 40 мг |
Сироватка у порошку, кислота аскорбінова, лактоза,магнію стеарат |
|
Вагілак Institute Rosell |
Капс. | Той же | |
|
Дуфалак Solvay Pharmaceuticals |
Рідина у флак. | - |
Лактулоза 67г/100мл Галактоза 11г/100мл Лактоза 6г/100мл |
|
Йогурт Institute Rosell |
Табл. Капс. |
L.acidofilus L.bifidus Str.thermophilus 2*10 L.bulgaricus L.acidofilus L.bifidus Str.thermophilus 2*10 L.bulgaricus |
Сахароза,сухі вершки,лактоза, магнезії стеарат, кислота аскорбінова Сухі вершки,лактоза, магнезії стеарат, кислота аскорбінова, желатин |
|
Йогурт Pharmascience |
Капс. | Той же | |
|
Колібактерин Алерген |
Суха речовина в флак 5 доз |
E.coli | - |
|
Колібактерин Біофарма |
Суха речовина в флак 5 доз |
Той же | |
|
Лактобактерин сухий Біолік |
Суха речовина в амп. 5 доз |
Lactobacillum | - |
|
Лактобактерин сухий Біомед |
Суха речовина в амп. 5 доз |
Той же | |
|
Лактобактерин сухий Біофарма |
Суха речовина в флак 5 доз |
Той же | |
|
Лінекс Lek |
Капс. |
L.acidofilus 1.2*10 B.bifidobacterium infantis v.liberorum Str.faecium |
- |
|
Л.ацидоффілюс Institute Rosell |
Капс. |
L.acidofilus 2*10 |
- |
|
Нормазе Molteni Pharm. |
Сироп у флак. | - | Лактулоза 64г/100мг |
|
Флонівін ВС ICN Yugoslavia |
Капс. |
B. cereus 1*10 |
- |
|
Хілак Merckle |
Рідина у флак. | - |
Стерильний беззародковий концентрат продуктів життєдіяльності бактерій,що виробляють молочну кислоту, лактозу,азот- місткі амінокислоти, заліза цитрат,натрію сульфат. |
|
Хілак форте Merckle |
Рідина у флак. | - |
Стерильний беззародковий екстракт продуктів обміну культур L.acidofilus, E.coli, Str.faecalis, L.helveticus,кислі фосфати калію та натрію, фосфорна та молочна кислоти |
Позитивний вплив пробіотиків на здоров'я людини проявляється різного роду позитивними ефектами, які в цілому характеризуються як пробіотична взаємодія. Цей розділ мікроекології людини представляє собою інтенсивно розвиваючу галузь науки, і тут можна привести суть тих ефектів, на вивченні яких ґрунтується успіх застосування пробіотиків. Основними з них являються наступні:
- колонізація ШКТ пробіотичними мікроорганізмами, які проявляють антагонізм по відношенню до умовно-патогенних та патогенних бактерій, вірусів, грибів та дріжджів. Постійна присутність в кишечнику достатньої кількості прикріплених до його стінки резидентних мікрорганізмів запобігає розмноженню патогенних агентів, їх інвазію в ентероцити і проходження через кишкову стінку шляхом створення в своєму біотопі несприятливого для сторонньої мікрофлори рН середовища, вироблення бактеріоцинів (антибіотичних субстанцій), а також лишение конкуруючих мікроорганізмів їх нутріентів та місць адгезії;
- корисна і адекватна метаболічна активність – продукція вітамінів К, біотина, ніацина, пиридоксина і фолієвої кислоти; гідроліз жовчних солей і холестерину та регуляція його рівня; участь в регуляції жіночих статевих гормонів та ін. [24].
- захисна роль; запобігання негативного впливу радіації, хімічних домішок в їжі, канцерогенних факторів, токсичних ендогенних субстратів, забрудненої води за рахунок стимулювання імунної відповіді і підвищення неспецифічної імунорезистентності – потенціювання продуктів інтерферона, інтерлейкінів, підвищення фагоцитарної здатності макрофагів та ін.
Ця функція пробіотиків в наш час визиває досить великий інтерес і активно досліджується, проводиться пошук штамів із найбільш вираженими імуногенними властивостями. В літературі можна зустріти судження про пробіотики – молочнокислі бактерії як пероральні вакцини, альтернативних подібним препаратам із аттенуйованих мікрорганізмів. Молочнокислі бактерії розглядаються як живі носії імуногенів і захисних антигеннів, а розробка ефективних імунних препаратів із пробіотиків являється одним із самих пріоритетних напрямків сучасної вакцинології. В той же час відомо успішне використання при імунодефіцитах пероральних та ректальних препаратів із пробіотиків – представників кокових мікрорганізмів Lactococcus, Enterococcus, Micrococcus, Streptococcus – у високих концентраціях.
Таким чином, приведені дані свідчать про те, що використання живих культур мікроорганізмів – представників нормальної мікрофлори в складі пробіотичних препаратів для лікування і профілактики дисбактеріозів різноманітної етіології являються новим і перспективним направленням у медицині. Ці дослідження потребують продовження в плані більш глибшого вивчення механізмів взаємовідносин мікро- та макроорганізма.
1.3.2 Застосування у ветеринарній практиці
Використання пробіотиків, як лікарських засобів досить поширене у ветеринарній практиці. Аналізуючи дані літератури бачимо, що для здоров'я тварин дуже важливим є наявність балансу між нормальною і потенційно патогенною мікрофлорою кишечника. Будь-яка зміна в цій рівновазі супроводжується функціональними порушеннями, які призводять до зниження продуктивності тварин.
В наш час більшість авторів доводить, що важливою умовою виникнення сальмонельозів, колібактеріозів, клостідіозів і інших кишкових інфекцій являється дія провокуючих факторів аліментарної природи: різке переведення молодняку на концентрований тип годування, взаємодія комплексу стрес-факторів. До останніх відноситься неправильне транспортування тварин, зміна кліматичних умов, застосування у великих дозах лікарських препаратів, особливо антибіотиків. У молодняку всіх видів тварин неонатальний період характеризується домінуванням кишкових хвороб. Це пов'язано в першу чергу з тим, що отриманий від матері після народження тварин імунітет згасає, а стабільність набутого залежить виключно від складу нормальної мікрофлори в кишечнику. Тому у вказаний період необхідно стабілізувати баланс за рахунок застосування пробіотиків. Пробіотики стимулююють процеси харчування завдяки нормалізації мікрофлори, яка в свою чергу слугує джерелом адьювантно-активних речовин, останні, попадаючи в кров, надають стимулюючий вплив на імунокомпетентну систему організму тварини [61].
Вченими встановлено, що використання пробіотиків, які містять живі культури B.subtilis, B.licheniformis, L.fermentum, L.salivarius, Str.bovis, Megasphaera elsdenii, Selenomonas ruminantium і ін., стимулює біосинтетичні процеси в травному тракті і сприяє збільшенню продуктивності тварин [62,63].
Найбільш перспективними вважають пробіотики створенні на основі мікроорганізмів, які відносяться до родів Bacillus, Lactobacillus, Propionibacterium, а серед них – ті види, котрі являються складовою частиною мікробіоценозів рубця жуйних тварин, зобу птахів, ШКТ поросят і ін. Відповідно аналізу даних літератури, проведеного Миршуновою і Киржаєвим [61], в більшості країн світу застосовують пробіотичні препарати для тварин, основані на монокультурах. В той же час, по даним інших авторів, ветеринарні спеціалісти, які використовують пробіотики для профілактики і лікування різних захворювань, віддають перевагу комплексним біопрепаратам, мікробним компонентом яких являється сполучення декількох видів мікрорганізмів (стрептококи, лактобацили, бактероїди, біфідобактерії і ін.). Такі пробіотики, як стверджують автори, сприяють збереженню голів великої рогатої худоби, овець, свиней, птиць. Звертаючись до зарубіжних даних, автори стверджують, що пробіотики, які використовують для підвищення продуктивності тварин, приймають в мінімально ефективній дозі (10-10 КУО в 1 г корму). При цьому їх вводять кожен день напротязі 1-2 місяців до досягнення результату. Для пробіотика важлива його постійна присутність в порожнині кишечника в значних кількостях, щоб отримати ефект при варіаціях, пов'язаних із годуванням і умовами утримання.
Приводимо
перелік пробіотиків, які найбільш часто застосовуються для
сільськогосподарських тварин [64]. У Франції запропонований препарат до складу
якого антибіотикостійкі штами молочнокислих бактерій - L.acidophilus,
L.bulgаricus, Lactococcus lactis. Крім того, в цій країні використовують
препарат ліо-біфідус і біфідаген, в Австрії – сугалон, в Німеччині – омніфлора,
які представляють собою суміш чистих ліофілізованих культур біфідобактерій,
ацидофільної і кишкової паличок. В Угорщині для боротьби із дизентерією
застосовують лактомікс, який складається із суміші ентерококів і лактобацил. У
Швеції розроблені і користуються великою популярністю серед ветеринарів
пробіотики фірми “Medifarm”, основою яких являються також ентерококи і
лактобацили, - лактиферм, лакктомікс, пробіоз, пигфегс, лако, ферлак, галако,
овікарб, бовіферм і ін [65]. В Росії в практику сільського господарства
впроваджено ряд біопрепаратів на основі бактерій-симбіонтів ШКТ, такий як
лактовіт, що містить молочнокислі бактерії і вітамін В![]() . З ціллю профілактики шлунково-кишкових
захворювань молодняку сільськогосподарських тварин застосовують препарату СБА
(L.lactis, L.acidophilus, B.bіfidum), пропацид АВК (L.acidophilus). В США для
профілактики діарей молодняку в ранньому віці застосовують
ацидофільно-дріжджове молоко (L.acidophilus + S.cerevisiae). В Інституті
мікробіології і вірусології НАН України створено три пробіотичних препарати на
основі лактобацил і ентерококів – Бовілакт, Лактосан, Лакктин-К для
сільськогосподарських тварин [66].
. З ціллю профілактики шлунково-кишкових
захворювань молодняку сільськогосподарських тварин застосовують препарату СБА
(L.lactis, L.acidophilus, B.bіfidum), пропацид АВК (L.acidophilus). В США для
профілактики діарей молодняку в ранньому віці застосовують
ацидофільно-дріжджове молоко (L.acidophilus + S.cerevisiae). В Інституті
мікробіології і вірусології НАН України створено три пробіотичних препарати на
основі лактобацил і ентерококів – Бовілакт, Лактосан, Лакктин-К для
сільськогосподарських тварин [66].
Штами спороутворюючих молочнокислих бактерій застосовують в Південній Кореї в якості стимуляторів росту курчат. Широке розповсюдження у ветеринарній практиці знайшли пробіотики із бацил. Відомий пробіотичний препарат на основі живих клітин B.subtilis і B.licheniformis – бактерин SL, розроблений в Інституті мікробіології і вірусології НАН України. Препарат широко впроваджений у ветеринарну практику і являється високоефективною терапевтичною речовиною при профілактиці і лікуванні діарей телят в післяпологовому періоді. В ІМВ НАНУ розроблений також новий пробіотик ендоспорин, призначений для лікування і профілактики післяпологових захворювань сільськогосподарських тварин. За своєю ефективністю немає аналогів в практиці ветеринарної медицини [52].
Представників роду Bacillus використовують для профілактики і терапії стафілококової, сальмонельозної, колібактеріозної і синєгнойної інфекцій (препарат Qiangsite). Новий бацилярний пробіотик “Biomate 2B Plus”, який складається із B.subtilis і B.licheniformis розроблений для поросят. Його застосування покращує засвоєння їжі, збільшує вагу, позитивно впливає на всі показники стану здоров'я тварин.
Введення
бацил у склад комплексних препаратів і спеціальних кормових сумішей,
призначених для профілактики сальмонельоза у домашніх птиць, показало їх високу
ефективність в пробіотиках “Primalas” і “Protexin”. Також відомий препарат БСП,
створений Українським інститутом сільськогосподарської мікробіології
(м.Чернігів). Уробактерин (Казахстан) містить уробактерії, які стимулюють
продукцію вітаміну В![]() в організмі тварин. “Бовітокс”
(Інститут ветеринарної медицини, Київ) – комплексний пробіотик, котрий містить
непатогенні штами роду Bacillus і мікробні культури заквасок кисломолочних
продуктів. Володіє загально-стимулюючою дією, викликаючи в організмі
новонароджених телят індукцію інтерферона [52].
в організмі тварин. “Бовітокс”
(Інститут ветеринарної медицини, Київ) – комплексний пробіотик, котрий містить
непатогенні штами роду Bacillus і мікробні культури заквасок кисломолочних
продуктів. Володіє загально-стимулюючою дією, викликаючи в організмі
новонароджених телят індукцію інтерферона [52].
Отже, виходячи із висновку спеціалістів ветеринарної медицини, пробіотики являються ефективними лікувально-профілактичними і ростостимулюючими препаратами. Їх застосовують для нормалізації мікрофлори екологічних систем організму тварин, особливо в умовах, промислового ведення тваринництва, птахівництва, свинарництва. Це екологічно чисті препарати, вони фізіологічні і безпечні за своєю дією для тварин [64].
Потреба у пробіотиках досить висока. Враховуючи несприятливу екологічну ситуацію в Україні, а також рівень загальної захворюваності понад 72 – 86 % населення України, особливо дітей, повинні не менше як двічі на рік проводити курс пробіотикотерапії чи пробіотикопрофілактику.
На сьогодні пробіотичні препарати в Україні виробляють досить мало підприємств. Серед них Одеське підприємство з виробництва імунобіологічних препаратів, Київське підприємство з виробництва бактерійних препаратів “Біофарма”, Харківське орендне підприємство “Біолік”. Це такі препарати, як біфідобактерин, лактобактерин, біфікол. На превеликий жаль технологія виготовлення флаконних лікарських форм пробіотиків, що використовується українськими виробниками, настільки несучасна, що говорити про забезпечення населення України вітчизняними пробіотиками нині неможливо. Підходи до технології виробництва, що існують в Україні (відсутність порошкоподібних форм) не дозволяють вирішити питання повноцінного широкого профілактичного застосування пробіотиків на цивілізованому рівні.
Винятком є деякі молокозаводи, що виробляють кисломолочні суміші з включенням біфідобактерій. Слід розробляти препарати пробіотиків, збагачені компонентами, які сприяють кращій проліферації і адсорбції біфідо- і лактобактерій (лактулоза, вітаміни, харчові і синтетичні волокна). Необхідно розширювати спектр кисломолочних харчових продуктів.
Отже, в сучасний період застосування пробіотиків та пребіотиків, в звязку із встановленням позитивної дії останніх на організм людини, набуває все більшого поширення. Значно збільшується кількість пробіотичних препаратів, розширюється спектр їх використання. Часто, однак, активність пробіотиків в експерименті та клінічних умовах не співпадають, що потребує подальшого збагачення знань відносно способу дії окремих препаратів, проведення коректних досліджень з метою визначення показів для застосування пробіотичних препаратів.
Розділ 2. Матеріали та методи досліджень
2.1 Матеріали досліджень
Обєктом дослідження являлись:
- виробничі штами: E.coli M17 (препарат “Колибактерин”) та B.cereus IP 5832 (“Бактисубтил”).
Препарат
“Колибактерин сухой” (Colibacterinum siccum) представляє собою ліофілізовану
мікробну масу живих кишкових паличок - штам E.coli М17, виготовлений Київським
підприємством з виробництва бактерійних препаратів “Біофарма”. Випускається у
флаконах. Одна доза містить 1*10![]() МК.
МК.
“Бактисубтил” (Bactisubtil) – кожна капсула препарату містить 1млрд. спор бактерій культури B.cereus IP 5832. Фірма-виробник Hoechst Marion Roussel.
- колекція свіжевиділених та музейних тест-культур (включаючи набір тест-штамів, які використовуються при контролі антагоністичної активності пробіотиків: Shigella sonnei 2802, 5063 Shigella flexneri 337, 170; Escherichia coli 157; Proteus vulgaris 177; Proteus mirabilis 24а, 249; Staphylococcus aureus 209): 24 клінічних штами роду Shigella (збудники дизентерій); 26 клінічних штамів – представників патогенної та умовно патогенної мікрофлори людини (родів Escherichia, Staphylococcus, Klebsiella, Pseudomonas, Enterobacter, Proteus); 4 колекційні штами (Staphylococcus epidermidis) та 11 музейних штамів, які були люб`язно надані нам для проведення досліджень Київським науково-дослідним інститутом епідеміології та інфекційних хвороб ім.Л.В. Громашевського (КНДІЕІХ), за що висловлюємо вдячність.
2.2 Методи дослідження культурально-біохімічних властивостей штамів
Дослідження культуральних і ферментативних властивостей штамів продуцентів проводили загальноприйнятими методами, використовуючи диференціально-діагностичні середовища (середовище Ендо, Левіна, Плоскірева, Сабуро, КА,Цейсслера).
2.3 Метод визначення антагоністичної активності мікроорганізмів
Для оцінки явища мікробного антагонізму окремих компонентів та композицій пробіотичних продуктів, а також офіціальних препаратів-пробіотиків в умовах in vitro використовували відповідні методики [68]. Антагоністичну активність визначали по відношенню до патогенних та УПМ з колекції живих культур лабораторії загальної мікробіології КНДІЕІХ і до клінічних ізолятів, виділених із обстежених осіб, використовуючи метод відстроченого антагонізму.
Тест-культури
З метою оцінки антагоністичної активності виробничого штаму використовують тест-культури, які повинні знаходитись в S-формі клітинного циклу, володіти типовими морфологічними, серологічними, біохімічними властивостями і вірулентністю, яка визначається для мікробів кишкової групи величиною LD50 при внутрішньочеревному заражені білих мишей; для шигелл Флекснера повинна бути не більше 250 млн МК при зараженні суспензії живих мікроорганізмів в 0.9% розчині хлориду натрію або не більше 20 млн МК при зараженні в 0.4% голодному агарі; для S. sonnei - не більше 50 млн МК при зараженні в 0.9% розчині хлориду натрію; для штамів Proteus - не більше 350 млн МК в 0.9% розчині хлориду натрію і 30-50 млн МК в 0.4% голодному агарі.
Тест-культури шигелл Флекснера і Зонне повинні давати позитивну кератоконюктивну пробу у морських свинок.
Тест-культури стафілококу повинні володіти наступними властивостями: утворювати зону гемолізу розміром (3-5) мм через (19±1) годин росту на МПА з 0.5% крові (людини, барана, кроля), розлитому в чашки Петрі шаром (2-3) мм; коагулювати плазму крові кроля на протязі (2±1) годин; викликати некроз при підшкірному введенні 200 млн МК добової культури в 0.2 см3 0.9% розчину хлориду натрію кролям вагою (1.5±0.2) кг на протязі 48-72 годин.
Антагоністичну активність штамів перевіряли до таких музейних штамів як S.flexneri, S.sonnei, ентеропатогенних E. coli, S.aureus, Proteus vulgaris i Proteus mirabilis (стандартних тест-штамів, які використовуються для контролю антагоністичної активності пробіотиків) та клінічних ізолятів. Стандартні тест-штами ідентифіковані по тестам сучасної класифікації, мають певні властивості, які визначають їх видову характеристику.
Виробничі штами повинні володіти високою антагоністичною активністю по відношенню до всіх вказаних тест-культур. Зони відсутності росту тест-культур повинні бути не менше 10 мм.
Музейні культури мікроорганізмів перед використанням активізували із ліофілізованого стану перенесенням в середовище м`ясо-пептонного бульйону (3-5 мл на одну ампулу), інкубували при 37ºС 1-3 доби та після одержання густої суспензії мікробних клітин переводили на агаризоване середовище (МПА).
Для
визначення антагонізму виробничих штамів використовували метод препендикулярних
штрихів на твердому поживному середовищі, сутність якого полягала в наступному:
на підсушені чашки Петрі із середовищем МПА по діаметру петлею діаметром (3,5![]() 0,5)мм висівали
штрихом суспензію двохдобової культури пробіотичних мікроорганізмів в
концентрації 1 млрд МК в 1мл ізотонічного розчину NaCl. Посіви інкубували в
термостаті при (37
0,5)мм висівали
штрихом суспензію двохдобової культури пробіотичних мікроорганізмів в
концентрації 1 млрд МК в 1мл ізотонічного розчину NaCl. Посіви інкубували в
термостаті при (37![]() 1)ºС. Через 2 доби
перпендикулярним штрихом до отриманої полоси росту відступив на 1-2мм
підсіювали суспензію однодобових культур тест-штамів мікроорганізмів в
концентрації 10
1)ºС. Через 2 доби
перпендикулярним штрихом до отриманої полоси росту відступив на 1-2мм
підсіювали суспензію однодобових культур тест-штамів мікроорганізмів в
концентрації 10![]() МК в 1 мл. Досліди проводили в
3-х повторюваннях. Результати враховували через 18год інкубування за величиною
зон пригнічення росту тест-штамів (вимірюючи ці зони лінійкою: від дослідженої
культури до початку росту тест-культури в мм). Контролем росту тест-культур
слугував їх паралельний посів штрихом на чашки із тим же середовищем (МПА) без
досліджуваної культури. Позитивним вважали результат при відстані затримки
росту тест-штаму більший за 7 мм.
МК в 1 мл. Досліди проводили в
3-х повторюваннях. Результати враховували через 18год інкубування за величиною
зон пригнічення росту тест-штамів (вимірюючи ці зони лінійкою: від дослідженої
культури до початку росту тест-культури в мм). Контролем росту тест-культур
слугував їх паралельний посів штрихом на чашки із тим же середовищем (МПА) без
досліджуваної культури. Позитивним вважали результат при відстані затримки
росту тест-штаму більший за 7 мм.
В
кожному випадку розраховували для кожного тест-штаму середнє арифметичне
значення затримки росту та його похибку (М![]() m).
m).
2.4 Методи математичної обробки результатів досліджень
Для обробки експериментальних матеріалів, отриманих при проведені досліджень, застосовують методи математичної статистики. За допомогою математичної статистики можна оцінити відтворюваність аналізу; встановити величину випадкових похибок; виключити результати, які містять промахи; встановити правильність отриманого результату; оцінити надійність результатів досліджень [67].
Важливою характеристикою випадкових величин є середньоарифметичне значення випадкової величини і її дисперсія.
Середньоарифметичне значення випадкової величини дорівнює сумі результатів всіх визначень, розділеній на їх кількість. Якщо х1, х2, х3,..., хі,..., хn означають n результатів визначень будь-якої величини, отже середньоарифметичне з n результатів буде:
![]() (2.4.1)
(2.4.1)
З теорії похибок, середньоарифметичне є найбільш вірогідним і найкращим значенням величини, яка визначається.
Дисперсія
показує яким чином групуються всі отримані результати аналізу навколо
середньоарифметичного, тобто характеризує ступінь розкиду ![]() навкол
навкол![]() .
.
 (2.4.2)
(2.4.2)
Середньоквадратична похибка окремого вимірювання визначається з рівняння дисперсії:
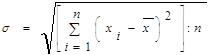 (2.4.3)
(2.4.3)
Інтервал значень, в який потрапляє вимірювана величина, називається довірливим інтервалом.
Вірогідність потрапляння нового результату у довірливий інтервал називається довірлива імовірність, надійність або коефіцієнт надійності і позначається літерою a.
Найчастіше
користуються величиною надійності a=0,95, яка означає, що
при великій кількості дослідів 95 результатів на кожні 100 будуть мати значення
в межах ![]() ±2s.
±2s.
Приведені вище рівняння стандартного відхилення і дисперсії можна використовувати для характеристики випадкових похибок, знайдених при достатньо великій кількості дослідів (при n®¥).
Оцінку точності і правильності досліджень проводять за наступними критеріями:
середньоарифметичне
значення ![]() ,
розраховується за (2.4.1);
,
розраховується за (2.4.1);
одиничне відхилення або відключення окремих визначень від середньоарифметичного:
![]() (2.4.4)
(2.4.4)
Алгебраїчна сума одиничних відхилень дорівнює нулю:
![]() (2.4.5)
(2.4.5)
Дисперсія знайдених значень х1, х2,..., хn при n паралельних дослідів визначається:
![]() (2.4.6)
(2.4.6)
- стандартне відхилення або середньоквадратична похибка окремого вимірювання:
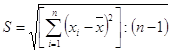 (2.4.7)
(2.4.7)
Відносна квадратична похибка, виражена у відсотках від середньоарифметичного значення, називається коефіцієнтом варіації і позначається літерою u:
![]() (2.4.8)
(2.4.8)
Дисперсія середнього результату при n паралельних дослідів складає n-ну частину початкової дисперсії:
![]() (2.4.9)
(2.4.9)
Стандартне відхилення середнього результату (середньоквадратична похибка середнього арифметичного результату) є позитивним значенням кореня квадратного з дисперсії середнього результату:
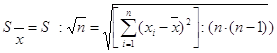 (2.4.10)
(2.4.10)
Для
визначення значення n, при якому значення ![]() наближується до істинного
значення а, вводиться нова величина, яку називають коефіцієнтом Ст’юдента і
позначають символом ta:
наближується до істинного
значення а, вводиться нова величина, яку називають коефіцієнтом Ст’юдента і
позначають символом ta:
![]() (2.4.11)
(2.4.11)
Є таблиця коефіцієнтів, де даються значення ta залежно від коефіцієнта надійності a та числа ступенів свободи k (k = n-1, де n – число дослідів).
Точність результату аналізу при вибраному a визначається величиною відхилення середнього результату від істинного (очікуваного) і виражається рівнянням:
![]() (2.4.12)
(2.4.12)
Довірливий інтервал та довірлива вірогідність (надійність) при вибраному коефіцієнті надійності a описується рівняннями:
![]() (2.4.13)
(2.4.13)
![]() (2.4.14)
(2.4.14)
Із збільшенням кількості дослідів, точність результатів зростає. Коли відоме істинне значення, відносна похибка середнього результату (у %) з надійністю a знаходять як відношення:
(ea: а)100% (2.4.15)
Відносна
похибка середнього результату (у %) може бути виражена і за
середньоарифметичним значенням ![]() з цією ж надійністю a:
з цією ж надійністю a:
(ea : ![]() )100% (2.4.16)
)100% (2.4.16)
Виявлення
систематичних похибок проводять шляхом порівняння різниці між середнім
значенням величини ![]() і її істинним значенням а з
точністю метода ea. Якщо |
і її істинним значенням а з
точністю метода ea. Якщо |![]() -а |>ea, то має місце
систематична похибка.
-а |>ea, то має місце
систематична похибка.
Розділ 3. Експериментальна частина
3.1 Культурально-біохімічні властивості штамів продуцентів
3.1.1 Штам E.coli M 17
Виробничий штам E.coli M17(О2: К1: Н6) відноситься до виду Escherichia coli, роду Escherichia, трибу Eschericiеaе, родини Enterobacteriaceae. Штам E.coli M17 являє собою рухомі грамнегативні короткі палички з закругленням на кінцях, довжиною від 1,5мкм до 4,0 мкм.
Штам
E.coli M17- факультативний аероб, на МПА через (15![]() 3) год утворює круглі випуклі
S-колонії 0,3-0,5 см в діаметрі з рівними краями, або сухі плоскі R-колонії з
нерівними краями. На середовищі Ендо утворює червоні колонії з металевим
блиском. На МПБ через (3
3) год утворює круглі випуклі
S-колонії 0,3-0,5 см в діаметрі з рівними краями, або сухі плоскі R-колонії з
нерівними краями. На середовищі Ендо утворює червоні колонії з металевим
блиском. На МПБ через (3![]() 1) год відбувається рівномірне
помутніння середовища і утворення осаду, або плівки чи пристіночного кільця. На
кровяному агарі може давати повний гемоліз.
1) год відбувається рівномірне
помутніння середовища і утворення осаду, або плівки чи пристіночного кільця. На
кровяному агарі може давати повний гемоліз.
Штам розщеплює з утворенням кислоти і газу глюкозу, лактозу, манніт, мальтозу, сахарозу; желатин не розжирує; утворює індол.
Оптимальна
температура росту штаму E.coli M 17 (37![]() 1)ºС.
1)ºС.
Штам E.coli M17 проявляв антагоністичну дію по відношеню до патогенних та УПМ, які використовуються при контролі пробіотиків.
Показник антагоністичної активності виробничого штаму E.coli M17 по відношенню до тест-штамів шигел Флекснера повинен бути не нижче 60%, а по відношенню до тест-штамів шигел Зонне – не нижче 30%
3.1.2 Штам B.cereus IP 5832
Виробничий штам B.cereus IP 5832 відноситься до виду Bacillus cereus, роду Bacillus, родини Bacillaceae. Штам являє собою рухому грампозитивну паличку із закругленими кінцями, довжиною 5-10 мкм і товщиною 1-2 мкм. Клітина- спорангій утворює одну ендоспору. Хемогетеротроф.
Штам B.cereus ІР 5832 – аероб, на МПА утворює білі, тверді, круглі або жовтуватого кольору “розплющені” колонії з нерівними краями; на кровяному агарі колонії зернисті, із широкою зоною гемоліза; на яєчному агарі утворює широку зону преципітації білого кольору (ефект бактеріальної лецитінази), зона швидко росте і через декілька діб інкубації охоплює всю поверхню чашки. Колонії, які виросли на агарі, мають характерний восковидний вид. В рідкому поживному середовищі бацила утворює білий хлоп`євидний осад, ніжну плівку на поверхні і визиває помутніння бульйона.
Штам володіє високою протеолітичною активністю – розріджує желатин протягом 1-4 діб; утворює лецитиназу і ацетилметилкарбінол, розщеплює до кислоти глюкозу і мальтозу, гліцерин, лактозу, галактозу інсулін, дільцит і декстрин.
Температурний оптимум росту 30°С, оптимум рН 7 –9,5
Виробничий штам повинен володіти антагоністичною активністю по відношеню до патогенних та УПМ, які використовуються при контролі пробіотиків.
3.2 Дослідження антагоністичної активності пробіотичних штамів по відношенню до стандартних тест-штамів та клінічних ізолятів
Пробіотики відіграють позитивну роль у підвищенні загальної резистентності організму, а також пригнічують УПМ. Антагоністична дія бактерій обумовлена їх високою конкурентною здатністю в процесі розмноження, що пояснюється широкою пристосованістю до умов культивування (рН, температурою). Здатність змінювати рН середовища, продукувати лізоцим і літичні ферменти являється частиною сумарного показника антагоністичної дії, яка властива бацилам, а для ентеробактерій характерне продукування мікроцинів.
Для більш повної характеристики при дослідженні штамів продуцентів, особлива увага була приділена їх взаємодії на види УПМ, збудників гострих кишкових інфекцій.
Для дослідження антагоністичної дії було використано промислові штами B.cereus IP 5832 та E.coli M17. Антагоністичну активність визначали у відношені 50 клінічних ізолятів – представників родин Enterobacteriaceae, Pseudomonadaceae, Micrococcaceae та музейних тест-культур. Дослідження проводились разом із співробітниками лабораторії загальної мікробіології КНДІЕІХ (зав. лабораторії д.м.н. Поліщук О.І.).
В таблиці 3.1 представлено результати досліджень антагоністичної дії пробіотичних штамів до стандартних тест-штамів.
Таблиця 3.1. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до музейних тест-культур
|
Назва музейних тест-культур |
Кіль- кість штамів |
Зона затримки росту тест-культур, мм | ||||
|
E.coli M17 С.30202 |
E.coli M17 С.51000 |
E.coli M17 С.10900 |
E.coli M17 С.31000 |
B.cereus IP5832 | ||
| Escherichia coli | 1 |
15.2 |
16.7 |
17.5 |
10 |
15 |
| Staphylococcus aureus | 1 |
25 |
22 |
23 |
20 |
21 |
| Candida albicans | 1 |
2.8 |
2.9 |
2.7 |
2.8 |
3 |
| P.vulgaris | 1 |
12.0 |
14.0 |
14.0 |
15.0 |
13.0 |
| P.mirabilis | 2 |
10.0 |
11.0 |
9.0 |
10.0 |
8.0 |
| Shigella flexneri | 2 |
15.0 |
17.0 |
20.0 |
18.0 |
19.0 |
| Shigella sonnei | 2 |
17.0 |
18.0 |
20.0 |
18.0 |
18.0 |
В таблицях 3.2 – 3.8 представлено результати досліджень з наведенням тільки тих клінічних штамів, які виявляли активність по відношенню до певних тест-культур.
Таблиця 3.2. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до клінічних тест-культур Escherichia coli
| Культура - антагоніст | Зона затримки росту тест-культур, мм | |||
| Клінічні штами | ||||
| Escherichia coli 227/1 | Escherichia coli 1705 | Escherichia coli 3394 | Escherichia coli 5873 | |
|
E.coli (“Колибактерин”) С30202 |
9.0 |
11.0 |
13.0 |
9.0 |
|
E.coli (“Колибактерин”) С51000 |
11.0 |
12.5 |
9.0 |
12.5 |
|
E.coli (“Колибактерин”) С10900 |
12.5 |
9.0 |
13.5 |
9.5 |
|
E.coli (“Колибактерин”) С31000 |
9.0 |
11.5 |
10.0 |
9.0 |
|
B.cereus IP 5832 (“Бактисубтил”) |
9.0 |
10.0 |
11.0 |
10.5 |
Таблиця 3.3. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до клінічних тест-культур Staphylococcus aureus
| Культура - антагоніст | Зона затримки росту тест-культур, мм | |||
| Клінічні штами | ||||
|
Staphylococcus aureus 0440 |
Staphylococcus aureus 1506 |
Staphylococcus aureus 1661 |
Staphylococcus epidermidis 1096 |
|
|
E.coli (“Колибактерин”) С30202 |
21.0 |
23.0 |
20.0 |
22.5 |
|
E.coli (“Колибактерин”) С51000 |
22.0 |
21.5 |
19.0 |
20.5 |
|
E.coli (“Колибактерин”) С10900 |
19.5 |
22.5 |
18.0 |
19.0 |
|
E.coli (“Колибактерин”) С31000 |
20.0 |
21.0 |
17.5 |
23.0 |
|
B.cereus IP 5832 (“Бактисубтил”) |
19.0 |
20.0 |
21.5 |
22.5 |
Таблиця 3.4. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до клінічних тест-культур Klebsiella
| Культура –антагоніст | Зона затримки росту тест-культур, мм | |||
| Клінічні штами | ||||
|
Klebsiella oxytoca144 |
Klebsiella pneumoniae 1462 |
Klebsiella pneumoniae 0362 |
Klebsiella oxytoca 401 |
|
|
E.coli (“Колибактерин”)С30202 |
12.0 |
10.0 |
11.0 |
10.5 |
|
E.coli (“Колибактерин”)С51000 |
12.5 |
11.5 |
11.0 |
11.5 |
|
E.coli (“Колибактерин”)С10900 |
13.0 |
12.0 |
10.5 |
12.5 |
|
E.coli (“Колибактерин”)С31000 |
11.0 |
12.5 |
11.5 |
12.0 |
|
B.cereus IP 5832 (“Бактисубтил”) |
10.0 |
11.0 |
12.0 |
12.0 |
Таблиця 3.5. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до клінічних тест-культур Pseudomonas aeruginosa
| Культура – антагоніст | Зона затримки росту тест-культур, мм | |||
| Клінічні штами | ||||
|
Pseudomonas aeruginosa 1578 |
Pseudomonas aeruginosa 433 |
Pseudomonas aeruginosa 1744 |
Pseudomonas aeruginosa 7/1 |
|
|
E.coli (“Колибактерин”) С30202 |
8.0 |
7.5 |
6.0 |
7.5 |
|
E.coli (“Колибактерин”) С51000 |
7.5 |
7.0 |
6.5 |
6.0 |
|
E.coli (“Колибактерин”) С10900 |
6.0 |
8.0 |
6.5 |
5.0 |
|
E.coli (“Колибактерин”) С31000 |
6.5 |
6.0 |
5.5 |
6.0 |
|
B.cereus IP 5832 (“Бактисубтил”) |
7.0 |
7.5 |
6.5 |
7.0 |
Таблиця 3.6. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до клінічних тест-культур Enterobacter
| Культура – антагоніст | Зона затримки росту тест-культур, мм | |||
| Клінічні штами | ||||
|
Enterobacter cloacae 405´ |
Enterobacter cloacae 0361 |
Enterobacter aerogenes 3112 |
Enterobacter cloacae 5797 |
|
|
E.coli (“Колибактерин”) С30202 |
14.0 |
13.0 |
14.5 |
12.5 |
|
E.coli (“Колибактерин”) С51000 |
13.0 |
13.0 |
12.0 |
12.5 |
|
E.coli (“Колибактерин”) С10900 |
8.0 |
7.0 |
8.5 |
8.0 |
|
E.coli (“Колибактерин”) С31000 |
12.0 |
11.0 |
12.5 |
11.0 |
|
B.cereus IP 5832 (“Бактисубтил”) |
15.0 |
13.0 |
15.0 |
15.5 |
Таблиця 3.7. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до клінічних тест-культур Proteus
| Культура – антагоніст | Зона затримки росту тест-культур, мм | |||||
| Клінічні штами | ||||||
|
Proteus mirabilis 1204 |
Proteus mirabilis 358 |
Proteus mirabilis 2048 |
Proteus vulgaris. 6349 |
Proteus vulgaris. 200E |
Proteus vulgaris. 1589 |
|
|
E.coli (“Колибактерин”) С30202 |
5.0 |
6.0 |
8. |
7.0 |
6.0 |
6.0 |
|
E.coli (“Колибактерин”) С51000 |
6.0 |
7.0 |
7. |
6.0 |
5.0 |
5.0 |
|
E.coli (“Колибактерин”) С10900 |
7.0 |
5.0 |
7.0 |
8.0 |
6.0 |
7.0 |
|
E.coli (“Колибактерин”) С31000 |
6.0 |
6.0 |
6.0 |
7.0 |
7.0 |
5.0 |
|
B.cereus IP 5832 (“Бактисубтил”) |
5.0 |
5.0 |
6.0 |
7.0 |
6.0 |
5.0 |
Таблиця 3.8. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до колекційних тест-культур
| Культура – антагоніст | Зона затримки росту тест-культур, мм | |||||
| Колекційні штами | Музейні штами | |||||
| S.epiderm. 4005 |
S.epiderm. Б/№ |
S.epiderm. №4 |
S.epiderm. 42a |
E.coli 055 |
E.coli 145 |
|
|
E.coli (“Колибактерин”) С30202 |
9.0 |
8.0 |
7.0 |
6.0 |
6.0 |
8.0 |
|
E.coli (“Колибактерин”) С51000 |
10.0 |
8.0 |
6.0 |
7.0 |
5.0 |
6.0 |
|
E.coli (“Колибактерин”) С10900 |
8.0 |
7.0 |
8.0 |
9.0 |
5.0 |
7.0 |
|
E.coli (“Колибактерин”) С31000 |
10.0 |
11.0 |
11.0 |
10.0 |
6.0 |
7.0 |
|
B.cereus IP 5832 (“Бактисубтил”) |
7.0 |
6.0 |
7.0 |
8.0 |
4.0 |
5.0 |
Розділ 4. Обговорення результатів
Представлені результати свідчать про помірну антагоністичну активність in vitro досліджених виробничих штамів.
Антагоністична активність пробіотичних препаратів “Колибактерин” та ”Бактисубтил” по відношенню до музейних культур (стандартних тест-штамів) практично не відрізнялась між собою. Найбільш високу активність E.coli M17 та B.cereus IP 5832, які входять до складу препаратів, спостерігали у відношені до музейних штамів шигел, стафілококів та протеїв (зони затримки росту цих мікроорганізмів складали 15-20 і більше мм). Менш вираженою була активність по відношенню до патогенної кишкової палички (зони затримки росту цих мікроорганізмів склали 10-15 мм).
На підставі аналізу, що представлений в таблиці 3.1., можна зробити висновок про те, що тест-культури Candida albicans, як обов`язковий тест-мікроорганізм має мінімальне пригнічення росту. З нашої точки зору це обумовлено філогенетичною стійкістю цієї культури до природних антибіотичних чинників, а також малою швидкістю росту самого мікроорганізму.
Бактеріальні тест-культури найбільш вразливі до дії речовин антибіотичної дії, що виділяються пробіотиками. Найбільш стійкими до впливу антибіотичних речовин колибактерину є культури роду Proteus, які мають мінімальні зони затримки росту 5 – 7 мм, але явно виражено приглушення роїння (рис 4.1).
Таким чином, можна говорити, що пробіотичні препарати на основі промислових штамів E.coli M17 та B.cereus IP 5832, виявляють досить широкий спектр антагоністичної активності по відношенню до музейних штамів бактерій.
Продовжуючи аналіз досліджень, можемо засвідчити, що для готових лікарських форм простежується відмінність в антагоністичній активності готових лікарських форм, що пройшли ВТК. Так для колибактерину серії 31000 простежується суттєва зміна, що може бути пов`язана із зміною умов зберігання, або порушенням технологічного процесу. Такий порівняльний аналіз є обов`язковий для оцінки ефективності готових лікарських засобів в контрольних лабораторіях МОЗ.
З метою дослідження, хоча б опосередковано, дії пробіотичних препаратів в організмі людини, вивчали антагоністичну активність препаратів на свіжевиділені клінічні штами різних родів (ентеробактерій, стафілококів), отриманих при обстеженнях дорослих хворих на туберкульоз та пієлонефрит.
Було використано 24 клінічних штами роду Shigella (S.flexneri – звичайний збудник епідемій дизентерії та гастроентерита у дітей; S.sonnei – збудник легкої форми дизентерії та літньої діареї у дітей); 26 клінічних штамів – представників патогенної та умовно патогенної мікрофлори людини (E.coli – збудник урогенітальних інфекцій та діареї у дітей; S.aureus – визиває фурункульоз, остеоміеліт, нагноювання ран та харчові отруєння; K.pneumoniae, К.oxytoca – являються збудниками госпітальних пневмоній, бактеріємії, інфекції сечовидільних шляхів, а також епідемічних діарей у новонароджених; P.aeruginosa – один із основних збудників локальних та системних гнійно-запальних процесів, особливо в умовах стаціонарів; E.cloacae – збудник гострих шлунково-кишкових захворювань; P.mirabilis, Р.vulgaris – визивають інфекцію сечовидільних шляхів у людини, а також вторинні септичні враження у паціентів із опіками та після хірургічних втручань); 4 колекційні штами (Staphylococcus epidermidis).
Активність препаратів “Колибактерин” та ”Бактисубтил” до клінічних штамів, в цілому, була нижчою в порівнянні з дією на музейні штами.
Як видно із представлених в табл. 3.2 – 3.7 даних виробничі штами E.coliM17 та B.cereus IP 5832 характеризуються вираженою антагоністичною активністю по відношенню до клінічних штамів стафілококів, ентеробактерів та кишкових паличок. Слід відмітити, що штам B.cereus IP 5832 проявляє більш виражену антагоністичну активність до клінічних ізолятів роду Enterobacter (зони затримки росту штамів становили 8 – 15 мм), в порівнянні із штамом E.coli M17 (Рис 4.2). Найбільш виражена активність пробіотичних штамів була відмічена до штамів роду Staphylococcus (Рис 4.3). Зони затримки росту стафілококів коливалися в межах 20 – 25 мм. Для клінічних штамів родів Escherichia та Klebsiella зони затримки росту складали 9 – 12 мм (Рис 4.4 та 4.5). Ще менш виражена активність була у штамів роду Pseudomonas, зони затримки росту становили 6 – 8 мм (Рис 4.6). До клінічних штамів роду Shigella (збудники дизентерії) була відмічена дуже низька антагоністична дія.
Підсумовуючи представлені in vitro результати досліджень, можна заключити, що промислові штами, які використовуються як основа для пробіотичних препаратів, мають досить високу антагоністичну активність по відношенню до широкого спектру музейних тест-штамів мікроорганізмів і дещо меншу по відношенню до клінічних штамів.
Рис 4.1. Характеристика антагоністичної активності культур E.coli M-17 та B.cereus IP 5832 по відношеню до клінічних та стандартних тест- штамів Proteus

Рис 4.2. Характеристика антагоністичної активності виробничих культур E.coli M17 та B.cereus IP5832 по відношенню до клінічних штамів E.cloacae
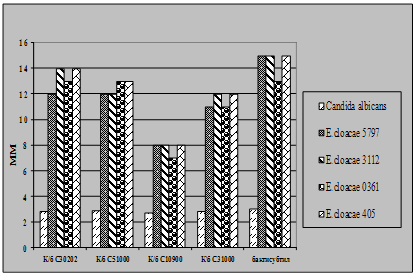
Рис 4.3. Характеристика антагоністичної активності виробничих культур E.coli M17 та B.cereus IP5832 по відношенню до клінічних та стандартних тест-штамів S.aureus
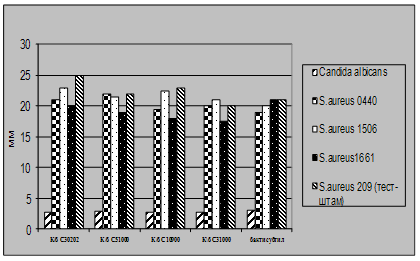
Рис 4.4. Характеристика антагоністичної активності штамів E.coli M17 та B.cereus IP 5832 по відношеню до клінічних та стандартних тест-культур E.coli
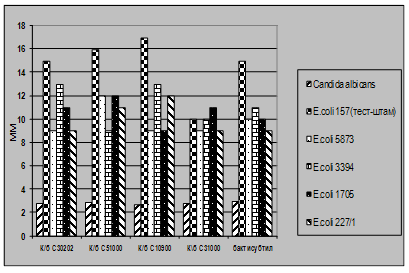
Рис 4.5. Характеристика антагоністичної активності виробничих культур E.coli M17 та B.cereus IP5832 по відношенню до клінічних штамів K.oxytoca та K.pneumoniae

Висновки
1. Проведений аналіз сучасного стану розробок пробіотичних лікарських засобів.
Систематизовані відомості про види пробіотиків і їх використання з ціллю нормалізації мікробного ценоза організму людини.
Досліджено антагоністичну активність сучасних пробіотичних препаратів “Колибактерин” та “Бактисубтил”, основою яких є виробничі штами E.coli M17 та B.cereus IP 5832. Антагонізм визначали по відношенню до 65 штамів патогенних та умовно патогенних мікроорганізмів (родів Escherichia, Staphylococcus, Klebsiella, Pseudomonas, Enterobacter, Proteus).
Встановлено, що дані препарати характеризуються чітко вираженою антагоністичною дією щодо стандартних тест-штамів (Shigella sonnei 2802, 5063; Shigella flexneri 337, 170; Escherichia coli 157; Proteus vulgaris 177; Proteus mirabilis 24а, 249; Staphylococcus aureus 209) та меншою антагоністичною дією до клінічних штамів патогенних та умовно-патогенних мікроорганізмів.
Список використаної літератури
1. Шендеров Б.А. Медицинская микробная экология и функциональное питание. Том 1: Микрофлора человека и животных и ее функции. М.: Гранть, 1998.
2. Мечников И.И. Этюды о природе человека. - М.: Науч. слово, 1903. - 173 с.
3. Мечников И.И. Этюды оптимизма. - 1907. - 350 с.
4. Барановский А.Ю., Кондрашина Э.А. Дисбактериоз и дисбиоз кишечника. - Санкт-Петребург и др., 2000. - 209 с.
5. Биологические свойства аэрококков-антагонистов – представителей микробиоценозов человека / Г.Н.Кременчуцкий, М.Л.Горбунова, Л.Г. Юргель и др.// Микробиол. журнал.- 1994.- Т.56, № 4.- С.36-42.
6. Лизько Н.Н., Шилов В.И. Современные представления о состоянии кишечной микрофлоры у здоровых взрослых людей // Журн. микробиологии, эпидемиологии и иммунологии.- 1979.- №4.-С. 36-41.
7. Коршунов В.М., Смирнов В.В., Ефимов Б.А. Рациональные подходы к проблеме коррекции микрофлоры кишечника // Вести Рос. МАН. - 1996.- № 2. - С. 60-65.
8. Лебедева М.Н., Гончарова Г.И., Лизько Н.Н. Современные аспекты нормы и патологии кишечной микрофлоры // Журн. микробиологии, эпидемиологии и иммунологии.- 1974.- №9.-С. 36-41.
9. Перспективи застосування біологічних бактерійних препаратів для корекції порушень мікробіоценозу кишечнику / О.А.Журило, Г.І.Барбова, Н.М.Недлінська // Український хіміотерапевтичний журнал.- 1999.- № 2.- С. 43-50.
10. Перетц Л.Г. Микрофлора человеческого тела. В кн.: Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней.- М.: Медгиз.- 1962.- Т.1.- С.659-671.
11. Бактериологическая диагностика дисбактериозов кишечника: Методические рекомендации / Р.Б.Эпштейн-Литвак, Ф.Л.Вильшанская.- М., 1969.- 29с.
12. Чебуркин О.В. Гнотобиология как наука о микрофлоре организма человека // Вестник сельхоз. наук.- 1984.- № 8.- С. 116-123.
13. Дисбактериоз кишечника (в помощь практическому врачу) / А.И. Парфенов, Ю.К. Калоев, С.А.Сафронова, Н.Г.Федотова // Український медичний часопис.- 1998.- №3(5).-V/VI.- С.65-70.
14. Нисевич Н.И., Гаспарян М.О., Новокшонов А.А. к вопросу о дисбактериозе кишечника у детей // Педиатрия.- 1999.- № 1.- С. 98-101.
15. Парфенов А.И. Микробная флора кишечника и дисбактериоз // Рус. мед. журн.-1998.- Т.6, № 18.- С.1170-1173.
16. Румянцев В.Г. Дисбактериоз кишечника: клиническое значение и приципы лечения // Рос. журн. гастроэнтерол., гепатол., колопроктл.- 1999.- Т.9, № 3.- С.61-63.
17. Красонголовец В.Н. Дисбактериоз кишечника.- М.: Медицина, 1989.- 207с.
18. Бабак О.Я., Кушнир И.Э. Современная диагностика и лечение нарушения микробиоценозов кишечника // Провизор. – 1999.- № 15-16.- С.91-93.
19. Бабак О.Я., Кушнір І.Е. Сучасна фармакотерапія дисбактеріоза кишечника. // Метод. рекомендації / Ін-т терапії АМНУ. - Москва; Харків, 1999. - 28 с.
20. Панчишина А.И., Олейник С.Ф. Дисбактериоз кишечника.- К.: Здоров`я, 1983.-116с.
21. Микробиологическая дианостика дисбактериозов: Методические рекомендации / В.А.Знаменский, Н.В.Дегтяр, С.Н.Кузьминский и др.- Киев.- 1986.- 27с.
22. Козько В.Н. Эубиоз, дисбактериоз, пробиотики // Лікування та діагностика. - 2001. - №2. - С. 21-27.
23. Петровская В.Г., Марко О.П. Микрофлора человека в норме и патологии. - М.: Медицина, 1976. - 144 с.
24. Шевелева С.А. Пробиотики, пробиотики и пробиот. продукты. Современное состояние вопроса // Вопросы питания 1099.- № 2.- С. 32-39.
25. Андрейчин М.А. Досягнення в терапії бактерійних діарей і шляхи її оптимізації // Інфекційні хвороби.-2000.- №1.- С.5-11.
26. Современные представления о механизмах лечебно-профилактического действия пробиотиков из бактерий рода Bacillus/ В.В.Смирнов, С.Р.Резник, В.А.Вьюницкая и др. // Микробиол. журн.- 1993.-Т.55, № 3.- С. 92-102.
27. Захарова И.Я., Павлова И.Н. Литические ферменты микроорганизмов. - Киев: Нак. думка, 1985.- 216 с.
28. Квасников Е.И., Нестеренко О.А. Молочнокислые бактерии и пути их использования. - М.: Наука, 1975. - 388 с.
29. Квасников Е.И., Шишлевская Т.Н., Коваленко Н.К. Антагонистическая активность молочнокислых бактерий по отношению к возбудителям кишечных заболеваний домашних птиц. // Микробиол. журнал. - 1983. –Т. 45, № 5.- С. 27-32.
30. Бифидобактерии и их использование в клинике, медицинской промышленности и сельском хозяйстве. Сб. научн. трудов Моск. НИИ эпидемиологии и микробиологии.- М.: 1986.- 208с.
31. Григор`єв О.В. Пробіотики України: збережемо генофонд. // Ліки України. - 1999. - №4. - С. 4-8.
32. Лихачева А.Ю., Бондаренко В.М., Соколова К.Я. Современное состояние вопроса таксономии бактерий рода Lactobacillus // Журн. микробиологии, эпидемиологии и иммунологии.- 1992.- №9-10.-С.74-78.
33. Чернышова Н.А.. Мельникова К.И., Френкель М.П. Опыт применения сухого бифидумбактерина у новорожденных групп риска с целью профилактики острых кишечных инфекций // Журн. микробиологии, эпидемиологии и иммунологии.- 1994.- № 2.- С.37-39.
34. Коваленко Н.К., Подгорский В.С. Пробиотики на основании молочнокислых бактерий // Микробиол. журнал.- 1994.- Т № 1.
35. Цой И.Г., Сапаров А.С,, Тимофеева И.К. Иммуностимулирующее действие лактобактерий на цитотоксичность естественных киллеров и продукцию интерферона // Журн. микробиологии, эпидемиологии и иммунологии.- 1994.- № 6.- С.112-113.
36. Тюрин М.В., Шендеров Б.А., Рахимова Н.Г., Поспелова В.В., Лагода И.В. К механизму антагонистической активности лактобацилл // Журн. микробиол., эпидемол. и иммунол. - 1989. - № 2. - С. 3-8.
37. Шендеров Б.А. Нормальная микрофлора и ее роль в поддержании здоровья человека // Рос. журн. гастроэнтерорл., гепатологии, колонпроктол. - 1999. - № 1. - С. 61-65.
38. Коваленко Н.К. Молочнокислі бактерії в кишковому тракті тутового шовкопряду // Мікробіол. журнал - 1970. –Т. 32, № 6. - С.297-300.
39. Далин М.В., Фиш Н.Г. Адгезины микроорганизмов. // Итоги науки и техники. Микробиолог. - 1985. - Т. 16. - С. 3-98.
40. Королев Н.П. Функции пектинов в клетках // Итоги науки и техники /ВИНИТИ. Общие проблемы физико-химической биологии. - М. 1984. - Т.1.- 351 с.
41. Маркова Т.П., Чувиров Д.Г. Механизм действия бактерийных иммуномодуляторов // Україн. медич. часопис. - 1998,- №6/8. - С. 27-32.
42. Нуриддинова Н.Р., Синяшин Н.И. Изучение иммуномодулирующего действия внеклеточных субстратов бифидо- и лактобактерий // В кн.: Микробиология, иммунология, эпидемиология, профилактика инфекционных заболеваний.- Ташкент, 1991.- С.95-97.
43. Сорокулова И.Б. Влияние пробиотиков из бацилл на функциональную активность макрофагов // Антибиотики и химиотерапия.- 1998.-Т.43, № 2.- С.20-23.
44. Матеріал підготовлено представництвом фірми "Меркле" в Україні. Застосування препарату «Хілак» при дисбактеріозі кишечника // 1999. - № 8.
45. О некоторых механизмах возникновения бессимптомной бкатериемии / В.В.Смирнов, С.Р.Резник, И.Б. Сорокулова, В.А.Вьюницкая // Микробиол. журн.- 1998.-Т.50, № 5.- С. 56-59.
46. Смирнов В.В., Резник С.Р., Сорокулова И.Б. Высокоеффективный биологический препарат биоспорин // Врачеб. дело.- 1993.- № 5-6.- С. 133-138.
47. Смирнов В.В., Резник С.Р., Сорокулова И.Б., Вьюницкая В.А. Дискуссионные вопросы создания и применения бактериальных препаратов для корреляции микрофлоры теплокровных // Микробиол. журнал. - 1992. – Т.54, № 6. - С. 82-94
48. Амбарцумян К.Ф., Саркисян Б.Г., Елоян Д.В. Действие культуральной молочной смеси “Наринэ” на кишечную микрофлору при функциональных и воспалительных поражениях толстой кишки // Клин. мед. М.,- 1989.- Т.67, № 7.- С.72-74.
49. Богданов И.Г. Изучение противоопухолевого действия антибиотиков ЛБ-51 на саркоме 180 Крокера // Пути и методы изыскания противораковых антибиотиков. М.: Медгиз., 1959. - С. 198-199.
50. Богданов И.Г., Величков В.Т., Далев П.Г. и др. Противоопухолевое действие гликопептидов клеточной стенки L.Bulgaricus // Бюлл. эксперем. биол. и мед. - 1977. – Т.84, № 12. - С. 709-712.
51. Бондаренко В.М., Рубакова Э.И., Лаврова В.А. Иммуностимулирующее действие лактобактерий, используемых в качестве основы препаратов пробиотиков. // Микробиол. журн. - 1998. - № 5. - С.107-112.
52. Смирнов В.В. Сорокулова И.Б., Пинчук И.В. Бактерии рода Bacillus -перспективный источник биологически активных веществ // Мікробіол. журн. - 2001- Т. 63, № 1. - С.72-79.
53. Смірнов В.В., Косюк І.В. Адгезивні властивості бактерій роду Bacillus - компонентів пробіотика // Мікробіол. журнал. - 1997. – Т.59, № 6. - С. 36-43.
54. Сорокулова И.Б. Перспективы применения бактерий рода Bacillus для конструирования новых биопрепаратов // Антибиоткики и химиотерапия. - 1996. – Т.41, № 10. - С. 13-15.
55. Коршунов В.М. Проблема регуляции микрофлоры кишечника. // Журнал микробиол. - 1995. - № 3.
56. Слабостицкая А.Т., Крышовская С.С., Резник С.Р. Ферментативная активность бацилл, перспективных для включения в состав биопрепаратов // Микробиол. журнал. - 1990. – Т.52, № 2. - С. 9-14.
57. Смирнов В.В., Слабостицкая А.Т., Крымовская С.С., Резник С.Р. Липолитическая активность спорообразующх бактерий // Микробиол. журнал. - 1988. – Т.50, № 2. – С. 6-12.
58. Смирнов В.В., Коваленко Н.К, Подгорский В.С., Сорокулова И.Б. Пробиотики на основе живых культур микроорганизмов // Мікробіол. журн. - 2002, Т.64, № 4. - С.62-80.
59. Дрозд Т.Е., Кременчуцкий Г.М., Горбунова М.Л. Стимулирующее влияние Aerococus viridans на фагоциты и антителообразование. // Журнал микробиол., єпидемиол. и иммунолог. - 1994. - № 6. - С. 11-12.
60. Дубинин Н.П. Общая генетика. - М. Наука. - 1976. - с. 306-307.
61. Миршунова Н.В., Киржаев Ф.С. Современное представление о роли нормальной микрофлоры пищеварительного тракта // Ветеринария. - 1993. - № 6. - С. 30-33.
62. Калачнюк Г.И., Копчены Я. и др. Стимуляция рубцового пищеварения и пробиотики // Биологические основы высокой продуктивности животных: Тезы. докл. междунар. конф. Боровск. 3-7 сентября 1990. - Боровск 1990.- Ч.2. - С. 118-119.
63. Калачнюк Г.І. Пробіотики у тваринництві. // Тваринництво України. - 1996.-№ 5. - С. 16-18.
64. Антипов В.А. Использование пробиотиков в животноводстве. // Ветеринария. - 1991. - № 4. - С. 55-58.
65. Григоров Ю.Г., Коркушко О.В., Селисько Т.М. и др. Влияние нового кисломолочного продукта "Лакгеровит" на показатели здоровья людей старших возрастов // Проблемы старения и долголетия. - 1994. - № 4. - С. 105-113.
66. Підгорський В.С., Коваленко Н.К., Мацюк В.М. Пробіотики, створені на основі молочнокислих бактерій для профілактики та лікування шлунково-кишкових хвороб молодняка сільськогосподарських тварин // Матеріали наук. конф. "Актуальні питання ветерин. медиц.", Київ, 1995. - С. 31-33.
67. Ашмарин И.П., Воробьев А. А. Статистические методы в микробиологических исследованиях. – Л.: Медгиз, 1962. – 140с.
68. Биргер М.О. Справочник по микробиологическим и вирусологическим методам определения. - Л.: Медгиз, 1982.- с.
69. Pharmindex. Лекарственные препараты. – 1997.- С.475.