Курсовая работа: Мікроорганізми як джерело створення безпечних антимікробних засобів
ВСТУП
РОЗДІЛ 1. ОСОБЛИВОСТІ МОРФО-ЦИТОЛОГІЧНОЇ ОРГАНІЗАЦІЇ МІКРООРГАНІЗМІВ
РОЗДІЛ 2. МОЖЛИВОСТІ ВИКОРИСТАННЯ МІКРОБІОЛОГІЧНИХ ПРЕПАРАТІВ ДЛЯ БОРОТЬБИ ІЗ ШКІДНИКАМИ
2.1 Мікробіологічні інсектициди
2.2 Інтродукція мікроорганізмів та мікробіологічний метод боротьби
2.3 Нешкідливість мікробіологічних агентів
РОЗДІЛ 3. МІКРООРГАНІЗМИ ЯК ДЖЕРЕЛО НОВИХ ІНСЕКТИЦИДНИХ ПРЕПАРАТІВ
3.1 Класифікація бактеріальних токсинів
3.2 Класифікація за анатомічним розміщенням
3.3 Класифікація за місцем або механізмом дії
3.4 Класифікація за структурою молекули токсину
3.5 Проблема токсинів у патології комах
3.6 Практичні можливості і перспективи використання інсектицидів
ВИСНОВОК
ЛІТЕРАТУРА
ВСТУП
Матеріали багатьох досліджень говорять про цінності мікробіологічного методу як практичної зброї проти деяких шкідливих комах. Вони виявляють також проведення активних досліджень фундаментальних і практичних сторін патології комах, що повинно гарантувати подальший прогрес. Патогени комах, застосовуваних повторно, позначають терміном "мікробіологічні інсектициди", патогени, які здатні виживати і поширюватися в популяціях шкідливих комах, розглядають як "інтродукції". Ефективність біологічного методу боротьби зі шкідниками рослин подекуди буває досить високою. Зафіксовано випадки, коли застосування мікробних препаратів викликало масову загибель шкідників. Проте результати застосування мікробіологічного методу значною мірою залежать від кліматичних умов, стану шкідників та інших чинників.
Збудниками інфекційних захворювань шкідливих комах можуть бути також гриби і віруси. В різних країнах світу на основі патогенних мікроорганізмів випускаються понад 50 препаратів для боротьби з 200 видами шкідливих комах. Найкраще налагоджено виробництво таких бактеріальних препаратів: ентобактерин, дендробацилін, ліпідоцид, а з грибкових препаратів — актинін, боверин та ін.
Мета роботи – розглянути можливості використання мікроорганізмів з метою створення екологічно безпечних антимікробних засобів.
Завданнями роботи є:
1) розглянути особливості морфо-цитологічної будови мікроорганізмів;
2) охарактеризувати можливості використання мікробіологічних препаратів для боротьби із шкідниками;
3) дати характеристику мікроорганізмам як джерелу нових інсектицидних препаратів.
РОЗДІЛ 1. ОСОБЛИВОСТІ МОРФО-ЦИТОЛОГІЧНОЇ ОРГАНІЗАЦІЇ МІКРООРГАНІЗМІВ
Ультраструктура прокаріотної клітини вивчаються за допомогою електронно-мікроскопічних, мікрохімічних та інших методів, які дають змогу з високою точністю визначити будову і хімічний склад бактерій. Завдяки цим методам вдалося встановити, що прокаріотна клітина має низку принципових особливостей ультраструктурної і хімічної організації порівняно з еукаріотною клітиною (рис. 1).
Зовні цитоплазматичної мембрани бактеріальної клітини розміщуються так звані поверхневі структури: оболонка, капсула, слизовий чохол, джгутики і ворсинки (війки). Цитоплазматичну мембрану разом з цитоплазмою, органелами і включеннями прийнято називати протопластом. Розглянемо спочатку будову, хімічний склад і функції поверхневих структур бактеріальної клітини.

Рис. 1. Комбіноване схематичне зображення прокаріотпої клітини (за Г. Шлегелем, 1972):
І — поверхневі структури: 1 — оболонка клітини; 2 — капсула; 3 — слизові виділення; 4 — слизовий чохол; 5 — джгутики; 6 — війки.
ІІ — цитоплазматичні клітинні структури: 7 — цитоплазматична мембрана; 8 — нуклеоїд; 9 — рибосоми; 10 — цитоплазма; 11 — хроматофори; 72 — хлоросоми; ЇЗ — пластинчасті тилакоїди; 14 — фікобілісоми; 15 — трубчасті тилакоїди; 16 — мезосома; 17 — аеросома (газова вакуоля); 18 — ламелярні структури.
ІІ — записні речовини: 19 — полісахаридні гранули; 20— гранули полі-(3-окси масляної кислоти; 21 — гранули поліфосфату; 22— гранули ціанофіцину; 23 — карбоксисоми; 24— включення сірки; 25 — крапельки жиру; 26 — гранули вуглеводів
За будовою і хімічним складом оболонка бактеріальної клітини суттєво відрізняється від клітинної оболонки еукаріотів. Її складають специфічні полімерні комплекси, яких немає в клітинних структурах інших організмів. Будова і хімічний склад оболонки є сталими для певних видів бактерій, на що зважають під час діагностування. Вважають, що саме оболонка визначає забарвлення бактерії за Грамом. Так називають розроблений данським мікробіологом X. Грамом у 1884 р. метод фарбування мікроорганізмів, який дає змогу диференціювати бактерії.
Після забарвлення бактерій карболовим генціанвіолетом і обробки препаратів розчином йоду та промивання їх спиртом, клітини одних бактерій знебарвлюються, а інші залишаються синьо-фіолетовими. Саме за цією ознакою бактерії поділяють на дві групи: грампозитивні забарвлюються у синьо-фіолетовий колір, грамнегативні знебарвлюються. Суть фарбування мікробів за Грамом досі ще остаточно не з'ясована. Вважають, що в основі цього методу лежать будова і особливості хімічного складу клітинних оболонок бактерій.
Характер побудови клітинної оболонки є важливішою ознакою, ніж саме фарбування за Грамом. Це дозволило Н. Гіббонсу і Р. Муррею ще в 1978 р. запропонувати грамнегативні еубактерії віднести до відділу грацілікутних, а грампозитивні — до відділу фірмікутних бактерій. До цих двох відділів прокаріотів належить переважна більшість бактерій [18].
До складу оболонки прокаріотів входять сім груп хімічних речовин (табл. 1). Як видно, хімічний склад оболонки грампозитивних і грамнегативних еубактерій досить помітно відрізняється. У перших основним компонентом клітинної стінки є пептидоглікани, які ще називають глікопептидами, мукопептидами, або муреїнами. У других — грамнегативних прокаріотів — вміст цього структурного полімеру в кілька разів менший, відсутні тейхоєві кислоти тощо.
Вважають, що головним структурним компонентом оболонок більшості бактерій є пептидоглікан (муреїн). Тільки у мікоплазм, L-форм бактерій, архебактерій та деяких метаноутворюючих і гало-фільних бактерій він відсутній. Пептидоглікан — гетерополімер, який складається з лінійних молекул глікану. Полісахаридний кістяк муреїну побудований із залишків, які чергуються, N-ацетилглюкозо-аміну і N-ацетилмурамової кислоти, з'єднаних між собою за допомогою β-1,4-глікозидних зв'язків (рис. 2). У грампозитивних бактерій нині виявлено близько 100 різних хімічних типів муреїну.
Таблиця 1 Хімічний склад клітинних оболонок грампозитивних і грамнегативних еубактерій
| Компоненти клітинної оболонки | Грампозитивні еубактерії | Грамнегативні еубактерії | |
| Внутрішній пептидоглікановий) шар | Зовнішній шар (зовнішня клітинна мембрана) | ||
| Пептидоглікан | + | + | - |
| Тейхоєві кислоти | + | - | - |
| Полісахариди | + | - | + |
| Білки | ± | - | + |
| Ліпіди | ± | - | + |
| Ліпополісахариди | - | - | + |
| Ліпопротеїни | - | ± | + |
Примітка: + — наявні у малій кількості, ± — наявне в усіх видів, — відсутні.
До сітки пептидоглікану клітинної оболонки прокаріотів входять також тейхоєві і тейхуронові кислоти, поліпептиди, ліпополісахариди, ліпопротеїни та ін. Тейхоєві кислоти після пептидоглікану є другим унікальним класом хімічних сполук клітинної стінки грампозитивних бактерій. Це полімери, які побудовані на основі спиртів рибіту і гліцерину, що їхні залишки з'єднані між собою фосфодіефір-ними зв'язками. При цьому утворюються рибіттейхоєві та гліцерол-тейхоєві кислоти.
Крім тейхоєвих кислот, у оболонках грампозитивних бактерій виявлено тейхуронові кислоти, що утворюються із залишків уронових кислот та N-ацетилглюкозоаміну. В разі бракування фосфору у середовищі вони спроможні заміняти тейхоєві кислоти, які ковалентно можуть з'єднуватися з N-ацетилмурамовою кислотою, їхні довгі лінійні молекули інколи пронизують увесь пептидоглікановий шар, сягаючи зовнішньої поверхні оболонки. Вільні гідроксили фосфорної кислоти, які залишаються, надають тейхоєвим кислотам властивості поліаніонів, завдяки чому ці кислоти визначають поверхневий заряд клітини.
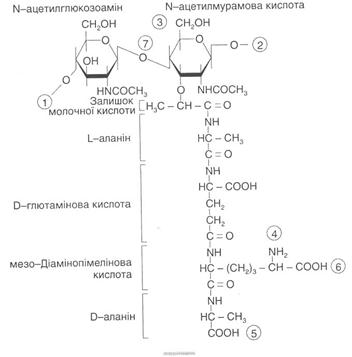
Рис. 2. Структура повторювальної одиниці пептидоглікану клітинної оболонки еубактерій.
Цифри в кільцях позначають: 1,2 — місця полімеризації гліканового скелета молекули; 3 - місце приєднання за допомогою фосфодіефірпого зв'язку молекули тейхоєвої кислоти в клітинній стінці грампозитивних бактерій; 4, 5 - місця, де відбуваються зв'язування між глікановими ланцюгами за допомогою пептидних зв'язків; 6 - місце ковалентного зв'язування з ліпонротеіном зовнішньої мембрани у грамнегативних бактерій; 7— місце дії лізоциму
У складі клітинної оболонки грампозитивних бактерій також виявлено в невеликих кількостях білки, ліпіди і полісахариди. З'ясовано, що полісахариди і ліпіди можуть ковалентно з'єднуватися з макромолекулами оболонки. Стосовно білків, то припускають, що вони виконують захисну функцію [18].
У грамнегативних еубактерій будова клітинної оболонки є набагато складнішою, ніж у грампозитивних (табл. 1). У середині оболонки цих бактерій міститься пептидоглікановий шар. Ззовні від нього розташований ще один шар (зовнішня мембрана), який складається з фосфоліпідів, ліпополісахаридів і білків, а під ним — цитоплазматична (внутрішня) мембрана, до складу якої також входять фосфоліпіди, білки тощо.
Білки зовнішньої мембрани грамнегативних бактерій поділяють на дві групи: основні, які беруть участь у формуванні мембранних гідрофільних пор (їх ще називають поринами) і мінорні білки, що виконують транспортну і рецепторну функції. Вони транспортують у клітину залізовмісні сполуки, вітаміни тощо.
Між зовнішньою і внутрішньою мембранами клітинної оболонки грамнегативних бактерій існує периплазматичний простір (пери-плазма), в якому, крім муреїнового шару, містяться специфічні білки, олігосахариди, неорганічні речовини і вода. Периплазматичні транспортні білки відіграють важливу роль у надходженні в клітину амінокислот, цукрів, фосфатів тощо.
Серед прокаріотів виявлено види бактерій, клітинна оболонка яких за структурою та хімічним складом помітно відрізняється від грампозитивних і грамнегативних типів. Вони належать до групи архебактерій, зокрема оболонки метаноутворюючих архебактерій містять пептидоглікан особливого хімічного складу. В інших представників цієї групи клітинна стінка складається переважно з кислого гетерополісахариду. Оболонка екстремальних галофілів, метаноутворюючих та ацидотермофільних архебактерій складається тільки з білка. Ці бактерії не забарвлюються за Грамом.
Поряд з цим слід зазначити, що за певних умов прокаріоти можуть існувати і без клітинних оболонок. Наприклад, за дії на клітини певними хімічними речовинами можна дістати структури (протопласти і сферопласти), які повністю або частково позбавлені оболонки. Вперше ці структури було виявлено у разі дії на бактерії ферментом лізоцимом з яєчного білка. Встановлено, що цей фермент розриває р-1,4-глікозидні зв'язки, які з'єднуют залишки N-ацетилглюкозоаміну і N-ацетилмурамової кислоти в пептидоглікані. Одержані при цьому протопласти або сферопласти набувають сферичної форми і в сприятливих умовах можуть виявляти певну метаболічну активність. Проте здатність до розмноження вони втрачають.
Унікальність структури і хімічного складу оболонки еубактерій та їх відмінність від рослинних і тваринних клітин дає змогу створювати і застосовувати медикаментозні препарати, які специфічно діють тільки на клітинну стінку прокаріотів і не завдають шкоди клітинам інших організмів. Прикладом цього є дія пеніциліну та деяких інших антибіотиків.
Цитоплазматична мембрана. Обов'язковим структурним компонентом бактеріальної клітини є цитоплазматична мембрана, яка відокремлює цитоплазму від клітинної оболонки. У мікоплазм та деяких інших прокаріотів цитоплазматична мембрана заміняє клітинну стінку. Під електронним мікроскопом цитоплазматична мембрана здебільшого має вигляд тришарового утворення з різною електронною щільністю, завтовшки 5—10 нм. На її частку припадає до 15 % сухої речовини клітини.
За хімічним складом цитоплазматична мембрана є білково-ліпідним комплексом, який містить 50-75 % білків, 15-45 % ліпідів та невеличку кількість вуглеводів. У ліпідах мембран багатьох прокаріотів виявлено низку специфічних жирних кислот, яких немає в мембранах еукаріотів. Це циклопропанові жирні кислоти. Головним ліпідним компонентом мембран бактерій є фосфоліпіди — похідні 3-фосфогліцеролу. Ліпіди підтримують механічну стабільність і зумовлюють гідрофобні властивості мембран [21].
На відміну від ліпідів, білковий склад цитоплазматичної мембрани прокаріотної клітини є набагато різноманітнішим. Наприклад, мембрана кишкової палички містить 27 основних і велику кількість мінорних білків. За амінокислотним складом ці білки майже не відрізняються від інших клітинних білків, за виключенням низького вмісту цистину в них. Досліди показали, що білки мембран бактеріальної клітини переважно є ферментами.
Донедавна найбільше визнання мала модель мембрани, запропонована ще 1935 р. Г.Доусоном і Д.Данієлі, яка дістала назву "елементарної мембрани". Згідно з цією моделлю, мембрана побудована з двох білкових шарів, між якими розташований бімолекулярний шар ліпідів. Однак останніми роками нагромадилось багато даних, які свідчать, що цитоплазматична мембрана має набагато складнішу будову, ніж "елементарна".
Тепер більшість вчених поділяють думку про те, що структура бактеріальної мембрани підпадає під рідинно-мозаїчну модель, розроблену для еукаріотів. Цитоплазматична мембрана утворена мінливим ліпідним бішаром, в який вмонтовані білки. Разом вони утворюють рухому мозаїку. Отже, за цією моделлю мембрана є "рідкою", лабільною, динамічною структурою, якій притаманна молекулярна асиметрія і мінливість.
При "біологічних" температурах мембранні ліпіди перебувають у розрідженому стані, який характеризується частковою впорядкованістю структури. Із зниженням температури вони переходять у кристалічний стан. "Рідка" структура мембран забезпечує свободу білкам, що є необхідним для здійснення процесів транспорту електронів і речовин через мембрану. Ця властивість також зумовлює високу еластичність мембран.
За сучаними даними, білки, що входять до складу цитоплазматичної мембрани, можна умовно поділити на такі групи: інтегральні, які цілком занурені в мембрану, а подекуди пронизують її наскрізь; периферійні білки, частково занурені в гідрофобну ділянку, і поверхневі, що містяться на поверхні мембрани (рис. 3). Зв'язок інтегральних білків з ліпідами частково, а периферійних повністю визначається електростатичними взаємодіями. Поряд з цим деякі білки і ліпіди н мембрані можуть бути ковалентно зв'язаними.
Отже, зовнішня цитоплазматична мембрана — складне високоорганізоване і високоспеціалізоване утворення, що виконує різноманітні функції. Вона є основним бар'єром, який забезпечує вибіркове надходження в клітину і вихід з неї різних речовин (іонів). На поверхні мембрани локалізовані ферментні системи, які беруть участь у синтезі мембранних ліпідів, компонентів клітинної оболонки та інших речовин. Клітинні мембрани містять високочутливі рецептори, за допомогою яких клітини розпізнають і, відповідним чином, реагують на інформацію, яка надходить ззовні [1].
Дуже важлива роль належить цитоплазматичній мембрані у перетворенні клітинної енергії. У бактерій, джерелом енергії для яких є процеси дихання або фотосинтезу, в цитоплазматичній мембрані пев ним чином розміщені переносники електронів (ЕТЛ), функціонування яких приводить до генерування електрохімічної енергії (AjlH+), що використовується потім у клітині по різних каналах, у тому числі й для утворення хімічної енергії (АТФ). У мембрані є також ферментні комплекси, які забезпечують перетворення AJIEP ї± АТФ.
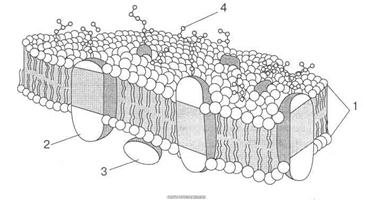
Рис. 3. Рідинно-мозаїчна структура мембран, запропонована С. Дж. Сінгером і Г. Ніколсоном (1972): 1 — біомолекулярний шар фосфоліпідів; 2 — внутрішній білок; 3 — периферійний білок; 4 — олігосахаридні групи
Цитоплазматична мембрана має спеціальні ділянки для прикріплення хромосоми і плазмід за реплікації їх і наступній сегрегації. Нарешті, мембрані належить інтегруюча роль в організмі, яка поєднується з бар'єрною функцією. Клітина являє собою єдине ціле, і порушення цілісності структури цитоплазматичної мембрани призводить до втрати нею життєдіяльності.
Внутрішньоцитоплазматичні мембрани. Розвинуті системи внутрішньоклітинних мембран мають фототрофні, хемотрофні та деякі інші бактерії. Виділяють кілька видів цих мембран. У фотосинтезуючих бактерій внутрішньоцитоплазматичні мембрани можуть мати форму трубочок, пласких дисків (тилакоїдів), пухирців (везикул, хроматофорів) тощо. Оскільки в цих мембранних структурах локалізовано фотосинтетичний апарат клітини (фотосинтезуючі пігменти та системи фосфорилювання), вони дістали загальну назву фотосинтетичних мембран. Всі фотосинтетичні мембрани є похідними цитоплазматичної мембрани, які виникли внаслідок її розростання та інвагінації в цитоплазму.
У зелених фототрофних бактерій та ціанобактерій внутрішньоклітинні фотосинтетичні мембрани відсутні. Основні компоненти фотосинтетичного апарату в них локалізовано на цитоплазматичній мембрані, а світловловлюючі пігменти містяться в органелах, які прилягають до мембрани — хлоросомах і фікобілісомах. У різних груп прокаріотів цитоплазматична мембрана утворює локальні впинання, які дістали назву мезосом. Ці мембранні утворення добре розвинуті у грампозитивних еубактерій. У грамнегативних вони трапляються рідше і менш розвинуті. За формою, розмірами і розміщенням розрізняють три основні типи мезосом: ламе-лярні (пластинчасті), тубулярні (трубчасті) і везикулярні, що нагадують пухирці. Є мезосоми й змішаного типу. Мезосоми найчастіше містяться в зоні формування клітинної перетинки і поділу бактеріального ядра.
Немає єдиної думки щодо функцій мезосом у прокаріотній клітині. Згідно з однією гіпотезою, мезосоми відіграють важливу роль у реплікації і сегрегації ДНК, поділі клітин і утворенні клітинної оболонки. За іншою гіпотезою, мезосоми не є обов'язковими структурами бактеріальної клітини. Вони тільки підсилюють певні клітинні функції. Нарешті, припускають, що мезосоми не беруть активної участі в процесах клітинного метаболізму, а виконують суто структурну функцію, що забезпечує компартменталізацію клітини, створює більш сприятливі умови для перебігу різних ферментативних реакцій [18].
Цитоплазма. Вміст клітини, оточений цитоплазматичною мембраною, називається цитоплазмою. За фізико-хімічною природою цитоплазма — складна колоїдна система. її складають: вода, білки, ліпіди, вуглеводи, мінеральні сполуки та інші речовини, співвідношення яких залежить від виду, віку, живлення бактерій та інших чинників. Фракція цитоплазми, яка має гомогенну консистенцію і містить макромолекули розчинних РНК, ферментних білків, продуктів і субстратів різних метаболічних реакцій тощо, дістала назву цитозоля.
Друга фракція цитоплазми містить різноманітні структурні утворення: внутрішньоцитоплазматичні мембрани, генетичний апарат (нуклеоїд і плазміди), рибосоми, інші внутрішньоклітинні структури і включення різної хімічної природи та функціонального призначення.
Рибосоми — округлі рибонуклепротеїнові тільця діаметром 15-20 нм, що розташовані довільно в цитоплазмі бактерій і складаються на 40 % із білка і на 60 % із РНК. їх кількість у клітині залежить від інтенсивності синтезу білка і може коливатися від 5000 до 90 000. Рибосоми прокаріотів мають константу седиментації 70 S, від чого і дістали назву 70 S-частинок. Вони побудовані з двох рибонуклеопротеї-нових субодиниць: малої 30 S і великої 50 S. Мала субодиниця побудована з однієї молекули 16 S РНК і переважно з однієї молекули кожного з білків 21 виду. Велика субодиниця містить дві молекули РНК (23 S і 5 S) та по одній копії білків 34 видів. Більша частина рибосомальних білків виконує структурну функцію.
За коефіцієнтом седиментації* та деякими іншими властивостями, до бактеріальних рибосом подібні рибосоми мітохондрій і хлоропластів еукаріотних клітин. Рибосоми є центрами синтезу білка в клітині. Під час синтезу білка вони набувають форми агрегатів, які називаються полірибосомами. Ці полісоми містяться у цитоплазмі або зв'язані з мембранними структурами.
Генетичний апарат. Тривалий час точилася дискусія про наявність у бактеріальній клітині ядра, подібного до ядра, що міститься в еукаріотних клітинах. Тепер ні в кого не виникає сумніву щодо наявності генетичного апарату в клітинах прокаріотів. Як і в еукаріотів він представлений молекулами ДНК, але між ними існують істотні відмінності у структурній організації. У прокаріотній клітині, на відміну від еукаріотної, ядерний апарат не відмежований від цитоплазми мембраною та займає певну ділянку в цитоплазмі. Враховуючи цю відмінність, ядерний апарат у прокаріотів запропоновано називати нуклеоїдом. Він міститься всередині цитоплазми і складається з гігантської молекули ДНК у формі замкненої в кільце подвійної спіралі, довжина якої у ціанобактерій може сягати 3 мм. Нуклеоїд у прокаріотів ще називають бактеріальною хромосомою.
Встановлено, що вміст пар нуклеотидних основ у молекулі ДНК бактеріальної хромосоми А+Т і Г+Ц є постійним для даного виду організму. Це відкриття стало важливою діагностичною ознакою бактерій. У молекулі ДНК нуклеоїда зосереджена майже вся генетична інформація прокаріотної клітини. Реплікація ДНК генетичного апарату бактерій відбувається за напівконсервативним механізмом і в нормі завжди передує поділу клітини. Отже, нуклеоїд прокаріотів є основним носієм спадкових властивостей клітини і основним фактором у передачі цих властивостей потомству [1].
У клітинах багатьох прокаріотів поряд з бактеріальною хромосомою містяться і позахромосомні кільцеві молекули ДНК, що дістали назву плазмідів. Вони здатні до автономної реплікації і зумовлюють деякі спадкові властивості бактерій, наприклад, здатність до кон'югації, резистентність до антибіотиків тощо.
Внутрішньоцитоплазматичні включення. В цитоплазмі прокаріотів різних видів містяться також включення, що оточені білковою мембраною і функціонують як структури. До них належать хлоросоми, фікобілісоми, аеросоми, магнітосоми і карбоксисоми. Серед включень, у яких відсутня мембрана, трапляються ті, що є місцем запасання поживних речовин та концентрування продуктів клітинного обміну, які відкладаються всередині прокаріотних клітин. За консистенцією вони бувають рідкі, тверді та газоподібні.
Хлоросоми — внутрішньоцитоплазматичні включення, які беруть певну участь у процесі фотосинтезу зелених бактерій. Вони мають форму пухирців, завдовжки 100-150 і завширшки 25—70 нм, оточені одношаровою щільною білковою мембраною, завтовшки 2—3 нм. У хлоросомах містяться бактеріохлорофіли. Хлоросоми розташовані біля цитоплазматичної мембрани.
Фікобілісоми характерні для ціанобактерій. Як і хлоросоми, вони беруть участь у процесі фотосинтезу. Ці включення мають напівсферичну форму і розташовуються правильними рядами на зовнішній поверхні фотосинтетичної мембрани. У фікобілісомах містяться водорозчинні пігменти білкової природи — фікобіліпротеїни.
Карбоксисоми — структури, що мають вигляд багатокутників, виявлені в клітинах фототрофних і хемолітотрофних еубакте-рій. Вони оточені одношаровою мембраною білкової природи і містять рибулозодифосфаткарбоксилазу — фермент, який бере участь у процесі фіксації СО2 у відновному пентозофосфатному циклі [1].
До включень, які мають пристосувальне значення належать магнітосоми і аеросоми. Магнітосоми виявлені в клітинах бактерій, яким притаманний магнітотаксис, тобто здатність плавати вздовж ліній магнітного поля, наприклад Aquaspirillum magneto-tacticum. Магнітосоми являють собою частинки Fe3O4, оточені мембраною. У різних видів прокаріотів магнітосоми можуть мати різну форму і різне розміщення в їхніх клітинах.
Аеросоми або газові вакуолі виявлено у представників 15 таксономічних груп (ціанобактерії, пурпурні, галобактерії, клостридіїта ін.). Вони оточені білковими мембранами завтовшки до 2 нм і за формою нагадують бджолині соти. Пухирці аеросом заповнені газом, подібним до газу довкілля. Вважають, що вони виконують функцію регуляторів плавучості цих організмів. Завдяки аеросомам бактерії можуть займати в товщі води найбільш вигідне положення щодо вмісту в ній поживних речовин, кисню, освітлення тощо.
До включень, які виконують роль запасних поживних речовин, належать полісахариди, ліпіди, поліпептиди, поліфосфати тощо. Із включень полісахаридної природи в клітинах найчастіше відкладаються глікоген, крохмаль і гранульоза (крохмалеподібна речовина). У випадку несприятливих умов ці сполуки використовуються прокаріотами як джерело вуглецю і енергії.
Ліпіди нагромаджуються в клітинах у вигляді гранул і крапельок жиру, зокрема таким включенням часто є полімер (3-оксимасляної кислоти. Накопичення ліпідів у клітинах надзвичайно інтенсивно відбувається тоді, коли середовище багате на вуглеводи та бідне на азот. Як і полісахариди, ліпіди є для бактерій добрим джерелом вуглецю і енергії.
Дуже поширеними запасними речовинами у багатьох прокаріотів є поліфосфати, які дістали назву волютину (метахроматинові гранули). Волютин нагромаджується в оцтовокислих, молочнокислих, азотфіксуючих та інших видах бактерій. Гранули волютину складаються переважно із поліфосфатів, а тому його найчастіше розглядають як внутрішньоклітинний резерв фосфору. Він використовується клітиною як джерело фосфору і енергії.
У ціанобактерій виявлено специфічні ціанофіцинові запасні речовини поліпептидної природи, які містять аспарагінову кислоту і аргінін. Поява цих включень під час культивування ціанобактерій з азотом і зникнення їх за виснаження середовища на азот дає підстави вважати, що вони є резервом азоту в разі браку його в середовищі. До включень, що їх відносять до продуктів клітинного метаболізму, належать виявлені в цитоплазмі деяких бактерій кристалоподібні включення білкової природи ромбоподібної, кубічної та інших форм. Ці утворення виявились дуже токсичними для гусениць шкідливих комах [5].
Для багатьох сіркобактерій характерне відкладання в клітинах молекулярної сірки як продукту клітинного обміну. Для аеробних тіонових бактерій, які окислюють H2S, сірка є джерелом енергії, а для анаеробних фотосинтезуючих сіркобактерій вона є донором електронів. У сіркобактерій із роду Achromatium виявлено включення у вигляді гранул карбонату кальцію, фізіологічне значення якого досі ще не з'ясовано.
У бактерій родів Caedobacter і Pseudomonas виявлено включення білкової природи, округлої форми, які заломлюють світло. Вони дістали назву R-тілець. Формування їх визначається вірусними або плазмідними генами. Функції R-тілець досі ще не вивчені.
РОЗДІЛ 2. МОЖЛИВОСТІ ВИКОРИСТАННЯ МІКРОБІОЛОГІЧНИХ ПРЕПАРАТІВ ДЛЯ БОРОТЬБИ ІЗ ШКІДНИКАМИ
2.1 Мікробіологічні інсектициди
Мікробіологічні інсектициди забезпечили новий летальний фактор для боротьби з деякими рослиноїдними шкідниками сільськогосподарських культур або лісу. Рівень чисельності популяції шкідника не впливає на ефективність цих препаратів. Для боротьби з комахами, що мають значення в медицині і ветеринарії, мікробіологічні інсектициди ще не розроблені, за винятком екзотоксину Bacіllus thurіngіensіs, що активно діє проти мух і вший (у даний час ще не використовується у виробничих масштабах).Число мікробіологічних інсектицидів дуже не велике в порівнянні з числом хімічних препаратів. Однак в обмеженому числі випадків, коли вони можуть використовуватися, вони настільки ж ефективні, як найкращі хімічні препарати, хоча вони часто коштують набагато дорожче. Препарати, що містять Bacіllus thurіngіensіs (ВТ), дозволені і використовуються у виробничих масштабах для боротьби з деякими шкідливими лускокрилими. Методи виробництва і складання препаратів добре розроблені. Число видів сприйнятливих метеликів велике й усі зростає і на щастя включає лише далеко не всі корисні види. Віруси поліедрозу і гранульозу численні, але вони більш специфічні, хоча в сукупності мають дуже широке коло хазяїнів і настільки ж перспективні в боротьбі зі шкідниками, як і ВТ. Велика перевага мікробіологічних інсектицидів полягає не тільки в їхній нешкідливості для людини і домашній тварин, але також у їхній специфічності, оскільки корисною комахою вони, видимо, заподіюють не більше шкоди, чим хижаки. Однак така специфічність, часто тільки для одного виду, може виявитися і недоліком, коли необхідно вести боротьбу одночасно з декількома шкідниками. Іншими недоліками, крім високої вартості порівняно з хімічними препаратами, є звичайно відсутність контактної дії, а іноді і здатність заражати тільки одну стадію розвитку шкідника.
Хімічні інсектициди порівняно мало діють на патогени комах, хоча окремі фунгіциди можуть ушкоджувати них; у той же час хімікати можуть підсилювати дія деяких патогенів. У СРСР біля Києва побудований завод для виробництва гриба Beauverіa bassіana.
Оскільки токсини діють на багатьох комахах як кишкові отрути, їхній можна використовувати в чистому вигляді, хоча в даний час використовуються тільки суміші спор із кристалами, тому що немає ніяких підстав для видалення спор. На більшість комах спори спричиняють специфічну дію, особливо в низьких дозуваннях, а в патогенезі деяких видів вони відіграють головну роль. Спорові препарати небажано застосовувати в сховищах запасів, але в препаратах для боротьби зі шкідниками запасів можна знищити не менш 99% суперечка ультрафіолетовим опроміненням без шкоди для кристалів або ж можна шляхом екстракції одержати звільнений від спор кристалічний білок, щоправда, менш стабільний і не в первісній кристалічній формі. В даний час вартість очищення препаратів від опор була б занадто висока. Досить чистий екзотоксин можна і зараз одержувати в промисловому масштабі, але це поки нерентабельне. Якщо екзотоксин у чистому виді виявиться досить нешкідливим, його можна буде застосовувати проти деяких мух, метеликів і інших груп комах.
2.2 Інтродукція мікроорганізмів та мікробіологічний метод боротьби
Патогени, що зустрічаються в природі, також відіграють значну роль у скороченні популяцій шкідників, причому масштаби придушення знов-таки коливалися ,у залежності від часу і району. Гарною ілюстрацією може бути чудове екологічне дослідження Entomophthora florіdana на Eutetranychus banksі в цитрусових насадженнях Флориди.
Дотепер описано близько 1000 видів мікроорганізмів, патогенних для комах і кліщів [20], і маються .надійні методи визначення багатьох видів і штамів, але лише деякі з них були інтродуковані навмисно. Частка успішних інтродукцій як мікро-, так і макробіологічних агентів.
Навмисна інтродукція патогенів і використання їх як мікробіологічні інсектициди є цінним методом боротьби, застосовуваним в наш час у відносно невеликому масштабі, і що патогени являють собою важливий фактор у природному обмеженні чисельності комах. Далі, ми можемо констатувати, що з нових методів боротьби зі шкідниками успіхи мікробіологічної боротьби значно скромніші успіхи, досягнуті у результаті кращого застосування хімікатів або макробіологічних агентів, але більше успіхів від використання стійких сортів рослин. Аналогічні думки були висловлені на симпозіумі в Римі в 1968 р. на тему "Нові перспективи в боротьбі зі шкідливими комахами" [20]. Наші досягнення включають також експертизу при застосуванні мікробіологічного методу і створення організацій для практичного використання і розширення цих знань. Ми здобуваємо більш детальне знання екології, необхідного помічника, тому що мікробіологічна боротьба часто йде повільніше і більш потай, чим хімічна. Так, найбільший ефект інтродукції патогену шкідливої комахи може проявитися через рік після обробки, як це було після інтродукції гриба Entomophthora проти яблонной мідяниці в Канаді і вірусу поліедроза соснового пилильщика в Шотландії. Оскільки мікробіологічний інсектицид може діяти повільно, його не можна використовувати на деяких культурах. Так, застосування вірусу поліедрозу Helіothіs zea дуже перспективно використовується на бавовнику, зерновому сорго і кукурудзі, де можна не зважати на деякі ушкодження, але неприйнятно на томатах, де навіть слабке ушкодження може знизити вартість врожаю [18]. Там, де припустимі невеликі ушкодження, мікробіологічну боротьбу можна вести тільки за допомогою швидко діючого і надійного мікробіологічного інсектициду, наприклад, що містить ВТ. Точно так само приймати як критерій негайну і масову загибель шкідника, яка досягається за допомогою летальних інсектицидів, можна лише в тих випадках, коли потрібно високий ступінь загибелі. Менш масова негайна загибель шкідника, не пригнітюча мікробіального агента, нерідко більш цінна для довгострокової боротьби.
2.3 Нешкідливість мікробіологічних агентів
Оскільки було відоме, що мікробіологічні агенти можуть містити токсини, були проведені токсикологічні дослідження на додаток до досліджень більш явної патогенності. Сучасні тенденції - це вимога підвищеної обережності. Урядові органи й установи, що регулюють використання пестицидів, несуть відповідальність за розробку і підтримку стандартів, але це не може служити підставою для бездіяльності або нерозумної затримки використання придатних патогенів. В останні роки США лідирували як у використанні патогенів, так і в розробці законодавства, що регулює їх застосування. Необхідно мати на увазі три аспекти безпеки - нешкідливість для здоров'я робочих, які виробляють або застосовують патоген, для здоров'я споживача, що користується продуктами, обробленими препаратом, нешкідливість для здоров'я диких тварин.
Кожен випадок необхідно розглядати окремо, однак, як правило, більшість патогенів комах нешкідливо для людини і хребетних тварин і жоден з них не володіє фітотоксичністю або фітопатогенністю. За винятком деяких випадків алергії, яка викликана спорами грибів, симптоми якої зникали, як тільки видалили агент, дослідження і застосування засобів мікробіологічної боротьби не спричиняли ніякої небезпеки або захворювань. Рідкі повідомлення про шкідливість патогенів комах для хребетних тварин або людини дуже обнадійливі, якщо враховувати, що комахи служать їжею хребетною твариною і живуть як усередині, так і на поверхні харчових продуктів (зокрема для людини) і в полі й у сховищах.
РОЗДІЛ 3. МІКРООРГАНІЗМИ ЯК ДЖЕРЕЛО НОВИХ ІНСЕКТИЦИДНИХ ПРЕПАРАТІВ
3.1 Класифікація бактеріальних токсинів
Слово "токсин" відбулося від грецького слова toxіkon, що значить отруту. В часи Ерліха токсинами називали всі речовини, які виробляли бактерії і викликали при ін'єкції такі ж симптоми, як при ін'єкції живих мікробів. У даному випадку, як це часто буває в біології, чим менше відомо про саме явище, тим зрозуміліше здається термін. Він одержав різне значення у фармакології, бактеріології, хімії, мікології і т.д.
Токсином називають звичайно будь-який отрутний або шкідливий продукт, виділюваний живим організмом, а в науковому розумінні (особливо в бактеріології) токсинами вважають спеціальний клас антигенних отрут клітинного походження з високою молекулярною масою. Отрути визначають як "будь-які речовини органічної або неорганічної природи, що при заковтуванні, вдиханні, поглинанні через шкіру або парентеральної ін'єкції викликають ушкодження тканин або порушення нормальних фізіологічних функцій" [3]. Тваринні отрути, що вводяться при ужаленні або укусі, визначаються терміном "веноми". Це суміші різних, хімічно неспоріднених компонентів, у число яких можуть входити один або більше токсинів у науковому розумінні цього терміна.
Токсини й в обивательському й у науковому розумінні класифікуються по-різному відповідно різним критеріям. Кожна класифікація проведена з відмінної від інших точки зору і з урахуванням тільки одного з можливих критеріїв. Як наслідок те саме з'єднання може бути віднесене до різних класів відповідно до критерію, обраним для класифікації. Найбільш вживані три критерії: 1) анатомічний - за місцем, де клітина виробляє токсини; 2) механізм або місце дії в організмі хазяїна і 3) структура молекули токсину.
3.2 Класифікація за анатомічним розміщенням
Розрізняють дві головні групи токсинів у залежності від того, де них виявляють або де вони виробляються в бактеріальній клітці: а) ендотоксини укладені усередині бактеріальної клітки, з якої їх можна екстрагувати; б) екзотоксини - це розчинні сполуки, виділені з бактеріальної клітини під час її активного росту в субстраті.
Ендотоксини
У медичній мікробіології ендотоксини розглядають як окрему групу. Приставка "ендо" означає, що вони повинні вироблятися усередині клітини. Фактично ендотоксини є частиною оболонки бактеріальної клітини, їх можна екстрагувати трихлоцтовой кислотою або феноловою водою. Токсичний макромолекулярний комплекс має (молекулярна маса до 106 і 107 і звичайно складається з трьох фракцій - протеїну (білка), ліпіду і полісахариду. Фракції можна розділити, хоча виключення ліпідів приводить до втрати токсичності. Полісахаридна фракція визначає антигенну властивість, яка пояснює імунологічну специфічність ендотоксину.
Ін'єкція ендотоксину сприйнятливому хазяїнові викликає типові синдром-лихоманку, лейкопенію, шкірну реакцію, шок і смерть.
Механізми дії ендотоксинів вивчалися широко, але результати усе ще невизначені. Передбачається, що токсична дія виражається тільки в антигенності, на яку організм хазяїна відповідає реакціями, звичайно подібними з алергійною або анафілактичной реакцією. Миші, вирощені без звичайних кишкових патогенів, несприйнятливі звичайним чином до ендотоксинів, і, отже, їх реактивність залежить від наявності звичайної кишкової мікрофлори.
Важко застосувати термін "ендотоксин" у його медичному розумінні до токсинів ентомопатогенів. У медичній мікробіології цим терміном позначають дуже спеціалізовану групу токсинів, механізм дії яких заснований на виразній реакції сприйнятливого хазяїна - гуморальної реакції, а не на прямій фармакологічній дії ендотоксину. Фактично ендотоксини складають частина поверхні клітки, і приставка "ендо" лише пояснює, що токсин зв'язаний з бактеріальною клітиною на відміну від екзотоксинів, які виділяються у субстрат.
Екзотоксини
Класичні екзотоксини виділяються в субстрат бактеріальними клітинами у фазі їх активного росту. В даний час екзотоксини можна охарактеризувати рядом властивостей: 1) вони являють собою окремі антигени, тобто імунохімічно це чисті хімічні речовини; 2) вони переходять у культуральний фільтрат, тобто не зв`язані бактеріальною клітиною; 3) вони являють собою білки з високою молекулярною масою і 4) у малих дозах вони здатні специфічним чином ушкоджувати сприйнятливого хазяїна.
Зараз уже відомо, що виділення екзотоксинів за межі клітини відбувається не відразу, оскільки це білки, що утворюються усередині клітини на рибосомах. Так, наприклад, вихід токсину з молодих клітин Clostrіdіum botulіnum (тип А) у дев'ять разів більше виходу його з фільтрату. Ця обставина використана для одержання великих кількостей ботулінового токсину стандартним способом.
Іншим, ще не вирішеним питанням є механізм виділення токсину з клітини в середовище. Оскільки деякі токсини це великі молекули (молекулярна маса їх досягає 106), важко уявити, що токсин може шляхом простої дифузії пройти через оболонку цитоплазми і клітини. У світлі сучасних знань ми можемо очікувати наявності якогось механізму проникнення, або якихось "отворів" у клітинній оболонці, або і того й іншого. Однак ні того ні іншого не було встановлено і потрібно набагато більше доказів.
3. 3 Класифікація за місцем або механізмом дії
Відповідно до місця або механізмом дії токсини можуть ушкоджувати насамперед структуру (наприклад, морфологічну окремість) або функцію (тобто нормальний обмін речовин). Нерідке ушкодження структури може виявитися тільки ще одною ділянкою порушення функції або навпаки. На практиці цей теоретично правильний критерій ускладнений усіма труднощами розрізнення між причиною і наслідком. Проте практично він усе ще корисний, особливо якщо класифікація заснована на місці дії, тому що знайти морфологічні ознаки токсичної дії набагато легше, ніж метаболічні.
Це один із самих старих критеріїв для поділу токсинів, оскільки він віднесений тканинам, що уражаються, і його правильність основана на клінічних і фармакологічних даних. Так, токсини, що діють на нервову систему, називаються нейротоксинами (тетанотоксин, ботулотоксин), що уражають шлунково-кишковий тракт - ентеротоксинами, що викликають розпад еритроцитів - гемолізинами, що викликають некроз - некротоксинами і т.д.
Місце дії токсину можна визначити не тільки на рівні тканини, але й у межах клітки. Наприклад, гемолізини ушкоджують клітинну оболонку еритроцитів. Хімічно гемолізини - це лецитинази, і, розщеплюючи лецитин, складову частину клітинної оболонки, вони ушкоджують клітку.
Біохімічно токсини відповідно до їх хімічної активності - це або ферменти, або інгібітори ферментів. Якщо деякі токсини є ферментами, то необхідно установити лінію розмежування між ферментом і токсином. Очевидно, ферментний токсин повинний мати усі властивості як ферменту, так і токсину. У цьому контексті варто згадати термін "додатковий фактор вірулентності", що відноситься до тих ферментам патогенних бактерій які в малих дозах не спричиняють прямої специфічно токсичної дії на сприйнятливого хазяїна і, таким чином, не беруть участь у патогенезі інфекції [1]. Тому в конкретних випадках краще говорити про "токсичні ферменти", поки ми не з'ясували механізм їхньої дії і чи можна їх віднести до сьогоденням токсинами. З іншого боку, було б нерозумно застосовувати термін "токсин" тільки до деяких загальновизнаних токсинів (ботулотоксини, тетанотоксины, ентеротоксини, лейкоцидин, токсин мишачого тифу, токсин сибірської виразки й ін.), тому що наші знання про механізм їх дії також обмежені.
Ензиматичну активність токсинів визначають по тим субстратам, на які вони діють у клітинах хазяїна. Так, наприклад, лецитинази розщеплюють лецитин чотирма різними шляхами. Для того щоб проявилася токсична активність ферменту, потрібно, щоб підходящий субстрат мався в сприйнятливому хазяїні і був для нього фізіологічно важливим. Так, різні лецитинази спричиняють неоднакову по силі дію на різні еритроцити, і ця сила дії залежить не тільки від наявності субстрату, але і від того, як цей субстрат убудований у клітку.
Потрібно також указати, що активність окремих токсинів може складатися, роблячи кінцеву токсичну дію.
3. 4 Класифікація за структурою молекули токсину
Цей новий і найбільш складний критерій розробили Бонвантр і ін. [18]. Він заснований на молекулярній структурі токсину і на ролі цієї в токсичній дії. Розрізняють три головних типи .молекул - прості токсини, складні токсини і токсичні суміші (мал. 4).
Прості токсини. Ця група включає один вид токсичних молекул, синтезованих у біологічно активній формі, що іноді утворять також активні димери або полімери. Цей вид молекул викликає загальне отруєння сприйнятливого хазяїна, як, імовірно, і токсин правця.
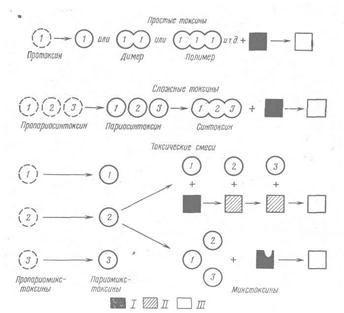
Рис. 4. Схематична класифікація бактеріальних токсинів за структурою їх молекул
1- сприйнятливий хазяїн; ІІ - змінений, але не цілком отруєний хазяїн; ІІІ - цілком отруєний хазяїн.
Молекула токсину може існувати у формі нетоксичного попередника протоксину. Він активується якимсь механізмом, що звільняє токсотрофні хімічні групи, або змінюючи конфігурацію поліпептидного ланцюга, або ж розщеплює молекулу на більш дрібні токсичні фрагменти. Результатом завжди є активація.
Складні токсини. Ці токсини існують у вигляді ряду нетоксичних компонентів, що повинні об'єднатися, щоб стати біологічно активними.
Токсичні суміші. Це найбільш складні токсичні системи. На відміну від складних токсинів окремі компоненти токсичних сумішей зберігають свою молекулярну ідентичність і не утворять хімічних сполук. На сприйнятливого хазяїна вони можуть діяти двома шляхами: у першому випадку токсичний ефект залежить від послідовності, у якій окремі компоненти діють на сприйнятливого хазяїна, і кінцевий ефект є наслідком послідовних змін хазяїна; у другому - окремі компоненти можуть діяти в хазяїні незалежно друг від друга, але не здатні викликати ті симптоми, що викликає вся суміш; якщо один з компонентів втрачає активність, неї втрачає і вся суміш, як, наприклад, токсин сибірської виразки і стафілококовий лейкоцидин.
3.5 Проблема токсинів у патології комах
У медичній і ветеринарній мікробіології токсини широко вивчаються вже протягом життя декількох поколінь, і новітні успіхи біохімії, імунохімії й інших суміжних дисциплін не тільки дають нові методи, але і ставлять нові питання. Тому не дивно, що про інсектицидні токсини відомо набагато менше.
У патології комах лише далеко не всі бактерії вивчені, як продуценти токсинів. Вірогідність отриманих результатів дуже різна, і ця утрудняє яке-небудь порівняння. Механізми дії і природа речовин визначаються звичайно тільки грубо, так що іноді буває важко з упевненістю віднести них до токсинів. Деякі виділені тільки у виді неочищених препаратів з невизначеними хімічною природою і фізіологічними функціями [20].
Як і в медичній мікробіології, ми можемо припустити, що токсини або токсичні речовини можуть різним образом брати участь у патогенезі хвороби комахи. Смит розрізняє чотири різні категорії. Навіть якщо він визначає токсин так, як прийнято в просторіччі, той його розподіл цілком виправданий насамперед методологічно. До першої категорії він відносить токсини, що грають першорядну роль у хворобі. До другого - токсини, що мають істотне значення, але не є єдиними хвороботворними факторами. Перша категорія походить на екзотоксини, друга - на ендотоксини, як вони визначалися вище. У третю категорію включені токсини, утворені іn vіtro, значення яких для хвороби, однак, невідомо. У цю категорію можна, імовірно, уключити більшість токсинів, відомих патології комах. Четверта категорія протилежна третьої, оскільки тут "токсичну дію створюють іn vіvo бактеріїї, що іn vіtro відповідних токсинів не утворять". Теоретично третя і четверта категорії можуть бути сумнівними, оскільки ці з'єднання або зовсім не токсини, або це токсини, які не можна одержати на поживних середовищах Але експериментально вони являють цінність, тому що демонструють усі можливі сполучення при вивченні патогенності. Звідси робиться практичний висновок, що, "займаючись невирішеними проблемами патогенності, варто досліджувати поводження й ознаки вірулентності бактерій іn vіvo, що потім можна бути б відтворити іn vіtro для більш детального дослідження". Це ж відноситься і до визначення токсичної активності. Тому раніш чим віднести з'єднання, виділене іn vіtro до токсинів, варто переконатися, що воно відіграє роль у патогенезі хвороби іn vіvo.
3. 6 Практичні можливості і перспективи використання інсектицидів
Знання токсинів або токсичних метаболітів можна використовувати в біологічній боротьбі безпосередньо для виробництва промислових мікробіологічних інсектицидів або побічно - для більш глибокого вивчення механізму патогенності мікроорганізму, що виробляє токсин.
Що стосується промислових препаратів токсинів, то в практиці використовуються паку тільки мікробіологічні інсектициди на основі В. thurіngіensіs. Кристалічний токсин, винятково сильного і специфічний стосовно широкого кола лускокрилих, можна застосовувати зовсім безпечно навіть на продовольчій сировині. В даний час він відіграє ведучу роль у патогенезі мікробіологічних інсектицидів. "Термостійкий екзотоксин" може знайти практичне застосування в боротьбі з комахами, якщо він виявиться дуже слаботоксичним для ссавців. Для оцінки практичної можливості застосування препарату вирішальним критерієм є економічність, у багатьох відносинах залежна не тільки від біологічної ефективності випробовуваного препарату, але і від ринкової кон'юнктури і від розпоряджень місцевих органів охорони здоров'я. Останній фактор може в багатьох відносинах відігравати обмежуючу роль, хоча іноді такі обмеження є скоріше наслідком новизни методу, чим практичного досвіду [3].
Навіть якщо використання частково очищених токсинів або токсичних метаболітів у біологічній боротьбі буде обходитися занадто дорого, у деяких умовах воно може виявитися вигідним. Так, може бути небажаним застосування живих мікроорганізмів або всього комплексу їх токсинів, якщо, крім потрібного токсину, вони утворять і інші, небезпечні для ссавців або для інших комах.
В даний час набагато краще виправдується непряме використання новітніх даних про токсини, оскільки вони можуть сприяти вивченню багатьох розділів патології комах. Знання природи конкретних токсинів допомагає пояснити механізм їх дії, розробити оптимальні умови виробництва і здійснювати цілеспрямований добір продуктивних штамів. Вивчення токсичних метаболітів може привести до виявлення біологічно активних з'єднань, що хімічна промисловість зможе потім цілком або частково синтезувати у формі чисто хімічних продуктів. Оскільки в число "антибіотиків" входять з'єднання, дуже ефективні проти деяких мікроорганізмів, але одночасно дуже малотоксичні для ссавців, деякі ентомотоксичні сполуки, нетоксичні для ссавців, можуть також виявитися в репертуарі не тільки ентомопатогенних, але й інших мікроорганізмів. Крім цього, вивчення механізму дії таких щодо специфічних у відношенні комах з'єднань може виявити коштовні нові можливості боротьби, засновані на своєрідності фізіології комах.
ВИСНОВОК
Для більшості представників мікросвіту характерною є одноклітинна будова. Бактеріальна клітина оточена оболонкою (а в окремих випадках — цитоплазматичною мембраною) і містить цитоплазму та різні органели. За будовою і хімічним складом оболонка бактеріальної клітини суттєво відрізняється від клітинної оболонки еукаріотів. Її складають специфічні полімерні комплекси, яких немає в клітинних структурах інших організмів. Обов'язковим структурним компонентом бактеріальної клітини є цитоплазматична мембрана, яка відокремлює цитоплазму від клітинної оболонки.
Мікробіологічні інсектициди забезпечили новий летальний фактор для боротьби з деякими рослиноїдними шкідниками сільськогосподарських культур або лісу. Рівень чисельності популяції шкідника не впливає на ефективність цих препаратів. Патогени, що зустрічаються в природі, також відіграють значну роль у скороченні популяцій шкідників, причому масштаби придушення знов-таки коливалися ,у залежності від часу і району.
Методи виділення з мікроорганізмів речовин, які могли б діяти на патогенні мікроорганізми та були екологічно безпечними, має досить багато переваг в порівняння з іншими препаратами.
ЛІТЕРАТУРА
1. Атабеков И.Г. Практикум по общей вирусологии. — М.: Из-во Московского университета, 1981. — 191 с.
2. Векірчик К.М. Практикум з мікробіології: Навч. посібник. – К.: Либідь, 2001. – 144 с.
3. Бойко А Л. Экология вирусов растений. — К.: Вища шк., 1990. — 165 с.
4. Борьба с вирусными болезнями растений. / Под ред. Х.Кеглер. М.: Агропромиздат. — 1986. — 326 с.
5. Вавилов Н.И. Иммунитет растений к инфекционным заболеваниям. - М: Наука, 1986. — 520 с.
6. Вершигора А.Ю., Бранцевич Л.Г., Василевская И.А. и др. Общая микробиология. — К.: Вища шк. Головное изд-во, 1988. — 342 с.
7. Вирощування екологічно чистої продукції рослинництва. /Под ред. Дегодюка Е.Г. — К.: Урожай, 1992. — 318 с.
8. Віруси і вірусні хвороби бобових культур на Україні. / Московець СМ., Краев В.Г., Порембська Н.Б. та ін. — К.: Наукова думка 1971.— 136 с.
9. Вірусні та мікоплазмові хвороби польових культур. / Під ред. Ж.П.Шевченко. — К.: Урожай, 1995. — 304 с
10. Вірусні хвороби сільськогосподарських культур/ Московець С.Н., Бобирь А.Д., Глушак Л.Е. / Під ред. Бобиря А.Д. — К.: Урожай, 1975. — С.72-80.
11. Власов Ю. И., Рядко Т.А., Лытаева Г.К. Вирусные болезни овощных культур. — Л.: Колос,1973. — 73с,
12. Власов Ю.И. Вирусные и микоплазменые болезни растений. — М.: Колос, 1992. — 207 с.
13. Власов Ю.И., Ларина Э.И. Сельскохозяйственная вирусология. — М.: Колос, 1982. — С. 150-156.
14. Гиббс А., Харрисон Б. Основы вирусологии растений: Пер. с англ. — М.: Мир, 1978. — 430 с.
15. Гнутова Р.В. Серология и иммунохимия вирусов растений. — М.: Наука, 1993. — 300 с.
16. Груздева Л.П., Яекин А.А. Почвоведение с основами геоботаники. — М.: Агропромиздат, 1991. — 448 с.
17. Генкель Л. А. Микробиология с основами вирусологии. — М.: Просвещение, 1974. — 270 с.
18. Гусев М. В., Минова Л. А. Микробиология. М.: Изд-во Моск. ун-та, 1992. - 448 с.
19. Дикий И.Л., Холупяк И.Ю., Шевелева Н.Ю. и др. Микробиология: Учебник для фарм. вузов. – Х.: Прапор, изд-во УкрФа, 1999. – 416 с.
20. Микроорганизмы в борьбе с вредными насекомыми и клещами. // Под ред. М.С. Гилярова. – М.: Колос, 1976. – 584 с.
21. Мишустин Е.Н., Емцев В.Т. Микробиология. – М.: Агропромиздат, 1987. – 368 с.