Реферат: Классификация химических реакций
Реферат по химии ученика 11 класса средней шк.№ 653 Николаева Алексея
В качестве классификационных признаков могут быть выбраны следующие:
1. Число и состав исходных веществ и продуктов реакции.
2. Агрегатное состояние реагентов и продуктов реакции.
3. Число фаз, в которых находятся участники реакции.
4. Природа переносимых частиц.
5. Возможность протекания реакции в прямом и обратном направлении.
6. Тепловой эффект.
7. Явление катализа.
Классификация по числу и составу исходных веществ и продуктов реакции.
Реакции соединения.
При реакциях соединения из нескольких реагирующих веществ относительно простого состава получается одно вещество более сложного состава:
A + B + C = D
Как правило, эти реакции сопровождаются выделением тепла, т.е. приводят к образованию более устойчивых и менее богатых энергией соединений.
Неорганическая химия.
Реакции соединения простых веществ всегда носят окислительно-восстановительный характер. Реакции соединения, протекающие между сложными веществами, могут происходить как без изменения валентности:
СаСО3 + СО2 + Н2О = Са(НСО3)2,
так и относиться к числу окислительно-восстановительных:
2FеСl2 + Сl2 = 2FеСl3.
Органическая химия.
В органической химии такие реакции часто называют реакциями присоединения. В них обычно участвуют соединения, содержащие двойную или тройную связь. Разновидности реакций присоединения: гидрирование, гидратация, гидрогалогенирование, полимеризация. Примеры данных реакций:
to
Н2С = СН2 + Н2 → CН3 – СН3
этилен этан
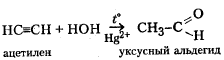
to
HC=CH + HCl → H2C=CHCl
ацетилен хлорвинил
to
n СН2=СН2 → (-СН2-СН2-)n
этилен полиэтилен
Реакции разложения.
Реакции разложения приводят к образованию нескольких соединений из одного сложного вещества:
А = В + С + D.
Продуктами разложения сложного вещества могут быть как простые, так и сложные вещества.
Неорганическая химия.
Из реакций разложения, протекающих без изменения валентных состояний, следует отметить разложение кристаллогидратов, оснований, кислот и солей кислородсодержащих кислот:
|
to |
||
|
CuSO4 5H2O |
= |
CuSO4 + 5H2O |
|
to |
||
|
Cu(OH)2 |
= |
CuO + H2O |
|
to |
||
|
H2SiO3 |
= |
SiO2 + H2O. |
К реакциям разложения окислительно-восстановительного характера относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления:
|
to |
||
|
2SO3 |
= |
2SO2 + O2. |
|
to |
||
|
4HNO3 |
= |
2H2O + 4NO2O + O2O. |
2AgNO3 = 2Ag + 2NO2 + O2,
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.
Органическая химия.
В органической химии к реакциям разложения относятся: дегидратация, дегидрирование» крекинг, дегидрогалогенирование, а также реакции деполимеризации, когда из полимера образуется исходный мономер. Соответствующие уравнения реакций:
to
С2Н5ОН → C2H4 + Н2O
to
С6Н14 → С6Н6 + 4Н2
гексан бензол
C8H18 → C4H10 + C4H8
Октан бутан бутен
C2H5Br → C2H4+ НВг
бромэтан этилен
(-СН2 – СН = С - СН2 -)n → n СН2 = СН – С = СН2
\СНз \ СНз
природный каучук 2-метилбутадиен-1,3
Реакции замещения.
При реакциях замещения обычно простое вещество взаимодействует со сложным, образуя другое простое вещество и другое сложное:
А + ВС = АВ + С.
Неорганическая химия.
Эти реакции в подавляющем большинстве принадлежат к окислительно-восстановительным:
2Аl + Fe2O3 = 2Fе + Аl2О3
Zn + 2НСl = ZnСl2 + Н2
2КВr + Сl2 = 2КСl + Вr2
2КСlO3 + l2 = 2KlO3 + Сl2.
Примеры реакций замещения, не сопровождающихся изменением валентных состояний атомов, крайне немногочисленны. Следует отметить реакцию двуокиси кремния с солями кислородсодержащих кислот, которым отвечают газообразные или летучие ангидриды:
СаСО3+ SiO2 = СаSiO3 + СО2
Са3(РО4)2 + ЗSiO2 = ЗСаSiO3 + Р2О5
Органическая химия.
В органической химии реакции замещения понимаются шире, то есть замещать может не один атом, а группа атомов или замещается не атом, а группа атомов. К разновидности реакции замещения можно отнести нитрование и галогенирование предельных углеводородов, ароматических соединений и спиртов:
C6H6 + Br2 → C6H5Br + HBr
бензол бромбензол
C2H5OH + HCl → C2H5Cl + H2O
этанол хлорэтан
Реакции обмена.
Реакциями обмена называют реакции между двумя соединениями, которые обмениваются между собой своими составными частями:
АВ + СD = АD + СВ.
Неорганическая химия
Если при реакциях замещения протекают окислительно-восстановительные процессы, то реакции обмена всегда происходят без изменения валентного состояния атомов. Это наиболее распространенная группа реакций между сложными веществами - оксидами, основаниями, кислотами и солями:
ZnO + Н2SО4 = ZnSО4 + Н2О
AgNО3 + КВr = АgВr + КNО3
СrСl3 + ЗNаОН = Сr(ОН)3 + ЗNаСl.
Частный случай этих реакций обмена - реакции нейтрализации:
НСl + КОН = КСl + Н2О.
Обычно эти реакции подчиняются законам химического равновесия и протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного, летучего вещества, осадка или малодиссоциирующего (для растворов) соединения:
NаНСО3 + НСl = NаСl + Н2О + СО2↑
Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О
Органическая химия
НСООН + NaOH → HCOONa + Н2O
муравьиная кислота формиат натрия
реакции гидролиза:
Na2CO3
+ Н2О ![]() NaHCO3 + NaOH
NaHCO3 + NaOH
карбонат натрия гидрокарбонат натрия
СО3 + Н2О
![]() НСО3+
ОН
НСО3+
ОН
реакции этерификации:
CH3COOH
+ C2H5OH ![]() CH3COOC2H5
+ H2O
CH3COOC2H5
+ H2O
уксусная этанол
этиловый эфир уксусной кислоты
Агрегатное состояние реагентов и продуктов реакции.
Газовые реакции
|
to |
||
|
H2 + Cl2 |
|
2HCl. |
Реакции в растворах
NaОН(рр) + НСl(p-p) = NaСl(p-p) + Н2О(ж)
Реакции между твердыми веществами
|
to |
||
|
СаО(тв) +SiO2(тв) |
= |
СаSiO3(тв) |
Число фаз, в которых находятся участники реакции.
Под фазой понимают совокупность однородных частей системы с одинаковыми физическими и химическими свойствами и отделенных друг от друга поверхностью раздела.
Гомогенные (однофазные) реакции.
К ним относят реакции, протекающие в газовой фазе, и целый ряд реакций, протекающих в растворах.
Гетерогенные (многофазные) реакции.
К ним относят реакции, в которых реагенты и продукты реакции находятся в разных фазах. Например:
газожидкофазные реакции
CO2(г) + NaOH(p-p) = NaHCO3(p-p).
газотвердофазные реакции
СO2(г) + СаО(тв) = СаСO3(тв).
жидкотвердофазные реакции
Na2SO4(рр) + ВаСl3(рр) = ВаSО4(тв)↓ + 2NaСl(p-p).
жидкогазотвердофазные реакции
Са(НСО3)2(рр) + Н2SО4(рр) = СО2(r)↑ +Н2О(ж) + СаSО4(тв)↓.
Природа переносимых частиц.
Протолитические реакции.
К протолитическим реакциям относят химические процессы, суть которых заключается в переносе протона от одних реагирующих веществ к другим.
В основе этой классификации лежит протолитическая теория кислот и оснований, в соответствии с которой кислотой считают любое вещество, отдающее протон, а основанием - вещество, способное присоединять протон, например:
|
CH3COOH |
+H2O= |
CH3COO-+ |
H3O+ |
| кислотаI | основаниеI | основаниеI | кислотаII |
|
NH3+ |
H2O= |
NH4++ |
OH- |
| основаниеI | кислотаII | кислотаII | основаниеII |
К протолитическим реакциям относят реакции нейтрализации и гидролиза.
Окислительно-восстановительные реакции.
Все химические реакции подразделяются на такие, в которых степени окисления не изменяются (например, реакция обмена) и на такие, в которых происходит изменение степеней окисления. Их называют окислительно-восстановительными реакциями. Ими могут быть реакции разложения, соединения, замещения и другие более сложные реакции. Например:
Zn + 2H+ → Zn2+ + H2↑
FeS2 + 8HNO3(конц) = Fe(NO3)3 + 5NO↑ + 2H2SO4 + 2H2O
Подавляющее большинство химических реакций относятся к окислительно-восстановительным, они играют исключительно важную роль.
Лиганднообменные реакции.
К таковым относят реакции, в ходе которых происходит перенос электронной пары с образованием ковалентной связи по донорноакцепторному механизму. Например:
Cu(NO3)2 + 4NH3 = [Cu(NH3)4](NO3)2
Fe + 5CO = [Fe(CO)5]
Al(OH)3 + NaOH = [NaAl(OH)4]
Характерной особенностью лиганднообменных реакций является то, что образование новых соединений, называемых комплексными, происходит без изменения степени окисления.
Возможность протекания реакции в прямом и обратном направлении.
Необратимые реакции.
Необратимыми называют такие химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ. Примерами необратимых реакций может служить разложение бертолетовой соли при нагревании:
2КСlО3 → 2КСl + ЗО2↑,
или окисление глюкозы кислородом воздуха:
С6Н12О6 + 6О2 → 6СО2 + 6Н2О
Обратимые реакции.
Обратимыми называют такие химические процессы, продукты которых способны реагировать друг с другом в тех же условиях, в которых они получены, с образованием исходных веществ.
Для обратимых реакций уравнение принято записывать следующим образом:
А + В ![]() АВ.
АВ.
Две противоположно направленные стрелки указывают на то, что при одних и тех же условиях одновременно протекает как прямая, так и обратная реакция, например:
СН3СООН
+ С2Н5ОН ![]() СН3СООС2Н5
+ Н2О.
СН3СООС2Н5
+ Н2О.
2SO2
+O2 ![]() 2SO3 + Q
2SO3 + Q
Следовательно, данные реакции не идут до конца, потому, что одновременно происходят две реакции — прямая (между исходными веществами) и обратная (разложение продукта реакции).
Классификация по тепловому эффекту.
Количество теплоты, которое выделяется или поглощается в результате реакции, называется тепловым эффектом данной реакции. По тепловому эффекту реакции делят:
Экзотермические.
Протекают с выделением тепла
СН4 + 2O2 → СО2 + 2Н2O + Q
Н2 + Cl2 → 2HCl + Q
Эндотермические.
Протекают с поглощением тепла
N2 + О2 → 2NO-Q
2Н2O → 2Н2 + O2 - Q
Классификация с учетом явления катализа.
Каталитические.
К ним относятся все процессы с участием катализаторов.
кат.
2SO2
+ O2 ![]() 2SO3
2SO3
Некаталитические.
К ним относятся любые мгновенно протекающие реакции в растворах
BaCl2 + H2SO4 = 2HCl + BaSO4↓
Список литературы
Ресурсы Интернет:
http://chem.km.ru – «Мир Химии»
http://chemi.org.ru – «Пособие для абитуриентов. Химия»
http://hemi.wallst.ru – «Альтернативный учебник по химии для 8-11 классов»
«Руководство по химии. Поступающим в ВУЗы» - Э.Т. Оганесян, М. 1991г.
Большой Энциклопедический Словарь. Химия» - М. 1998г.