Учебное пособие: Полимеразная цепная реакция
Полимеразная цепная реакция
Введение
Полимеразная цепная реакция — это метод амплификации in vitro, с помощью которого в течение нескольких часов можно выделить и размножить определенную последовательность ДНК в количестве, превышающем исходное в 108 раз. Такая высокая степень направленного обогащения значительно упрощает использование имеющегося образца ДНК-Некоторые области применения ПЦР: высокоэффективное клонирование геномных последовательностей, прямое секвенирование митохондриальной и геномной ДНК, анализ вариаций нуклеотидных последовательностей и выявление вирусных патогенов.
При амплификации с помощью ПЦР используют два олигонуклеотидных праймера, фланкирующие интересующий нас участок ДНК; процесс амплификации заключается в повторяющихся циклах температурной денатурации ДНК, отжига праймеров с комплементарными последовательностями и последующей достройки полинуклеотидных цепей с этих праймеров ДНК-полимеразой. Праймеры ориентированы таким образом, что синтез с помощью полимеразы. протекает только между ними, удваивая количество копий этого участка ДНК.
В результате происходит экспоненциальное увеличение количества специфического фрагмента приблизительно по формуле 2n, где п — число прошедших циклов амплификации. Поскольку праймеры физически включаются в концы продуктов застройки, они детерминируют сам продукт реакции — фрагмент ДНК, равный по длине расстоянию между 5'-концами праймеров на исследуемом участке ДНК. Недавние эксперименты показали, что процесс амплификации идет гораздо более эффективно, если использовать термостабильную ДНК-полимеразу, выделенную из бактерии Thermits aquaticus. В отличие от термолабильного фрагмента Клёнова ДНК-полимеразы I Е. coli, использовавшегося ранее, Год-полимераза сохраняет свою активность после тепловой денатурации ДНК, и нет необходимости в замене фермента после каждого цикла. Еще одно достоинство новой полимеразы заключается в более высоком температурном оптимуме детерминируемой ею реакции, что значительно повышает специфичность, количественный выход и возможную длину синтезированных копий интересующей последовательности.
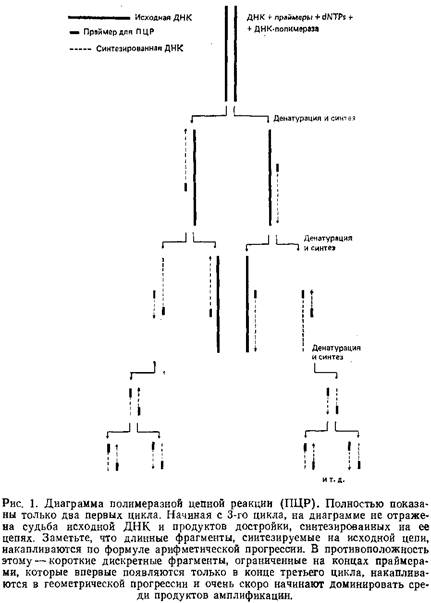
Эта работа описывает ПЦР-амплификацию с использованием ДНК-полимеразы Taq и стратегию прямого секвенирования продуктов ПЦР-амплификации.
1. Основные методики
1.1 Оборудование
Реакции обычно проводят в 0,5- или 1,5 мл микроцентрифужных пробирках Эппендорф. Оборудование для нагрева и охлаждения может быть совсем простым и состоять всего лишь из набора водяных бань с различной температурой воды, или очень сложным и включать нагревательный блок, управляемый микропроцессором. Такой блок используется для полностью автоматизированной реакции амплификации. Условиям неавтоматического проведения ПЦР могут удовлетворять как водяные бани, так и масляные или воздушные нагревательные блоки. Водяные и масляные бани обеспечивают более быстрый теплообмен, чем воздушные нагревательные блоки, но не всегда обеспечивают требуемую чистоту работы.
Если говорить о нагревательных блоках, то наилучшие результаты получаются при использовании алюминиевых штативов с отверстием по форме пробирок. Штативы с большими отверстиями, заполненными песком или мягкими стеклянными шариками, непригодны, поскольку такие наполнители обладают малой теплопроводностью и способны поддерживать температуру не дольше нескольких циклов.
В настоящее время разработано несколько автоматических устройств для проведения цепной реакции полимеризации с участием год-полимеразы. В одном из аппаратов образцы из одной водяной бани в другую переносит робот. В другом — образцы помещены в полость, в которой смена холодной и горячей воды контролируется микрокомпьютером или простым таймером, соединенным с клапанами устройства, подающего воду. Контролируемый микрокомпьютером нагревательный блок, специально разработанный для автоматизированной реакции, можно приобрести у фирмы Perkin Elmer-Cetus Instruments. Он состоит из алюминиевого штатива на 48 образцов, который нагревается электрически, охлаждается жидкостью и для которого можно запрограммировать любой профиль кривой нагрева. Соблюдение необходимых условий дает возможность получать продукты амплификации эквивалентного качества и количества при любом способе проведения.
1.2 Компоненты реакции
Помимо последовательности ДНК, которую необходимо амплифицировать, смесь для ПЦР содержит буфер, дезоксирибонуклеозидтрифосфаты, два праймера, специфичных в отношении связывания с исследуемым образцом, и термостабильную ДНК-полимеразу Taq. Буфер для ПЦР, использующий 7-полимеразу, содержит 50 мм KG, 10 мм Трис-HCl, рН 8,4, 2,5 мм MgCl2 и 100 мкг/мл желатины. Желатина предпочтительнее БСА, так как она более устойчива к коагуляции на этапе денатурации и легко стерилизуется автоклавированием. Некоторые методики для нарушения вторичной структуры ДНК предусматривают использование 10%-ного диметилсульфоксида, хотя по нашему опыту это соединение в некоторой степени ингибирует полимеразу и снижает выход продукта амплификации. Если ДМСО все-таки применяется, для удобства следует приготовить 10-кратный исходный раствор и хранить его при — 20°С.
Нейтрализованные растворы трифосфатов можно приобрести у ряда коммерческих фирм. Затраты могут быть значительно снижены, если закупать лиофилизированные порошки и делать из них водные растворы. Прежде чем приступить к работе, эти растворы необходимо нейтрализовать гидроокисью натрия и точно развести, проверив концентрацию по УФ-поглощению. Для хранения готовят смесь всех трифосфатов и полученный 8 мм раствор замораживают при — 20°С.
Праймеры для ПЦР обычно имеют длину 20 нуклеотидов. Можно синтезировать и более длинные затравки, но они редко бывают необходимы. К 5'-концу праймера можно присоединить последовательность, не комплементарную исследуемому образцу. Такие последовательности включаются в двухцепочечные продукты ПЦР, что обеспечивает возможность введения сайтов рестрикции или регуляторных элементов. Если о подлежащей амплификации последовательности имеется только ограниченная информация, можно использовать и более короткие праймеры с учетом поправки на изменение стабильности «посадки» праймера при температуре достройки. Препараты праймеров следует хранить в концентрации 10 мкм в ТЕ-буфере при —20°С.
Подбор эффективных праймеров для ПЦР — процесс эмпирический. Соблюдение определенных требований увеличивает вероятность получения праймеров, пригодных для использования.
1. Выбирайте праймеры с содержанием GC ~50% и случайным распределением оснований. Следует избегать использования праймеров с протяженными полипуриновыми, полипиримидиновыми или другими неординарными последовательностями.
2. Избегайте последовательностей с устойчивыми вторичными структурами. Для изучения вторичной структуры очень полезны компьютерные программы, исходно разработанные для анализа вторичных структур РНК, и программы построения дот-матриц гомологии.
3. Проверьте затравки на комплементарность друг другу. Очевидно, что праймеры, отжигающиеся друг с другом, не смогут участвовать в амплификации интересующей последовательности.
Хотя большинство затравок с большей или меньшей эффективностью способно работать, бывают случаи, когда и синтезированные праймеры совершенно непригодны для амплификации желаемых последовательностей. Причина этого явления остается пока неясной. Во многих случаях простой сдвиг последовательности затравки на несколько оснований «вверх» или «вниз» решает проблему.
7а-7-полимеразу можно приобрести у ряда фирм. Для реакции ПЦР обычно используют фермент в концентрации 2 ед. в 100 мкл реакционной смеси. Для амплификации образцов ДНК, обладающих высокой кинетической сложностью, например, последовательностей геномной ДНК, оптимум концентрации Гад-полимеразы обычно 1-4 ед. на 100 мкл реакционной смеси. Увеличение количества фермента выше указанного уровня может привести к возрастанию уровня неспецифического синтеза и к уменьшению выхода требуемого фрагмента.
1.3 Параметры температурных циклов
Полимеразная цепная реакция предусматривает инкубацию образцов при трех температурах, соответствующих трем этапам цикла амплификации, - денатурации, отжигу и достройке.
Обычно двухцепочечную ДНК денатурируют путем кратковременного нагрева образца до 90-95°С, затем проводят отжиг, охлаждая образец до 40-60°С, и далее нагревают до 70-75°С, чтобы осуществить достройку отожженных затравок с помощью 7а-7-полимеразы. Время инкубации при 70-75 СС варьируют в зависимости от длины амплифицируемой последовательности. Длительность температурного скачка определяется типом оборудования, используемого для нагрева и охлаждения. За одним лишь исключением, скорость смены температуры не имеет значения и для сокращения длительности цикла практически всегда используются быстрые температурные скачки. Однако, чтобы быть уверенным, что образцы все-таки нагрелись до необходимой температуры, время скачка следует определить, проводя замеры температуры в контрольном эксперименте амплификации. Термопара для замера в микронробах и цифровой многофункциональный счетчик очень полезны для этих целей.
Обычно длительность смены температур для 100 мкл реакционной смеси в 1,5 мл пробирках и водяных банях, настроенных на 72°, 93о и 55°С, следующая:
1) 72° — 93°С— 1 мин,
2) 93 — 55°С— 1 мин,
3) 55 — 72°С — 45 с.
Время скачка для таких же образцов, но в нагревательном блоке с формованными отверстиями обычно больше, по крайней мере, в два раза. Недостаточный прогрев на этапе денатурации — одна из наиболее распространенных причин неудач при проведении реакции ПЦР вручную. Как правило, разделение цепей происходит, если реакционная смесь нагрета выше 90°С. Чтобы гарантировать разделение, следует довести температуру смеси до 93°С. Как только этот рубеж достигнут, образец можно охлаждать до температуры отжига затравки. Долгая денатурация не является необходимой; более того, именно непродолжительное воздействие повышенных температур обеспечивает поддержание высокой активности фермента в течение всей реакции амплификации. Чтобы предотвратить потерю влаги за счет испарения с поверхности реакционной смеси, можно наслоить на нее 50 мкл минерального масла.
Температура проведения отжига зависит от длины затравки и содержания в ней GC-nap. Для типичной затравки длиной 20 нуклеотидов и 50%-ным содержанием GC-nap подбор температуры хорошо начинать с 50-60°С. Из-за большого молярного избытка затравки в реакционной смеси гибридизация происходит почти мгновенно и не требуется долгой инкубации при температуре отжига. Иногда оказывается возможным отжигать затравки и при 72°С, т.е. при температуре достройки. При этом значительно упрощается вся процедура: она сводится к двухтемпературному циклу.
В некоторых случаях, когда доступны только 12-15-нуклеотидные затравки, требуется температура отжига 40°С. Однако затравки такой длины не удерживаются на матрице при температуре достройки 72°С. Преодолеть эту трудность можно следующим образом. Используя частичную ферментативную активность полимеразы при низких температурах, можно удлинить затравки на несколько нуклеотидов и тем самым стабилизировать их. Это достигается либо за счет промежуточной инкубации в течение нескольких минут при 55-60°С или путем медленного нагревания от 40 до 72°С.
Температура достройки праймера 72°С очень близка к температуре, при которой ДНК-полимераза Taq проявляет максимальную активность. Как уже отмечено, продолжительность инкубации при 72°С зависит от длины амплифицируемого участка ДНК. Считается, что Га-полимераза синтезирует последовательность длиной 1000 нуклеотидов за 1 мин, однако можно опробовать и более короткое время инкубации. Этап удлинения затравки можно совсем исключить, если исследуемая последовательность имеет длину, не превышающую 150 нуклеотидов. При нагреве между этапами отжига и денатурации образцы будут находиться в диапазоне температур 70-75°С несколько секунд, что достаточно для полной достройки отожженной затравки.
2. Амплификация геномной последовательности «вручную»
Методика, описанная в этом разделе, предназначена для проведения амплификации однокопийной последовательности ДНК длиной до 500 п. н. Детали ее могут быть изменены в соответствии с целями эксперимента. Реакционная смесь в объеме 100 мкл включает 1 мкг геномной ДНК человека, 1-кратный солевой буфер, 1 мм каждого праймера, 0,2 мм каждого dNTP и 2,5 единиц Гад-полимеразы. В приведенном частном примере район, а также с помощью гибридизации с олигонуклеотидными пробами. Теперь для этого разработан метод секвенирования амплифицированной ДНК без предварительного ее клонирования.

Прямое секвенирование имеет два важных преимущества перед традиционным клонированием фрагментов ПЦР в плазмидных и вирусных геномах.
1. Эту процедуру проще стандартизовать, так как ее проводят in vitro и она не зависит от живых систем. 2. Метод более быстр и надежен, поскольку в норме достаточно проанализировать единственную последовательность для каждого образца. Если же мы имеем дело с клонированными ПЦР-последовательностями, то для одного образца их нужно проанализировать несколько, чтобы отличить мутации, происшедшие в исходной геномной последовательности, от случайных ошибок при достройке ДНК-полимеразой в реакции ПЦР.и таких артефактов полимеразной реакции, как образование мозаичных аллелей вследствие рекомбинации in vitro.
Простота, с которой можно получить четкие надежные данные, не прибегая к клонированию в бактериях, определяется 1) способностью ПЦР-затравок амплифицировать только интересующие последовательности и 2) способом получения образца, приемлемого для секвениро-вания. Для прямого секвенирования продуктов ПЦР вполне пригоден химический метод. Мы рассмотрим здесь только наиболее распространенный метод Сэнгера, использующий нуклеотиды-терминаторы полимеразной реакции. Специфичность ПЦР-затравок в принципе определяет гомогенность амплифицируемых последовательностей. В идеале, в результате реакции экспоненциально наращивается только интересующая последовательность. Однако в реальных условиях многие праймеры амплифицируют также различные посторонние последовательности. Повышая температуру отжига в полимеразной реакции, это осложнение удается преодолеть. К тому же для устранения затруднений, связанных со свойствами конкретной амплифицируемой последовательности, можно применить предварительную очистку интересующей последовательности электрофорезом в геле или использовать денатурирующий градиентный гель.
В конечном счете, если эти осложнения никак более не удается преодолеть, можно при секвенировании использовать внутренние праймеры, отжигающиеся только на интересующей последовательности.
Еще одно неудобство, вызванное прямым секвенированием продуктов ПЦР, обусловлено способностью двух цепей амплифицированного фрагмента к быстрой реассоциации, что мешает отжигу секвенационного праймера на комплементарной последовательности или блокирует реакцию достройки комплекса затравка — матрица. Устранить это препятствие можно, применяя один из вариантов стандартного метода секвенирования двухцепочечной ДНК или модифицируя ПЦР с целью получения одноцепочечных продуктов.
3.1 Секвестрование двухцепочечных образцов
Для приготовления двухцепочечных образцов, используемых при секвенировании, выберите одну из двух методик.
1. Денатурируйте образец NaOH, перенесите в лед, нейтрализуйте реакцию, после чего быстро осадите ДНК- Растворите ДНК в буфере, содержащем секвенационный праймер, при необходимой температуре отжига.
2. Денатурируйте образец нагреванием, затем быстро перенесите в спиртовую баню, охлажденную до температуры сухого льда, замедлив таким образом процесс реассоциации цепей. Добавьте секвенационный праймер и нагрейте до необходимой температуры отжига.
Для секвенирования двухцепочечных плазмидных ДНК подходят оба способа. Секвенировать продукты ПЦР по этим инструкциям гораздо труднее, так как короткие линейные фрагменты ДНК более склонны к реассоциации, чем двухцепочечные кольцевые плазмиды.
3.2 Секвенирование одноцепочечных фрагментов ДНК
Затруднения, связанные с реассоциацией цепей фрагмента, можно преодолеть, если приготовить одноцепочечные образцы ДНК путем разделения цепей в геле или синтезировать их в самой реакции ПЦР. Для разделения цепей фрагментов длиной не менее 500 п. н. могут быть с успехом использованы соответствующие агарозные гели. В случае более коротких фрагментов такой подход не эффективен. Однако недавно мы разработали метод, позволяющий синтезировать одноцепочечные ДНК в ходе реакции ПЦР.
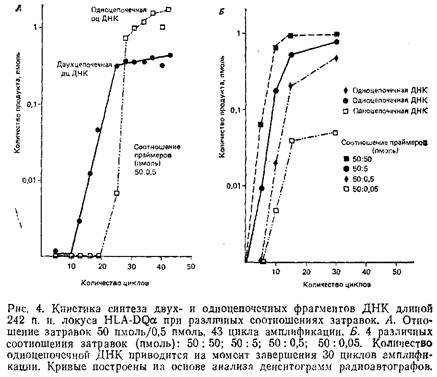
Эта процедура предусматривает использование неэквивалентных количеств двух праймеров для амплификации, что позволяет синтезировать за первые 20-25 циклов двухцепочечную ДНК и за последующие 5-10 циклов в условиях недостатка одного из праймеров — одноцепочечную ДНК.
Рис. 4, А демонстрирует накопление дцДНК и оцДНК в ходе обычной амплификации геномной последовательности, использующей исходное соотношение затравок 50:0,5 пмоль в 100 мкл реакционной смеси. Как и ожидалось, количество дцДНК возрастает экспоненциально до момента практического исчезновения из реакционной смеси одного из праймеров, после чего количество этой ДНК нарастает очень медленно. Фракция оцДНК появляется, начиная с 25-го цикла, с момента, когда запас лимитирующей затравки почти полностью исчерпан. После короткой начальной стадии быстрого роста оцДНК накапливается линейно, чего следует ожидать в присутствии одного праймера.
Разные соотношения праймеров дадут в принципе сходную картину образования оцДНК. Различные неравные отношения 50:5, 50:0,5, 50:0,05 дают за 30 циклов полимеразной реакции количество оцДНК, превышающее количество синтезированной дцДНК. Как правило, соотношение 50:0,5 позволяет получить после 30 циклов ПЦР 1-5 пмоль оцДНК. Образованная оцДНК может быть затем секвенирована с использованием лимитирующего праймера ПЦР или внутреннего праймера по обычной схеме химической или энзиматической методики секвенирования. Синтезированные фрагменты будут иметь гомогенный 5'-конец и в различной степени усеченный 3'-конец вследствие преждевременной терминами синтеза. Однако при использовании некоторых секвенационных затравок только полная оцДНК. может служить образцом для секвенирования.

1. Проведите реакцию ПЦР по уже описанной методике, изменив только количества используемых праймеров на 50 пмоль и 0,5 пмоль в 100 мкл реакционной смеси. Проведите 30— 35 циклов реакции. Если необходимо секвенировать обе цепи, приготовьте также образец с обратным соотношением объема используемых затравок.
2. После завершения ПЦР смешайте 100 мкл реакционной смеси с 2 мл дистиллированной воды, заполните этой смесью микроконцентратор Centricon 30 и для удаления избытка dNTP и компонентов буфера отцентрнфугируйте при 5000 об/мин в роторе с фиксированным наклоном пробирок.
3. Высушите 10 из 40 мкл концентрата и растворите в 10 мкл секвенационного буфера, содержащего 1 пмоль секвенационного праймера.
4. Прогрейте смесь праймер — матрица при 65 °С в течение 2 мин, затем оставьте охлаждаться до 30 °С в течение 20 мин.
5. Добавьте 1 мкл 100 мМ DDT, 2 мкл смеси для включения метки, разведенной в соотношении 1/100, 0,5 мкл dATP, 10 мкКи/мкл, 2 мкл ДНК-полимеразы Т7.
6. Внесите 3,5 мкл приготовленной смеси в каждую из 4 пробирок, содержащих 2,5 мкл смеси дидезоксирибонуклеозидов, и инкубируйте 5 мин при 37°С.
Остановите реакцию добавлением 4 мкл 95%-ного формамида, 20 мм ЭДТА; прогрейте в течение 2 мин при 75°С и нанесите на секвенационный гель.
Заключение
ПЦР открывает возможность быстрого синтеза миллионов копий индивидуальной последовательности ДНК, что значительно упрощает последующий ее анализ.
Поскольку в результате цепной амплификации образуются идентичные фрагменты специфичной ДНК, сразу же может быть осуществлено клонирование или секвенирование продуктов реакции. Матрицей для ПЦР-амплификации могут служить как геномная ДНК, так и кДНК, синтезированная путем обратной транскрипции РНК- Чувствительность метода позволяет обнаружить и амплифицировать единственную молекулу ДНК- При автоматизации ПЦР и наличии нерадиоактивных материалов для мечения ДНК полнмеразная цепная реакция обещает стать в будущем стандартной молекулярно-биологической процедурой. Можно предположить, что велика будет и ее роль в диагностике наследственных и инфекционных заболеваний.