Курсовая работа: Строение и принцип действия переносчиков
Министерство образования и науки Российской Федерации
Пензенский государственный педагогический университет
им.В.Г. Белинского.
Кафедра биохимии
Курсовая работа
на тему:
Строение и принцип действия переносчиков
Выполнил: студентка
4 курса группы БХ-41
Живаева Любовь
Проверил:
к. б. н. Соловьев В.Б.
Пенза 2009 г
Содержание
Введение. 3
1. Переносчики: разнообразие функций. 7
2. Переносчики как ферменты: применение теории скоростей. 9
3. Применение теории переходного состояния при изучении работы переносчиков 10
4. Анализ стационарного состояния. 12
5. Некоторые симпортеры, антипортеры и унипортеры.. 14
5.1 Белок полосы 3 - анионный переносчик из мембраны эритроцитов. 15
5.2 Группа митохондриальных переносчиков. 17
5.3 Переносчик глюкозы из мембраны эритроцита. 18
5.4 Лактозопермеаза из е. Соli 20
6. Несколько примеров активных переносчиков, использующих энергию атр и фосфоенолпирувата. 22
6.1 Переносчики катионов плазматической мембраны (е1e2-типа): атр-зависимые ионные насосы.. 25
6.2 АТР-азы F1F0-типа из митохондрий, хлоропластов и бактерии. 30
6.3 Три других класса переносчиков. 32
Заключение. 36
Введение
ОБЩИЕ ПОЛОЖЕНИЯ.
Фосфолипидный биослой является очень эффективным барьером для множества небольших растворимых молекул. Тем не менее через плазматическую мембрану, а также через мембраны, ограничивающие различные органеллы (например, митохондрии), постоянно транспортируются полярные вещества и ионы. Этот транспорт целиком опосредован белками, и для объяснения механизма переноса растворимых веществ через мембрану было предложено много моделей. Будет полезно ввести несколько терминов, использующихся для характеристики белков или структур, участвующих в трансмембранном транспорте. В табл.1 дается классификация транспортных белков. Прежде всего их подразделяют на каналы (или поры) и переносчики. Поры и каналы часто изображают в виде туннелей через мембрану, в которых места связывания транспортируемых растворимых веществ доступны с обеих сторон мембраны одновременно. Канальные белки не претерпевают никаких конформационных изменений в процессе переноса растворимых веществ с одной стороны мембраны на другую. Напротив, конформация переносчиков в процессе транспорта различных веществ изменяется. Переносимое вещество связывается с одной стороны мембраны, и для высвобождения его с другой стороны в переносчике должно произойти определенное конформационное изменение. При этом в любой момент времени место связывания вещества доступно только с одной стороны мембраны.
Таблица 1. Классификация некоторых транспортных белков, основанная на механизме их действия и энергетике.

Переносчики можно разделить на две группы: пассивные и активные. Мы будем использовать термин пассивный переносчик в том случае, когда при его участии осуществляется перенос через мембрану единственного типа веществ. Переносчики-унипортеры только увеличивают поток вещества, идущий без потребления энергии, т.е. по градиенту электрохимического потенциала. Такой процесс называется облегченной диффузией. Наиболее полно изученным пассивным переносчиком является переносчик глюкозы в эритроцитах.
Активные переносчики осуществляют перенос веществ через мембрану с затратами энергии, в результате эти вещества накапливаются с одной стороны мембраны. При этом транспорт вещества должен быть сопряжен с другим, запасающим свободную энергию процессом. Почти все первичные активные переносчики являются ионными насосами, в которых перемещение иона прямо сопряжено с поставляющей энергию химической или фотохимической реакцией. Примером ионного насоса является бактериородопсин, который для переноса протонов через мембрану использует энергию фотонов видимого света. В большинстве случаев ионные насосы являются электрогенными: при работе первичного насоса осуществляется перемещение заряда, в результате чего происходит разделение электрических зарядов и на мембране создается напряжение.
Первичные активные переносчики генерируют напряжение и создают трансмембранные ионные градиенты. Вторичные активные переносчики используют такие градиенты в качестве движущей силы для транспорта растворимых веществ. Наиболее полно охарактеризованным примером такого рода является белок - переносчик лактозы (лактозопермеаза) из Escherichia colt. Этот переносчик использует протонный электрохимический градиент, генерируемый дыхательной электронтранспортной цепью, в качестве движущей силы для накопления лактозы в клетке. Это пример симпорта, когда через мембрану одновременно переносятся два разных вещества (например, протоны и лактоза). Антипортеры осуществляют транспорт веществ в противоположных направлениях. Так, например, белок полосы 3 эритроцитов осуществляет сопряженный транспорт Cl - и НСО3 - в противоположных направлениях через эритроцитарную мембрану.
Термины пермеаза, транслоказа и переносчик, являющиеся синонимами, их часто используют по отношению к транспортным белкам, отличным от первичных активных переносчиков. Обычно термин "пермеаза" применяют при описании бактериальных транспортных белков. Термин "переносчик", по-видимому, лучше использовать по отношению к ионофорам или сходным с ними структурам, которые связываются с ионами и переносят их через биослой в составе комплекса.
Некоторые группы переносчиков:
1. Митохондриальные переносчики:
переносчик ADP/ATP; - переносчик Н+ - фосфатаза;
разобщающий белок (переносчик Н+ /ОН -)
2. Переносчики сахаров:
переносчик глюкозы (клетки млекопитающих);
переносчик Н+-арабинозы (Е. coli);
переносчик Н+ - ксилозы (Е. coli);
3. АТРазы E1E2-типа, сопряженные с трансмембранным переносом ионов:
Н+ /К+-АТРаза (слизистая желудка млекопитающих);
Na+ /К+ - АТРаза (плазматическая мембрана);
Са2+-АТРаза (саркоплазматический ретикулум);
Н+ - АТРаза (плазматическая мембрана);
К+-АТРаза (S. faecalis).
1. Переносчики: разнообразие функций
Функции переносчиков весьма разнообразны; проиллюстрируем их на нескольких примерах.
Таблица 2. Сравнение скоростей транспорта для некоторых систем.
| Система | Скорость транспорта, с-1 |
| Н+-лактозопермеаза Е | 30 |
| Переносчик глюкозы(эритроциты) | 300 |
| Анионный переносчик белок полосы 3 | 100 000 |
| Бактериородопсин | 50 |
| Nа+/К+-АТРаза | 450 |
| Цитохром с-оксидаза | 1000 |
В табл.2 приведены значения числа оборотов для нескольких переносчиков. Для лактозопермеазы Е. coli максимальное число оборотов составляет всего лишь 30 с-1. Ее роль состоит в транспорте лактозы - углевода, который затем участвует в клеточном метаболизме.
Для ионных насосов, использующих для работы энергию гидролиза АТР или переноса электронов, характерны максимальные числа оборотов, что довольно типично для ферментов.
Однако не все переносчики работают столь медленно. Анионный переносчик белок полосы 3 из эритроцитарной мембраны играет важную физиологическую роль в усилении быстрого трансмембранного обмена С1 - на НСО3-. Одна из функций эритроцитов заключается в усилении транспорта СО2 от различных тканей к легким. В венозных капиллярах СО2 быстро диффундирует через эритроцитарную мембрану. В клетке под действием карбоангидразы СО2 превращается в Н2СО3, затем быстро устанавливается равновесие Н2СО3 ↔ Н+ + НСО3 - , и анион бикарбоната переносится через мембрану в плазму крови белком полосы 3. В результате по мере того, как эритроцит проходит по капиллярам, концентрация НСО3 - в плазме увеличивается, причем этот процесс занимает меньше 1 с. Когда кровь достигает легких, начинается диффузия СО2 в атмосферу. При этом под действием карбоангидразы в эритроцитах происходит массовое превращение Н2СО3 в СО2 и Н2О. Этот процесс в свою очередь является движущей силой для переноса аниона бикарбоната внутрь эритроцита, где он быстро превращается в СО2 и Н2О.
Транспортная система должна функционировать очень быстро, но в отличие от ионных каналов в аксонах здесь нет нужды в электрогенных реакциях, которые только замедлили бы быстрый массовый транспорт. Но транспорт катиона, например Na+, вместе с НСО3 - был бы нежелателен, поскольку изменение концентрации соли в эритроците привело бы к осмотическому дисбалансу. Эта проблема решается с помощью антипортера, который в обмен на каждый транспортируемый ион НСО3 - переносит в обратном направлении анион Сl-. Такая челночная система работает очень быстро.
2. Переносчики как ферменты: применение теории скоростей
Кинетическую теорию переходного состояния Эйринга, используемую энзимологами, успешно применяют и в случае различных транспортных систем. В основе этого подхода лежит предположение о том, что система может находиться в нескольких дискретных состояниях, каждому из которых соответствует стандартное значение электрохимического потенциала. При этом взаимные переходы между двумя состояниями сопряжены с переходом системы через промежуточные стадии с более высокой свобод ной энергией, и константы скоростей переходов зависят от высоты соответствующих энергетических барьеров. Минимумы на кривых изменения свободной энергии (рис.1) соответствуют местам связывания транспортируемых веществ. Можно предположить, что переносчик имеет одно или несколько мест связывания переносимых веществ. При достаточно высоких концентрациях переносимого вещества все эти места оказываются занятыми и скорость переноса достигает своего максимального значения К mах, равного максимальной скорости работы фермента. Экспериментальные подтверждения этому получены для всех переносчиков.
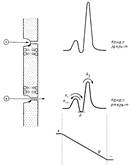
Рис.1
3. Применение теории переходного состояния при изучении работы переносчиков
Рассмотрим простой переносчик с одним местом связывания, транспортирующий молекулы через мембрану. Рис.2 иллюстрирует основные свойства как первичного активного переносчика, так и пермеазы.
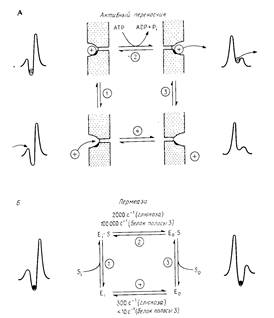
Рис.2
Рассмотрим четыре состояния белка-переносчика:
1) белок обращен внутрь/связан с субстратом;
2) обращен внутрь/не связан;
3) обращен наружу/ связан с субстратом;
4) обращен наружу/не связан.
Тогда транспорт можно представить в виде следующей последовательности элементарных обратимых стадий. Субстрат связывается с участком, обращенным к одной стороне мембраны (определяемой как цис-сторона). Происходит конформационное изменение, существенно уменьшающее кинетический барьер для перемещения иона к выходу из канала и увеличивающее энергетический барьер для движения в обратном направлении. Это конформационное изменение может быть спонтанным или может происходить с потреблением энергии (например, энергии гидролиза АТР). Участок переносчика со связанным субстратом оказывается теперь обращенным к противоположной стороне мембраны (определяемой как транс-сторона). Субстрат высвобождается из комплекса с переносчиком и выходит на противоположной стороне мембраны. Для активных переносчиков сродство субстрата к белку ниже, когда место связывания обращено к транс-стороне мембраны. Происходит конформационное изменение, возвращающее белок-переносчик к исходной конформации, в которой место связывания вновь обращено к цис-стороне.
Ключевым моментом в работе всех переносчиков является наличие высокого энергетического барьера, для преодоления которого соответствующие белки должны претерпеть конформационные изменения. Если для этого необходима энергия, то система может работать как активный переносчик (пример - Са2 + - насос, транспортирующий ионы Са2+ за счет энергии гидролиза АТР). Если для конформационного перехода необходимо, чтобы молекула переносимого вещества была связана с белком, т.е. стадия 4 отсутствует, то белок будет катализировать только обмен вещества через биослой, поскольку он не может изомеризоваться в "незагруженной" форме (пример - белок полосы 3 эритроцитов). Кинетическая теория переходного состояния имеет определенные ограничения, но ее применение упрощает решение многих сложных задач и позволяет единым образом подходить к рассмотрению различных транспортных механизмов.
4. Анализ стационарного состояния
Для кинетической характеристики транспортных систем, которые катализируют облегченную диффузию или активный транспорт, могут использоваться различные подходы к анализу стационарного состояния. Все эти подходы основаны на измерении скорости переноса растворимых веществ через мембрану, но при разных условиях. В качестве примера мы рассмотрим эксперименты, которые проводились на пермеазах и мембранных везикулах. Обычно для такого рода измерений используют радиоактивные метки. Ключевым моментом является то, что пермеаза должна не только переносить вещество через бислой (цис → транс), то также и возвращаться обратно (транс → цис). Скорость транспорта может зависеть от любой из этих стадий. Опишем вкратце некоторые подходы к анализу.
1. Субстрат присутствует только с одной стороны мембраны (цис). Начальная скорость транспорта измеряется для однонаправленного потока. Обратите внимание, что для обеспечения постоянного потока транспортируемого вещества переносчик (пермеаза) должен вернуться свободным. Измеряют поток как функцию [S] цис для процесса, протекающего в любом направлении (например, для переноса вещества внутрь везикул или для выведения его из везикул).
Равновесный обмен. Субстрат присутствует в одинаковой концентрации с обеих сторон мембраны, но радиоактивная метка - только с одной стороны (цис). В этом случае пермеаза может возвращаться, будучи связанной с немеченым веществом. Из меряют поток как функцию [S].
Меченый субстрат находится с цис-стороны мембраны, а в насыщающей концентрации он присутствует на противоположной (транс) стороне. Измеряют поток как функцию [S] цuc. Как и в первом случае, при этом регистрируют однонаправленный поток (цис→ транс). Такой поток называют также встречным, поскольку меченое вещество переносится против своего химического градиента.
Удельная радиоактивность субстрата с обеих сторон мембраны одинакова. В насыщающей концентрации субстрат находится на транс-стороне, a [S] цис изменяется. В этом случае измеряют суммарный перенос, поскольку радиоактивное вещество пересекает мембрану в обоих направлениях. При таких условиях измерения состояние системы близко к равновесному.
Во всех случаях определяют Vmax и Км которые при этом не обязательно совпадают для разных подходов. Для разных моделей можно получить кинетические уравнения для стационарного состояния и проверить их. Как и в классических работах по энзимологии, очень полезным может оказаться использование ингибиторов. При этом ингибиторы можно вводить с любой стороны мембраны, что позволяет получить дополнительную информацию.
Такого рода подходы можно применять при работе с клетками, субклеточными мембранными везикулами или искусственными реконструированными системами. Для исследования работы ионных каналов обычно применяют электрические методы, которые дают огромные преимущества. Их мы рассмотрим в следующем разделе.
5. Некоторые симпортеры, антипортеры и унипортеры
К настоящему времени достаточно хорошо охарактеризовано несколько систем, катализирующих транспорт одного или более растворимых веществ. При этом скорость переноса с помощью этих белковых комплексов гораздо ниже, чем даже через наиболее "медленные" каналы. В данном разделе мы рассмотрим переносчик глюкозы и анионный переносчик (белок полосы 3) из мембраны эритроцита, лактозопермеазу из Е coli и группу митохондриальных переносчиков. Транспортные функции этих белков весьма разнообразны: они катализируют облегченную диффузию одного какого-то вещества, симпорт Н+ и сахара, в результате чего происходит накопление сахара в клетке, и антипорт растворенного вещества.
Отметим некоторые общие свойства этих процессов:
1. В некоторых случаях эти транспортные белки являются олигомерами, обычно димерами. Однако, по-видимому, только у митохондриальных переносчиков (например, у системы обмена ATP/ADP) канал образуется из структурных элементов разных мо номеров. Во всех других случаях, по всей вероятности, каждая субъединица функционирует независимо, даже если она является частью олигомера.
2. Весьма высокая степень гомологии транспортных белков указывает на их близкое структурное родство, хотя они существенно различаются как по субстратной специфичности, так и по функциям. Это позволяет предположить, что для широкой группы функционально различных переносчиков характерны общие транспортные механизмы.
3. Для анализа работы в большинстве случаев транспортных белков можно с успехом использовать модели с чередованием кон- формационных состояний, аналогичные модели, схематически представленной на рис.2. При этом лимитирующей стадией является конформационное изменение с той стороной мембраны, где находится место связывания.
4. В большинстве случаев сродство переносчика к транспортируемому веществу не зависит от того, к какой стороне мембраны обращено место связывания. Однако для первичных активных транспортных систем наблюдается иная картина.
5. Все рассматриваемые здесь переносчики обычно чувствительны к реагентам, действие которых направлено на сульфгидрильные группы. Однако это не обязательно должно означать, что между переносчиками имеется значительное структурное сходство или они используют одинаковый механизм транспорта. Например, установлено, что ни один из восьми остатков цистеина лактозопермеазы не участвует непосредственно в транспорте. Высказывалось также предположение, что погруженные в мембрану остатки пролина распределены в транспортных белках непропорционально, однако значение этого факта остается неясным.
5.1 Белок полосы 3 - анионный переносчик из мембраны эритроцитов
На долю белка полосы 3 приходится около 25% общего количества мембранных белков эритроцита человека; сходные белки присутствуют также в неэритроидных клетках. Этот белок выполняет несколько функций, причем их можно соотнести с двумя основными доменами белковой молекулы. N-концевая часть (41 000 Да) является гидрофильной и локализована с цитоплазматической стороны эритроцитарной мембраны. Она содержит места связывания для компонентов цитоскелета (анкирина), а также для ферментов гликолиза и гемоглобина. Этот домен можно удалить путем протеолиза, не затронув С-концевого домена (52 000 Да), который остается связанным с мембраной и опосредует Сl - /НСО3 - обмен, а также образует канал в мембране, через который может проникать вода. Внецитоплазматический компонент этой части белка содержит также углеводные антигенные детерминанты нескольких систем групп крови. В мембране белок полосы 3 находится в форме димера или тетрамера.
Было проведено клонирование и секвенирование участка ДНК, кодирующего белок полосы 3 из эритроцитов мыши. Эти данные послужили основой для построения модели белка полосы 3. Было высказано предположение, что он имеет 12 трансмембранных α-спиралей, при этом некоторые из них являются амфифильными. Экспериментальные данные, подтверждающие эту гипотезу, получены только для нескольких участков полипептида и основаны главным образом на результатах протеолиза и локализации связанных углеводов.
Обширные кинетические исследования согласуются с моделью с чередованием конформаций и одним местом связывания (см. рис.2). Однако скорость равновесного анионного обмена с помощью переносчика по меньшей мере в 104 раз превышает скорость транспорта как такового. Следовательно, незагруженный переносчик не претерпевает быстрых конформационных превращений, необходимых для того, чтобы анион мог связаться с мембраной. По данным ЯМР с использованием 35С1, у переносчика имеется единственное место связывания, и оно может быть обращено как внутрь, так и наружу. Результаты опытов с использованием ингибиторов транспорта тоже свидетельствуют о том, что в канале имеется единственное место связывания аниона, локализованное где-то в середине канала. При этом предполагается, что переход этого места связывания с одной стороны мембраны на другую блокируется неким "скользящим барьером", который перемещается вдоль канала в результате конформационных изменений. Лимитирующей стадией является конформационный переход нагруженного переносчика, но происходит он достаточно быстро, с частотой 105 с-1 при 37 °С. По-видимому, такая высокая скорость предотвращает значительные конформационные изменения в белке. Природа этого конформационного перехода и точная структура канала экспериментально не определены.
Конформационный переход загруженного переносчика, лимитирующий весь транспортный процесс, лишь в очень малой степени зависит от мембранного потенциала. Это согласуется с таким конформационным переходом, в результате которого через мембрану перемещается 0,1 связанного с белком заряда. Если этот переход сопряжен с перемещением анионного субстрата, то он должен сопровождаться переносом противоиона, например заряженной аминокислотной группы. В отличие от этого потенциалзависимое конформационное изменение, индуцирующее открывание натриевого канала, приводит к результирующему перемещению через мембрану шести связанных с белком зарядов.
5.2 Группа митохондриальных переносчиков.
Гомологичность некоторых транспортных белков внутренней митохондриальной мембраны свидетельствует об их близком родстве: по всей вероятности, они произошли от общего предка в результате дивергентной эволюции. Имеются по меньшей мере три представителя этой группы:
1) ADP/ATP-транслоказа;
2) переносчик фосфата;
3) разобщающий белок.
В структуре этих белков имеется много общего, и тем не менее они существенно различаются по субстратной специфичности. ADP/ATP-транслоказа катализирует транспорт ADP и АТР через бислой. При физиологических условиях АТР транспортируется из митохондрий, a ADP переносится в матрикс. Механизм этого процесса, по-видимому, аналогичен таковому для белка полосы 3, за исключением того, что АТР несет на один отрицательный заряд больше, чем ADP, и поэтому обмен зависит от трансмембранного электрического потенциала на митохондриальной мембране. Переносчик фосфата осуществляет одновременно и симпорт Н+, и, по-видимому, механизм его работы сходен с описанным ранее механизмом для Н+ - лактозопермеазы из Е. coli. Этот белок катализирует транспорт фосфата внутрь митохондрий. Благодаря симпорту Н+ процесс в целом является электронейтральным и не зависит от трансмембранного потенциала. Разобщающий белок был обнаружен в митохондриях из клеток бурого жира млекопитающих; его функция заключается в диссипации протонного электрохимического градиента, создаваемого при функционировании дыхательной цепи, в результате чего генерируется тепло. Разобщающий белок может также катализировать транспорт анионов, например С1 - , так что, может быть, на самом деле он катализирует транспорт ОН-, который невозможно экспериментально отличить от транспорта Н+. Этот переносчик связывается с нуклеотидами, которые ингибируют транспорт, и его работа может регулироваться жирными кислотами.
Все три переносчика, а возможно, еще и α-кетоглутарат/малат-транслоказа, имеют сходное строение; этот вывод был сделан на основе данных об их аминокислотной последовательности. Все они имеют мол. массу около 33000 Да и состоят из трех гомологичных доменов, каждый из которых содержит 100 аминокислот. По всей вероятности, эти три домена образовались в результате утроения единственного гена. Была построена модель, согласно которой каждый из гомологичных доменов дважды пересекает мембрану, а вся субъединица содержит шесть трансмембранных α-спиралей. С этой моделью согласуются данные по химической модификации. Отметим, что такая структура имеет много общего с Na+ - каналом, состоящим из четырех родственных гомологичных доменов. ADP/ATP-транслоказа является димером и, по-видимому, содержит единственный канал, по которому осуществляется транспорт. Такой вывод основывается на результатах исследований по связыванию ингибиторов с высоким сродством (например, карбоксиатрактилозида).
5.3 Переносчик глюкозы из мембраны эритроцита
Этот переносчик охарактеризован наиболее полно из всех белков, катализирующих диффузию единственного вещества через мембрану. Он переносит через эритроцитарную мембрану D-глюкозу, которая затем используется при гликолизе. Такие же или аналогичные переносчики глюкозы присутствуют и в других типах животных клеток. Большой прогресс в этой области исследований был достигнут благодаря секвенированию ДНК, кодирующей переносчик глюкозы из клеток гепатомы человека и из клеток мозга крысы. Очищенный переносчик из эритроцитов представляет собой гликопротеин с кажущейся мол. массой 55 000. По-видимому, в мембране он находится в виде димера. Если судить по данным об аминокислотной последовательности, то переносчик должен содержать 12 трансмембранных α-спиральных участков, однако экспериментальные данные не дают окончательного ответа на этот вопрос. Очищенный переносчик удалось встроить в фосфолипидные везикулы, при этом оказалось, что он ориентирован асимметрично.
Как и при исследовании канальных белков, очень важную роль сыграли опыты с использованием специфических ингибиторов, обладающих высоким сродством к переносчику. В число этих ингибиторов входят цитохалазин В и флоретин, которые связываются с переносчиком со стехиометрией 1:
1. Одни ингибиторы (цитохалазин В) связываются с переносчиком только в том случае, если они находятся с цитоплазматической стороны мембраны, другие специфически связываются с наружной стороны мембраны (флоретин). Места связывания двух указанных ингибиторов находятся вблизи С-конца полипептида.
Большинство кинетических данных и данных по связыванию согласуются с простой моделью четырех состояний (рис.2), в которой предполагается, что существует единственное место связывания D-глюкозы, находящееся внутри канала. Для измерения индивидуальных констант скоростей использовали ЯМР и метод остановленной струи. Конформация загруженного канала изменяется с константой скорости 2000 с-1, которая приблизительно в семь раз выше аналогичной константы для незагруженного канала (300с-1 при 23°С). Следовательно, обмен глюкозы происходит с большей скоростью, чем транспорт как таковой, для осуществления которого незагруженный переносчик должен возвратиться через мембрану. Природа конформационного изменения неизвестна, хотя оно было зарегистрировано при помощи инфракрасной спектроскопии с преобразованием Фурье и, как предполагают, включает скольжение α-спиралей друг относительно друга.
Между переносчиком глюкозы из клеток млекопитающих и некоторыми транспортными системами бактерий наблюдается значительная гомология. Удивительно, что такая гомология наблюдается также между переносчиком глюкозы и белками, осуществляющими симпорт Н+ - арабинозы и Н+ - ксилозы. Эти симпортеры, как и описываемая ниже система транспорта Н+ - лактозы, используют для аккумуляции указанных Сахаров электрохимический протонный градиент. Переносчик глюкозы из мембраны эритроцитов не транспортирует Н+ и не способен к транспорту против градиента глюкозы. Очень важными представляются работы по изучению взаимосвязи структуры белкового комплекса и механизма его работы.
5.4 Лактозопермеаза из е. Соli
Этот комплекс изучен наиболее полно из всех симпортных белков. Он кодируется lacY-геном, который является частью lac-оперона, и его часто называют lac-пермеазой. Ген lacY был клонирован и секвенирован, и из штамма-сверхпродуцента был выделен белок - продукт этого гена. Пермеазу можно изучать в цитоплазматических мембранных везикулах (кабакосомах), в интактных клетках или в реконструированных протеолипосомах. Судя по данным об аминокислотной последовательности, белок имеет мол. массу 46 500, хотя результаты электрофореза в полиакриламидном геле с ДСН дают другую величину. Почти не вызывает сомнения, что функциональной единицей в мембране является мономер, хотя некоторые данные свидетельствуют о существовании димерной формы пермеазы in vivo.
На основании данных об аминокислотной последовательности лактозопермеазы были построены модели, согласно которым этот белок имеет 12 или 14 трансмембранных α-спиралей. Это в основном согласуется со спектроскопическими данными, свидетельствующими о высоком содержании α-спиралей, и немногочисленными топологическими данными.
Кинетику транспорта с помощью пермеазы изучали, используя подходы:
1) выведение лактозы по градиенту или транспорт в везикулы (нуль с транс-стороны);
2) активный транспорт лактозы против градиента концентрации, сопряженный с протонным электрохимическим градиентом;
3) равновесный обмен;
4) противоток (бесконечность с цис-стороны).
1. Пермеаза имеет одно или более мест связывания для протона и одно - для лактозы. Эти места бывают поочередно обращены к периплазматической и цитоплазматической сторонам мембаны, и соответствующий конформационный переход является лимитирую щей стадией процесса. Максимальная скорость транспорта равна 25-50 с-1. При наличии трансмембранного протонного электрохимического потенциала (ДДН+) Км для лактозы составляет - 80 мкМ; место связывания протона, возможно, характеризуется высоким рКл, поэтому большую часть времени протонировано.
При ДДН+ = 0 значение Км для лактозы гораздо выше - 15-20 мМ.
2. Транспорт лактозы обязательно сопровождается транспортом Н+ со стехиометрией 1:
3. Конечным результатом транспорта является перенос через бислой положительного заряда. Следовательно, важную роль в установлении равновесия и скорости транспорта играют трансмембранный электрический потенциал и разность протонного химического потенциала.
6. Несколько примеров активных переносчиков, использующих энергию атр и фосфоенолпирувата
Есть несколько замечаний, касающихся первичных активных переносчиков. Охарактеризовано довольно много систем, с помощью которых происходит сопряжение транспорта тех или иных веществ через мембрану с гидролизом макроэргической фосфатной связи или с другой реакцией, в ходе которой высвобождается энергия.
Как уже отмечалось, в основе кинетических моделей многих первичных активных транспортных систем лежит концепция чередования конформационных изменений. При этом совершенно необязательно, чтобы реакция, в ходе которой высвобождается энергия, например реакция гидролиза АТР, была прямо сопряжена с конформационным переходом, необходимым для транспорта; важно лишь, чтобы такое сопряжение существовало с одной или несколькими стадиями кинетического цикла. Требования, предъявляемые к структуре трансмембранного "канала" первичного активного переносчика, аналогичны таковым для других переносчиков, но здесь возникает дополнительная сложность - необходимость контроля сопряжения химической реакции, в ходе которой высвобождается энергия, и транспорта растворимого вещества.
О молекулярной структуре первичных активных транспортных систем известно даже меньше, чем о транспортных белках, обсуждавшихся ранее в этой главе. Идентифицировать группы родственных переносчиков, близких по строению и механизму работы, помогают данные об их аминокислотной последовательности, которых становится все больше. Однако достоверные данные о том, каково строение участков, непосредственно вовлеченных в транспорт веществ, отсутствуют. В основе различного рода структурных моделей активных переносчиков лежит предположение о том, что трансмембранный канал, через который транспортируются вещества, образован кластером трансмембранных амфифильных α-спиралей. Сходным образом и модели, описывающие сопряжение химических реакций и транспорта веществ, опираются на весьма немногочисленные экспериментальные данные. Модели сопряжения можно разделить на две главные группы. Согласно модели прямого сопряжения, химическая реакция оказывает непосредственное влияние на перенос транспортируемого вещества, причем этот процесс не требует значительных опосредованных белком конформационных изменений. Например, протоны, участвующие в гидролизе АТР, могли бы быть именно теми ионами, которые транспортируются через мембрану в ходе данной реакции. Для этого необходимо, чтобы участок комплекса, где протекает химическая реакция (например, гидролиз АТР), и участок связывания транспортируемого вещества были расположены очень близко друг к другу. В отличии от этого модели непрямого сопряжения химическая реакция оказывает влияние на транспортный процесс через опосредованные белком конформационные изменения. Допускается даже, что химическая реакция и активный транспорт могут быть связаны с разными субъединицами внутри комплекса. Эти модели имеют то преимущество, что с их помощью нетрудно объяснить транспорт различных веществ (например, Na+, Н +) одними и теми же или близкородственными белками при участии одних и тех же механизмов.
Активные транспортные системы функционируют со скоростями, типичными для многих ферментов, т.е.102-103 с-1 в условиях насыщения. В отличие от канальных белков селективность в отношении субстрата обусловливается главным образом сродством транспортируемого вещества к активному переносчику. Более того, большинство первичных активных переносчиков обычно функционирует в условиях, когда концентрация переносимого вещества с цис-стороны близка или немного превышает Км и лимитирующей стадией транспорта является конформационный переход белка или химическая реакция, служащая источником энергии для данной системы.
И наконец, роль первичных активных транспортных систем заключается в перемещении вещества через мембрану против его концентрационного градиента в одном направлении (цис → транс). Поскольку переносчик после высвобождения транспортируемого вещества должен опять изменить свою ориентацию с транс на цис, необходим какой-то механизм, препятствующий возвращению на цис-сторону загруженного переносчика (т.е. обратному транспорту вещества). Следовательно, сродство активного переносчика к транспортируемому веществу должно быть/ выше с цис-стороны (где этот субстрат при низких концентрациях связывается с переносчиком), чем с транс-стороны (где оно диссоциирует при гораздо более высоких концентрациях). Если бы это было не так, переносчик работал бы очень неэффективно при высоких концентрациях субстрата с транс-стороны. В такой реакции энергия затрачивается главным образом на изменение сродства переносчика к транспортируемому веществу. Например, ёние Na+ /К+ - АТР-азы или Са2+ - АТР-азы при помощи АТР ведет к стабилизации конформации тех переносчиков, у которых место связывания ионов обращено наружу и которые имеют низкое сродство соответственно к Na+ или Са2+. В то же время связывание АТР стабилизирует ту форму Na+/К+ - АТР-азы, в которой места связывания ионов, обращенные к цитоплазме, имеют низкое сродство к К+. Следовательно, механизм сопряжения реакции, в ходе которой высвобождается энергия, и транспорта, катализируемого активными переносчиками, лучше всего рассматривать исходя из термодинамических принципов, т.е. как временную стабилизацию определенных конформаций и изменение сродства к транспортируемому веществу.
Можно выделить пять групп переносчиков, которые используют свободную энергию макроэргической фосфатной связи для осуществления транспорта веществ, т.е. природа нашла несколько путей решения этой задачи.
6.1 Переносчики катионов плазматической мембраны (е1 e2-типа): атр-зависимые ионные насосы
Несколько про - и эукариотических ион-переносящих АТРаз составляют единое семейство и обладают сходными аминокислотными последовательностями и механизмами переноса ионов (табл.2).
Таблица 2.

Наиболее полно охарактеризованы Nа+ /К+-АТРаза из плазматической мембраны животных клеток и Са2+ - АТРаза из саркоплазматического ретикулума. Большинство ферментов этой группы представляют собой единый полипептид с мол. массой 100000; исключение составляет Na+/К+ - АТРаза, выделенная из нескольких источников, которая содержит вторую, меньшую субъединицу с неизвестной функцией. Эти переносчики ингибируются ванадатом и прямо фосфорилируются АТР с образованием фосфорилированного интермедиата, играющего важную роль в транспорте (см. рис.3).
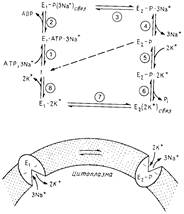
Рис.3 Кинетическая схема для Na+ /К+ - АТРазы. Для Са2+ - АТРазы можно использовать тот же механизм, за исключением того, что вслед за лефосфорилированием Е2 - Р переносчик возвращается в конформацию E1 в незагруженном состоянии (пунктирная линия).
Катионные переносчики этой группы значительно различаются по ионной специфичности (см. табл.2). Неодинакова и стехиометрия транспорта. Например, Са2+ - АТРаза переносит 2Са2+/АТР в полость саркоплазматического ретикулума, в то время как Na+/К+ - АТРаза переносит 3Na+ наружу и 2К + в цитоплазму через плазматическую мембрану. При этом различия в работе АТРазы касаются не только стехиометрии и природы переносимых ионов, но также и того, что Са2+ - АТРаза способна переносить ионы лишь в одном направлении, в то время как Na+ /K+ - АТРаза делает это в обоих направлениях.
Название "фермент Е1E2-типа" было введено в работе, посвященной Na+/К+-АТРазе. Как показали исследования, этот белок существует по меньшей мере в двух различающихся конформациях, для которых характерны разное связывание субстратов и неодинаковая подверженность мягкому протеолизу. Форма Е1 соответствует конформации, в которой места связывания ионов обращены в сторону цитоплазмы (высокое сродство к Na+, низкое - к К+) и которая обладает высоким сродством к АТР. Места связывания ионов в фосфорилированной форме Е2 обращены наружу (высокое сродство к К +, низкое-к Na +). На рис.3 изображен транспортный цикл, в котором участвуют две ненагруженные формы переносчика и две нагруженные, Е2 (2К+) связи E1 (3Na+) связь со "спрятанными" внутри насосного комплекса ионами. Изучение связывания К+ фосфорилированной формой переносчика (Е2-Р) показало, что оно происходит в двух разных местах.
Основные особенности каталитического цикла.
1. E1-форма связывает три иона Na+ с цитоплазматической стороны мембраны и затем взаимодействует с АТР, образуя фосфорилированиый фермент. Фосфорилируется при этом специфический аспартат, консервативный в этой группе ферментов.
2. После отсоединения ADP ионы оказываются "спрятанными" внутри комплекса.
3. Фосфорилирование белка стабилизирует конформацию с низким сродством к Na+; при этом места связывания ионов обращены наружу. Это способствует переходу E1-P в E2-P, в результате которого и осуществляется перенос.
4. В форме Е2-Р места связывания ионов обращены во внеклеточную среду; эта конформация обладает высоким сродством к К+, который связывается, катализирует дефосфорилирование и остается "спрятанным" внутри комплекса. Обратите внимание, что Na+ необходим для быстрого фосфорилирования, а К+ - для быстрого дефосфорилирования. Ванадат связывается с формой Е2, возможно, как некий аналог переходного состояния фосфата. У других ферментов E1E2-типa, например Са2+ - АТРазы, форма Е2-Р дефосфорилируется и переходит в форму E1, которая в свою очередь переходит в незагруженную форму.
5. Лимитирующей стадией каталитического цикла является, по всей вероятности, освобождение К+ и переход его из связанного с ферментом состояния в свободное. Этот процесс стимулируется связыванием АТРс сайтом, обладающим низким сродством.
Следовательно, АТР выполняет две разные функции, выступая в качестве субстрата и аллостерического эффектора. Сколько мест связывания АТР имеет фермент, пока неясно.
Определена аминокислотная последовательность нескольких АТРаз E1E2-типа, включая Na+/К+ - АТРазу (а-субъединица) из нескольких источников, Са2+ - АТРазу, Н+ - АТРазу из плазматической мембраны дрожжей и Neurospora crassa и К+ - АТРазу из S. faecalis. Исходя из профилей гидрофобности, были построены модели, согласно которым эти белковые комплексы содержат 6, 8 или 10 трансмембранных α-спиральных сегментов (рис.4).
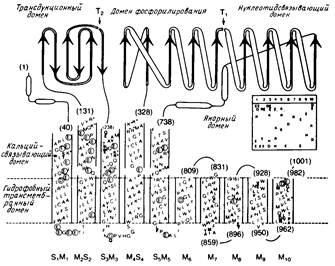
Рис.4
Некоторые участки полипептидов, в том числе и сегмент, содержащий сайт фосфорилирования, в значительной степени гомологичны. Все белки имеют большую гидрофильную петлю, содержащую домены, с которыми, по всей вероятности, связываются нуклеотиды и где происходит фосфорилирование.
У Са+ - АТРазы один расщепляемый трипсином сайт, чувствительный к конформационному переходу Е1 → Е2, находится в "трансдукционном" домене (рис.4). Исследовалось также связывание Са2+ с ферментом; было высказано предположение, что транспорту Са2+ предшествует связывание двух ионов Са2+ с определенными участками внутри белкового комплекса. По всей вероятности, у Са2+ - АТРазы места связывания Са2+ с высоким сродством располагаются на значительном удалении от места связывания нуклеотидов, однако эту гипотезу нужно еще проверить. Основные особенности строения Са2+ - АТРазы, представленные на рис.4, согласуются с данными электронной микроскопии, согласно которым этот белковый комплекс сильно выступает из биослоя в цитоплазму. Вероятно, в условиях in vivo АТРазы Е1 / Е2 - типа агрегируют, образуя по меньшей мере димеры, но подтвердить данное предположение экспериментально очень трудно. Тем не менее очевидно, что мономеры также способны к катализу, по крайней мере в некоторых случаях.
Определена аминокислотная последовательность меньшей α-субъединицы Na+/К+ - АТРазы. Было высказано предположение, что эта субъединица имеет одну или четыре трансмембранные а-спирали.
В заключение отметим, что благодаря легкости клонирования этих мембранных АТРаз и возможности использования разных экспериментальных подходов эти системы являются отличным объектом для применения к ним направленного мутагенеза и других генетических методов. Подобные методы уже применяются в исследованиях F1F0 - АТРаз.
6.2 АТР-азы F1F0-типа из митохондрий, хлоропластов и бактерии
Большинство бактерий, а также митохондрии и хлоропласты содержат родственные АТРазы F1F0 - типа, которые используют трансмембранный протонный электрохимический градиент для синтеза АТР из ADP и неорганического фосфата. В физиологических условиях эти ферменты являются АТР-синтазами. Они содержат от 8 (е. coli) до 13 (митохондрии сердца быка) различных субъединиц и, таким образом, являются гораздо более сложными структурами, чем АТРазы E1E2-типa из плазматических мембран. АТРазы F1F0-типа состоят из двух частей:
1) гидрофильного глобулярного F1-комплекса, содержащего места связывания нуклеотидов и функционирующего в качестве АТРазы, и 2) мембраносвязанного F0 - комплекса, который функционирует как Н+ - проводящий канал. F1 - и F0 - комплексы могут отсоединяться друг от друга, а после очистки их можно реконструировать с восстановлением функциональной активности.
F1-комплекс из Е. coli содержит пять субъединиц в стехиометрии aifiiybe. Между тремя парами в составе F1 наблюдается асимметрия, возникающая, по всей вероятности, в результате асимметричных взаимодействий с другими субъединицами. В составе каждого комплекса имеется по три каталитических центра, и для быстрого оборота фермента необходимо, чтобы АТР был связан более чем с одним местом связывания. Для объяснения механизма катализа были построены различные модели с чередованием мест связывания, в частности модель, согласно которой в ходе катализа происходит физическое вращение частей фермента.
F0-комплекс из фермента Е. coli устроен достаточно просто, он содержит только три субъединицы в стехиометрии a1b2c10. Все эти субъединицы необходимы для формирования Н+ - проводящего канала. Остается неясным, можно ли рассматривать F0 как канал в том смысле, как мы его понимаем в этой главе. Полагают, что Н+ - проводящая часть F0 образована α-спиралями из множественных копий γ - субъедииицы. По всей вероятности, эта субъединица содержит пять трансмембранных α - спиралей, в то время как а - и b - субъединицы - по одной. Результаты, полученные с помощью генетических методов, согласуются с предположением, согласно которому погруженные в мембрану части всех трех субъединиц играют важную роль в обеспечении протонной проводимости.
Изучение этой системы показывает нам, сколь успешным может быть применение генетических методов для исследования строения мембранных белков, для которых отсутствуют кристаллографические данные высокого разрешения. Очень важно выяснить, приводит ли замена единственной аминокислоты в таком белке к конформационным изменениям, которые скажутся на катализе. По-видимому, результат такой замены сильно зависит от природы переносчика. Например, как мы уже обсуждали, очень обнадеживающими в этом отношении являются данные, полученные для лактозопермеазы. Очевидно, в следующем десятилетии в изучении взаимосвязи между структурой и функцией мембранных белков главную роль будут играть различные генетические методы, в частности направленный мутагенез.
Рассмотрим результаты, полученные к настоящему времени для F1F0 - ATPaзы из Е. coli.
1. Наличие многочисленных мутантных форм позволяет идентифицировать участок, являющийся, по всей вероятности, каталитическим нуклеотидсвязывающим доменом. Исследование мутантных форм показало также, что между α - и β - субъединицами имеется конформационное сопряжение.
2. Показано, что мутантные формы неспособны к сопряжению транспорта Н+ с катализируемой комплексом F1, АТРазной активностью, а также к связыванию комплексов F1, и F0.
3. Показано, что определенные аминокислотные остатки в субъединицах а, b и γ опосредуют протонную проницаемость; имеющиеся генетические данные позволяют предположить, что субъединица b непосредственно контактирует в мембране с субъединицами а и γ.
Связаны ли все эти явления с локальными или глобальными конформационными изменениями, покажут дальнейшие исследования. Пока же мы не может сказать определенно, как происходит сопряжение гидролиза АТР и транспорта Н+ при работе АТРазы F1F0-типа, а также с чем связана протонная проводимость.
Важными в этом отношении могут оказаться данные о том, что цитоплазматическая мембрана анаэробной бактерии Propionigenium modestum содержит Na+ - зависимую АТРазу F1F0-типа. Если этот фермент работает как первичный АТР-зависимый Na+ - насос, то логично предположить, что механизм функционирования Н+ - АТРазы и Na+ - АТРазы одинаков. Например, это позволит исключить модели прямого сопряжения.
6.3 Три других класса переносчиков
Помимо АТР-зависимых активных переносчиков Е1Е2 - и F1F0 - типов есть еще три класса активных переносчиков, использующих свободную энергию гидролиза макроэргических фосфатных связей. О реальных механизмах транспорта или сопряжения в этих системах известно немного. Отметим несколько интересных их особенностей.
1. Бактериальные фосфотрансферазы. Этот комплекс был обнаружен только в бактериях; он катализирует транспорт Сахаров, таких, как глюкоза и маннитол. Уникальной особенностью этой системы является то, что транспорт сахара сопровождается его фосфорилированием. Получаемое фосфатное производное сахара уже не может служить субстратом для переносчика в бактериальной мембране, и таким образом предотвращается обратный поток сахара через эту систему. Вспомним, что в переносчиках Е1Е2-типа фосфорилирование переносчика стабилизирует форму с низким сродством к переносимому веществу (например, Са2+ или Na+), что также препятствует обратному переносу транспортируемых веществ.
Конечным донором фосфата в фосфотрансферазной системе является фосфоенолпируват. Фосфат переносится специфической последовательностью растворимых фосфорилированных интермедиатов в цитоплазму к мембраносвязанному транспортному белку, называемому фермент II или Е II. Существует группа ферментов Е II-типа, специфичных к разным сахарам, но обладающих сходной первичной структурой. По всей вероятности, внутри мембраны ферменты Е II - типа образуют димеры. Высказывалось предположение, что они формируют каналы. Эти белки чувствительны к реагентам, действующим на сульфгидрильные группы, и к окислению, что может играть важную роль в условиях in vivo. Немного известно о том, каким образом фосфорилированные ферменты Е II - типа осуществляют транспорт и фосфорилирование сахаров. Разумной представляется модифицированная модель с чередованием конформаций и единственным местом связывания.
2. Бактериальные периплазматические транспортные системы. В дополнение к системам симпорта (катион - сахар) и фосфотрансферазной системе бактерии имеют еще одну систему активного транспорта растворимых веществ, которая используется для различных аминокислот и сахаров. Так, охарактеризованы системы, специфичные к гистидину (S. typhimurium) и мальтозе (Е. coli). К сожалению, биохимические данные, которые могли бы дополнить интенсивные генетические исследования мембраносвязанных компонентов этих систем, весьма немногочисленны. Уникальной особенностью этих систем является то, что они содержат субстратспецифичные связывающие белки, локализованные в периплазматическом пространстве. Роль этих белков заключается в связывании переносимого вещества и последующей передаче его собственно транспортирующей системе цитоплазматической мембраны. Специфичность системы определяется как связывающими белками, так и мембраносвязанными компонентами. Цитоплазматический мембранный компонент содержит три субъединицы, две из которых являются трансмембранными белками, а третья, по всей вероятности, прочно связана с цитоплазматической стороной мембраны. Как оказалось, этот третий компонент транспортного комплекса содержит место связывания нуклеотидов, где, как предполагается, происходит гидролиз АТР - реакция, являющаяся движущей силой активного транспорта. Однако прямые данные, подтверждающие эту гипотезу, отсутствуют. Практически ничего не известно о механизме транспорта, за исключением того, что для него необходим растворимый связывающий белок.
По всей вероятности, эта система аналогична транспортной системе млекопитающих, которая используется ими для выведения из клетки нежелательных лекарственных веществ и обеспечивает множественную лекарственную устойчивость. По-видимому, транспорт разных лекарственных веществ единственной транспортной системой опосредуется группой немембранных связывающих белков. Сходное предположение высказывалось относительно кодируемой плазмидой бактериальной транспортной системы, которая выводит из клеток арсенаты. Предполагается, что эти системы также используют гидролиз АТР в качестве источника энергии, однако это не было прямо продемонстрировано.
3. Вакуолярные Н+ - АТРазы. В эукариотических клетках имеются Н+ - АТРазы, локализованные в мембранах различных внутренних органелл (кроме митохондрий). Эти АТРазы отличаются от АТРаз как F1F0 - , так и Е1Е2-типов. В некоторых случаях функцией Н+ - АТРазы является транспорт протонов внутрь той или иной органеллы для закисления ее содержимого. Например, известно, что низкий рН в эндоцитозных пузырьках необходим для отсоединения лигандов от их рецепторов, происходящего вслед за эндоцитозом. Хотя достоверные данные о структурном родстве этих Н+ - АТРаз пока не получены, известно, что все они 1) содержат более одной субъединицы;
2) не образуют фосфорилированного интермедиата;
3) нечувствительны к ванадату;
4) транспортируют Н+. Однако все эти вопросы требуют дополнительных биохимических и структурных исследований.
Заключение
Таким образом, рассмотрев строение, механизм работы и разнообразные функции переносчиков, можно сделать вывод о том, что они имеют огромное значение в жизнедеятельности человеческого организма.