Курсовая работа: Производство нитробензола
Министерство Образования и Науки РФ
Казанский Государственный Технологический
Университет
Кафедра Общей Химической Технологии
КУРСОВАЯ РАБОТА
по курсу: Технология химических производств
на тему:
Производство нитробензола
Казань 2010
Содержание
Задание
1. Теоретическая часть
Технологическая схема производства нитробензола
2. Практическая часть
Материальный баланс процесса.
Технологические и технико-экономические показатели процесса
3. Реклама
Список литературы
Задание:
1. Составить и описать технологическую схему производства нитробензола
2. Составить материальный баланс процесса
3. Рассчитать технологические и технико-экономические показатели
4. Реклама
В основу расчета принять следующие реакции
C6H6+HNO3→C6H5NO2+H2O
C6H5NO2+HNO3→C6H4(NO2)2+H2O
Исходные данные:
|
Производительность установки ,т/сут: 1. по нитробензолу 2. по динитробензолу |
25 10 |
|
Конверсия бензола % Концентрация бензола % масс |
44 99.2 |
|
Состав нитрующей смеси % масс 1. азотная кислота 2. серная кислота 3. вода |
21 58.6 20.4 |
| Массовое соотношение бензол-нитрирующая смесь | 1 : 4.3 |
| Потери бензола % масс | 3 |
1. Теоретическая часть
Технологическая схема производства нитробензола
Нитробензол (темп, пл, +5,7°, темп. кип. 210,9°) представляет собой нерастворимую в воде желтоватую жидкость с запахом горького миндаля; ядовит, как все нитросоединения.
Впервые нитрование бензола было осуществлено Митчерлихом. В промышленности оно было начато в 1847 г.
Нитрующую смесь для нитрования бензола до нитробензола составляли с таким расчетом, чтобы количество азотной кислоты лишь немного превышало теоретическое, а серную кислоту берут в таком количестве чтобы к концу процесса нитрования в отработанной кислоте содержалось около 70%
Нитрование проводится при 40°. Повышение температуры способствует образованию динитробензола.
Процесс нитрования можно проводить по периодической, и по непрерывной схеме.
При периодической процесс начинают с наполнения нитратора бензолом затем включают печку, подогревают бензол до 40 — 45° и постепенно вводят нитрующую смесь, регулируя поступление и охлаждение нитратора водой таким образом, чтобы поддерживать температуру процесса около 40°.
Закончив приливание нитрующей смеси, прекращают охлаждение и дают температуре подняться до 50°. При низкой температуре содержимое нитратора «выдерживают» около 1 часа, втечение этого времени реакция нитрования почти полностью заканчивается; остается всего около 1% непрореагировавшего бензола. После выдержки содержимое нитратора сливают или передавливают в сифонную трубку в отстойник-сепаратор, представляющий собой цилиндрический аппарат с коническим дном и мешалкой. В отстойнике продукты нитрования разделяются на два слоя: верхний — нитрообензольный и нижний — кислотный. Из отстойника отработанная кислота, содержащая 70—72% H2SO4, небольшое количество окисленных продуктов, окислов азота и растворенного и эмульгированного бензола, поступает в сборник. Сырой нитробензол промывают в отстойнике несколько раз холодной водой, а затем раствором соды.
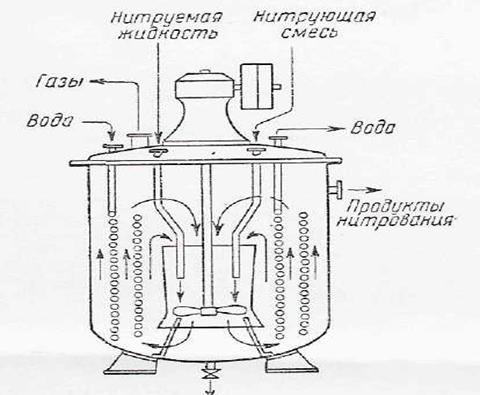
Начиная с 30-х годов XX века, нитробензол на крупных установках стали получать непрерывным методом. В процессах непрерывного нитрирования бензола применяются нитраторы различных систем. Простотой, надежностью конструкции отличается нитратор с вертикальной циркуляцией реакционной массы (рисунок 2).
Такой нитратор представляет собой чугунный, или выполненный кислотоупорной стали котел с змеевиками и быстроходной пропеллерной мешалкой, помещенной внутри направляющего вертикального стального цилиндра. Бензол и нитрующая смесь непрерывно поступают через трубки в центральную часть нитратора смешиваются с его содержимым, скользят .снизу вверх, омывая змеевики, а затем сверху вниз через направляющий цилиндр. Избыток реакционной смеси непрерывно отводится из штуцера в верхней части нитратора.
Рисунок 1. Типовая схема процесса получения нитросоединений
 |
|||||
![]()
![]()
 |
|||
![]() Нитрирующая смесь
Нитрирующая смесь
отработанная Кислый
кислота нитропродукт
 |
|||||
![]() Исходное Промытая
Исходное Промытая
![]()
![]() вещество и
отработ.
вещество и
отработ.
нитропродукт кислота
На денитрацию
|
![]()
![]() вода
вода
 |
|||||
раствор
Nа2СО3 Промывные воды
|
Рисунок 2. Нитратор непрерывного действия.
|
|
Для доведения реакции нитробензола до конца выходящую из нитратора реакционную смесь будут дополнительно выдерживать в цилиндрическом резервуаре с мешалкой (дозреватель). Остальные процессы отстаивание и промывка сырого нитробензола — также легко осуществляются по непрерывкой схеме.
2. Практическая часть
Материальный баланс процесса
| ПРИХОД | РАСХОД | |||
| Кг/ч | Кмоль/ч | Кг/ч | Кмоль/ч | |
|
С6Н6 HNО3 Н2SO4 Н2О(пр) С6Н5NО2 С6Н4(NО2)2 Н2О(1) Н2О(2) Примесь бензола |
1547.94 1397.79 3900.5 1357.85 - - - - 12.48 |
19.85 22.19 39.78 75.42 - - - - - |
840.84+46.44потери 708.12 3900.5 1357.85 736.63 416.67 152.46 44.64 12.48 |
10.78+0.6потери 11.24 39.78 75.42 5.99 2.48 8.47 2.48 |
| Σ = 8216.56 | Σ = 8216.63 |
Mr(C6H6)=12*6+6=78 кг/кмоль
Mr(HNО3)=1+14+16*3=63 кг/кмоль
Mr(Н2SO4)=32.06+2+16*4=98.06 кг/кмоль
Mr(С6Н5NО2)=12*6+5+14+16*2=123 кг/кмоль
Mr(С6Н4(NО2)2)=12*6+4+14*2+16*4=168 кг/кмоль
Mr(Н2О)=18 кг/кмоль
1. Производительность установки по нитробензолу:
mвсего(С6Н5NО2) = 25т/сут = 25 * 1000/24 = 1041.67 кг/ч
wвсего(С6Н5NО2) = 1041.67/123 = 8.47 кмоль/ч
2. Количество прореагировавшего бензола, исходя из уравнения реакции:
wпрор(C6H6) = w(С6Н5NО2) = 8.47 кмоль/ч
mпрор(C6H6) = 8.47 * 78 = 660.66 кг/ч
3. Учитывая конверсию, всего чистого бензола было:
660.66 – 44 %
х – 100 %
х = mчист(C6H6) = 660.66 * 100/44 = 1501.5 кг/ч
4. Учитывая потери 3% масс, всего чистого бензола вступило в реакцию:
1501.5 – 97 %
х – 100 %
х = mчист всего(C6H6) = 1501.5 * 100/97 = 1547.94 кг
wчист всего(C6H6) = 1547.94/78 = 19.85 кмоль/ч
mпотерь(C6H6) = 1547.94 – 1501.5 = 46.44 кг
wпотерь(C6H6) = 46.44/78 = 0.6 кмоь/ч
5. Учитывая концентрацию бензола 99.2 % масс, технического бензола, вступившего в реакцию:
1547.94 – 99.2 %
х – 100%
х = mтех(C6H6) = 1547.94 * 100/99.2 = 1560,42 кг
mпримеси(C6H6) = 1560.42 – 1547.94 = 12.48 кг/ч
6. Массовое соотношение бензол – нитрирующая смесь 1: 4,3
на 1 кг бензола берется 43 кг нитрирующей смеси, масса нитрирующей смеси:
mсмесь = mчист всего(C6H6) * 4.3 = 1547.94 * 4.3 = 6656.14 кг
7. Состав нитрирующей смеси:
Ø азотная кислота:
6656/14 – 100 %
х – 21 %
х = m(HNО3) = 6656.14 * 21/100 = 1397.79 кг
w(HNО3) = 1397.79/63 = 22.19 кмоль/ч
Ø серная кислота
m(Н2SO4) = 6656.14 * 58.6/100 = 3900.5 кг/ч
w(Н2SO4) = 3900.5/98.06 = 39.78 кмоль/ч
Ø вода
m(Н2О) = 6656.14 * 20.4/100 = 1357.85 кг/ч
w(Н2О) = 1357.85/18 = 75.42 кмоль/ч
8. Количество воды из первой реакции:
w(Н2О)(1) = w(С6Н5NО2) =8.47 кмоль/ч
m(Н2О)(1) = 8.47 * 18 = 152,46 кг/ч
9. Не прореагировавшего бензола:
mнепр = mчист(C6H6) – mпрор(C6H6) = 840.84 кг/ч
wнепр(C6H6) = 840.84/78 10.78 кмоль/ч
10. Производительность по динитробензолу:
10т/сут = 10 * 1000/24 = 416.67 кг/ч
w(С6Н4(NО2)2) = 416.67/168 = 2.48 кмоль/ч
11. Количество нитробензола пошедшего на реакцию:
mвсего(С6Н5NО2) = w(С6Н4(NО2)2) = 2.48 кмоль/ч
mпрор(С6Н5NО2) = 2.48 * 123 = 305.04 кг
12. Количество оставшегося нитробензола:
mвсего(С6Н5NО2) – mпрор(С6Н5NО2) = 1041.67 – 305.04 = 736.63 кг
wост(С6Н5NО2) 736.63/123 = 5.99 кмоль/ч
13. Количество HNО3 прошедшего на обе реакции:
wо(HNО3) = w1(HNО3) + w2(HNО3)
w1(HNО3) = wвс(С6Н5NО2) = 8.47 кмоль/ч
w2(HNО3) = w(С6Н4(NО2)2) = 2.48 кмоь/ч
wо(HNО3) = 10.95 кмоль/ч
не прореагировавший
wост(HNО3) = wост(HNО3) - wо(HNО3) = 22.19 – 10.95 = 11.24 кмоль/ч
mост(HNО3) = 11.24 * 65 = 708.12 кг/ч
14. Масса и количество воды, полученной во второй реакции:
w(Н2О)(2) = w(С6Н4(NО2)2) = 2.48 кмоль/ч
m(Н2О)(2) = 2.48 *18 = 44.64 кг/ч
Технологические и технико-экономические показатели процесса
1. Пропускная способность установки: 8216,56 кг/ч
2. Конверсия или степень превращения бензола =
=M(C6H6) подано – M(C6H6) непрореагировало / M(C6H6) подано = 1547.94-(840.84+46.44) * 1547ю94 = 0.49 %
3. Теоретические расходные коэффициенты:
по С6Н6:
sтС6Н6 = Mr(C6H6) / Mr(C6Н5NO2) = 78 / 123 = 0,63 кг/кг;
по НNО3:
sт НNО3: = Mr(НNО3) / Mr(C6Н5NO2) = 63/ 123 = 0,51 кг/кг.
4. Фактические расходные коэффициенты:
по С6Н6:
sфС6Н6 = m(C6H6)техн / m(C6Н5NO2) = 1547.94+12.48 / 736.63 = 2.12 кг/кг;
sф НNО3 = m(НNО3)техн / m(C6Н5NO2) =1397.79+3900.5+1357.85 / 736.63 = 9.03 кг/кг.
Выход на поданное сырье C6Н5NO2 :
1) Фактический выход:
QФ = m(C6Н5NO2) = 736.63 кг;
2) Теоретический выход:
Mr(С6Н6) ¾ Mr(C6Н5NO2), 78 ¾ 123,
m(С6Н6) ¾ QТ; 1547.94 ¾ QТ ;
QТ = (1547.94 * 123) / 78 = 2440.98 кг;
Выход C6Н5NO2 по бензолу:
bС6Н6 = QФ / QТ * 100% = 736.63 / 2440.98 * 100% = 30.18%
5. Выход на превращенное сырье:
Mr(С6Н6) ¾ Mr(C6Н5NO2), 78 ¾ 123,
m(С6Н6) ¾ QТ; 660.66 ¾ QТ ;
Qт' = 660.66 * 123/78 = 1041.81 кг
β' C6Н6 = QФ / QТ * 100 % = 736.63/1041.81 *100% = 70.71 %
3. Реклама
Оптовая фирма химического сырья предлагает организацию оптовых поставок нитробензола в качестве сырья для производства анилина и селективного растворителя при очистке нефтяных смазочных масел.
Крупным химическим предприятиям
специальные скидки!!!
Заказывая нитробензол у нас вы экономите на стоимости сырья и снижаете себестоимость своей продукции!!!
Обращаться по адресу: г. Казань
ул. Магистральная 76. ООО «Нитробензолхим»
тел. 256-67-89.
Список литературы:
1. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. Изд. 2-е, пер. М., «Химия», 1975, 736 с.
2. Юкельсон И.И. Технология основного органического синтеза. М.: «Химия», 2008, 846 с.
3. Общая химическая технология /Под ред. А.Г. Амелина. М.: «Химия», 2007, 400 с.
4. Расчеты химико-технологических процессов /Под ред. И.П. Мухленова. Л.:Химия, 2009, 300 с.
5. С.И. Вольфкович Общая химическая технология. М.: Государственное научно-техническое издательство химической литературы. 2009, 633с.
| Производство циклогексана из бензола | |
|
Министерство образования Республики Беларусь Учреждение образования "Белорусский государственный технологический университет" Кафедра технологии ... Бензол смешивают со свежим и циркулирующим водородом, смесь нагревают в теплообменнике сырье/продукт и направляют в реактор (рис. - состав технического бензола (w, %): С6Н6 - 99,91; С6Н5СНз -0,03; С6Н11СНз -0,03; С5Н9СН3 - 0,02; C7H16 -0,01; |
Раздел: Промышленность, производство Тип: курсовая работа |
| Разработка энергосберегающих технологий процесса ректификации ... | |
|
Российской Федерации Федеральное агентство по образованию МОСКОВСКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ ТОНКОЙ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ ИМ. М.В. ЛОМОНОСОВА Кафедра ... Реакционная смесь, выходящая из расширенной части реактора, содержащая 64-65% бензола, 33,5- 34% хлорбензола, 1,5% полихлоридов, немного растворенных НС1 и FeCl3, вместе с ... Все расчеты проводили на 200 КМоль/час исходной смеси с помощью программного комплекса PRO П. |
Раздел: Рефераты по химии Тип: дипломная работа |
| Программа для поступающих в вузы (ответы) | |
|
Программа по химии для абитуриентов Предмет химии. Явления химические и физические. Атомно-молекулярное учение. Атомы. Молекулы. Молекулярное и ... Массовая доля растворенного вещества w - отношение массы растворенного вещества m1 к общей массе m: Галогеналкан + КОН (Н2О) = Спирт + КГ; |
Раздел: Рефераты по химии Тип: реферат |
| Производство тетрахлорметана и тетрахлорэтилена | |
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ Учереждение образования "Белорусский государственный технологический университет" Факультет инженерно ... В процессе работы отходы практически полностью превращаются в НС1, С12, СО2, Н2О. 0,18 кмоль/ч или 0,18=71 = 12,78 кг/ч; |
Раздел: Промышленность, производство Тип: курсовая работа |
| Разработка процесса производства изопропилбензола на ОАО "Омский ... | |
|
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ Омский государственный технический университет НЕФТЕХИМИЧЕСКИЙ ИНСТИТУТ КАФЕДРА "ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ ... 4. Удельный расход сырья и материалов на технологию: бензол - 780 кг/т ИПБ; пропилен - 234 кг/т ИПБ. 101,45 кмоль / ч - количество пропановой фракции; 0,24 и 0,02 МПа - упругость паров бензола и изопропилбензола при температуре 40 0С. |
Раздел: Рефераты по химии Тип: дипломная работа |