Реферат: Белки как форма существования жизни
Тема урока: Белки
Цели:
актуализировать знания о белках из курса биологии;
изучить физические и химические свойства, цветные реакции белков;
учащиеся должны уметь характеризовать состав и строение белков,
функции белков в клетке, значение их для жизни.
Оборудование и реактивы: концентрированная HNO3, белок, растворы CuSO4, NaOH, спиртовка, спички, держатель, пробирки.
Ход урока:
Белки, по утверждению Ф. Энгельса, одна из форм существования жизни.
"Повсюду, где мы встречаем жизнь, мы находим, что она связана с каким-либо белковым телом, и повсюду, где мы встречаем какое-либо белковое тело, не находящееся в процессе разложения, мы без исключения встречаем и явление жизни". (К. Маркс, Ф. Энгельс. Собрание сочинений. Т. 20). Белки - строительный материал, выполняют двигательную, каталитическую, транспортную, защитную, энергетическую функции.
Белки были выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот. В то время были исследованы такие белки, как альбумин ("яичный белок"), фибрин (белок из крови) и глютен из зерна пшеницы.
В 80-х годах XIX столетия русский биохимик Данилевский А.Я., чуть позднее - (в 1903 г) немецкий ученый Фишер Э. - выдвинули полипептидную теорию строения белков: белки соединены в цепочку из остатков α - аминокислот посредством пептидных связей ―СО ― NH ―.
В настоящее время известно 22 аминокислоты, которые и создают огромное множество белковых молекул. Причем каждая из них имеет свой, строго определенный, порядок чередования аминокислот. Выделяют четыре структуры белковой молекулы. Первичная - чередование остатков α - аминокислот; вторичная - цепи, закрученные в виде спирали; третичная - конфигурация, которую принимает в пространстве закрученная спираль (она обеспечивает биологическую активность белковой молекулы); четвертичная - соединенные друг с другом макромолекулы белков. При нагревании, встряхивании разрушается третичная структура белка, он утрачивает свое биологическое действие.
Белки - это сложные высокомолекулярные природные соединения, построенные из остатков α - аминокислот, соединенных пептидными (амидными) связями ―СО ― NH ―.
Число аминокислотных остатков, входящих в молекулы белков, различно: в инсулине их 51 (20 в одной и 31 - в другой цепочке), в миоглобине - 140. Молекулярные массы белков могут колебаться от 10 000 до нескольких миллионов.
Mr (белка яйца) = 36 000; Mr (белка мышц) = 1 500 000. Состав гемоглобина выражается формулой (C738H1166O208N203S2Fe) 4. Посчитать его молекулярную массу несложно.
Белки являются главным носителем жизни. Сведения о составе и строении белков получены при изучении продуктов их гидролиза. В настоящее время установлено, что молекулы большинства белков состоят из 22 различных α - аминокислот.
В состав белков входят: С - 50 - 52%; Н - 6 - 8%; О - 19 - 24%; N - 15 - 18%; S - 0,5 - 2,0%.
Современные исследования позволяют различать в структуре белка первичную, вторичную, третичную и четвертичную структуры. (Слайд 6).
Под первичной структурой белка понимается точная последовательность расположения отдельных аминокислотных остатков в макромолекуле (все связи ковалентные, прочные). С.228 учебника, рис.37.
Вторичная структура - форма полипептидной цепи в пространстве (чаще всего спираль). Белковая цепь закручена в спираль (за счет множества водородных связей).
Третичная структура - реальная трехмерная конфигурация, возникающая при закручивании в спираль полипептидных цепей белков, происходящем под действием дисульфидных, водородных и иных связей.

Разные способы изображения трёхмерной структуры белка.
Четвертичная структура - соединение друг с другом макромолекул белков. Образуют комплекс. С.229, рис.40.

Уровни структуры белков: 1 - первичная; 2 - вторичная; 3 - третичная; 4 - четвертичная.
Многие белки (глобулярные) растворимы в воде, растворах солей, кислот и почти все растворяются в щелочах; не растворяются в органических растворителях; нерастворимы белки (фибриллярные), из которых построены ткани живых организмов (кожа, сухожилия, мышцы, ногти, волосы), а белки плазмы крови растворимы.
Химические свойства.
1) гидролиз (при нагревании с растворами кислот, щелочей, при действии ферментов)
O H O H
|| : | || : |
H2N ― CH2 ― C ―: N ― CH ― C ―: N ― CH ― C = O → H2N ― CH2 ― C = O +
: | : | | |
H2O CH2 H2O CH2 OH OH
| | глицин
OH SH
трипептид
+ H2N ― CH ― C = O + H2N ― CH ― C = O
| | | |
CH2 OH CH2 OH
| |
ОН SH
серин цистеин
Гидролиз белков сводится к гидролизу полипептидных связей. К этому же сводится и переваривание белков:
Белок ↔ аминокислоты → кровь во все клетки и ткани организма.
2) денатурация - нарушение природной структуры белка (под действием нагревания и химических реагентов)
Денатурация белка куриного яйца под воздействием высокой температуры
3) амфотерность:
+ NaOH
__________ cвойства кислот
![]()
![]() Белок
Белок
__________ свойства оснований
+ HCl
4) цветные реакции белков - качественные реакции
Лабораторный опыт. ! Правила работы!
а) ксантопротеиновая реакция.
Налейте в пробирку немного белка. Прилейте к нему 3-4 капли концентрированной азотной кислоты. Отметьте произошедшие изменения.
Белок + HNO3 конц. → желтое окрашивание
б) биуретовая реакция.
Налейте в пробирку немного гидроксида натрия, добавьте к нему раствор сульфата меди (II) так, чтобы щелочь оставалась в избытке. К полученному осадку прилейте раствор белка. Отметьте, какие произошли изменения.
Белок + Cu (OH) 2↓ → раствор фиолетового цвета.
?Как еще можно определить белок? (При горении - запах жженых перьев).
Вывод: качественными на белки являются реакции с концентрированной азотной кислотой (желтое окрашивание), со свежеосажденным гидроксидом меди (II) (раствор фиолетового цвета) и горение белков (запах жженых перьев).
Из органических соединений, входящих в живую клетку, важнейшую роль играют белки. На их долю приходится около 50% массы клетки.
Белки являются строительным материалом для оболочки, органоидов и мембран клетки. Из них построены кровеносные сосуды, сухожилия, волосы.
Они выполняют каталитическую функцию. Все клеточные катализаторы - белки (активные центры фермента), структура активного центра фермента и структура субстрата точно соответствуют друг другу.
Сократительные белки вызывают всякое движение.
Белки выполняют транспортную роль - белок крови гемоглобин присоединяет кислород и разносит по всем тканям.
Белки выполняют защитную функцию - выработка белковых тел антител для обезвреживания чужеродных веществ.
При разложении 1 г белка выделяется 17,6 кДж энергии. (Разлагаются белки до СО2, NH3, мочевины (NH2) 2CO и H2O).
Содержание белков в различных тканях человека неодинаково.
В мышцах - до 80%, в селезенке, крови, легких - около 72%, в коже - 63%, в печени - 57%, в мозге - 15%, жировая ткань, костная и ткань зубов содержат от 14 до 28% белков.
Белки входят в состав многих лекарственных препаратов. Ведутся работы по искусственному получению белковых веществ (синтезированы инсулин, рибонуклеаза).
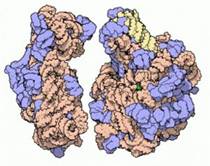
Молекулярная модель малой (слева) и большой (справа) субъединиц бактериальной рибосомы - молекулярной машины, синтезирующей белки. Голубым цветом показаны белки в составе рибосомы, но основную структурную роль выполняет рРНК.
Это важно, так как эксперты Всемирной организации здравоохранения считают, что примерно половина населения земного шара находится в состоянии белкового голодания, а мировая нехватка пищевого белка составляет около 15 млн. тонн в год при норме потребления белка в сутки взрослым человеком 115 грамм.
Мы вспомнили то, что вы знали о белках из курса биологии, рассмотрели химические свойства белков, их значение для жизни. Предлагаю вам проверить ваши прошлые знания, ответив на вопросы. Вам нужно вставить пропущенные слова или фразы.
Проверь себя
Главным носителем жизни являются ….
… - это сложные высокомолекулярные соединения, построенные из ….
Элементный состав белков: ….
Молекулярная масса белков изменяется от … до ….
Многие белки растворимы в …, почти все растворяются в ….
Нерастворимы белки, из которых построены ….
В структуре белка различают … структуры.
Функции белков в организме ….
Ответы:
1. Белки.
Белки; остатков α - аминокислот.
С, Н, О, N, S.
Десяти тысяч, миллионов.
Воде, растворах солей, кислот; щелочах.
Ткани живых организмов: кожа, сухожилия, мышцы, ногти, волосы.
Первичную, вторичную, третичную, четвертичную.
Строительная, каталитическая, двигательная, транспортная, защитная, энергетическая.
Критерии оценки:
"5" - все ответы правильные; "3" - 3 неверных ответа;
"4" - 1-2 неверных ответа; "2" - 4 и более неверных ответов.
Опорный конспект:
Белки - это сложные высокомолекулярные природные соединения, построенные из остатков α - аминокислот, соединенных пептидными (амидными) связями ―СО ― NH ―.
Число аминокислотных остатков, входящих в молекулы белков, различно: инсулин - 51, миоглобин - 140. Mr (белка) = от 10 000 до нескольких миллионов.
Mr (белка яйца) = 36 000; Mr (белка мышц) = 1 500 000.
Гемоглобин (C738H1166O208N203S2Fe) 4.
Структуры белка.
Первичная - последовательность чередования аминокислотных остатков (все связи ковалентные, прочные).
Вторичная - форма полипептидной цепи в пространстве (чаще всего спираль). Белковая цепь закручена в спираль (за счет множества водородных связей). Третичная - реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль (за счет гидрофобных связей), у некоторых S - S - связи (бисульфидные связи).
Четвертичная - соединенные друг с другом макромолекулы белков.
Химические свойства
1) гидролиз (при нагревании с растворами кислот, щелочей, при действии ферментов)
O H O H
|| : | || : |
H2N ― CH2 ― C ―: N ― CH ― C ―: N ― CH ― C = O → H2N ― CH2 ― C = O +
: | : | | |
H2O CH2 H2O CH2 OH OH
| | глицин
OH SH
трипептид
+ H2N ― CH ― C = O + H2N ― CH ― C = O
| | | |
CH2 OH CH2 OH
| |
ОН SH
серин цистеин
Гидролиз белков сводится к гидролизу полипептидных связей. К этому же сводится и переваривание белков:
белок ↔ аминокислоты → кровь во все клетки и ткани организма.
2) денатурация - нарушение природной структуры белка (под действием нагревания и химических реагентов)
3) амфотерность:
+ NaOH
__________ cвойства кислот
|
Белок ―|
|__________ свойства оснований
+ HCl
4) цветные реакции белков - качественные реакции
а) ксантопротеиновая реакция.
Белок + HNO3 конц. → желтое окрашивание
б) биуретовая реакция.
Белок + Cu (OH) 2↓ → раствор фиолетового цвета.
в) горение - запах жженых перьев.
Вывод: качественными на белки являются реакции с концентрированной азотной кислотой (желтое окрашивание), со свежеосажденным гидроксидом меди (II) (раствор фиолетового цвета) и горение белков (запах жженых перьев).
Роль белков в клетке.
1. Строительный материал - образование оболочки, органоидов и мембран клетки. Построены кровеносные сосуды, сухожилия, волосы.
2. Каталитическая роль - все клеточные катализаторы белки.
3. Двигательная функция - сократительные белки вызывают всякое движение.
4. Транспортная функция - белок крови гемоглобин присоединяет кислород и разносит по всем тканям.
5. Защитная роль - выработка белковых тел антител для обезвреживания чужеродных веществ.
6. Энергетическая роль: 1 г белка → 17,6 кДж.