Дипломная работа: Изучение оценки биологической безопасности продукции птицеводства на лабораторных животных
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение высшего профессионального образования
"Московский государственный университет прикладной биотехнологии"
Ветеринарно-санитарный факультет
Кафедра незаразных болезней
Специальность 110501- Ветеринарно-санитарная экспертиза
ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ РАБОТА
"Изучение оценки биологической безопасности продукции птицеводства на лабораторных животных"
Выполнил :
cтудент 5 курса
ветеринарно-санитарного факультета
МОСКВА 2010г.
СОДЕРЖАНИЕ
Введение
1. Обзор литературы
1.1 Токсикологическая характеристика соединений свинца и кадмия и распространение в окружающей среде
1.2 Пути поступления, распределение и накопление соединений свинца и кадмия в организме животных
1.3 Токсикологическое действие свинец – и кадмийсодержащих соединений на организм животных
1.4 Патологоанатомические и морфологические изменения в органах и тканях животных при отравлении соединениями свинца и кадмия
2. Материалы и методы исследования
2.1 Токсикологические методы исследования
2.2 Гистологические методы исследования
3. Результаты исследований
3.1 Биохимические показатели сыворотки крови крыс
3.2 Накопление свинца и кадмия в органах крыс
3.3 Морфологические изменения в органах крыс при поступлении в организм мяса цыплят-бройлеров, содержащего свинец и кадмий
Заключение
Выводы
Практические рекомендации
Список литературы
ВВЕДЕНИЕ
В последние годы в нашей стране большое место в удовлетворении потребностей населения в мясных продуктах занимает бройлерное птицеводство. Мясо бройлеров отличается высокими вкусовыми качествами и является ценным продуктом питания. В этой связи промышленное выращивание цыплят-бройлеров приобретает все большее значение.
В настоящее время наблюдается значительное загрязнение окружающей среды тяжелыми металлами и, в частности, соединениями свинца и кадмия. Установлено, что при кормление птицы кормами, содержащими допустимые уровни содержания тяжелых металлов, мясо птицы аккумулирует в себе в количествах превышающих допустимые уровни. Основная опасность токсичных элементов для организма заключается не в проявлении острого отравления, а в постоянной кумуляции их в органах и тканях на протяжении всей жизни. При этом в органах и системах организма возникают патологические процессы различной тяжести, зависящие от количества соединений тяжелых металлов, поступивших в него.В связи с этим целью исследования является изучение оценки биологической безопасности продукции птицеводства на лабораторных животных.
Задачи:
1. Изучить накопление свинца и кадмия в органах крыс, получавших с основным рационом мясо цыплят-бройлеров с повышенным содержанием токсикоэлементов
2. Изучить влияние накопления тяжёлых металлов в организме крыс на гематологические показатели.
3. Изучить патологические изменения в органах крыс, получавших с рационом мясо цыплят-бройлеров с повышенным содержанием свинца и кадмия
1. ОБЗОР ЛИТЕРАТУРЫ
1.1 Токсикологическая характеристика соединений свинца и кадмия и распространение в окружающей среде
Среди множества химических веществ, встречающихся в окружающей среде, значительное место занимают соединения тяжелых металлов и, в частности, свинца и кадмия.
Содержание свинца в земной коре составляет 1,6´10-3 % и в основном концентрируется в таких минералах как галенит, англезит, церуссит. Общие запасы свинца на Земле, оцениваемые в 100 млн. тонн, в основном представлены в виде сульфатов. Среднее содержание свинца в атмосфере 2´10-9–5´10-4 мкг/куб. м. В окружающую среду ежегодно из природных источников свинец поступает с вулканическими выбросами, почвенной силикатной и метеоритной пылью и морскими солевыми аэрозолями до 230 тысяч тонн (Ван Мансвельт Я.Д., 2004; Е.Б. Бурлакова, 2000).
Свинец широко используется в производстве кабелей, как компонент различных сплавов, для защитных экранов от гамма-излучения, при производстве электрических аккумуляторов, красок и пигментов, в химическом машиностроении, пиротехнике, полиграфии, сельском хозяйстве.
Выбросы свинца в окружающую среду в результате деятельности человека весьма значительны. Источниками загрязнения биосферы свинцом являются выхлопные газы двигателей внутреннего сгорания (с ними поступает ежегодно до 260 тысяч тонн), высокотемпературные технологические процессы (сжигание каменного угля поставляет в окружающую среду 27,5-35 тысяч тонн, а нефти и бензина почти 50 % антропогенного выброса этого металла), добыча и переработка металла (в результате работы металлургических предприятий на поверхность Земли поступает около 90 тысяч тонн).
Основным источником свинцовых загрязнений является мировой автомобильный парк, который в результате выбросов автомобильных двигателей обогащает атмосферу рассеянным свинцом, оседающим на поверхности почвы (в придорожной зоне) в виде мелких твердых частиц или рассеивающихся в воздухе в виде аэрозолей. При сгорании 1 л этилированного бензина в воздух попадает 200-400 мг свинца.
Вблизи автострад с интенсивным движением транспорта в почве может накапливаться до 1000 мг свинца на 1 кг почвы. Наибольшее загрязнение почв свинцом, в 7-15 раз превышающее фоновое, отмечается на расстоянии 1-5 м от шоссе (М.М. Ватсон и др.,2002).
Концентрация свинца в природных водах обычно не превышает 10 мкг/л, что обусловлено его осаждением и комплексообразованием с органическими и неорганическими лигандами, интенсивность этих процессов во многом зависит от величины показателя рН (А.П. Пурмаль, 1998).
Уровень общего содержания свинца в атмосферных осадках обычно колеблется от 1 до 50 мкг/л, но в районах интенсивной промышленности может достигать до 1000 мкг/л, приводя к серьезному загрязнению снежного покрова и почв (М.Ю. Кроль, Г.А. Ларионов, 2007).
Аккумуляция свинца почвами зависит от таких их свойств, как кислотность, химический состав, поглощающая способность, которые в совокупности влияют на подвижность свинца и доступность его для растений (В.В. Пиунова и др., 1997; Н.З. Милащенко, 2000).
Распределение свинца в растениях неравномерное: наибольшая концентрация обычно наблюдается в корнях, меньше - в вегетативных частях растений, а наименьшее его содержание отмечается в репродуктивных органах – плодах, семенах (Т. М. Капитонова, 2008).
В корнеплодах и капусте, выращенных вблизи автомагистралей, количество свинца в 5-10 раз превышает предельно допустимую суточную норму (Н.Ф. Сидоров, 2005).
Значительное увеличение концентрации свинца обнаруживается также в овощах, выращенных на пригородных участках, удаленных от крупных городов на расстоянии до 25 км (К.С. Пегасова, 2001).
Загрязняют окружающую среду свинцом и многие отходы. Подавляющая по абсолютной массе часть свинца накапливается в бытовом мусоре – до 65 %, в осадках канализационных стоков и осадках городских очистных сооружений – до 20 % (Б.И. Кочуров, 2005).
Кадмий относится к рассеянным элементам и содержится в виде примеси во многих минералах. Его средняя концентрация в морской воде – около 0,1 мкг/л, а в земной коре – 0,1 мг/кг и обычно он сопутствует цинку (А.П. Пурмаль, 2008).
Кадмий находит широкое применение в ядерной энергетике для изготовления стержней атомных реакторов, в гальванотехнике в качестве антикоррозийных и декоративных покрытий, производстве аккумуляторов, используется как стабилизатор поливинилхлорида, пигмент в стекле и пластмассах, электродный материал, компонент различных сплавов (В.Т. Самохин и др., 2006).
Основными источниками загрязнения окружающей среды кадмием являются производство цветных металлов, сжигание твердых отходов, угля, сточные воды горно-металлургических комбинатов, производство минеральных удобрений и красителей (L.M. Candelaria et al., 1995; F. Cabrera et al., 2001).
Около 52 % кадмия попадает в окружающую среду при сжигании и переработке материалов, содержащих металл, особенно изделий из пластмасс, куда он добавляется для прочности, а также кадмиевых красителей (L.M. Sluman, 2001).
Кадмий является спутником широко применяемого цинка и всегда присутствует в изделиях, содержащих цинк (B.Filipek-Mazur et al., 2007).
Заводы, выплавляющие кадмий ежегодно выбрасывают в атмосферу около 1 тыс. тонн этого металла (F. Ganbey, E. Coliach, 2007).
Кроме того, в окружающую среду кадмий попадает вместе с минеральными удобрениями (в количестве 8-10 % он входит в состав суперфосфата) и с фунгицидами. Ежегодные дозы кадмия, поступающего в почву этим путем составляют 0,3–12 кг/га (Y. Ge et al., 2000).
Антропогенная эмиссия кадмия в биосферу превышает природную в несколько раз. Например, в воздушную среду ежегодно поступает около 9000 тонн кадмия, причем 7700 тонн (т.е. более 85 %) – в результате деятельности человека. Только в Балтийское море каждый год попадает 200 тонн кадмия (Min Han et al., 2004).
Кадмий легко аккумулируется многими организмами, в особенности бактериями и моллюсками, где уровни биоконцентрации достигают порядка несколько тысяч (A. Piskac, 2002).
В растениях кадмий концентрируется в основном в корнях и в меньшей степени в листьях (M. Sevaljevic et al., 2000).
В пресноводной среде кадмий в основном поглощается за счет абсорбции или адсорбции непосредственно из воды, в то же время морские организмы, напротив, поглощают кадмий из пищи (P. Planguart et al., 1999).
1.2 Пути поступления, распределение и накопление соединений свинца и кадмия в организме животных
Вопрос о путях поступления соединений свинца имеет, в первую очередь, практическое значение, поскольку характер профилактических мероприятий находиться в прямой зависимости от путей их поступления. В организм животных, токсикоэлемент попадает в виде пыли или аэрозоли ингаляционным путем, оральным, через кожу и слизистые оболочки.
При бурном развитии новых технологических процессов в различных отраслях промышленности тяжелые металлы в возрастающих количествах поступают в окружающую среду, оказывая, тем самым, влияние на живые организмы.
Однако, несмотря на предохранительные меры, тенденция к увеличению тяжелых металлов в биосфере будет наблюдаться и в дальнейшем (В.В. Худолей, И.В. Мизгирев, 2006).
Так, при исследовании уровня загрязнения атмосферного воздуха в районах, где находится свинцово-плавильный завод, крупная теплоэлектростанция и завод по производству суперфосфатных удобрений, установлено, что годовой выброс соединений свинца в воздух составляет 18,650 мкг/м3 (D. Popovae et al., 2006).
Повышенное содержание свинца и кадмия обнаруживается в почве, воде, в печени, почках, крови и молоке животных, выращенных вблизи цинкоплавильного завода (J. Slamecka et al., 1994; S.K. Dwivedi et al., 2001).
М. Кирова и др. (2005) изучали содержание свинца в мышцах и внутренних органах крупного рогатого скота в районе комбината цветных металлов.
Было установлено, что содержание свинца в мышечной ткани, внутренних органах и трубчатых костях находится в прямой корреляции с возрастом животных и топографической близостью населенных мест к основному загрязнителю тяжелыми металлами – комбинату цветных металлов.
Кроме того, накопление свинца в организме крупного рогатого скота происходит в следующей последовательности: печень – почки – трубчатые кости – селезенка – мышечная ткань и является показателем хронической интоксикации организма животных свинцом без проявления клиники острого отравления, хотя в некоторых случаях было обнаружено повышенное содержание токсикоэлемента в мышечной ткани и печени.
Основными соединениями в выбросах дымовых труб промышленных предприятий являются: кадмия окись, свинца сульфат, свинца окись и свинца сульфид (A. Ciesla, J. Saniszewska, 2007).
Накопление свинца и кадмия в организме сельскохозяйственных животных, выращенных в промышленных районах, происходит в 2-4 раза больше, чем в органах и тканях животных, выращенных в сельских районах (V. Antoniou et al., 2005; Р. Иванова и др., 2005; М. Кирова, 2005; S.K. Dnivedi et al., 2005; О.И. Кальсина, 2005; M. Gallo et al., 2008).
В настоящее время во многих странах мира уделяется большое внимание загрязнению соединениями свинца окружающей среды в результате добавления к автомобильному топливу алкилсвинцовых присадок, таких как тетраэтилсвинец и тетраметилсвинец. С выхлопными газами соединения свинца выносятся в виде твердых частиц, около 20 % которых оседает в непосредственной близости от дороги.
Заметно повышено содержание свинца в организме животных, выращенных около автострад (K. Wilke et al., 2000).
Установлено, что вдоль автомобильных дорог содержание свинца намного выше (М.М. Ватсон, Н. Робертс, Д.Д. Маккукзи, 2002, А.О. Aduadi, T.A. Gbodi, Y.O. Alio, 2000). С удалением от дорог на расстояние 220 м в обе стороны концентрация свинца в почве снижается от 60 мг/кг до 30 мг/кг (Singh et al., 2007). В крови коров и буйволов концентрация свинца соответственно составляет 1,62+0,38 и 0,86+0,23 мг/л.
По сведениям К. С. Пегасовой (2001) в хозяйствах, расположенных вблизи федеральных автомагистралей, содержание свинца в мясной и молочной продукции составляет 0,7 допустимого уровня.
Особую опасность представляют сточные воды производств: металлургического, металлообрабатывающего, машиностроительного, химического, химикофармацевтического, нефтехимического, спичечного, фитоматериалов. Содержание в сточных водах иногда достигает 8204 мг/л, бытовые стоки содержат обычно не более 0,48 мг/л (J. Bires et al., 1995; М.Ю. Кроль, Г.А. Ларионов, 2007).
В результате поступления соединений тяжелых металлов в окружающую среду происходит их накопление в почве, воде, а оттуда они мигрируют в растения и корма.
С кормами соединения свинца и кадмия поступают в организм животных, иногда в количествах, превышающих допустимые уровни (М. Kirchgessner et al., 2004; R.I. Bakalli et al., 2005; Е.А. Печкурова, О.Н. Новикова, 2007; B. Filipek-Mazur et al., 2007; J. Kelemen et al., 2008; Г.А. Ларионов, Г.К. Волков, 2001; Л. Баскин, 2000).
При содержании тяжелых металлов в почве выше допустимых норм отмечают повышение поступления токсикоэлементов в рационы и соответственно в продукцию животноводства, ухудшение качества сельскохозяйственной продукции. Например, при содержании в рационе свинца в 2-7 раз выше ПДК содержание его в молоке оказалось в 1,25-2 раза выше допустимых уровней (Н. И. Морозова, 2008).
Значительное содержание свинца отмечается в фосфорных удобрениях – до 34 мг/кг, а в сложных и комбинированных – его концентрация доходит до 57 мг/кг (Н.З. Милащенко, 2000).
Кроме того, поступление тяжелых металлов из почвы в растения возрастает параллельно с увеличением кислотности почвы. Это происходит потому, что соединения лучше растворяются в кислой среде (P. Planguart et al., 2000).
При техногенном загрязнении почвы тяжелыми металлами одновременно в ней возрастает доля их подвижных форм (В. А. Вострокнутов и др., 2007).
Большая часть свинецсодержащих соединений проходит в организме транзитом, т. е. не всасывается, и меньшая часть быстро включается в обменные процессы. Так, приблизительно только 10 % свинца, поступающего в организм, всасывается (D. Rondia, 2001).
Абсорбция свинца при поступлении нерастворимых солей – сульфатов, сульфидов, хроматов очень низка. Несколько большее количество свинца всасывается при введении в желудочно-кишечный тракт хорошо растворимых соединений ацетата и нитрата. Желудочно-кишечная абсорбция свинца повышается при недостаточном содержании в пище кальция и железа, избытке витамина Д. Токсичность свинца зависит и от других факторов (Р. Е. Андрушайте, 2001).
При парентеральной инъекции растворимых солей абсорбция свинца происходит не полностью, а часть его задерживается в местах введения. При внутривенном введении солей свинца большая его часть связывается с эритроцитами, около 5 % остается в плазме в форме коллоидальных частиц фосфатов или комплексов с белками и органическими кислотами (K.A. Winship, 2001). Витамин Е защищает эритроциты от действия свинца (В.А. Тутельян и др., 2007).
Поступивший в кровь свинец быстро распределяется по органам, затем происходит перераспределение. Образуется два обменных пула свинца: быстрый – кровь, мягкие ткани и медленный – скелет (Р.Е. Андрушайте, В.К. Бауман, 2002).
Свинецсодержащие соединения, оказавшиеся в крови, разносятся и накапливаются в жировой ткани почек, печени, селезенке, костях.
При большей концентрации свинец поступает в клетки кожи, мышцы и кости, из последних он вытесняет кальций (V.N. Nayah et al., 2005).
При высокой концентрации свинца в крови отмечается достоверная корреляция между уровнем свинца в крови и моче (К. Higashikawa et al., 2000).
Свинец, независимо от путей поступления в организм содержится, в основном, в эритроцитах. Есть данные о перераспределении свинца и постепенном его накоплении в сыворотке крови, где он образует комплексы с разными фракциями белка. По-видимому, наиболее прочным является комплекс с g-глобулином. Уже через несколько часов после введения, свинец попадает в органы, по интенсивности поглощения в порядке убывания образующих следующий ряд: почки – печень – легкие – селезенка – мышцы (M.R. Moore, 2008).
Доказано, что всасывание тяжелых металлов из тонкого отдела кишечника зависит от их растворимости в воде (C.A. Kan, 2004).
Свинецсодержащие соединения откладываются в клетках почечных канальцев, образуя внутриядерные включения, окруженные ограничивающей мембраной. Предполагается, что таким образом осуществляется защита цитоплазменных органелл (Y. Bremmer, 2003).
В организме имеются три основных депо свинца: почки, печень и костная ткань. В других же органах свинец удерживается в значительно меньших количествах (Р.Е. Андрушайте, Б.Э. Гайлите, 2007).
Внутри клеток свинец распределяется неравномерно. Отмечается концентрирование свинца в клеточной мембране, митохондриях (E. Ritz, R. Nowach, 2004).
Таким образом, основными путями поступления свинца в организм является дыхательная система и желудочно-кишечный тракт. В кровь всасывается 30-50 % свинца, поступившего в дыхательные пути и 10-45 %, поступившего в пищеварительный тракт. Причем, 50-60 % свинца, поступившего в кровь, выводится через кишечник, остальное накапливается, главным образом, в костях (Hu Howard, P.L. Milder et al., 2002).
При повышенном содержании тяжелых металлов в организме происходит нарушение многих процессов, начиная с клеточных мембран, т. к. ионы металлов могут связываться со специфическими участками фосфолипидных полярных частей (В.А. Тутельян и др., 2007). В результате этого взаимодействия происходит расширение или сжатие поверхности мембраны и, следовательно, изменение ее обычных свойств. Особенно опасны металлоорганические соединения, т. к. они гораздо лучше проходят барьеры внутри организма (В. Калоус, З. Павличек, 2005).
Основные пути поступления кадмия в организм – желудочно-кишечный тракт и легкие.
Желудочно-кишечная абсорбция кадмия низка: для животных она составляет 3-8 %. На нее влияют уровень потребления цинка и растворимость солей кадмия.
Эксперименты на животных указывают, что кадмий абсорбируется посредством пассивной диффузии в двенадцатиперстной, тонкой и подвздошной кишках (P.J. Landrigan, 2003).
Абсорбция ионов кадмия из центров парентеральной инъекции в кровь происходит быстро и полно. В крови ионы кадмия входят в эритроциты и распределяются в плазме. Кадмий присоединяется к плазменным белкам, особенно g-глобулинам, и легко попадает в ткани.
При внутривенных инъекциях солей кадмия наблюдаются быстрое распределение его в тканях и медленное выделение. Так, распределение кадмия в печени, почках, селезенке и других органах через 28 дней мало отличается от распределения его через 1 час (A.K. Gautam, A.R. Chrowdhury, 2007).
Абсорбция кадмия через кожу незначительна. После вдыхания кадмиевой пыли или аэрозоля кадмий быстро и полностью абсорбируется легкими. Только малорастворимые соли, такие как CdS, остаются в легких не абсорбированными и вызывают местные воспаления и язвы. Вдыхаемые соли кадмия в зависимости от растворимости абсорбируются на 10-40 % (B.A. Fowler, R.E. Gandley, 2003).
Способ транспортировки кадмийсодержащих соединений кровью не ясен. Экспериментальные данные на животных дают основание предполагать, что соединения кадмия переносятся плазмой, взаимодействуя с протеинами с низким молекулярным весом и эритроцитами, в первую очередь гемоглобином и другими протеинами. Эксперименты показывают, что после одной инъекции уровень кадмия повышается, а затем быстро снижается, при этом введенная фракция вначале присутствует в плазме, в комплексе с протеинами, в последующем обнаруживается в эритроцитах. Кадмийсодержащие вещества, находящиеся в красных клетках крови, не поступают в плазму крови и не заменяются соединениями кадмия из плазмы, но почки обладают уникальной способностью выделять этот связанный кадмий из крови (A. Bernard, R. Lauwerus, 2004).
Задержка кадмия наблюдается во всех тканях у животных, в наибольшем количестве – в почках, печени, органах размножения и легких. Причем в почках и печени концентрируется до 50 % всего количества кадмия в организме. Другие органы, такие, как легкие, мозг, селезенка, сердце, жир также аккумулируют значительные количества кадмия. Кадмий не обнаружен в поджелудочной железе, аорте, пищеводе (H.-W. Schlipkoter et al.,2006).
Накопление кадмия в почках и печени происходит в форме металлотионеина с молекулярной массой в 10000 дальтон. Синтез кадмийсодержащего белка металлотионеина является, по существу, механизмом защиты и приводит к избирательному накоплению кадмия в почках и печени, где, процент связывания с металлотионеинами кадмия составляет 76-87 %.
Независимо от способа введения кадмий проникает через плаценту беременных крыс и хомяков. Это подтверждается заметно большим количеством содержания его в печени новорожденных, по сравнению с материнскими особями (в 2,5 раза) (P. Chomdhury, 2003). Однако, по сравнению со свинцом, перенос кадмия от матери к плоду и новорожденному оценивают как незначительный (A. Bernard, R. Lauwerus, 2006).
У животных и птиц экскреция кадмия осуществляется медленно, в основном с фекалиями, но отмечается и незначительное его выделение почками (B. Baranski et al., 2003).
Выделения кадмия происходит главным образом через желудочно-кишечный тракт. При этом значительную роль играет экскреция желчью (S. Bondia et al., 2001).
Хотя кадмий селективно накапливается в эпителии почечных канальцев (связываясь с низкомолекулярным белком), выделение его с мочой незначительно и повышается только при длительной экспозиции (M.A. Cheney et al., 2001).
Не абсорбированный кадмий (80 %) при пер оральном введении выделяется в течение 5 дней с фекалиями (I. Mucata et al., 2003).
Соединения свинца и кадмия, оказавшиеся в организме животных, депонируются в почках, печени, костной ткани и выделяются из него с калом, мочой, а также с молоком.
Повышенное содержание токсикоэлементов обнаруживается в молоке коров, если они выпасались вблизи промышленных предприятий (В.Н. Жуленко, М.А. Малярова, 2000; A. Litminczuk et al., 2003).
Большие количества свинца и кадмия в молоке установлены в том случае, когда в организм животных поступают корма из регионов, где почва загрязнена этими токсикоэлементами (LB. Nillett et al., 2004; A. Gorska, Z. Litwinczuk, 2006).
Концентрация свинца и кадмия в коровьем молоке выше в летний сезон, нежели в зимний, это связано с кормами, которые поступают в организм животных (J. Citek et al., 2005).
В связи с этим, количество свинца и кадмия, превышающие предельно допустимые уровни устанавливаются и в молочных продуктах (S.M. Fathi et al., 2000; Р.В. Осикина, Т.К. Тезиев, 2001).
При проведении токсико-экологической оценки объектов животноводства обнаруживаются высокое содержание свинца и кадмия в печени и почках животных и в яйцах кур, выращенных в неблагоприятных районах (G. Garmience et al., 2003; A. Meluzzi, 2004; Е.А. Печкурова, О.Н. Новикова, 2004; E. Arkuszewska et al., 2004; Е.Е. Носов, 2006; M. Lopez Mlonso, 2006; Ю.А. Лаврушина и др., 2007; G. Ysast, 2007).
Наличие соединений свинца и кадмия нельзя не учитывать производителям мясной, молочной продукции и птицепродуктов. Этим и обусловлено выполнение предпринятых нами исследований по определению уровня свинца и кадмия в кормах, органах и тканях кур и крупного рогатого скота, выращенных в различных регионах Московской области.
1.3 Токсикологическое действие свинец – и кадмийсодержащих соединений на организм животных
Одной из наиболее важных биологических проблем является оценка степени опасности токсикоэлементов для человека и животных.
Попав в организм, соединения тяжелых металлов могут стать причиной не только острых и хронических отравлений, но и появление отдельных последствий, которые возможны из-за канцерогенного, гонадотоксического, тератогенного (L.Friberg et al., 2000; V . Geldmacher, M. Mallinckrodt, 2004; К.А. Winship, 2005) и эмбриотоксического действия ( B. N. Nayak et al., 2000).
Поступающие из мест всасывания токсические вещества находятся в растворенном состоянии в плазме крови или взаимодействуют с белками плазмы крови, в первую очередь, с альбумином (А.И. Луйк, В.Д. Лукьянчук, 2004; Т.М. Зайцева и др., 2005). При этом взаимодействие белков и малых молекул осуществляется ковалентными, ионными, водородными и слабыми электростатическими связями.
Однако Jugo Sloboden (2000) и K.A.Winship (2001) установили, что распределение свинца между плазмой крови и кровяными клетками весьма различно и составляет 1,43-1,95 % и 98,05-98,57 % соответственно.
Наряду с этим, при определении количества токсикоэлемента в цельной крови и сыворотке установлено, что сыворотка крови является мобильным и активным носителем свинца, а цельная кровь служит резервуаром (D.T. Nixon et al., 2005; J. Jonglard et al., 2007).
И.Б. Беклишев и Стеценко (2001) отмечают, что свинец вызывает структурные изменения в мембране эритроцитов. Причем в самом эритроците он взаимодействует непосредственно с гемоглобином, при этом образуются нерастворимые комплексы, в связи с чем, период жизнедеятельности эритроцитов сокращается, некоторые клетки разрушаются. Кроме того, наблюдается выделение из эритроцитов ионов калия и снижение механической устойчивости клетки (M.R. Moore, 2005).
В настоящее время установлено, что свинец в небольших количествах, еще 10 лет назад, считавшихся безопасным, вызывает субклиническое действие, отдельные проявления которого получили название биологических маркеров токсичности. Так, анемию обуславливает ингибиторное действие свинца на дегидратазу дельта-аминолевули-новой кислоты (ДАЛК) и феррохелатазу (ФХ) – ферментов, участвующих в синтезе гемма (H.Grzyber et al., 2001; P.J. Landrigan , 2003).
Поражения органов кроветворения объясняют прямым токсическим воздействием соединений тяжелых металлов на молодые клетки кроветворения, в частности, угнетением некоторых ферментативных процессов, ответственных за пролиферацию и дифференцировку этих клеток, а также уменьшением проницаемости мембран эритроцитов, в связи с чем, затрудняется транспорт биологически важных веществ мембраны.
В условиях эксперимента при введении животным свинца ацетата отмечается увеличение концентрации свинца в крови, при этом содержание эритроцитов в крови снижается, а ретикулоцитов увеличивается. В костном мозгу обнаруживается существенное увеличение пронормобластов, а также ранних промежуточных и поздних нормо- бластов (A.K. Gautam, A.R. Chowdhury, 2007).
Специальными исследованиями установлено, что свинец влияет на ряд важных и взаимосвязанных клеточных систем, в том числе на дыхание митохондрий и синтез белка (B.A. Fowler et al., 2003).
Хорошо изучено влияние свинецсодержащих веществ на нервную систему, как центральную, так и периферическую (А.И. Бурханов, 1992).
Ученый Б.А. Абеумов (2003), проводивший свои исследования на собаках, показал, что при интоксикации свинцом происходят определенные взаимосвязанные гемо- и ликвородинамические изменения, которые вызывают декомпенсированные состояния в цереброспинальной системе, приводящие к нарушению функции мозга. А исследователь T.W. Clarkson (2001) считает, что ЦНС является основной "мишенью" токсического действия неорганических соединений свинца, особенно алкильных производных.
Данные, полученные некоторыми исследователями о накоплении свинца в мозгу противоречивы. Так, K.A. Winship (2003) считает, что накопление токсикоэлемента происходит, главным образом, в сером веществе и базальных ганглиях. А по данным H.Sоurander et al., (2004), свинец накапливается в белом веществе мозга, что в свою очередь, приводит к развитию энцефалопатии.
Наряду с этим, характерным проявлением действия соединений свинца на нервную систему является поражение двигательных аксонов (P.J. Landrigan, 2003), а изменение в нервных клетках по мнению (Z. Anca, A. Ossian, 2005) происходит в результате ингибирования свинцом метаболизма глюкозы.
До сих пор было принято считать, что опасность представляет свинец, циркулирующий в крови, тогда как его отложение в костях _ от 60 до 90% от его общего поступления в организм рассматривалось как механизм детоксикации (Hu Howard, F.L. Milder, 2005). Однако при быстром переходе токсикоэлемента из костей в кровь может произойти острое отравление. Кроме того, шведские ученые показали, что продолжительность задержки свинца в костях зависит от их типа: в губчатых костях период полувыведения свинца в костях зависит от их типа: в губчатых костях период полувыведения свинца составляет до 5 лет, тогда как в плотных костях он в 2-4 раза больше (J. Raloff, 2008).
Свинец вызывает обширные патологические изменения в нервной системе, крови, сосудах (S. Stoev, S. Lazarova, 2005), активно влияет на синтез белка ( В.Г. Сафронов и др., 2003), энергетический обмен клетки и её генетический аппарат (С. Фотеева и др., 2007).
Свинецсодержащие соединения подавляют ферментативные процессы превращения порфиринов и кровообразование (M.Z. Khan et al., 2003), ингибирует SH-содержащие ферменты (В.Г. Софронов и др, 2004), холинэстеразу (А.В. Новиков, А.В. Конюхова, 2000), различные АТФазы, угнетает окисление жирных кислот, нарушает белковый, липидный и углеводный обмены (S. Cheshnudjeva, H. Stranchev, 2006; С.А. Лавина, С.А. Карпова, 2007).
Соединения свинца нарушают деятельность сердечно-сосудистой системы, вызывая изменения электрической и механической активности сердечной мышцы, морфологические и биохимические изменения в миокарде с признаками сосудистой дегенерации, повреждения мышечной стенки сосудов и нарушения сосудистого тонуса.
При проведении гематологических исследований С.Лазаревой и др. (2005) у овец, получавших четырехкратно с интервалом в 15 дней ацетата свинца, уже через 24 часа после первого поступления установлена анемия, базофильно пунктированные эритроциты, тромбоцитопения, повышение концентрации гемоглобина, повышение гематокрита, анизоцитоз, моноцитопения и уменьшение гранулоцитов. А в результате проведенных морфологических исследований на 11-й день после четвертого введения обнаружено катаральный энтерит с некрозами в тонких кишках, дистрофические изменения и некроз печени, зернистая и гиалиновая дистрофия с базофильными ядерными включениями в некоторых клетках извитых почечных канальцев, а также дистрофические изменения надпочечников, миокарда, головного мозга и скелетной мускулатуры. Органические соединения свинца, например тетраэтилсвинец, высокотоксичны для нервных тканей. Они подавляют метаболизм глюкозы, синтез РНК и ДНК, повреждают миелиновые оболочки нервных клеток, что сопровождается снижением скорости передачи нервного возбуждения (J. Stem, 2000).
Соединения свинца обладают канцерогенностью и генотоксичностью, они могут вызывать мутации, нарушая третичную структуру и функции ферментов синтеза и репарации ДНК (S. Kaya et al., 2001; S.S. Haneef et. al.,2001; S.De Guise et al., 2003).
M. Kirova (1996) установила обратно пропорциональную зависимость между содержанием свинца в крови и молоке лактирующих животных в районах с металлургической деятельностью и активностью ДАЛ–дегидрогеназы в эритроцитах. Показатель энзимной активности ДАЛ–дегидрогеназы в крови лактирующих животных может быть достоверным индикатором повышения уровня свинца в молоке и крови лактирующих животных.
Кроме того, загрязнение окружающей среды свинцом и кадмием стало одной из причин развития плацентарной недостаточности. При нарушении формирования плаценты может развиться сосудистая или ферментативная недостаточность.
Так, при воздействии уксуснокислого свинца структурные и метаболические изменения в системе мать–плацента–плод крысы связаны с развитием адаптивно–компенсаторных процессов, что выражается в гипертрофии и гиперплазии митохондрий, мембранных профилей гранулярного эндоплазматического ретикулума и элементов аппарата Гольджи. При этом воздействие свинца с 16 по 20-сутки беременности сопровождается более глубокими деструктивными изменениями в клетках плаценты, происходящими в комплексе с процессами истощения энергоресурсов (И.Ф. Степаненко, 2002).
Л.Ф. Минина, О.Ц. Цыренжапов (2005) и др. предполагают, что существует определенная связь между количеством поступающего в организм животных свинца и развитием мочекаменной болезни. При этом добавки селена и цеолита снижает токсическое воздействие избытка свинца.
Кадмийсодержащие вещества, поступившие в кровь до 90%, обнаруживаются в ее форменных элементах преимущественно в лимфоцитах (A. Bernara, R. Lanweryt, 2004).
У млекопитающих в переносе кадмия в крови участвует белок – микроглобулин (I. Dremner, 2001). А наибольшая скорость растворения в плазме крови зарегистрирована для окиси кадмия (M. Frenet et al., 2003).
Соединения кадмия, как и свинца, также обладают нейротоксическим действием (P. Vig et al., 2002). Кроме того, специальными исследованиями установлено, что при введении в организм лабораторных животных кадмия хлорида снижается общее содержание липидов в крови. При этом количество фосфолипидов, галактолипидов и свободного холестерина уменьшается на 27, 29 и 36 % соответственно (S. Gulati et al., 2003).
Другими авторами установлено угнетающее влияние кадмия на синтез белков клетками печени и расценено как ранний признак токсического влияния элемента (I.Y. Mitone et al., 2007).
Опасность кадмия состоит в том, что период полувыведения его составляет 16 и более лет, а это значит, он накапливается в организме и вызывает хроническое отравление без выраженных клинических симптомов или схожие симптомы с признаками отравления другими соединениями тяжелых металлов (М.А. Малярова, 2006).
В организме соединения тяжелых металлов в наибольших количествах накапливаются в почках и печени (I. Bremner, 1989) и тем самым оказывают токсическое действие (H.-W. Sehliproter et al., 2006).
Нефротоксическое действие кадмия проявляется поражением канальцев почек, характерным признаком которого является протеинурия с повышенным выделением низкомолекулярных белков сыворотки крови: бета-микроглобулина, ретинолсвязывающего белка, лизоцима и РНКазы. Одновременно при этом наблюдается выход с мочой большого количества и других веществ, выделяющихся в норме через клубочки так же, как и белки, глюкоза, аминокислоты и кальций. При тяжелых поражениях нарушается фильтрация в клубочках (C.G. Elinder et al., 2004; E.L. Sebai et al., 2005).
Токсическое действие свинца связывают, в первую очередь, с тем, что его ионы при поступлении в организм взаимодействуют с сульфгидрильными группами белков, в частности ферментов, образуя устойчивые соединения – меркаптиды и, блокируя, таким образом, различные ферментные системы (S.O. Knowles, W.E. Donaldson, 2000). Кадмий же взаимодействует еще и с аминными и карбоксильными группами. В результате потери протеинами многих физико-химических и биологических свойств, нарушается белковый, углеводный и жировой обмены (Б.А. Атчабаров и др., 2002).
Кроме того, метаболизм и биологическое действие соединений тяжелых металлов было установлено после открытия тщательного изучения свойств специфических белков металлотионеинов. В печени животных с металлотионеином взаимодействует преимущественно цинк, а почках – цинк и кадмий, примерно в равных количествах. Причем содержание металлотионеинов в печени меньше, нежели в почках.
Биосинтез металлотионеинов и их содержание значительно увеличиваются в печени, почках, поджелудочной железе и слизистой оболочке кишечника при поступлении в организм соединений тяжелых металлов (H. Webb, C. Cain, 2002; D. Eaton, B. Toal, 2003).
Функция металлотионеинов заключается во взаимодействии металлов и уменьшении их токсичности (G.F. Nordberd, 2004; M.D. Ender et al., 2006).
Механизм действия кадмия проявляется в связывании с отрицательно заряженными группами мембран и модификации заряда на их поверхности. А это приводит к изменению микровязкости мембраны (О.И. Лебедь, 2004).
Неорганический кадмий не вызывает острых поражений почек, эффект его действия на почки связан с накоплением металлотионеин- связанного кадмия. При достижении критической концентрации металлотионеин-связанного кадмия клетка погибает(J.R.Glaister, 2006).
Специфическое заболевание, вызванное кадмиевым отравлением под названием "итай-итай" было выявлено в Японии. Клиника такого заболевания проявляется в нарушении различных функций организма в результате остеомаляции. При этом развивается сильная хрупкость костей.
При изучении гематологических и биохимических показателей мочи овец, получавших низкие дозы кадмия сульфата (4,5 мг/кг) в течение 8 дней С. Лазаровой (2005) было установлено в первые четыре дня опыта снижение объема мочи, экскреции креатинина, мочевины, ионов кальция, натрия, калия и хлора и увеличение ее удельного веса с выделением протеина, глюкозы и фосфатов. В дальнейшем количество мочи увеличилось и сопровождалось резким повышением содержания креатинина, мочевины, ионов кальция, калия и фосфатов в моче.
При внесении в сыворотку крови лошадей in vitro водных растворов нитрата кадмия и ацетата свинца в различных дозах изучали кинетику ферментативных реакций (С.А. Лавина, 2007). Соединения кадмия и свинца снижали активность щелочной фосфатазы, достоверно снижали активность I-нафтилацетатэстеразы и недостоверно – активность ацетилхолинэстеразы, но не влияли на активность оксидазы in vitro.
Влияние кадмия на щелочную фосфатазу обусловлено тем, что он является антиметаболитом по отношению к Zn2+, замещая его в ферменте. Таким образом, снижается активность фермента, снижается скорость катализируемых им реакций и связывание субстратом. Влияние свинца на различные ферменты обусловлено тем, что его соединения связываются с сульфгидрильными, фосфатными и карбоксильными группами ферментов, тем самым, снижая активность ферментов.
При изучении генотоксического действия кадмия на лимфоидные клетки мышей in vivo К. В. Привезенцев, Н. П. Сирота и др. (2006) доказали, что в основе генотоксичности кадмия для эукариотических клеток лежит способность индуцировать однонитевые разрывы и щелочелабильные сайты в ДНК, а образование цитогенетических повреждений, типа микроядер, подтверждает данные об индукции однонитевых разрывов ДНК при действии кадмия на эукариотические клетки.
1.4 Патологоанатомические и морфологические изменения в органах и тканях животных при отравлении соединениями свинца и кадмия
При остром отравлении животных обнаруживаются признаки истощения. Слизистая оболочка желудка и тонкого кишечника гиперемирована, набухшая, в состоянии катарального воспаления с наличием точечных кровоизлияний и некротических явлений (H.D. Dellmann, 2003).
Печень дряблая, с желтушными оттенками, с кровоизлияниями под капсулой.
Под плеврой, капсулой селезёнки и эпикардом точечные и полосчатые кровоизлияния. Сердечная мышца дряблая, имеет вид варёного мяса, сосуды мозга кровенаполнены (K. S. Ramos et al., 2001).
У птиц наблюдают воспаление слизистой оболочки и некроз железистого желудка и кишечника. Печень дряблая, глинистого цвета, под эпикардом многочисленные кровоизлияния (R. I. Bacalli et al., 2002).
При подостром и хроническом отравлении животных находят катаральное воспаление слизистой оболочки пищеварительного тракта с наличием язв, участков некроза, окрашенных в серый и чёрный цвета. Отмечают сильно выраженную желтушность печени, сморщенную почку, кровоизлияние в сердечной мышце, застойные явления в легочной ткани, анемию органов брюшной полости (G. Lockiteh, 2003).
Соединения свинца и кадмия относят к гепатотоксическим веществам, которые обычно вызывают в организме животных при отравлениях явления печеночной недостаточности, морфологическим субстратом которой служат жировая дистрофия и некроз гепатоцитов (C.R. Elcombe et al., 2005).
В печени при жировой инфильтрации в цитоплазме гепатоцитов сначала появляются отдельные мелкие капли жира, которые по мере накопления перемещаются к центру и сливаются в более крупные капли (крупнокапельное ожирение) и, наконец, в одну большую каплю жира, последняя оттесняет ядро и атрофирующую цитоплазму к периферии клетки, придавая ей перстневидную форму, свойственную клеткам жировой ткани (L. Schneitzer et al., 2006).
При очаговой жировой декомпозиции в печени с распадом ядер возникают участки жирового некроза. В этих случаях вокруг таких очагов развиваются резорбтивные ожирения лейкоцитов и макрофагов соединительной ткани, из которых в процессе фагоцитоза жира образуются липофаги и зернистые шары. Клетки, фагоцитирующие холестерин, приобретают пластинчатую форму (M. Schumacher et al., 2006).
Внешний вид печени при жировой дистрофии существенно изменяется. Жировая инфильтрация перилобулярного типа в сочетании с острой застойной гиперемией придаёт ей мускатный рисунок (G. Lochitch, 2007).
При выраженной жировой дистрофии печень увеличена, желто-коричневого цвета, сальная, дряблая, рисунок долей сглажен (K. Kostial et al., 2007).
При накоплении свинца и кадмия в почках образуются дистрофические изменения, которые могут протекать по типу зернистой и жировой дистрофии (S. P. Andreoli, 2007).
При белковом некрозе процесс локализуется чаще всего в эпителии извитых канальцев и боуменовой капсулы, петлях Генле и прямых канальцах (A. Kesseler et al., 2007).
В качестве основных изменений в канальцах выступают тяжелое зернистое и геалиново-капельное перерождения эпителия. Кроме того, в эпителии канальцев как коркового, так и мозгового слоя контрастно выступает вакуольно-водяночная или гидропическая дистрофия (J. Martel et al., 2008).
Макроскопически почки увеличены, капсула обычно легко снимается, с поверхности светло-серого цвета, консистенция размягчена, граница между корковым и мозговым слоями стерта (D. H. Petering, 2002).
Липоидный нефроз характерен отложением жира в виде капель в протоплазме почечного эпителия, что затем приводит к атрофии ядра и цитоплазмы, гибели активной паренхимы (B.A. Fowler, 2002).
При тяжелых интоксикациях животных липоидный нефроз приводит к увеличению размера почек, утолщается корковый слой (I. Ambrsi et al., 2000).
2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальные исследования проводились в Московском государственном университете прикладной биотехнологии на кафедре незаразных болезней, в лаборатории токсикологии.
Для изучения биологической безопасности мяса цыплят-бройлеров с повышенным содержанием свинца и кадмия были сформированы 3 группы лабораторных крыс в каждой по 10 животных. В рацион крыс в течение двух недель включали мясо цыплят бройлеров, содержащее кадмий и свинец в количестве, превышающем МДУ. Таким образом, крысы получали:
1 группа – контроль;
2 группа – мясо цыплят бройлеров, содержащее соединения свинца в количестве , превышающее МДУ в 1,3 раза.
3 группа – мясо цыплят бройлеров, содержащее соединения кадмия в количестве, превышающее МДУ в 1,2 раза.
В конце эксперимента лабораторные животные были забиты (путем декапитации) и отобраны пробы крови для биохимических исследований и органов для гистологических исследований.
Статистическая обработка полученных результатов проводилась на персональном компьютере с использованием прикладных программ Microsoft Excel и Statgraphics.
Полученный цифровой материал приведён в соответствие с "Международной системой физических величин" (ГОСТ 8471-81).
2.1 Токсикологические методы исследования
Для проведения анализов нами был выбран полярографический метод исследования. Данный метод в течение нескольких десятков лет находит широкое применение в различных лабораториях для определения соединений металлов в пищевых продуктах, в том числе и в аналитической токсикологии. Это объясняется тем, что для проведения анализа требуется значительное количество разбавленного раствора вещества. Данный метод в 1986 г. определен ГОСТ (26932-86 и 26933-86) как основной и является теперь единым для исследования пищевых продуктов и других биоматериалов на наличие в них соединений тяжелых металлов. Исследование органов и тканей на общее содержание свинца и кадмия проводили на полярографе ПЛС-1.
Анализы и исследования, проводимые с помощью полярографа, основаны на регистрации и последующей расшифровке полярограмм (вольт-амперных кривых), представляющих собой зависимость тока, проходящего через электролитическую ячейку от потенциала ртутно-капельного электрода.
Для обеспечения снятия полярограмм в удобном виде для последующей обработки в полярографе имеется возможность выбора различной степени демпфицирования. Запись полярограмм проводили на лабораторном компенсационном двухкоординатном самопишущем приборе. Электролитическая ячейка с раствором, в которой содержится способное восстанавливаться или окисляться на рабочем электроде анализируемое вещество, является нелинейным сопротивлением. Вольтамперная характеристика такой ячейки представляет собой характерную кривую, имеющую форму волны, которую называют полярограммой или полярографической волной.
Данный метод выгодно отличается от других способов анализа, поскольку он позволяет определить несколько токсикоэлементов в одной подготовленной пробе.
Метод определения кадмия и свинца основан на сухой минерализации (озолении) пробы с использованием в качестве вспомогательного средства азотной кислоты и количественном определении кадмия и свинца полярографированием в режиме переменного тока. Основной раствор кадмия готовили путем помещения 1 г. металлического кадмия в коническую колбу на 250 мл и растворяли при нагревании на электроплитке в 25 см разбавленной 1:1 азотной кислоты. Раствор выпаривали на электроплитке со слабым нагревом до объема 3 см3, приливали 15 мл хлористоводородной (соляной) кислоты плотностью 1,19г/см3 и вновь выпаривали до того же объема. Выпаривание повторяли еще два раза, добавляя 50 мл хлористоводородной кислоты. После охлаждения добавляли 50 мл хлористоводородной кислоты, количественно переносили раствор в мерную колбу на 1000 мл и доводили бидистилированной водой до метки. Раствор хранят не более 1 года. Концентрация кадмия в основном растворе равна 1мг/см3.
Стандартные растворы необходимой концентрации готовили последовательным разбавлением в 10, 100, и 1000 раз основного раствора кадмия хлористоводородной кислотой (0,1 мол/дм3).
Для приготовления основного раствора свинца использовали свинца нитрат, перекристаллзованый и высушенный при 104 °С до постоянной массы 1,599 г высушенной соли растворяли в небольшом количестве бидистиллированной воды и количественно переносили в мерную колбу вместимостью 1000 мл. В колбу добавляли 5см3 азотной кислоты плотностью 1,4 г/см3 и доводили объем до метки бидистиллированной водой. Раствор хранят не более 1 года. Концентрация свинца в основном растворе равна 1мг/см3 .
Стандартные растворы необходимой концентрации готовили последовательным разбавлением в 10, 100 и 1000 раз основного раствора свинца хлористоводородной кислотой (0,1 мол/дм3). В ходе исследований проверяли каждую новую партию реактивов.
Контрольные растворы готовили, используя все реактивы и растворы, аналогично приготовлению испытуемого раствора. Если контрольный раствор содержит измеримое количество кадмия или свинца, его готовят при каждой серии измерении.
Для подготовки капилляра электрода, последний помещают в стакан хлористоводородной кислоты (мол/дм3) и проводят сначала накопление в течении 60 с, затем растворение при максимальной скорости развертки (10,0—
10,5 в/с). Процедуру электрохимической очистки повторяют еще 2 раза. Ячейку многократно промывают бидистилированной водой.
Приготовление испытуемого раствора проводили растворением золы, полученной при минерализации в тигле при нагревании на электроплитке с 5 мл разбавленной (1:1) хлористоводородной кислоты. В последующем раствор выпаривали до объема около 1мл, а затем досуха в водяной бане. Осадок растворяли в 15 мл раствора хлористоводородной кислоты. В последующем раствор выпаривали до объема около 1 мл, а затем досуха на водяной бане. Осадок растворяли в 15 мл раствора хлористоводородной кислоты (0,1 моль/дм3) и количественно переносили в стакан электролизера, смывая тигель 5 мл той же кислоты. Для минерализации (озоления) продукты помещали на электроплитку ипроводили обугливание до прекращения выделения дыма, затем тигельпомещали в электропечь при температуре 250°С .
Минерализацию проб проводили постепенно, повышая температуру электропечи на 50°С через каждые 30 мин, и доводя ее до 400°С продолжая минерализацию в этих условиях до получения серой золы.
После изъятия тигля с золой из электропечи последний охлаждали до комнатной температуры, и серую золу смачивали 0,5-1,0 см3 раствора азотной кислоты. Затем кислоту досуха выпаривали на электроплитке со слабым нагревом и снова помещали тигель с пробой в электропечь при температуре 250°С, постепенно доводя температуру до 450°С, и выдерживали 1 час. Минерализация считается законченной, когда зола станет белого или слегка окрашенного цвета, без обугленных частиц.
При наличии обугленных частиц повторяют обработку золы раствором азотной кислоты.
Лабораторную стеклянную посуду промывали хромовой смесью, водой, азотной кислотой, дважды бидистилированной водой и высушивали. Затем промывали раствором дитизона 0,01 г/дм³ и хлороформом и высушивали на воздухе в вытяжном шкафу.
Измерения проводили на полярографе в режиме переменного тока с ртутно-капельным электродом в электролизере вместимостью 5см3. Полярограмму записывали при напряжении от -0,6 до -1,0 относительно донной ртути, выбирая режим работы в соответствии с инструкцией к полярографу.
Прямое полярографирование использовали в тех случаях, когда массовая доля кадмия или свинца в пробе обеспечивает получение четкого пика металла в полярограмме, а состав элементов в золе не создает помех. Для этой цели в две конические колбы вместимостью 10 или 25 см3 помещали 4 см3 контрольного или испытуемого раствора. В первую колбу добавляли 1 см3 соответствующего фонового электролита и пропускали через раствор азот или другой инертный газ в течение 10 минут. Затем раствор немедленно переносили в электролизер, предварительно промытый дистиллированной водой, фоновым электролитом и полярографируемым раствором, полярографировали и измеряли высоту пика токсикоэлемента .
Во вторую колбу вносили добавку - стандартный размер в таком количестве, чтобы высота пика токсикоэлемента на полярограмме, примерно удвоилась, по сравнению с первоначальной. Добавку следует вносить в малом объеме (не более 1 см3 ), чтобы предотвратить изменение концентрации фонового электролита и зольных элементов. Затем в колбу добавляли фоновый электролит в объеме, необходимом для доведения его до 5см3. Пропускали инертный газ, полярографировали в тех же условиях и измеряли высоту пика токсикоэлемента.
Полярографирование с предварительным внесением токсикоэлемента в испытуемый раствор проводили при анализе образцов с низкой массовой долей токсикоэлементов или в тех случаях, когда на полярограмме вследствие помех из-за сложного элементарного состава золы наблюдался только нечеткий изгиб в области пика токсикоэлемента. Для определения в две конические колбы вместимостью 10 или 25 см помещали по 4 см контрольного или испытуемого раствора и добавляли минимальное количество токсикоэлемента (0,2-0,5 мкг), которое обеспечило бы получение на полярограмме четкого пика кадмия или свинца.
Далее поступали так же, как и при прямом полярографировании. Массовую долю токсикоэлемента (X) в мг/кг или массовую концентрацию (X) в мг/дм вычисляли по высоте пиков, измеренных на полярограмме с помощью линейки с погрешностью до 1 мм, соответственно по формулам:
- при прямом полярографировании:
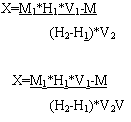
- при полярографировании с предварительным внесением токсикоэлемента:
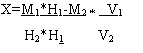
где Н1 - высота пика, полученного при первом полярографировании, мм;
Н2 - высота пика, полученного при втором полярографировании, мм;
V2 - объем испытуемого раствора после внесения добавки, см;
V1- объем испытуемого раствора, приготовленного из озоленной навески, см;
М - масса навески продукта, взятая для озоления, г;
V - объем продукта, взятый для озоления, см;
Хк - масса свинца или кадмия в контрольном растворе, мкг;
M1 - масса токсикоэлемента, добавленная перед вторым полярографированием, мкг; М2 - масса токсикоэлемента, предварительно добавленная для получения четкого пика токсикоэлемента, мкг Мк – масса токсикоэлемента в контрольном растворе, мкг.
2.2 Гистологические методы исследования
Кусочки органов размером 0,5х0,5 см фиксировали в 10% растворе нейтрального формалина в течение 48 часов при комнатной температуре. Срезы изготавливали на санном микротом толщиной 5-7мкм. Окраску срезов проводили гематоксилином Эрлиха с последующее докраской 1 % раствором эозина и судана III на жир. Окрашенные срезы заключали в полистирол. Изучение срезов проводили под световым микроскопом при увеличении в 400 раз
3. Результаты исследований
3.1 Накопление свинца и кадмия в органах крыс
При исследовании наличия химических веществ в биологических объектах, прежде всего, необходимо изучить накопление и распределение их в организме. Это необходимо для того, чтобы можно было судить о материальной кумуляции токсикоэлементов в организме и установлении органа накопителя. Изучение накопления и распределения свинца и кадмия в организме дает возможность проведения корреляции между патологическим процессом в органах, содержанием токсикоэлементов в них и изменением биологических показателей в крови животных.
Скорость всасывания соединений тяжелых металлов, их распределение и токсичность зависит не только от биологических особенностей органов пищеварения, а так же физико–химических свойств всасываемых веществ, взаимодействие их с компонентами пищи и от присутствия в кормах различных добавок.
Как известно, содержание протеина в рационе влияет на всасывание токсикоэлементов в организме животных.
В ходе исследований было установлено, что больше всего свинца накапливается в органах крыс, причем больше всего он накапливается в почках и составляет 11,85 ± 0,12 мг/кг. Если сравнивать с контрольной группой, то содержание свинца увеличивается в 24 раза (Р<0,001).
В печени уровень свинца увеличивается в 15 раза, а в сердце 13 раз и составляет – 7,58 ± 0,67 мг/кг и 5,61 ± 0,47 мг/кг соответственно.
При поступлении в организм крыс соединения кадмия на протяжении двух недель, его уровень также больше всего увеличивается в органах крыс.
Содержание токсикоэлемента составляет: в почках – 0,94 ± 0,21 мг/кг, в печени – 0,71 ± 0,62 мг/кг и в сердце –0,75 ± 0,32 мг/кг, т.е. это количество больше, чем в контрольной группе: в почках в 35,7 (Р<0,001), в печени – 23 раза (Р<0,001) и в сердце – в 28 раз (Р<0,01).
Таблица 1. Содержание свинца и кадмии в органах крыс.
| Органы | Контрольная группа, содержание свинца | Контрольная группа, содержание кадмия | Группа, получавшая мясо, содержащее свинец | Группа, получавшая мясо, содержащее кадмий |
| Почки | 0,48 ± 0,08 | 0,04 ± 0,01 | 11,85 ± 0,12 | 0,94 ± 0,21 |
| Печень | 0,52 ± 0,07 | 0,05 ± 0,01 | 7,58 ± 0,67 | 0,71 ± 0,62 |
| Сердце | 0,43 ± 0,06 | 0,03 ± 0,01 | 5,61 ± 0,47 | 0,75 ± 0,32 |
3.2 Биохимические показатели сыворотки крови крыс
В ходе исследований было установлено, что у крыс, получавших соединения свинца с мясом, количество общего белка в сыворотке крови уменьшается по сравнению с контролем в 1,3 раза и составляет 53,4 ± 0,5 г/л (Р<0,001) (Таблица 1 ).
Содержание белка в сыворотке у крыс, получавших соединения кадмия с мясом составляет 59,7 ± 0,2 г/л, т.е. меньше, чем в контрольной группе в 1,1 раз (Р<0,001). (Таблица 2 ).
Количество альбуминов в сыворотке крови этой группы также уменьшается при поступлении свинца – в 1,2 раза и при поступлении кадмия – 1,1 раз и составляет 31,6 ± 1,3 г/л и 35,5 ± 0,4 г/л соответственно (Р<0,01).
А уровень глобулинов в тоже время увеличивается, при поступлении в организм свинца – в 1,4 раза и при поступлении кадмия – 1,5 раза и составляет 31,1 ± 0,7 г/л и 34,1 ± 0,7г/л соответственно.
За счет увеличения количества глобулина и уменьшения альбумина в сыворотке крови уменьшается и коэффициент А/Г. Если в контрольной группе он составил 1,70, то во 2-ой группе он равен 1,02 и в 3-ой группе – 1,04.
Таблица 2. Биохимические показатели крови крыс
| Показатели |
1группа контроль |
Группа, получавшая мясо, содержащее свинец | Группа, получавшая мясо, содержащее кадмий |
| Общий белок, г/л | 68,2±0,5 | 53,4±0,5 | 59,7 ± 0,2 |
| Альбумин, г/л | 37,1±0,3 | 31,6±1,3 | 35,5 ± 0,4 |
| Глобулин, г\л | 21,8±0,6 | 26,5±0,09 | 24,2 ± 0,1 |
| Коэффициент А/Г | 1,70 | 1,19 | 1,46 |
| Глюкоза, ммоль/л | 5,76±0,04 | 3,38±0,16 | 4,49 ± 0,13 |
| Общий биллирубин, ммоль/л | 3,70±0,62 | 8,78±0,14 | 11,80 ± 1,14 |
| Холестерин, мкмоль/л | 11,10±0,01 | 12,20±0,33 | 14,7 ± 0,14 |
| АсАТ, ммоль/л | 1,13±0,07 | 1,76±0,09 | 1,62 ± 0,04 |
|
АлАТ, ммоль/л |
0,55±0,02 | 1,09±0,08 | 0,98 ± 0,01 |
| Щелочная фосфатаза, ммоль/л | 1,08±0,03 | 3,09±0,04 | 4,11 ± 0,01 |
Таким образом, при поступлении в организм крыс соединений свинца и кадмия с мясом уровень белка в сыворотке крови уменьшается в 1,3 раза и 1,1 раз, альбумина – в 1,2 и 1,1 раз, а количество глобулина увеличивается в 1,4 и 1,5 раз соответственно.
Проведенные нами исследования по определению показателей безазотистых органических компонентов показали, что в cыворотке крови крыс, получавших соединение свинца, уровень холестерина увеличился в 1,1 раз и составил 12,20 ± 0,33 мкмоль/л (Р<0,01), а у крыс, получавших соединения кадмия – в 1,32 раза и составил 14,7 ± 0,14 мкмоль/л (Р<0,001).
Наблюдается уменьшение количества глюкозы в сыворотке крови крыс при поступлении в организм кадмия и составило: в 3-ей группе – 4,49 ± 0,13 ммоль/л т.е. произошло уменьшение в 1,28 раз (Р<0,001), в 1,15 раз (Р<0,01), и в 1,02 раза (Р<0,01) соответственно
Причиной или следствием различных патологических состояний является нарушение нормального функционирования ферментных процессов. В ходе исследований была определена активность следующих ферментов: аспарагиновой аминотрансферазы (АсАТ), аланиновой аминотрансферазы (АлАТ) и щелочной фосфатазы.
При поступлении в организм крыс соединений свинца с мясом происходит увеличение показателей ферментов сыворотки крови: щелочной фосфатазы в 2,86 раз, АсАТ – в 1,56 раз, АлАТ – в 1,98 раз и составляет 3,09 ± 0,04 ммоль/л, 1,76 ± 0,09 ммоль/л, 1,09 ± 0,08 ммоль/л соответственно (Р<0,001). При этом коэффициент де – Ритиса также уменьшился и равнялся 1,61.
Аналогичные данные были получены и в опытных группах крыс, получавших с рационом соединения кадмия.
Таким образом, увеличение показателей ферментов при интоксикации крыс соединениями свинца и кадмия указывает на патологические изменения в организме.
3.3 Морфологические изменения в органах крыс при поступлении в организм мяса цыплят-бройлеров, содержащего свинец и кадмий
При проведении гистологических исследований необходим самый тщательный анализ морфологических изменений в органах, а затем обобщение наблюдаемых изменений в их взаимосвязи.
Изучая динамику морфологических изменений при различных заболеваниях, сопоставляя эти изменения с функциональными проявлениями болезни, патологическая морфология дает возможность раскрыть механизм болезней, ее патогенез.
Для изучения токсического действия соединения свинца и кадмия на организм крыс нами были проведены гистологические исследования печени, почек, сердца и легких в 3-х группах животных. Одна из исследуемых групп была контрольной.
При исследовании внутренних органов крыс контрольной группы установлено, что печень имеет характерное дольчатое строение (рис.1). Печеночные дольки окружены соединительнотканной прослойкой. На периферии дольки располагаются триоды, состоящие из междолькового желчного протока, междольковых артерий и вен.
Гепатоциты формируют четко выраженные радиально лежащие балки, между которыми находятся умеренные кровенаполненные венозные синусы. Венозные синусоиды в центре долек формируют центральную вену с четко выраженным просветом. Гепатоциты многогранной формы, содержат 1 – 2 ядра, цитоплазма клеток равномерна окрашена.
Паренхима почек состоит из четко выраженного периферического коркового вещества и внутреннего мозгового (Рис. 2 ). В состав коркового вещества входят имеющие характерные структуру почечные тельца, состоящие из клубочков капилляров, капсулы клубочка и извитых канальцев (проксимальных и дистальных), а в состав мозгового – прямые канальцы. Проксимальные канальцы имеют диаметр около 60 мкм, полость его варьирует от узкой щели до широкого округлого просвета. Эпителий проксимальных канальцев состоит из одного ряда кубических клеток с равномерно окрашенной цитоплазмой. Ядра округлой формы с четко выраженной хроматиновой структурой. Дистальные канальцы имеют диаметр 35 мкм, выстланы кубическим эпителием, просвет округлый, хорошо выражен.
Собирательные трубочки мозгового слоя выстланы кубическим или призматическим эпителием. Клетки светлые, границы клеток четко выражены.
Легкие – органы дыхания, состоят из имеющих характерное строение воздухоносных путей и респираторного отдела (Рис. 3 ). Стенки бронхов среднего калибра покрыты однослойным многорядным реснитчатым эпителием или однослойным однорядным мерцательным, в бронхах малого калибра. Собственный слой слизистой оболочки состоит из рыхлой соединительной ткани. Мышечной слой слизистой формируется слоем гладких мышечных клеток ориентированных по спирали. Подслизистая основа сформирована из рыхлой соединительной ткани и включает в свой состав концевые отделы слизисто – белковых желез. Фиброзно-хрящевая оболочка бронхов среднего калибра, характеризуется обширными хрящевыми пластинками, которые в бронхах малого калибра полностью отсутствуют.
Респираторные бронхиолы распадаются на альвеолярные ходы, которые, ветвясь, заканчиваются альвеолярными мешками, состоящими из совокупности респираторных альвеол. Альвеолы выстланы однослойным эпителием, расположенным на базальной мембране. Интерстициальная ткань легкого сопровождают умеренно кровенаполненые кровеносные сосуды и воздухоносные пути, она разграничивает доли и дольки паренхимы органа, ее элементы выявляются в составе долек органа, в стенках альвеол и ходов альвеол.
Для соединительной ткани сопровождающей бронхи, характерны скопление лимфоидной ткани, формирующей по ходу бронхиального дерева лимфоидные узелки.
При исследовании сердца установлено, что эпикард и эндокард имеют свойственное строение (Рис. 4 ).
Основная часть миокарда, рабочая сердечная ткань, сформирована из миоцитов, прочно соединенных своими концами и образующих многочисленные анастомозы. Зоны контакта миоцитов имеют вид одиночных темноокрашенных прямолинейных или ступенчатых полосок, расположенных перпендикулярно длины оси клеток. Миоциты содержат 1-2 светлых ядра овальной формы, имеющих центральное расположение. Поперечная исчерченность, обусловленная строением миофибрилл, отчетливо выражена. Миоциты окружены тонковолокнистой соединительной тканью (эндомизий миокарда), содержащие многочисленные умеренно кровенаполненые капилляры, обеспечивающие процессы микроциркуляции.
Атипичные миоциты (проводящие) более светлые, имеют неправильную форму и поперечный диаметр в 2-3 раза больше, чем диаметр сократительных миоцитов.
При скармливании крысам мяса цыплят-бройлеров, содержащего свинец, установлено, что структура печени неоднородна (Рис. 5). Наряду с сохранившими нормальное строение дольками, в паренхиме печени обнаруживаются очаги с выраженной зернистой дистрофией, с признаками дистрофического ожирения и участками некроза, наиболее выраженных в дольках с нарушенным балочного строения.
В качестве основных изменений в структуре почек на первый план выступает зернистая дистрофия основной массы эпителия извитых канальцев, петель Генли и собирательных трубочек, а также очаговый некроз эпителия канальцев (Рис.6).
Поражение интерстициальной ткани имеет характер отдельных более или менее многочисленных очагов, разбросанных среди нормальной ткани.
В миокарде (Рис.7) отмечается наличие кровоизлияний, гиперемия сосудов, умеренная очаговая зернистая дистрофия.
В легких (Рис. 8) отмечается гиперемия сосудов. Междольковые и межальвеолярные перегородки расширены. Альвеолы заполнены воздухом и жидкостью, содержащей незначительное количество белковых веществ и клеточных элементов.
При скармливании крысам мяса цыплят-бройлеров, содержащего свинец, установлено, что в печени (Рис. 9 ) гепатоциты в состоянии умеренной зернистой или очаговой жировой дистрофии, балочное строение долек печени сохранено, венозные синусы расширены, гепатоциты несколько набухшие с мутноватой цитоплазмой, ядра сохранены, контуры их сглажены. В отдельных дольках обнаруживаются группы клеток, в цитоплазме которых выявляются жировые капли различной величины.
Наряду с отмеченными изменениями на периферии отдельных долек отмечаются гепатоциты в состоянии некроза.
В качестве основных изменений в структуре почек (Рис. 10) на первый план выступает зернистая дистрофия основной массы эпителия извитых канальцев, петель Генли и собирательных трубочек, а также очаговый некроз эпителия канальцев. Поражения интерстициальной ткани имеет характер отдельных очагов. В миокарде (Рис.11) сосуды гиперемированы, поперечная исчерченость ослаблена в отдельных участках мышцы. Отмечается умеренная зернистая дистрофия. В легких (Рис. 12) отмечается гиперемия сосудов. Междольковые и межальвеолярные перегородки несколько расширены, альвеолы заполнены воздухом и жидкостью, содержащей незначительное количество белковых веществ и клеточных элементов.
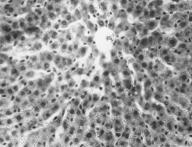
Рисунок 1. Печень. Группа № 1 (контроль)
Печень имеет характерное дольчатое строение. Гепатоциты формируют четко выраженные, радиально лежащие балки. (Увел.400).
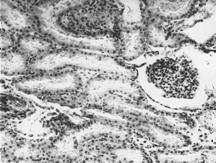
Рисунок 2. Почки. Группа № 1 (контроль). Паренхима органа состоит из четко выраженного периферического коркового вещества и мозгового слоя. (Увел.400).

Рисунок 3. Сердце. Группа № 1 (контроль).
Эпикард и эндокард имеет свойственное им строение (Увел. 400).
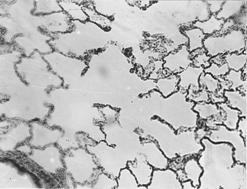
Рисунок 4. Легкие. Группа № 1 (контроль)
Имеют характерное строение воздухоносных путей и респираторного отдела. (Увел. 400).
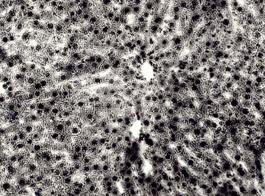
Рисунок 5. Печень. Группа № 2 .
В паренхиме обнаруживаются очаги выраженной зернистой дистрофии с признаками дистрофического ожирения и участками некроза (Увел.400).
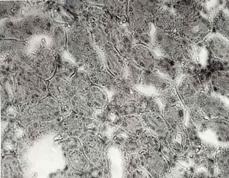
Рисунок 6. Почки. Группа № 2
Зернистая дистрофия основной массы эпителия извитых канальцев (Увел. 400).
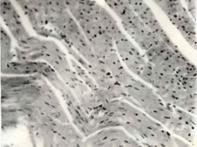
Рисунок 7. Сердце. Группа № 2
В миокарде отмечается наличие кровоизлияний, гиперемия сосудов, умеренная очаговая зернистая дистрофия (Увел.400).
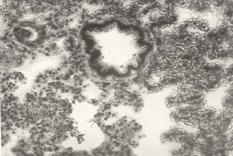
Рисунок 8. Легкие. Группа № 2
Гиперемия сосудов. Альвеолы заполнены воздухом и жидкостью, содержащей белковые вещества и клеточные элементы (Увел.400).
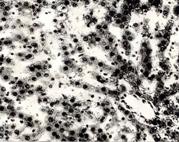
Рисунок 9. Печень. Группа № 3
В клетках печени обнаруживается наличие дистрофического ожирения с признаками зернистой дистрофии. В пораженных участках долек гепатоциты увеличены (Увел.400).
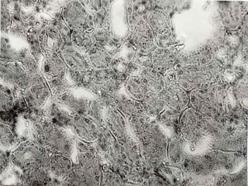
Рисунок 10. Почки. Группа № 3
Изменения структуры почек носят очаговый характер. Некротические изменения выражены в меньшей степени и носят менее распространенный характер (Увел.400).

Рисунок 11. Сердце. Группа № 3
В миокарде гиперемия сосудов, умеренная зернистая дистрофия (Увел.400).
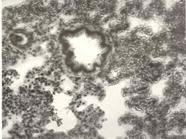
Рисунок 12. Легкие. Группа № 3
Кровеносные сосуды инъецированы. Междольковые перегородки расширены (Увел.400).
Заключение
Актуальной проблемой обеспечения экологически чистого питания населения является максимально возможная безопасность пищевых продуктов, которые могут являться источником и носителем большого числа потенциально опасных и токсичных веществ.
Поэтому изучение влияния свинца и кадмия на безопасность мяса цыплят-бройлеров при накапливании в нём токсикоэлементов является весьма актуальным.
Свинец - и кадмийсодержащие соединения поступали крысам в составе мяса цыплят-бройлеров в течение двух недель.
В ходе исследований было установлено, что больше всего свинца накапливается в органах крыс, причем больше всего он содержится в почках и составляет 11,85 ± 0,12 мг/кг. Если сравнивать с контрольной группой, то содержание свинца больше в 24 раза (Р<0,001).
В печени уровень свинца больше в 15 раза, а в сердце 13 раз и составляет – 7,58 ± 0,67 мг/кг и 5,61 ± 0,47 мг/кг соответственно.
При поступлении в организм крыс соединения кадмия на протяжении двух недель, его содержание также больше всего увеличивается в органах крыс.
Содержание токсикоэлемента составляет: в почках – 0,94 ± 0,21 мг/кг, в печени – 0,71 ± 0,62 мг/кг и в сердце –0,75 ± 0,32 мг/кг, т.е. это количество больше, чем в контрольной группе: в почках в 35,7 (Р<0,001), в печени – 23 раза (Р<0,001) и в сердце – в 28 раз (Р<0,01).
При поступлении в организм крыс соединений свинца и кадмия с мясом происходит увеличение показателей ферментов сыворотки крови (аспарагиновой аминотрансферазы (АсАТ), аланиновой аминотрансферазы (АлАТ) и щелочной фосфатазы), что указывает на патологические изменения в организме.
При скармливании крысам мяса цыплят-бройлеров, содержащего свинец в органах выявлены патологические изменения: дистрофия паренхиматозных клеток печени; в почках - жировая инфильтрация с преимущественным поражением прямых канальцев, которая сочетается с умеренной зернистой дистрофией; в миокарде отмечается гиперемия сосудов, очаговое кровоизлияние, зернистая дистрофия миоцитов; в легких обнаруживается гиперемия кровеносных сосудов, бронхиальный эпителий в состоянии слизистой дистрофии, десквамирован.
При скармливании крысам мяса цыплят-бройлеров, содержащего кадмий, в органах выявлены патологические изменения: в клетках печени обнаруживается наличие дистрофического ожирения с признаками зернистой дистрофии. В пораженных участках долек гепатоциты долек гепатоциты увеличены. Изменения структуры почек носят очаговый характер. Некротические изменения выражены в меньшей степени и носят менее распространенный. В миокарде гиперемия сосудов, умеренная зернистая дистрофия. В лёгких - кровеносные сосуды инъецированы. Междольковые перегородки расширены.
Выводы
1) При поступлении в организм крыс соединений свинца и кадмия на протяжении двух недель, их уровень больше всего увеличивается в органах крыс, особенно в почках.
2) При поступлении в организм крыс мяса цыплят-бройлеров, содержащее соединения свинца и кадмия происходит увеличение показателей ферментов сыворотки крови (аспарагиновой аминотрансферазы (АсАТ), аланиновой аминотрансферазы (АлАТ) и щелочной фосфатазы), что указывает на патологические изменения в организме.
3) В органах крыс выявлены патологические изменения: дистрофия паренхиматозных клеток печени; в почках - жировая инфильтрация с преимущественным поражением прямых канальцев, которая сочетается с умеренной зернистой дистрофией; в миокарде отмечается гиперемия сосудов, очаговое кровоизлияние, зернистая дистрофия миоцитов; в легких обнаруживается гиперемия кровеносных сосудов, бронхиальный эпителий в состоянии слизистой дистрофии, десквамирован.
Практические рекомендации
1) Для проведения оценки биологической безопасности мяса птицы при отравлениях тяжёлыми металлами рекомендуется проводить исследования на лабораторных животных. Результаты оценивать по изменению внутренних органов.
2) Контроль содержания в мясе тяжёлых металлов надо проводить непосредственно при убое птицы, с учётом выявленных признаков отравления.
3) Мясо, содержащее тяжёлые металлы выше МДУ, направлять на проварку, с целью снижения уровня вредных веществ.
СПИСОК ЛИТЕРАТУРЫ
1. Антонович Е.А., Седокур Л.К. Качество продуктов питания в условиях химизации с/х Справочник.-К. Урожай, 1990-240с.
2. Азаров В.Н., Виноградова B.C. Основы микробиологии и пищевой гигиены -М.:Экономика, 1977-190с.
3. Базлов В.Н., Лысак Г.Н.,Полуторнова Т.И. Охрана природы и инженерная защита окружающей среды в пищевой промышленности,-М.;Легкая и пищевая промышленность, 1933-208с.
4. Бандман А.П., Волкова Н.В., Грекова Т.Д. и др. Вредные химические вещества. Неорганические соединения V-VIII групп. Справочное изд. Химия,1989-592с.
5. Бачинский Г.А. Социоэкология: теоретические и прикладные аспекты.-К.Наукова думка, 1991-160с
6. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. М. Издательство "Медицина" 1998, с543-704.
7. Березин И.В., Савин Ю.В. Основы биохимии Учебное пособие -М, Издательство Московского университета, 1990,-253с.
8. Богуш А.А. Ветеринарно-санитарная и биологическая характеристика мяса при содержании тяжелых металлов. Минск, 1996,вып. 32, с 208-213.
9. Бортникова Д.К. Физиология и биохимия с/х. Птицы - М. ,1969,72с
10. Вейзенен Г. Савин В. Тяжелые металлы в кормах и продуктах животноводства (комбикормовая промышленность). 1996,№7,с22-24.
11. Волков И.Б., Ковалев В.Д. Остаточные количества химических веществ в продуктах животного происхождения (Ветеринария) 1994 №4 с 42-44.
12. Габович Р. Д. Припутина Л. С. Гигиенические основы охраны продуктов питания от вредных химических веществ , Здоровье ,1987-248с.
13. Гадаскина Н.Д., Толоконцев Н.А. Яды- вчера и сегодня: Очерки по истории ядов- и.Наука,1988-205с
14. Донченко Л.В., Надыкина В.Д. Безопасность пищевого сырья и продуктов питания-М: Пищепромиздат, 1999,350с.
15. Жвиблярская А. Ю. Основы микробиологии, санитарии и гигиены в пищевой промышленности - М: Пищевая промышленность 1977.-206с.
16. Журавская Н.К., Гутник Б.Е., Журавская Н.А., "Технологический контроль производства мяса и мясопродуктов" -М: Агропромиздат, 1985-296с.
17. Заяс Ю.Ф. Качество мяса и мясопродуктов. -М .: 1903-368с.
18. Зигель X., Зигель А., Некоторые вопросы токсичности ионов металлов - М.: Мир, 1993-368с.
19. Киприянов Н. Н. Контроль содержания тяжелых металлов при оценке качества сырья и пищевых продуктов. ( Обзорная информация. Серия 18 .Консервная овощесушильная и пищеконцентратная промышленность.-М.: АгроНИИТЭИПП,1990,Вып 1-29с.
20. Киприянов Н.А. Состояние и перспектива контроля соединений тяжелых металлов в пищевой воде, сырье,пищевых продуктах и атмосферном воздухе. (Обзорная информация.Серия 14. Обзоры по информацыонному обеспечению. Общесоюзный н-т программ. -М.: АгроНИИТЭИПП , 1991 ,Вып.2-31 с.
21. Киприянов Н.А.,Устюгов Г.П., Фролова С.С. Контроль содержания тяжелых металлов при оценке качества сырья в пищевых продуктах. (Обзорная информация. Серия 14 ) Обзоры по информацыонному обеспечениюн-т программ.-М.: АгроНИИТЭИПП, 1990,Вып. 1 -29с.
22. Клесов А.А. ,Рабинавич М.Л. и др. II Биоорганическая химия.-1980-т.6.-№8.-с1225-2242.
23. Кнорс Д.Г.,Мизина С.Д. Биологическая химия. М; Высшая школа 1998 480 с.
24. КормилицынВ. И. , Цлукишвилли М.С., Япамов Ю. И. Основы экологии.-М.: Колос, 1995-271 с
25. Крамаренко В.Ф. Токсикологическая химия Киев, ИО. "Высшая школа", 1989.
26. Ленинджер А.А. Основы биохимии. Т. 1-3-М. Высшая школа. 1989-495.
27. Ливчак И.Ф., Воронов Ю.В., Стрелков Т. В. Охрана окружающей среды. -М.: Колос, 1995-271С.
28. Малина В.П. Свинец .-М.: Наука, 1986-357С.
29. Медико-биологические требования и санитарные нормы качества продовольственного сырья и пищевых продуктов. -М.: Издательство стандартов 1990-185с.
30. Николаев А.Я. Биологическая химия, М. : Высшая школа. 1989-495с.
31. Овчинников Ю.А. Биоорганическая химия .М.: Просвещение, 1987.
32. Полянский Н.Г. Свинец.-М.:Наука, 1986-357с.
33. Страйдер Л. Биохимия.Т. 1-3.-М: Мир, 1984.
34. Сырье и продукты пищевые .Методы определения токсичных элементов. -М. Издательство стандартов, 1994-127с.
35. Тутельи В.А., Бондарев г.и., Мартинчик А.А. Питание и процессы биотрансформации чужеродных веществ. Итоги науки и техники. Токсикология. М.: ВИНИИТИ,1983- 128с.
36. Уша Б.В. ,Кузин В. С.,Жавнис С.Э., Филатова Г.В. Биохимические исследования крови у с\х животных II Методические указания МТИМНП.-М.1987-ЗЗс.
37. Экология и безопасность. Справочник .-В 3-х томах -М: ВНИИПИ,1992.