Курсовая работа: Методы получения наночастиц
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ТОМСКИЙ ГОСУДАРСТВЕННЫЙ ПЕДАГОГИЧЕСКИЙ УНИВЕРСИТЕТ» (ТГПУ)
Биолого-химический факультет
Кафедра неорганической химии
Методы получения наночастиц
Курсовая работа
Выполнила: студентка 152 гр
Божко П.В
Томск-2008 г.
Содержание
Введение
1. Общие сведения о методах получения наночастиц
2. Получение наночастиц в газовой фазе
2.1 Получение наночастиц в процессе «испарение – конденсация»
2.2 Газофазное получение наночастиц
2.3 Получение наночастиц с помощью топохимических реакций
2.4 Сверхзвуковое истечение газов из сопла
2.5 Термолиз
2.6 Термическое разложение и восстановление
3. Получение наночастиц в жидкой фазе
3.1 Химическая конденсация
3.2 Осаждение в растворах и расплавах
3.3 Золь-гель метод
3.4 Электрохимический метод получения наночастиц
4. Получение наночастиц с использованием плазмы
4.1 Плазмохимический синтез
4.2 Электроэрозионный метод
4.3 Ударно-волновой или детонационный синтез
5. Механохимический синтез
6. Биохимические методы получения наноматериалов
7. Криохимический синтез
7.1 Основные процессы криохимической нанотехнологии
7.1.1 Приготовление и диспергирование растворов
7.1.2 Замораживание жидких капель
7.1.3 Сублимация
7.1.4 Десублимация
Заключение
Список литературы
Введение
Изучение наноструктур интенсивно началось примерно двадцать лет назад, и уже занимает определенное место в сфере применения. Хотя слово нанотехнология является относительно новым, устройства и структуры нанометровых размеров не новы. На самом деле они существуют на Земле столько же, сколько существует сама жизнь.
Нанотехнология — это область науки и техники, связанная с разработкой устройств размером порядка нанометра (одной миллиардной доли метра), т. е. устройств, составляющих от нескольких десятков до нескольких тысяч атомов. Основное назначение таких устройств — работать с отдельными атомами и молекулами (межатомные расстояния в биологических молекулах измеряются десятыми долями нанометра). Импульс развитию нанотехнологии дало создание сканирующего туннельного микроскопа — устройства, позволяющего исследовать вещество на атомном уровне ("видеть" атомы) и перемещать отдельные атомы. За это изобретение в 1986 году была присуждена Нобелевская премия.
Так как нанохимия включает в себя множество разделов, и охватить их все в курсовой работе невозможно, я остановлюсь на разделе: методы получения наночастиц.
Таким образом, целью данной курсовой работы является обобщение литературных данных о способах получения наночастиц, и далее будут рассмотрены самые распространенные из них.
1. Общие сведения о методах получения наночастиц
Наиболее общей кинетической закономерностью формирования наноразмерных частиц является сочетание высокой скорости зарождения кристаллической фазы с малой скоростью ее роста. Именно эти особенности синтеза наночастиц определяют технологические пути его осуществления.
Все методы получения наночастиц можно разделить на две большие группы. Первая объединяет способы, позволяющие получать и изучать наночастицы, но на основе этих методов трудно создавать новые материалы. Сюда можно отнести конденсацию при сверхнизких температурах, некоторые варианты химического, фотохимического и радиационного восстановления, лазерное испарение.
Вторая группа включает методы, позволяющие на основе наночастиц получать наноматериалы. Это в первую очередь различные варианты механохимического дробления, конденсация из газовой фазы, плазмохимические методы и др.
Такое разделение методов является относительно условным. Но отражает еще одну их особенность: получение частиц путем укрупнения отдельных атомов и агрегации, или подход «снизу», и различные варианты диспергирования, или подход «сверху». Первый подход характерен в основном для химических методов получения наноразмерных частиц, второй для физических методов. Получение наночастиц путем укрупнения атомов позволяет рассматривать единичные атомы как нижнюю границу нанохимии. Верхняя граница определяется количеством атомов в кластере, при котором дальнейшее увеличение размера частицы не ведет к качественным изменениям химических свойств.
2. Получение наночастиц в газовой фазе
2.1 Получение наночастиц в процессе «испарение – конденсация»
В газовой фазе наиболее часто проводят следующие процессы: испарение - конденсация (испарение в электрической дуге и в плазме); осаждение; топохимические реакции (восстановления, окисления, разложение частиц твердой фазы).
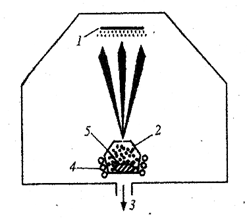
Рис. 1 Схема получения нанопорошков в процессе испарение – конденсация
В процессе «испарение - конденсация» жидкие или твердые вещества испаряют при контролируемой температуре в атмосфере инертного газа низкого давления с последующей конденсацией пара в охлаждающей среде или на охлаждающих устройствах (рис. 1). Этот способ позволяет получать частицы размером от двух до нескольких сотен нанометров. Наночастицы с размером менее 20 нм обычно имеют сферическую форму, а у более крупных может появляться огранка.
Обычно испаряемое вещество 5 помещают в нагревательную камеру 2 с нагревателем 4 и отверстием (диафрагмой), через которое испарившиеся частицы вещества попадают в вакуумное пространство (с давлением около 0,10–0,01Па), где происходит формирование молекулярного пучка. Частицы, двигаясь практически прямолинейно, конденсируются на охлаждаемой подложке 1.Откачка газа из аппарата осуществляется через клапан 3.
Если проводить испарение вещества в режиме, когда нет столкновения между частицами в пространстве диафрагмы, то длина свободного пробега частицы лч>dд (здесь dд - диаметр диафрагмы). Истечение пучка частиц из нагревательной камеры будет эффузионное; интенсивность пучка J, частиц/(см2·с), на расстоянии r от источника.
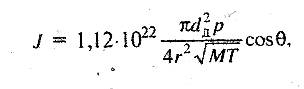
Где p – давление; М – молекулярная масса; Т – температура источника тепла;Ө - угол между направлением пучка и нормалью к плоскости отверстия.
Как видно из выражения, интенсивность пучка ~ 1/r2, то есть распределение распыляемых частиц в пространстве приблизительно такое же, как и для источника. Другими словами, испускаемые частицы распространяются в вакууме по законам геометрической оптики.
Молекулярные пучки, получаемые при эффузионном истечении испаряющихся частиц, обладают малой интенсивностью порядка J=1012 – 1014 частиц/(см2·с). Температуру источника выбирают в зависимости от требуемой интенсивности молекулярного пучка и равновесного давления над испаряемым материалом. Она может быть выше или ниже температуры плавления вещества.
Необходимо отметить, что некоторые вещества (например, Sn и Ge) испаряются как в виде отдельных атомов, так и в виде малых кластеров. В молекулярных пучках малой интенсивности, получаемых при эффузионном истечении через отверстие в нагревательной камере, наблюдается равномерное распределение кластеров малых размеров.
Основным достоинством метода молекулярных пучков является возможность достаточно точно регулировать интенсивность пучка и управлять скоростью подачи частиц в зону конденсации [2].
2.2 Газофазное получение наночастиц
Метод молекулярных пучков малой интенсивности часто комбинируют с химическими способами осаждения. Осаждение осуществляют вблизи холодной поверхности аппарата или непосредственно на ней при контролируемой температуре и пониженном давлении для уменьшения вероятности столкновения частиц.
Для газофазного получения наночастиц применяются установки, различающиеся способами подвода и нагрева испаряемого материала, составом газовой среды, методами осуществления процесса конденсации и отбора получаемого порошка. Например, порошок осаждают на охлаждаемый вращающийся цилиндр или барабан и счищают с него скребком в приемную емкость.
Схема конструкции аппарата для газофазного синтеза металлических нанопорошков включает (рис. 2) рабочую камеру 1, охлаждаемый барабан 2, скребок 3, воронку 4, приемную емкость для порошка 5, нагреваемый трубчатый реактор 6, устройство 7 для регулируемой подачи испаряемого материала и несущего газа. В трубчатом реакторе 6 испаряемый материал смешивают с несущим инертным газом и переводят в газофазное состояние.

Рис. 2 Схема аппарата для газофазного синтеза металлисеских нанопорошков
Полученный непрерывный поток кластеров или наночастиц поступает из реактора в рабочую камеру 1 аппарата, в которой создается давление порядка 1 – 50 Па. Конденсация наночастиц и осаждение их в виде порошка происходит на поверхности охлаждаемого вращающегося барабана 2. с помощью скребка 3 порошок удаляют с поверхности барабана; затем он через воронку 4 поступает в приемную емкость 5 и направляется на дальнейшую переработку.
В отличие от испарения в вакууме, атомы вещества, испаренного в разреженной атмосфере, быстрее теряют кинетическую энергию из-за столкновения с атомами газа и образуют зародыши кристаллов (кластеры). При их конденсации образуются Нанокристаллические частицы. Так в процессе конденсации паров алюминия в среде водорода, гелия и аргона при различных давлениях газов получают частицы размером 100-20 нм.
2.3 Получение наночастиц с помощью топохимических реакций
С помощью топохимических реакций определенных газовых сред с металлическими наночастицами в момент их конденсации из паровой фазы можно получать наночастицы желаемых соединений. Для получения требуемого соединения взаимодействие испаряемого металла с газом-реагентом можно обеспечивать и непосредственно в газовой фазе.
В методе газофазных химических реакций синтез наноматериалов происходит за счет химических превращений, протекающих в атмосфере паров легколетучих веществ. Газофазные химические реакции можно разделить на реакции разложения, протекающие с участием одного реагента по схеме
![]() А В + С,
А В + С,
И реакции между двумя и более реагентов по схеме
![]() А + В С + D
А + В С + D
Необходимым условием протекания первого типа химических реакций является существование реагента, содержащего все элементы конечного продукта. Поэтому второй тип газофазных реакций находит более широкое распространение.
При проведении газофазных химических реакций исходные реагенты должны быть легколетучими. В качестве исходных реагентов широко используются галогениды (особенно хлориды металлов), оксихлориды металлов MeOnClm, алкооксиды Me(OR)n, алкильные соединения Me(R)n, пары металлов и так далее. Этим методом можно получать наноматериалы бора, газовой сажи, металлов, сплавов, нитридов, карбидов, силицидов, сульфидов и других соединений.
При синтезе наноматериалов рассматриваемым методом на свойства получаемых продуктов в значительной степени оказывают влияние конструкции реакторов, метод нагревания реагентов, температурный градиент в ходе проведения процесса и ряд других факторов.
Газофазные химические реакции обычно проводят в различного типа трубчатых проточных реакторах. Наибольшее распространение получили реакторы с внешним нагреванием реакционной зоны. В качестве конструкционных материалов реакционной зоны аппаратов используют соединения кварца, керамические материалы или глинозем.
Топохимическое взаимодействие газовой фазы с порошком применяют для нанесения на его частицы различных покрытий и введения модифицирующих добавок. При этом необходимо регулировать степень неравномерности процесса так, чтобы твердая фаза выделялась только на поверхности частиц, а не в объеме между частицами. Например, к топохимическим реакциям можно отнести взаимодействие оксидов с азотом в присутствии углерода для синтеза нитридов. Таким способом синтезируют порошки нитридов кремния, алюминия, титана и циркония.
Состав инертного газа влияет на скорость роста частиц. Более тяжелые атомы окружающей среды интенсивнее отбирают энергию от конденсируемых атомов и этим способствуют росту частиц, так же как понижение температуры охлаждения тоже способствуют росту частиц. Меняя в аппарате давление газа и состав газовой среды, можно получать наночастицы различного размера. Так, замена гелия на аргон или ксенон в несколько раз увеличивает размер получаемых наночастиц.
Получению нанопорошков в газовой фазе способствует относительно низкое поверхностное натяжение на границе твердое тело – газ; увеличение поверхностного натяжения приводит к уплотнению наночастиц в агрегате. В то же время высокая температура ускоряет диффузионные процессы, что способствует росту частиц и образованию твердотельных мостиков между частицами. Главная проблема рассматриваемого способа заключается в отделении наночастиц от газовой фазы в условиях, когда концентрация частиц в газовом потоке мала, а температура газа достаточно высокая. Для улавливания наночастиц применяют специальные фильтрующие устройства (например, металлокерамические фильтры, электрофильтры), центробежное осаждение твердых частиц в циклонных аппаратах и гидроциклонах, специальные газовые центрифуги.
2.4 Сверхзвуковое истечение газов из сопла
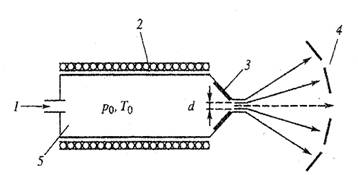
Рис. 3. Схема сверхзвукового истечения частиц из сопла
Молекулярные пучки большой интенсивности, когда J~1016 – 1018 частиц/ (см2·с), и с более низкой температурой по сравнению с эффузионными источниками можно получать с помощью сверхзвукового истечения из сопла. Образующийся в источнике относительно плотный горячий пар вещества 1 (рис 3.) термостатируется в камере торможения 5, где с помощью нагревателя 2 поддерживаются давление Р0 и температура Т0, и выпускается через сопло 3 с диаметром d~1 мм в вакуум или буферный газ. В результате образуется расширяющийся пучок частиц с малым углом расхождения. Тепловая энергия потока горячего газа или пара в камере торможения трансформируется в кинетическую энергию сверхзвукового потока. Сформировавшийся поток движется в направлении от плоскости среза сопла к подложке 4 и расширяется, что приводит к его охлаждению. В результате охлаждения газ превращается в пересыщенный пар, внутри которого могут зарождаться кластеры, содержащие от 2-106 атомов [2].
2.5 Термолиз

Рис. 4. Установка для получения наночастиц металла путем термического разложения твердого вещества, содержащего катионы металла, молекулярные анионы или металлорганические соединения
Наночастицы могут образовываться в результате разложения при высокой температуре твердых веществ, содержащих катионы металлов, молекулярные анионы или металлорганические соединения. Такой процесс называется термолизом. Например, малые частицы лития можно получить разложением азида лития LiN3. Вещество помещается в откачанную кварцевую трубку и нагревается до 400оC в установке, показанной на рис. 4. При температуре около 370оС азид разлагается с выделением газообразного N2, что можно определить по увеличению давления в вакуумированном пространстве. Через несколько минут давление падает до первоначального уровня, показывая, что весь N2 удален. Оставшиеся атомы лития объединяются в маленькие коллоидные металлические частицы. Таким методом можно получить частицы с размерами менее 5 нм. Частицы можно пассивировать, вводя в камеру соответствующий газ.
2.6 Термическое разложение и восстановление
В процессах термического разложения обычно используют сложные металлорганические соединения, гидроксиды, карбонилы, формиаты, нитраты, оксалаты, амиды и амиды металлов, которые при определенной температуре распадаются с образованием синтезируемого вещества и выделением газовой фазы.
Например, пиролизом формиатов железа, кобальта, никеля, меди в вакууме или инертном газе при температуре 470 – 530 К получают дисперсные порошки металлов со средним размером частиц 100 – 300 нм. Нанокристаллический порошок нитрида алюминия (AlN) со средним размером частиц 8 нм получали разложением в аммиаке при 900 К полиамида алюминия. Бориды переходных металлов можно получать пиролизом борогидридов при 600 – 700 К, то есть при температуре, которая гораздо ниже обычных температур твердофазного синтеза.
В общем виде основную реакцию пиролиза формиатов можно представить в виде следующего результирующего уравнения:
![]() (HCOO)n Me MeO + H2 + CO + H2O
+ Me
(HCOO)n Me MeO + H2 + CO + H2O
+ Me
При этом реакция восстановления оксидов металлов газами CO и H2, выделяющимися при пиролизе, рассматривается как вторичная. По той же схеме происходит разложение формиатов Cu и Zn и других металлов.
Следует отметить, что при пиролизе формиатов Cu и Ni преобладает выход свободного металла, а при пиролизе формиатов Mn и Fe – выход оксидов металлов. Другие формиаты металлов могут занимать промежуточное положение; например, пи пиролизе формиата кобальта образуются 50-60 % CoO и 50-40 % Co/
Исследования показали, что температура разложения формиатов повышается в ряду Fe Ni Co Cu, а скорость реакции разложения возрастает в обратном порядке.
Термическое разложение оксалатов многих металлов (Mn, Fe, Cu) протекает по уравнению
![]() MeC2 O4 MeO + Co + CO2
MeC2 O4 MeO + Co + CO2
Пиролиз оксалатов, формиатов и других солей позволяет получать порошки с размером частиц около 100 нм.
Путем термической диссоциации карбонилов при температуре до 773 К по реакции возможно получение полиметаллических пленок с размерами кристаллитов порядка 20 нм.
![]() Men (CO)m nMe +
mCO
Men (CO)m nMe +
mCO
Характерной особенностью термического разложения является сравнительно невысокая селективность процесса, поскольку продукт реакции обычно представляет собой смесь целевого продукта и других соединений.
Метод восстановления используют для получения наноматериалов (чаще всего металлов) из исходных кислородосодержащих соединений. При переработке оксидов металлов в качестве восстановителей используют газы – водород, монооксид углерода, конвертированный природный газ. Этим процессам соответствуют реакции в результате которых получают нанопорошки металлов: Fe, W, Ni, Mo, Cu, Co.
![]() MeO + H2 Me + H2O (пар),
MeO + H2 Me + H2O (пар),
![]() MeO + CO Me + CO2,
MeO + CO Me + CO2,
Распространенным методом получения высокодисперсных металлических порошков является восстановление соединений металлов (гидрооксидов, хлоридов, нитратов, карбонатов) в токе водорода при температуре менее 500 К. достоинствами этого метода являются низкое содержание примесей и узкое распределение частиц порошка по размерам.
3. Получение наночастиц в жидкой фазе
3.1 Химическая конденсация
Химические методы получения наночастиц и ультрадисперсных систем известны достаточно давно. Коллоидный раствор золя золота (красного) с размером частиц 20 нм был получен в 1857г. М.Фарадеем. Агрегативная устойчивость золя объясняется образованием двойного электрического слоя на поверхности раздела твердое тело-раствор и возникновением электростатической составляющей расклинивающего давления, являющегося основным фактором стабилизации данной системы.
Наиболее простым и часто используемым способом является синтез наночастиц в растворах при протекании различных реакций. Для получения металлических наночастиц применяют реакции восстановления, при которых в качестве восстановителя используют алюмо- и борогидриды, тетрабораты, гипофосфиты и многие другие неорганические и органические соединения.
Наноразмерные частицы солей и оксидов металлов получают чаще всего в реакциях обмена и гидролиза. Например, золь золота с размером частиц 7 нм может быть получен восстановлением хлорида золота боргидридом натрия с использованием в качестве стабилизатора додекантиола. Тиолы широко используются для стабилизации наночастиц полупроводников.
В качестве стабилизаторов используют и другие органические соединения, способные образовывать поверхностные комплексы.
Реакцию гидролиза проводят в органических растворителях. Последующая полимеризация приводит к образованию геля:
![]() M(OR)4 + 4H2O M(OH)4 + 4ROH
M(OR)4 + 4H2O M(OH)4 + 4ROH
![]() mM(OH)n (MO2) +
2mH2O
mM(OH)n (MO2) +
2mH2O
Этот метод обладает чрезвычайно широкими возможностями и позволяет получать материалы, содержащие и биологически активные макромолекулы.
3.2 Осаждение в растворах и расплавах
Осаждение в растворах. Общие закономерности образования наночастиц в жидких средах зависят от множества факторов: состава и свойств исходного вещества (раствора, расплава); характера диаграммы равновесия фаз рассматриваемой системы; способа создания пересыщения раствора или расплава; используемого оборудования и режимов его работы.
В случае синтеза необходимых фаз проводят термообработку порошка после его сушки или эти фазы объединяют в оду. После термообработки проводят дезагрегацию агрегатов до размеров наночастиц.
Исходные вещества и растворитель выбирают так, чтобы побочные продукты можно было полностью удалять из целевого продукта при промывании и последующей термообработки без загрязнения окружающей среды. Для эффективного смешения реагентов используют перемешивающие устройства с различными типами мешалок (пропеллерные, стержневые, турбинные), циркуляционное перемешивание с помощью насосов (центробежных и шестеренчатых), диспергирующих устройств (форсунки, сопла, инжекторы, вращающиеся диски, акустические распылители и так далее).
С одной стороны, для увеличения производительности реактора растворимость исходных веществ должна быть большой. Однако при получении наночастиц это будет повышать их массовое содержание в образующейся суспензии и вероятность объединения в агрегаты.
С другой стороны, для обеспечения высокой степени неравновесности процесса зародышеобразования твердой фазы необходимо использовать насыщенные растворы исходных веществ. Чтобы при этом сохранить малую долю наночастиц в суспензии, целесообразно использовать малорастворимые исходные вещества. При этом производительность реактора будет уменьшаться. Другой возможностью является использование малого количества осаждаемого вещества и большого избытка осадителя. При осаждении в водных растворах в качестве осадителей чаще всего используют растворы аммиака, углекислого аммония, щавелевую кислоту или оксолат аммония. В качестве исходных веществ при осаждении выбирают хорошо растворимые соли азотной, соляной или уксусной кислот.
Процесс идет по реакции:
MenAm + (K)OH Men(OH)m + KA
где А – анионы: NO3-, Cl-, SO4-; К – катионы: Na+, NH4+, K+; n, m – коэффициенты.
При регулировании pH м температуры раствора возможно создание условий для получения высокодисперсных гидроксидов. Затем продукт прокаливают и при необходимости восстанавливают. Полученные порошки металлов имеют размер 50-150 нм сферической или близкой к сфере формы.
Методом осаждения можно получать оксидные металлические и металлоксидные материалы, композиции на их основе, различные ферриты и соли.
Ответственной стадией, определяющей свойства полученного порошка, является его отделение от жидкой фазы. С возникновением межфазной границы газ-жидкость резко увеличивают силы Лапласа, сжимаемые частицы. В результате действия этих сил в частицах наноразмерного спектра возникают сжимающие давления порядка мегапаскалей, которые используются при компактировании макрочастиц в монолитные пористые изделия. При этом в порах агрегата создаются гидротермальные условия, приводящие к увеличению растворимости частиц и упрочнению агрегатов за счет механизма растворение-конденсация. Частицы объединяются в прочный агрегат, а далее – в отдельный кристалл.
Для удаления жидкой фазы из осадка используют процессы фильтрования, центрифугирования, электрофореза, сушки. Вероятность образования прочных агрегатов можно уменьшить за счет замещения воды органическими растворителями, а также использованием ПАВ, сублимационной сушки, применением сушильного агента в сверхкритических условиях.
Разновидностью технологии получения наночастиц в жидких средах является управляемое растворение более крупных частиц в подходящих растворителях. Для этого необходимо затормозить или вообще прекратить процесс их растворения в интервале наноразмеров. Этим же способом можно проводить коррекцию размеров получаемых перечисленными методами частиц в случаях, когда их размер оказался больше необходимого.
Осаждение в расплавах. При этом способе жидкой средой являются расплавы солей или металлов (чаще всего используют расплавы солей). Образование твердой фазы происходит при достаточно высокой температуре, когда диффузионные процессы вызывают высокую скорость роста кристаллов. Основной проблемой при этом является исключение захвата синтезируемым порошком компонентов побочных соединений. Для выделения синтезированного порошка после охлаждения соль растворяют в подходящих растворителях.
Изменяя степень неравновесности процесса можно регулировать структуру материала. Если остановить процесс на стадии, когда твердая фаза имеет наноразмеры, можно получать наноматериал. Однако сделать это весьма трудно из-за большой скорости диффузионного массопереноса при достаточно высокой температуре среды.
Более перспективен этот метод для получения наночастиц растворением исходных более крупных частиц. В этом случае можно сразу получать нанокомпозит, если растворяющаяся среда, например стеклообразная, будет играть роль матрицы для наночастиц [2].
3.3 Золь-гель метод
Золь-гель метод включает несколько основных технологических фаз (рис. 5.). Первоначально получают водные или органические растворы исходных веществ. Из растворов образуют золи (коллоидные системы) с твердой дисперсной фазой и жидкой дисперсионной средой для получения золя используют, например, гидролиз солей слабых оснований или алкоголятов. Можно использовать и другие реакции, приводящие к образованию стабильных и концентрированных золей (например, применение пептизаторов – веществ, препятствующих распаду агрегатов частиц в дисперсных системах). Эффективным является нанесение на наночастицы в процессе гидролиза защитного слоя из водорастворимых полимеров или ПАВ, добавляемых вместе с водой в процессе гидролиза.
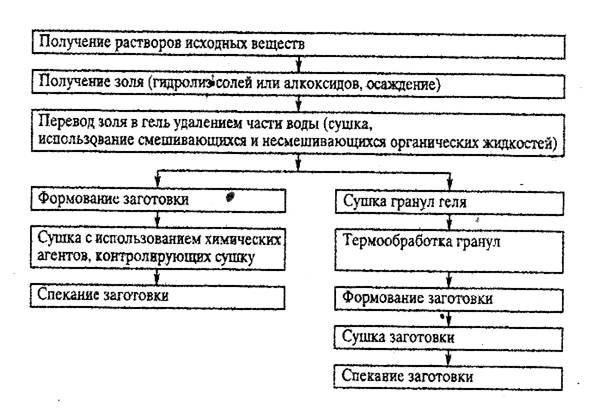
Рис. 5. Схема процессов получения нанопорошков золь-гель методом
В дальнейшем золь переводят в гель при удалении из него части воды нагреванием, экстракцией соответствующим растворителем. В ряде случаев проводят распыление водного золя в нагретую несмешивающуюся с водой органическую жидкость.
Переводя золь в гель, получают структурированные коллоидные системы. Твердые частицы дисперсной фазы соединены между собой в рыхлую пространственную сетку, которая содержит в своих ячейках жидкую дисперсионную среду, лишая текучести систему в целом. Контакты между частицами легко и обратимо разрушаются при механических и тепловых воздействиях.
Гели с водной дисперсионной средой называются гидрогелями, а с углеводородной – органогелями.
Высушиванием геля можно получать аэрогели или ксерогели – хрупкие микропористые тела (порошки). Порошки используют для формования изделий, плазменного напыления и так далее.
Гель можно использовать непосредственно для получения пленок или монолитных изделий.
В настоящее время золь-гель метод широко используется для получения наночастиц из неорганических неметаллических материалов.
3.4 Электрохимический метод получения наночастиц
Электрохимический метод связан с выделением на катоде вещества в процессе электролиза простых и комплексных катионов и анионов. Если в цепь постоянного электрического тока включить систему, состоящую из двух электродов и раствора (расплава) электролита, то у электродов будут протекать реакции окисления-восстановления. На аноде (положительный электрод) анионы отдают электроны и окисляются; на катоде (отрицательный электрод) катионы присоединяют электроны и восстанавливаются. Образующийся на катоде осадок в результате, например, электрокристаллизации, в морфологическом отношении может быть как рыхлым, так и плотным слоем из множества микрокристаллитов.
На текстуру осадка влияют многие факторы, такие, например, как природа вещества и растворителя, тип и концентрация ионов целевого продукта и посторонних примесей, адгезионные свойства осаждаемых частиц, температура среды, электрический потенциал, условия диффузии и другие.
Одним из перспективных научных направлений является использования электрохимического синтеза для конструирования наноструктурных материалов. Суть его заключается в формировании в ходе кинетически контролируемого электровосстановления двухмерных (лэнгмюровских) монослоев металлических наночастиц под монослойными матрицами ПАВ.
Основными достоинствами метода являются экспериментальная доступность и возможность контроля и управления процессом получения наночастиц.
4. Получение наночастиц с использованием плазмы
4.1 Плазмохимический синтез
Одним из самых распространенных химических методов получения ультрадисперсных порошков металлов, нитридов, карбидов, оксидов, боридов, а также их смесей является плазмохимический синтез. Для этого метода характерны очень быстрое (за 10-3 – 10-6 с) протекание реакции вдали от равновесия и высокая скорость образования зародышей новой фазы при относительно малой скорости их роста.
При плазмохимическом синтезе используют низкотемпературную (400-800 К) азотную, аммиачную, углеводородную, аргонную плазму, которую создают с помощью электрической дуги, электромагнитного высокочастотного поля или их комбинации в реакторах, называемых плазмотронами. В них поток исходных веществ (газообразных, жидких или твердых) быстро пролетает через зону, где поддерживается плазма, получая от нее энергию для проведения реакций химического превращения. Плазмообразующим газом может быть и само исходное вещество.
Принципиальная схема наиболее широко используемого аппарата с электродуговым генератором плазмы приведена на Рис. 6.
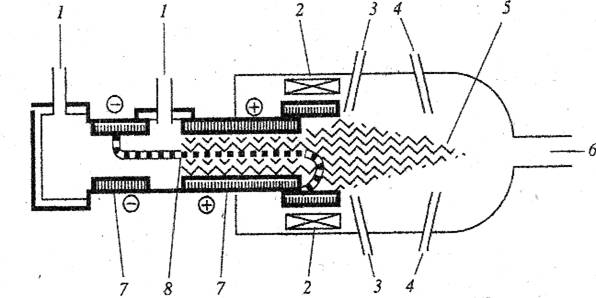
Рис. 6. схема реактора с электродуговым плазмотроном
Реактор включает следующие основные узлы: электроды 7, патрубки 1 для входа плазмообразующего газа, катушки электромагнитов 2, для поддержания плазменной дуги, патрубки 3 для ввода реагентов, устройства ввода холодного газа 4, приемное устройство продуктов синтеза 6. образующийся между электродами столб дуги 8 образует поток плазмы 5; при этом в реакторе достигается температура 1200 - 4500 К. Полученные продукты закаляют различными способами: в трубчатых теплообменниках, посредством затапливания потока реагирующей смеси струями холодных газов или жидкости, в охлаждаемых соплах Лаваля [2].
Характеристики получаемых порошков зависят от используемого сырья, технологии синтеза и типа плазмотрона; их частицы являются монокристаллами и имеют размеры 10-100 нм и более.
Процессы, происходящие при плазмохимическом синтезе и газофазном методе получения наночастиц, близки между собой. После взаимодействия в плазме происходит образование активных частиц, находящихся в газовой фазе. В дальнейшем необходимо сохранить их наноразмеры и выделить из газовой фазы.
Для порошков плазмохимического синтеза характерны широкое распределение наночастиц по размерам и, как следствие этого, наличие довольно крупных (до 1-5 мкм) частиц, то есть низкая селективность процесса, а также высокое содержание примесей в порошке.
Для получения наночастиц можно использовать не только метод их роста зародышей, но и растворение в плазме более крупных частиц.
На практике используются реакторы, в рабочий объем которых вводятся излучения лазера через специальное окно и поток реакционной смеси. В области их пересечения возникает реакционная зона, где происходит образование частиц. Размер частиц зависит от давления реактора и интенсивности излучения лазера. Параметрами лазерного излучения управлять значительно легче (чем высокочастотной или дуговой плазмой), что позволяет получать более узкое распределение частиц по размерам. Таким способом получили порошок нитрида кремния с размерами частиц 10-20 нм.
4.2 Электроэрозионный метод
Суть метода заключается в образовании дуги между электродами, погруженными в ванну с жидкостью. В этих условиях вещество электродов частично диспергируется и взаимодействует с жидкостью с образованием дисперсного порошка. Например, электроэрозия алюминиевых электродов в воде приводит к образованию порошка гидроксида алюминия.
Полученный твердый осадок отделяют от жидкой фазы методами фильтрации, центрифугирования, электрофореза. Затем порошок сушат и в случае необходимости предварительно измельчают. В процессе последующей термообработки из порошка синтезируют целевой продукт, из которого в процессе дезагрегации получают частицы нужного размера. Этим методом можно получать частицы наноразмеров, если в жидкую фазу помещать частицы большого размера.
4.3 Ударно-волновой или детонационный синтез
Данным методом наночастицы получают в плазме, образованной в процессе взрыва бризантных взрывчатых веществ (ВВ) во взрывной камере (детонационной трубе).
В зависимости от мощности и типа взрывного устройства ударно-волновое взаимодействие на материал осуществляется за очень короткий промежуток времени (десятые доли микросекунд) при температуре более 3000 К и давлении в несколько десятков гектопаскалей. При таких условиях возможен фазовый переход в веществах с образованием упорядоченных диссипативных наноразмерных структур.
Ударно-волновой метод наиболее эффективен для материалов, синтез которых осуществляется при высоких давлениях, например, порошков алмаза, кубического нитрата бора и других.
При взрывном превращении конденсированных ВВ с отрицательным кислородным балансом (смесь тротила и гексогена) в продуктах реакции присутствует углерод, из которого и образуется алмазная дисперсная фаза с размером частиц порядка 4-5 нм.
Подвергая ударно-волновому воздействию от заряда ВВ пористые структуры различных металлов и их солей, гели гидрооксидов металлов, можно получать нанопорошки оксидов Al, Mg, Ti, Zn, Si и другие.
Достоинством метода ударно-волнового синтеза является возможность получения нанопорошков различных соединений не только обычных фаз, но и фаз высокого давления. Вместе с тем практическое применение способа требует специальных помещений и технологического оборудования для проведения взрывных работ [2].
5. Механохимический синтез
При этом способе обеспечивают механическую обработку твердых тел, в результате которой происходят измельчение и пластическая деформация веществ. Измельчение материалов сопровождается разрывом химических связей, что предопределяет возможность последующего образования новых химических связей, то есть протекание механохимических реакций.
Механическое воздействие при измельчении материалов является импульсным; при этом возникновение поля напряжений и его последующая релаксация происходят не в течение всего времени пребывания частиц в реакторе, а только в момент соударения частиц и в короткое время после него.
Механическое воздействие бывает не только импульсивным, но и локальным, так как происходит не во всей массе твердого вещества, а лишь там, где возникает и затем релаксирует поле напряжений.
Воздействие энергии, выделяющей при высокой степени неравновесности во время удара или истирания, из-за низкой теплопроводности твердых тел приводит к тому, что какая-то часть вещества находится в виде ионов и электронов – в состоянии плазмы. Механохимические процессы в твердом теле можно объяснить с использованием фононной теории разрушения хрупких тел (фонон – квант энергии упругих колебаний кристаллической решетки).
Механическое измельчение твердых материалов осуществляют в мельницах сверхтонкого измельчения (шаровых, планетарных, вибрационных, струйных). При взаимодействии рабочих органов с измельчаемым материалом возможен его локальный кратковременный разогрев до высоких (плазменных) температур, получение которых в обычных условиях осуществляется при высоких температурах.
Механическим способом можно получать нанопорошки с размером частиц от 200 до 5-10 нм. Так, при помоле смеси металла и углерода в течении 48 часов были получены частицы TiC, ZrC, VC и NbC с размером 7-10 нм. В шаровой мельнице из смеси порошков вольфрама углерода и кобальта с исходным размером частиц около 75 мкм за 100 часов были получены частицы нанокомпозита WC-Co с размером частиц 11-12 нм.
6. Биохимические методы получения наноматериалов
Наноматериалы могут производиться и в биологических системах. Во многих случаях живые организмы, например, некоторые бактерии и простейшие организмы, производят минеральные вещества с частицами и микроскопическими структурами в нанометровом диапазоне размеров.
В процессах биоминерализации действуют механизмы тонкого биохимического контроля, в результате чего производятся материалы с четко определенными характеристиками.
Живые организмы могут быть использованы как прямой источник ультрадисперсных материалов, свойства которых могут быть изменены путем варьирования биологических условий синтеза или переработки.
Ультрадисперсные материалы, полученные биохимическими методами синтеза, могут быть исходными материалами для некоторых уже опробованных и известных методов синтеза и обработки наноматериалов, а также в ряде технологических процессов. Пока работ в этом направлении исследований немного, но уже можно указать ряд примеров получения и использования биологических наноматериалов.
В настоящее время ультрадисперсные материалы могут быть получены из ряда биологических объектов, например, ферритинов и связанных с ними белков, содержащих железо, магнетических бактерий и другое.
Так, ферритины (вид белков) обеспечивают для живых организмов возможность синтезировать частицы гидроксидов и оксифосфатов железа нанометрового размера. Способность магнетотактических бактерий использовать линии магнитного поля Земли для собственной ориентации позволяет иметь цепочки наноразмерных (40-100 нм) однодоменных частиц магнетита.
Возможно также получение наноматериалов с помощью микроорганизмов. В настоящее время открыты бактерии, окисляющие серу, железо, водород и другие вещества. С помощью микроорганизмов стало возможным проводить химические реакции для извлечения из руд различных металлов, минуя традиционные технологические процессы. В качестве примера можно привести технологию бактериального выщелачивания меди из сульфидных материалов, урана из руд, отделение примесей мышьяка от концентратов олова и золота.
В некоторых странах в настоящее время до 5% меди, большое количество урана и цинка получают микробиологическими методами. Существуют хорошие предпосылки, подтвержденными лабораторными исследованиями, использования микробиологических процессов извлечения марганца, висмута, свинца, германия из бедных карбонатных руд. С помощью микроорганизмов можно вскрыть тонко вкрапленное золото арсенопиритных концентратов.
Поэтому в технической микробиологии появилось новое направление, которое называют микробиологической гидрометаллургией [2].
7. Криохимический синтез
Высокая активность атомов и кластеров металлов в отсутствие стабилизаторов обуславливает реакцию в более крупные частицы. Процесс агрегации атомов металлов идет практически без энергии активации. Стабилизацию активных атомов почти всех элементов периодической системы удалось осуществить при низких (77 К) и сверхнизких (4-10 К) температурах методом матричной изоляции. Суть этого метода состоит в применении инертных газов при сверхнизких температурах. Чаще всего в качестве матрицы используются аргон и ксенон. Пары атомов металлов конденсируют с большим, обычно тысячекратным, избытком инертного газа на поверхность, охлаждаемую, до 10-12 К. Значительное разбавление инертных газов и низкие температуры практически исключают возможность диффузии атомов металлов, и в конденсате происходит их стабилизация. Физико-химические свойства таких атомов исследуют различными спектральными и радиоспектральными методами [3].
7.1 Основные процессы криохимической нанотехнологии
7.1.1 Приготовление и диспергирование растворов
В результате растворения исходного вещества или веществ в том или ином растворителе удается достичь максимально возможной степени смешивания компонентов в гомогенном растворе, в котором гарантирована высокая степень точности соответствия заданного состава.
В качестве растворителя чаще всего используют воду; однако, возможно применять и другие растворители, которые легко замораживаются и сублимируются.
Затем полученный раствор диспергируют в отдельные капли требуемого размера, и их охлаждают до полного замораживания влаги. Процесс гидродинамического диспергирования осуществляют за счет истечения раствора через различные насадки и фильеры, а также с использование форсунок.
7.1.2 Замораживание жидких капель
Данный процесс обеспечивает при непосредственном контакте с хладоагентами или на охлаждаемых поверхностях.
При непосредственном контакте с хладоагентами замораживание производят в объеме жидкого хладоагента, например, жидкого азота или охлажденной органической жидкости (например, гексан). При этом получают гранулы сферической формы.
При кристаллизации на охлаждаемых поверхностях капля раствора теряет сферическую форму, приобретая вид чечевицеобразных гранул. В ряде случаев процесс кристаллизации осуществляют в тонкой пленке, которую перед замораживанием наносят на охлаждаемую поверхность.
Нашел широкое промышленное применение процесс испарительного замораживания (или самозамораживание) диспергируемых фрагментов раствора в вакууме при давлении более низком, чем давление, соответствующее тройной точке диаграммы состояния растворителя.
Скорость охлаждения капель раствора на стадии замораживания существенно влияет на структуру образующихся кристаллов льда и высушиваемого продукта. Режим замораживания особенно важен при получении наноструктурных элементов на последующей стадии сублимационного обезвоживания гранул. Для этого процесс замораживания должен протекать настолько быстро, чтобы предотвратить согрегацию компонентов раствора.
Обычно скорость охлаждения определяют на основании теоретических расчетов или подбирают опытным путем; она зависит от состава продукта, его теплофизических свойств, способа охлаждения и других факторов.
Затем замороженные гранулы просеивают (в случае необходимости) и помешают в сублимационную камеру, где происходит их сублимационная сушка.
Малоразмерные фрагменты раствора (капли, тонкие пленки) можно замораживать также в самой камере сушки при вакуумировании. В этом случае в результате понижения давления происходит интенсивное практически адиабатное испарения влаги. При этом за счет отвода теплоты испарения наблюдается самоохлаждение продукта – вплоть до его полного замораживания. При осуществлении такого процесса обычно удаляется до 10 % влаги.
Главная цель процесса криокристаллизации заключается в сохранении высокой химической и гранулометрической однородности, присущей диспергируемому раствору. Возможность сохранения высокой химической однородности определяется различными условиями, в том числе размером замораживаемых капель раствора, его температурой, физико-химической природой и температурой хладоагента.
7.1.3 Сублимация
Стадию испарения (сублимации) влаги реализуют ниже тройной точки на диаграмме равновесия «растворитель – растворенное вещество». Параметры данной точки (температура, давление) зависят от свойств растворителя и растворенного вещества, а также от состава раствора. Например, для чистой воды эти температуры составляют:
давление р =610 Па и Т = 273,0076 К
На стадии сублимации теплоту, затрачиваемую на испарение льда, к продукту подводят путем кондуктивного теплопереноса (теплопроводностью) или с использованием источников инфракрасного, электромагнитного и других видов излучения (радиационный электропровод); в ряде случаев используют их комбинацию. Удельная теплота сублимации вещества qсуб примерно равна сумме их удельных теплот плавления qпл и испарения qисп. Для воды показатель qсуб достигает примерно 3 МДж/кг, а qпл составляет всего примерно 0,34 МДж/кг.
При сублимационном обезвоживании удается избежать химических изменений компонентов, свести к минимуму потери летучих компонентов материала, высушить продукт без вспенивания, сохранить дисперсность составных частей композиции материала, поддержать стерильность и свести к минимуму окисление продукта.
Удалять растворитель из замороженного материала можно также способом криоэкстракции и криоосаждения. При криоэкстракции извлечение льда из гранул материала производится жидкими экстрагентами (например, ацетоном, метанолом, пропанолом, спиртом и другими). При этом температура среды и экстрагента должна быть ниже температуры замерзания солевого раствора. В этом случае лимитирующей стадией процесса является внешняя диффузия, то есть скорость диффузии молекул воды от поверхности гранул в объем экстрагента.
При криоосаждении удаление растворителя из замороженных гранул осуществляют при температуре ниже температуры плавления целевого продукта путем обработки осадителями (например, щавелевой кислотой, гидроксидом аммония и другими).
7.1.4 Десублимация
Обычно с понижением влажности материала интенсивность парообразования также падает. В соответствии с этим следует снижать количество подводимой теплоты, так как излишек может привести к нагреву материала – вплоть до плавления льда, что нарушит режим сублимационной сушки.
Для поддержания движущей силы в процессе сублимационной сушки необходимо обеспечивать непрерывный отвод паров влаги из сушильной камеры (сублиматора). Это можно сделать двумя способами:
Во-первых, необходимый вакуум можно поддерживать, используя прямой отсос образующихся паров из сушильной камеры с помощью вакуумных насосов (пароструйных, эжекторных);
Во-вторых, поддерживать вакуум в сушильной камере можно путем адсорбционного поглощения паров растворителя (воды) цеолитами или другими адсорбентами.
Более эффективным является удаление паров влаги путем их конденсации. Поскольку процесс сублимации осуществляют при достаточно высоком вакууме (остаточном давлении порядка 50-150 Па и температуре – 20-50 оС), то в этих условиях происходит твердофазная конденсация (десублимация) паров растворителя. Такой процесс десублимации можно проводить с использованием как поверхностных, так и контактных конденсаторов.
Продукт сублимационного обезвоживания получается в виде пористых гранул, состоящих из равномерной смеси ультрадисперсных элементов (частичек) твердых растворов солей. Отдельные частички структуры гранул скреплены по зонам контакта хрупкими кристаллическими «мостиками».
В случае необходимости такие гранулы подвергаются термообработке, при которой происходит дегидратизация солевых компонентов и разложение солей окислов.
Лимитирующей стадией получения наночастиц методом криохимической технологии является процесс сублимационной сушки, продолжительность которого составляет 10-20 часов.
Также необходимо отметить, что криохимический метод нашел применение для получения различных ультрадисперсных материалов неорганических солей; он перспективен и для сложных органических соединений. Способ можно использовать не только для водных, но и неводных растворов, а также смесей вода - неводный растворитель [2].
Заключение
В данной курсовой работе рассмотрен ряд способов получения наночастиц. Самыми широко используемыми являются методы, основанные на испарении и конденсации, плазмохимии, и восстановлении водородом металлов из оксидов, поскольку при их использовании можно управлять свойствами наноматериалов, кроме того, они наиболее просты в применении и аппаратурном оформлении.
В заключение хочется отметить, что общая тенденция развития техники и технологии направлена на снижение материалоемкости и энергоемкости процессов, аппаратов и технологий, поэтому проблема нанотехнологий сейчас очень актуальна во всем мире. Но, к сожалению Россия отстает в развитии этого направления, так как не хватает финансовых вложений, и работа ведется на устаревшей аппаратуре. Для примера, в США создаются правительственные программы по вовлечению частного капитала для разработки наноматериалов. Русский академик Панин отметил, что беда в том, что мы торопимся, а кадров нет, нанотехнологиями занимаются люди других специальностей, уже со своим багажом знаний. И, тем не менее, работы по изучению и открытию новых свойств наночастиц ведутся очень интенсивно.
Список литературы
1. Соловьев М. Нанотехнология — ключ к бессмертию и свободе. // Компьютерра, 1997, № 41, с. 48-50
2. Генералов М.Б. Криохимическая нанотехнология: Учеб. пособие для вузов. М.: ИКЦ “Академкнига”, 2006. – 325 с.
3. Сергеев Г.Б. “Нанохимия” Изд. Московского ун-та, 2003
4. Пул Ч. Оуэнс Ф. Нанотехнологии. – М.: Техносфера, 2004
5. Вестн. Моск. ун-та. Сер.2. химия. 2001. Т. 42. №5
6. Гусев А.И., Ремпель А.А. Нанокристаллические материалы. – М.: ФИЗМАТЛИТ, 2001. – 224 с.
| Поиск оптимального содержания пигмента в покрытиях на основе алкидного ... | |
|
Реферат Отчет содержит стр., рис., табл., источников, прил. МАНГАНАТ (IV) КАЛЬЦИЯ, СИЛИКАТ НАТРИЯ, МАНГАНАТ(IV) СИЛИКАТ КАЛЬЦИЯ, СООСАЖДЕНИЕ ... Материал загрязняющимся антикоррозионным покрытием получают нанося на поверхность субстрата композицию на основе 10%-ого водного раствора силикатов, алюминатов, цирконатов щелочных ... Оксид цинка необходим как регулятор рН водной фазы на границе металл - покрытие, накапливающейся там в результате проникновения воды, помимо этого игольчатая форма пигментных ... |
Раздел: Рефераты по химии Тип: дипломная работа |
| Развитие, становление и основные аспекты фармации | |
|
РАЗВИТИЕ, СТАНОВЛЕНИЕ И ОСНОВНЫЕ АСПЕКТЫ ФАРМАЦИИ Для ветеринарного провизора необходимы знания, с помощью которых можно контролировать качество ... молекулы воды или спирта (классический пример реакции конденсации альдегидов - синтез гексаметилентетрамина из формальдегида и аммиака); реакцию нейтрализации для получения солей ... Для идентификации препаратов, а также для количественного определения широко используют спектрофотометрию: для морфина гидрохлорида растворитель вода или 0,1 М раствор соляной ... |
Раздел: Рефераты по медицине Тип: книга |
| Давно ли люди гибнут за металл и как именно закалялась сталь | |
|
Давно ли люди гибнут за металл и как именно закалялась сталь? Содержание Давно ли люди гибнут за металл и как именно закалялась сталь? Вопросы ... Основной ацетат свинца Pb (CH3COO) 2-Pb (OH) 2 - менее растворимый в воде белый порошок - используется для обесцвечивания органических растворов и очистки растворов сахара перед ... На отрицательно заряженном электроде - катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на положительно заряженном электроде - аноде идет ... |
Раздел: Рефераты по истории Тип: книга |
| Биокерамика на основе фосфатов кальция | |
|
Российская академия наук Институт физико-химических проблем керамических материалов С.М. Баринов, В.С. Комлев Биокерамика на основе фосфатов кальция ... Твердофазные методы синтеза легче поддаются контролю, в отличие от жидкофазных, и характеристики конечного продукта (размер и агломерированность частиц порошка, соотношение мягких ... Замещенные гидроксиапатиты синтезировали двумя способами: осаждением из растворов нитрата Са (Mg), однозамещенного фосфата аммония, карбоната аммония и аммиака (1) и твердо ... |
Раздел: Рефераты по химии Тип: книга |
| Металлы и сплавы | |
|
... Национальный аэрокосмический университет им. Н.Е. Жуковского "Харьковский авиационный институт" АВИАЦИОННОЕ МАТЕРИАЛОВЕДЕНИЕ Часть 1 Металлы и сплавы Способы получения однородной монолитной массы сплава могут быть различными: кристаллизация из расплава; конденсация из газообразной фазы; спекание порошков или гранул. Твердые растворы замещения образуются путем замещения атомами растворенного вещества атомов растворителя в его кристаллической решетке. |
Раздел: Промышленность, производство Тип: учебное пособие |