Курсовая работа: Исследование комплексообразования ПКЭАК с ионами двухвалентных металлов
Министерство образования и науки Республики Казахстан
СЕМИПАЛАТИНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
имени ШАКАРИМА
МАГИСТРАТУРА ФЗ и ЗОС
КАФЕДРА ХИМИИ И ЭКСПЕРТИЗЫ
Курсовая работа
Исследование комплексообразования ПКЭАК с ионами двухвалентных металлов
Исполнитель Сальменбаев С.Е.
Научный руководитель Кудайбергенов С.Е.
Допущена к защите
Зав. Кафедрой Яшкарова М.Г.
СЕМИПАЛАТИНСК - 2008
РЕФЕРАТ
Курсовая работа содержит: 40 страниц, 9 рисунков, 8 таблиц, приложений, список литературы включает 14 наименований.
Тема: «Исследование комплексообразования ПКЭАК с ионами двухвалентных металлов»
Результатом исследования является полиамфолит бетаиновой структуры поли (карбоксиэтил 3-аминокротонат) (ПКЭАК) синтезированный в институте полимерных материалов и технологий г. Алматы.
Цель работы: исследование взаимодействия полиамфолита с ионами металлов и изучение возможности его практического применения.
Работа выполнена на кафедре химии и экспертизы Семипалатинского
Государственного университета имени Шакарима.
В работе был использован метод потенциометрического титрования.
Были исследованы:
1. Исследование взаимодействия линейного полиэлектролита с ионами двухвалентных металлов: Ca, Sr, Ni, Co, Cd, Pb, Zn, Cu.
СОДЕРЖАНИЕ
Введение
Перечень сокращений, символов и обозначений
1.Теоретическая часть
1.1 Комплексы водорастворимых полимеров с различными классами соединений
1.2 Комплексы полимеров с низкомолекулярными соединениями
1.2.1 Комплексы полимер – ион металла
1.3 Амфотерные полиэлектролиты
1.4 Применение комплексов полимер – металл в катализе
2.Методическая часть
2.1 Характеристика исходных веществ
2.2 Методика исследования
3. Экспериментальная часть
3.1.Результаты и обсуждение
4.Заключение
5.Список использованных источников
6.Приложения
Введение
Актуальность темы
Известно, что число полиамфолитов и полимерных бетаинов весьма ограничено. Линейные и слабосшитые полимерные бетаины, содержащие кислотные и основные функциональные группы, представляют большой интерес, так как они наиболее близки по свойствам к природным полимерам. Исследование полиамфолитов и их взаимодействий с самыми различными соединениями (комплементарными макромолекулами, белками, ионами металлов, лекарственными веществами и т.д.) интересно с точки зрения моделирования процессов, протекающих в биологических системах, а также возможного использования в различных процессах – в процессах извлечения ионов металлов, разделения, очистки и концентрирования белков, иммобилизации и контролируемом высвобождении лекарственных веществ и т.д.
Данная работа посвящена исследованию процессов комплексооборазования поли (карбоксиэтил 3-аминокротоната) с ионами двухвалентных металлов.
Цель работы
1) Исследование комплексообразования ПКЭАК с ионами двухвалентных металлов потенциометрическим титрованием.
Научная новизна темы
Научная новизна данной работы в том, что исследуемый объект является совершенно новым полиэлектролитом, ранее еще не исследованным. Полученные результаты могут быть использованы при извлечении металлов из природных и сточных вод, создании полимерных катализаторов, биомедицинских препаратов.
Достоверность полученных данных
Полученные данные подтверждают комплексообразование полиамфолита с ионами двухвалентных металлов.
ПЕРЕЧЕНЬ СОКРАЩЕНИЙ, СИМВОЛОВ И ОБОЗНАЧЕНИЙ.
ПКЭАК – поли-карбоксиэтил 3-аминокротонат
ПМК – полимер-металлические комплексы
ИЭТ – изоэлектрическая точка
ПЭГ - полиэтиленгликоль
ТПМК – тройные полимер – металлические комплексы
ПЭК – полиэлектролитные комплексы
ПА - полиамфолит
ПЭ – полиэлектролит
П4ВП – поли-4-винилпиридин
ПВПД – поливинилпиролидон
ВМС: высокомолекулярные соединения.
Me: металл.
др.: другое.
ИК: инфракрасный.
ПМК: полимер металлические комплексы.
ИОС: ионно-обменные смолы.
ИПК: интерполимерные комплексы.
х.ч.: химически чистый.
1.Теоретическая часть
1.1 Комплексы водорастворимых полимеров с различными классами соединений
Исследование взаимодействий комплементарных макромолекул и продуктов этих реакций – полимерных комплексов представляет одну из важнейших проблем химии и физики полимеров и молекулярной биологии [1-3].
Комплементарными называются разнородные макромолекулы, содержащие функциональные группы, которые способны к специфическим взаимодействиям, а геометрическое строение цепей не создает препятствий для возникновения достаточно большого числа межмолекулярных связей. Это могут быть водородные связи, электростатические, ион-дипольные, ван-дер-ваальсовые и гидрофобные взаимодействия.
Интерес к данной проблеме связан с тем, что взаимодействие комплементарных структур и продукты их ассоциации играют исключительно важную роль в живых организмах (это образование двойных и тройных спиралей комплексов полинуклеотидов, надмолекулярных структур клеток вирусов, комплексов фермент-субстрат, антиген-антитело). Классическим примером кооперативного интерполимерного комплекса является двойная спираль из комплементарных цепей ДНК. Изучение подобных взаимодействий, но с участием синтетических комплементарных макромолекул делает возможным моделирование процессов, протекающих в биологических системах, на сравнительно простых полимерных объектах, т.е. позволяет осуществить подход к биологическим системам и протекающим в них процессам со стороны химии.
С другой стороны, продукты взаимодействия комплементарных макромолекул – полимерные комплексы являются, по существу, новыми полимерными материалами, хотя и получены в большинстве случаев из известных полимеров при простом смешении растворов взаимодействующих компонентов в общем растворителе. Это открывает новые пути рационального использования известных полимеров и сам процесс комлексообразования можно рассматривать как способ модификации традиционных полимеров.
По типу специфических взаимодействий, обуславливающих комплексообразование, различают комплексы, обусловленные ван-дер-ваальсовыми взаимодействиями (например, комплексы стереоизомеров полиметилметакрилата), электростатическими взаимодействиями (полиэлектролитные комплексы), комплексы с водородными связями (комплексы неионогенных полимеров с поликарбоновыми кислотами), комплексы с координационными связями (например, комплексы полимер-металл).
Существует большой класс так называемых молекулярных комплексов, которые являются продуктами невалентных взаимодействий, в основном, неионогенных полимеров – полиэтиленгликоля (ПЭГ) с резорцином, поливинилпиролидона (ПВПД) с фенолами, высокомолекулярные соединения включения полиэтиленгликоля с мочевиной, тиомочевинной, пергидротрифениленом, солям ртути, поливинилового спирта (ПВС) с йодом и боратами. К молекулярным комплексам относятся комплексы, образующиеся между гетероатомом (O, N, S, P)-содержащими полимерами и ионами щелочных и щелочно-земельных металлов. Эти комплексы стабилизированы ион-дипольными взаимодействиями. Наряду с основным взаимодействием, обуславливающим образование полимерного комплекса, не менее важную роль играют и другие взаимодействия. Например, в стабилизации полиэлектролитных комплексов с водородными связями большую роль играют гидрофобные взаимодействия.
В процессах комплексообразования полимеров могут участвовать различные классы соединений: комплементарные макромолекулы (интерполимерные комплексы), поверхностно-активные вещества (комплексы полимер-ПАВ), ионы металлов (комплексы полимер-металл), красители (комплексы полимер-краситель), лекарственные вещества, органические молекулы и т.д.[4-9].
Полимерные комплексы могут быть получены несколькими способами. Наиболее распространенный из них – это смешение растворов готовых взаимодействующих компонентов в общем растворителе. В результате образуются так называемые комплексы смешения, свойства которых наиболее детально изучены в растворах[4-8]
Полимерные комплексы могут быть получены методом матричной полимеризации. При этом образуются более высокоориентированные полимерные комплексы, поскольку матрица контролирует скорость образования «дочерней цепи», её длину, химическое строение и структуру. Полимерный комплекс образуется лишь при достижении некоторой критической степени полимеризации «дочерней цепи», после чего растущая цепь ассоциируется с матрицей и начинается собственно матричная полимеризация.
В последние годы разработан новый способ получения полимерных комплексов в дополнение к традиционным (смешением растворов готовых комплементарных молекул или реакцией матричной полимеризации). Способ заключается в осуществлении реакции коплексообразования на границе раздела двух несмешивающихся жидкостей, например, бензол-вода, в которой растворены взаимодействующие компоненты[12-14]. Эти несмешивающиеся жидкости являются перекрестно-селективными растворителями для исходных компонентов. Полимерные комплексы образуются в виде тонких пленок на границе раздела фаз.
Факт комплексообразования в каждой системе устанавливается совокупностью физических и физико-химических методов. Самые различные методы – потенциометрия, кондуктометрия, турбидиметрия, вискозиметрия, калориметрия, седиментация, двойное лучепреломление, светорассеяние, высокоразрешающая ЯМР-спектроскопия, хроматография, ИК- и УФ-спектроскопия, флуоресценция, электронная микроскопия, рентгеноструктурный анализ и другие могут быть использованы для исследования образования, состава и свойств полимерных комплексов.
Экспериментальные результаты могут быть представлены в виде кривых титрования или диаграмм свойство-состав. Экстремумы или точки перегиба на кривых титрования указывают на образование комплексов и их состав. Диаграммы свойство-состав бинарной смеси не подчиняются правилу аддитивности, имеют экстремальный характер и обнаруживают особые точки, что согласно основам физико-химического анализа, свидетельствует об образовании индивидуального соединения (полимерного комплекса), имеющего определенный состав. На седиментограммах поликомплексов наблюдается один пик, однозначно подтверждающий, что полимерный комплекс является индивидуальным соединением, а не смесью исходных взаимодействующих компонентов. В том случае, когда комплексообразования в системе не происходит и комплексы не образуются, кривые титрования не имеют особых точек, а зависимости свойство-состав не подчиняются правилу аддитивности.
Полимерные компоненты, участвующие в реакциях комплексообразования, могут быть гомополимерами и сополимерами (регулярными, статистичными, блочными). Они могут нести положительный заряд (поликатионы), отрицательный заряд (полианионы), оба типа зарядов (полиамфолиты), или быть неионогенными.
1.2 Комплексы полимеров с низкомолекулярными соединениями
1.2.1 Комплексы полимер – ион металла
Полимер-металлические комплексы образуются в результате взаимодействия полимеров содержащих функциональные группы (поликатионов, полианионов, неионогенных полимеров), с ионами переходных металлов (Cu2+, Cd2+, Zn2+, Ni2+, Co2+, Mg2+, Fe2+ и др.)[14]. Возможно получение таких комплексов и путем полимеризации закомплексованного мономера, например, винилового эфира моноэтаноламина с ионами переходных металлов. Этот класс полимерных комплексов представляет большой интерес в процессах очистки и извлечения ионов металлов из промышленных и природных вод, в процессах водоподготовки, синтеза полимерных катализаторов, действующих по принципу энзимов, извлечения ионов металлов из почв и т.д.
Обычно связь между ионом металла и полимерным лигандом осуществляется посредством донорно-акцепторного взаимодействия с образованием координационной связи (хелатные комплексы) или замещением протона лиганда ионом металла с образованием ионной связи. Ионы металлов являются акцепторами; атомы O-, -N, -S, -F, -Cl полимерной цепи, предоставляющие пару электронов для образования связи, являются донорами. В низкомолекулярных комплексных соединениях обычно координационное число металла равно 4 или 6. В случае макромолекулярных лигандов могут образовываться координационные центры состава 1:1, 1:2, 1:3 или 1:4. Свободные вакансии координационной сферы ионов переходных металлов занимают молекулы растворителя или других низкомолекулярных веществ. Изменение конформации полимерного лиганда в процессе комплексообразования может значительно влиять на результаты расчетов координационного числа иона металла и константы устойчивости комплексов[13,14]. Так, до сих пор остается открытым вопрос: имеет место ступенчатое образование комплекса полимер – металл или сразу образуется полимер-металлический комплекс с максимальным координационным числом?
Характерной особенностью комплексов полимер – металл в отличие от комплексов низкомолекулярный лиганд – металл является близость всех последовательных констант комплексообразования. Это связано с высокой локальной плотностью активных центров взаимодействия в полимерных цепях, т.е. «полимерный эффект» может играть значительную роль в образовании комплексов полимер – ион металла.
В водном растворе ионы металлов всегда гидратированы (т.е. координационно связаны с водой) – иногда частично, а иногда и полностью. Комплексообразование протекает через замещение некоторого числа молекул воды лигандами, к которым металл имеет большое сродство. При равных концентрациях двух или большого числа лигандов (или двух или большого числа ионов металлов при данной концентрации лиганда) наибольшую концентрацию в состоянии равновесия будет иметь координационное соединение с наибольшей константой устойчивости.
Полимер-металлические комплексы могут быть получены различными путями: 1) в результате внутри- и или межмолекулярной «сшивки»; 2) при взаимодействии полимерного лиганда со стабильным комплексом, в котором центральный ион металла замаскирован низкомолекулярным лигандом; 3) полимеризацией пар мономер-ион металла; 4) путем включения иона металла в сетку полимера и т.д.
Комплексы полимер – ион металла в воде имеют компактную структуру, стабилизированную внутри- и межцепными координационными «сшивками», которые существенно изменяют размер клубка полилиганда. При добавлении к раствору поли-4-винилпиридина (П4ВП) в метаноле вязкость уменьшается, т.е. происходит сворачивание цепей П4ВП вследствие внутрицепного хелатирования. Сжатие макромолекул различно для разных ионов металла, т.е. структура полимер-металлического комплекса зависит от типа иона металла.
На устойчивость комплексов полимер – ион металла в растворе сильное влияние оказывают такие факторы как конформация и микроструктура полимерных лигандов, природа металлов, степень ионизации, природа противоионов (анионов) металлов, рН среды, ионная сила раствора, природа растворителя, температура, т.е. все те факторы, которые определяют конформационное состояние макромолекул в растворе и их гидродинамические характеристики. Многочисленные исследования систем полимер – металл посвящены установлению влияния этих факторов на свойства и структуру образующихся полимер-металлических комплексов.
Обнаружено, что некоторые типы синтетических полиамфолитов способны связывать ионы металлов при определенных значениях рН и высвобождать их в изоэлектрической точке (ИЭТ). Такое поведение полиамфолитов, возможно связано с тем, что в ИЭТ электростатическое притяжение между противоположно заряженными зарядами звеньев полиамфолита является более сильным, чем взаимодействие полимер – металл, что ведет к высвобождению связанных ионов металлов из макромолекулярного клубка.
Путем стехиометрических превращений в звеньях полимерной цепи возможна настройка «первичной» структуры макромолекулы на взаимодействие с определенным ионом металла. Так, комплекс линейный полимер – ион металла сшивается сшивающим агентом, и затем металл удаляется действием минеральной кислоты. Полученный сорбент обладает высокой специфичностью и селективностью.
Повышенный интерес к полимерметаллическим комплексам, с одной стороны, обусловлен тем, что некоторые ионы металлов (железо, медь кобальт, и др.) играют особо важную роль в живых организмах – участвуют в ферментативных реакциях (металлоэнзимы), мышечных сокращениях, явлениях переноса (например, гемоглобин), мембранных процессах (натрий-каливый насос) и т.д. Другая необходимость изучения комплексов полимер-металл связана с практическими задачами – извлечением редких и благородных металлов из промышленных сточных вод, созданием высокоэффективных гомогенных и гетерогенных полимерных катализаторов, термо- и механостойких полимерных материалов, полупроводников, мембран и т.д. Возрастает роль комплексных соединений полимеров в медицине. Всестороннее исследование процессов комплексообразования с целью определения состава, структуры и констант устойчивости комплексов, кинетики и механизма их формирования, анализ влияния микроструктуры, конформационного состояния макромолекул и хелатного эффекта, в конечном счете, может привести к установлению основных закономерностей комплексообразования и физико-химического поведения координационных соединений в растворах.
Помимо органических полимеров должны быть рассмотрены и неорганические макромолекулы, которые обеспечивают лучшую теоретическую и химическую стойкость образующихся полимер-металлических комплексов. Должны быть также рассмотрены надмолекулярные структуры полимер-металлических комплексов, обеспечивающие некоторые свойства материалов на их основе. Взаимодействия макромолекула – ион металла (комплекс, хелат) контролируют не только высокоорганизованную структуру полимер-металлических комплексов, но и их свойства. Полагают возможным обнаружение полимер-металличесими комплексами следующих свойств и соответствующее их применение:
· Извлечение и концентрирование ионов металлов посредством образования комплексов полимер-металл
· Терапевтические эффекты – лекарства, протолекарства
· Селективность – газовый транспорт / разделение, сенсоры
· Ионная проводимость – электрон-улавливающие устройства, батареи
· Системы переменой валентности – мультиэлектронный переход, катализ, фотокатализ
· Электронные взаимодействия в твердом состоянии – проводимость, электрокатализ, электрохимия
· Фотовзаимодействия в твердом состоянии – фотопроводимость, фотогальваника, лазерография, люминесценция, оптическое хранение / переключение
· Нелинейная оптика – модуляторы, интегрированная оптика
· Керамика – квантовые устройства
Наиболее широко взаимодействия полимер – ион металла используются для извлечения и концентрирования ионов металлов. [13,14]
1.3 Амфотерные полиэлектролиты
Высокомолекулярные соединения, содержащие в цепи функциональные группы кислотного и основного характера, называются полиамфолитами. К ним относится большинство полимеров биологического происхождения – белки и нуклеиновые кислоты. Однако в отличие от синтетических аналогов биополимеры обладают специфическим строением, функциями и свойствами, которые в полной мере проявляются лишь в живом организме. Тем не менее, ряд свойств природных полимеров удается моделировать при помощи синтетических амфотерных макромолекул.
Широко и разнообразно применение практическое применение амфотерных полиэлектролитов в различных областях народного хозяйства. Амфотерные ионообменники обладают высокой сорбционной емкостью по отношению к ионам металлов и позволяют проводить селективное разделение. Благодаря высокому содержанию функциональных групп они служат эффективными флокулянтами и коагулянтами. Полимерные амфолиты могут выступать в роли катализаторов, моделирующих функцию биокатализаторов – ферментов, носителей лекарственных препаратов – полимерных депо, микрокапсул, латексов и т.д.
Извлечение ионов переходных металлов и органических примесей как водорастворимыми, так и водонабухающими полиамфолитами особенно важно для гидрометаллургии и решения экологических проблем. В большинстве случаев взаимодействие водорастворимых полиамфолитов с ионами переходных металлов сопровождается осаждением комплексов полиамфолит – металл. Ионы металлов могут быть выщелочены из осадка более сильным низкомолекулярным комплексующим агентом. Извлечение ионов металлов также возможно в изоэлектрической точке (ИЭТ) полиамфолитов. Если ИЭТ растворимого полиамфолита смещена преимущественно в щелочную область, то ионы переходных металлов могут осаждаться в виде гидроксидов, а макромолекулы растворимого полиамфолита остаются в супернатанте. И наоборот, если ИЭТ находиться в кислой области и полиамфолит является нерастворимым, то тогда полиамфолит может осаждаться, в то время как ионы металлов остаются в растворе. Эти подходы успешно используются для разделения ионов переходных металлов.
В зависимости от изменения рН среды полиамфолиты проявляют свойства, как поликислот, так и полиоснований. Значение рН, при котором средний заряд макромолекул равен нулю, соответствует изоэлектрической точке полиамфолита (ИЭТ). Классическим методом установления ИЭТ является электрофорез при разных рН с экстраполяцией к нулевому заряду.
Можно ожидать, что в области рН, значительно удаленной от ИЭТ, в макромолекуле будет появляться избыток зарядов одного знака. Это, в свою очередь, разворачивает цепные молекулы и увеличивает их размеры. При приближении к ИЭТ взаимное притяжение противоположно заряженных групп должно приводить к относительно плотному сворачиванию полиионов. Характерная особенность большинства полиамфолитов – ухудшение растворимости в воде вблизи ИЭТ.
По поведению вблизи ИЭТ полиамфолиты можно разделить на два типа: полиамфолиты, водорастворимые при любых значениях рН, и полиамфолиты, которые вблизи ИЭТ коагулируют и дают область нерастворимости. Наличие или отсутствие растворимости определяется концентрацией биполярных ионов (цвиттерионов) в ИЭТ. Если в пределе полимерная молекула представляет собой строение цвиттериона, то данный полиамфолит водорастворим во всем интервале изменения рН. Если же макромолекула в ИЭТ не заряжена (т.е. концентрация биполярных ионов очень низкая), то для таких полиамфолитов обнаруживается область нерастворимости. В свою очередь концентрация цвиттерионов зависит от константы диссоциации кислотных и основных составляющих сополимера.
Равновесие ионов водорода в растворах синтетических полиамфолитов детально не анализировалось. Причина этого заключается в том, что вблизи ИЭТ макромолекула в целом электронейтральна и имеет очень компактную конформацию. При приближении к ИЭТ труднее титровать ту или иную группу, несмотря на изменение рН среды на две единицы. Однако по мере преобладания положительного или отрицательного зарядов происходит разворачивание цепи, и дальнейшее титрование кислотных и основных групп значительно облегчается.
Для амфотерных полиэлектролитов вблизи ИЭТ возможно увеличение размеров клубка в присутствии низкомолекулярных электролитов. В кислой и щелочной областях молекулы полиамфолита веду себя как поликатионы и полианионы соответственно – вязкость полиамфолита () падает с ростом ионной силы раствора (), тогда как в ИЭТ наблюдается противоположный эффект – вязкость полиамфолита возрастает с увеличением . Такой характер изменения () с ростом ионной силы обусловлен тем, что низкомолекулярный электролит, экранируя противоположные заряды на макромолекулах, ослабляет их взаимодействие и приводит к разворачиванию клубка.
Амфотерные полиэлектролиты наиболее близки по своей структуре и поведению к биологическим полимерам. Однако процесс комплексообразования с участием полиамфолитов и ионов металлов изучен недостаточно. Причиной этого является, по-видимому, сложность структуры и конформационная лабильность такого класса полиэлектролитов. В отличие от гомополиэлектролитов полиамфолиты в своем составе содержат, по крайней мере, две потенциально комплексообразующие группы. Причем доля их участия в образовании комплексов будет определяться структурой и составом сополимеров, степенью ионизации составляющих звеньев, а также конформационным состоянием амфотерных макромолекул, зависящим от рН среды, ионной силы раствора, температуры и т.д. [7,13, 14].
1.4 Применение комплексов полимер – металл в катализе
Одним из интенсивно развивающихся направлений химии является катализ полимерами, возникший на стыке химии высокомолекулярных соединений, координационной химии и каталитической химии. С помощью синтетических макромолекул можно конструировать полимерные катализаторы, работающие по принципу ферментов, многие из которых представляют собой ионополимеры с встроенными ионами металлов. Благодаря точности сборки такие полимер-металлические комплексы проявляют высокую каталитическую активность, стабильность и избирательность действия. В решении важных проблем химической и нефтехимической отрасли большая роль будет принадлежать каталитически активным металлокомплексам, закрепленным на полимерные носители. Они представляют собой гетерогенные катализаторы с активной фазой – гомогенным комплексом, который может быть закреплен на полимерной подложке различными способами – инкапсуляцией, ковалентным присоединением, координационными связями, гельиммобилизацией и т.д. Эти катализаторы сочетают преимущества как гомогенных (высокая активность и селективность), так и гетерогенных катализаторов (простота отделения катализатора от продуктов реакции).
Полимеры, содержащие функциональные группы, являются подходящими носителями ионов металлов. При взаимодействии их с ионами металлов образуются новые типы координационных соединений, в которых лигандами являются макромолекулы.
Интерес к координационным соединениям ионов различных металлов с макромолекулярными лигандами обусловлен тем, что ионы железа, меди, кобальта, цинка играют важную роль в ферментативных реакциях.
Каталитическое действие комплексов водорастворимых полимеров с ионами переходных металлов рассмотрено на примере реакций разложения пероксида водорода, окисления, гидрирования и др. Такие комплексы часто проявляют более высокую активность, чем соответствующие низкомолекулярные аналоги.[6,11,14].
2.Методическая часть
2.1 Характеристика исходных веществ
При выполнении работы были использованы следующие реактивы:
Полиамфолит ПКЭАК бетаиновой структуры (синтезирован в институте полимерных материалов и технологий г. Алматы)
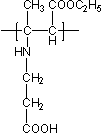
CoCl2, NiCl2, Cd (CH3COO)2, Sr (NO3)2, CaCl2, ZnSO4, Pb (NO3)2, CuCl2.
NaOH (фиксанал), HCl – 37% , г/см3, Буферные растворы приготовленные из стандарт-титров с pH = 1,65; 6,86; 9,18.
Использованные приборы:
рН растворов измеряли на иономере универсальном ЭВ-74 со стеклянным и хлорсеребряным электродом.
Для работы были использованы:
1. Аналитические весы.
2. Технические весы.
3. Калька.
4. Фильтровальная бумага.
5. Мерные колбы на 25мл, 50мл, 100мл, 1000мл.
6. Пипетки на 1мл, 2мл, 5 мл, 10мл.
7. Колбы для титрования.
8. Бюретка.
9. Стаканчики на 25мл, 50мл.
10. Секундомер.
11. Груша.
12. Мерные цилиндры на 25мл.
13. Воронки.
2.2 Методика исследования
рН-метрическое титрование проводили при помощи иономера ЭВ-74 (точностью измерения + 0,05 ед рН) со стеклянными и хлорсеребряными электродами. Градуировку электродной системы осуществляли по стандартным буферным растворам с рН = 1,65; 6,86; 9,18.
В стакан для титрования наливают 10 мл 0,001 М раствора полимера. Титрование ведут 0,01 М раствором соли металла при постоянном перемешивании из микробюретки. Измерение рН производят через каждые 0,05 мл добавленной соли металла до постоянного значения pH. Результаты отображают в виде графика, где на оси абсцисс – объем прилитой соли металла, на оси ординат – соответствующее значение pH.
Таблицы и графики представлены в приложении.
3.Экспериментальная часть
3.1Результаты и обсуждение
Цель работы:
1. Исследование комплексообразования ПКЭАК с ионами двухвалентных металлов: Ca, Sr, Ni, Co, Cd, Pb, Zn, Cu.
Полимер бетаиновой структуры синтезирован в институте полимерных материалов и технологий г. Алматы содержит в полимерной цепи карбоксильные группы и аминогруппы, что позволяет рассматривать его как новый полиамфолит. Определение комплексообразования ПКЭАК с ионами двухвалентных металлов провели потенциометрическим методом.
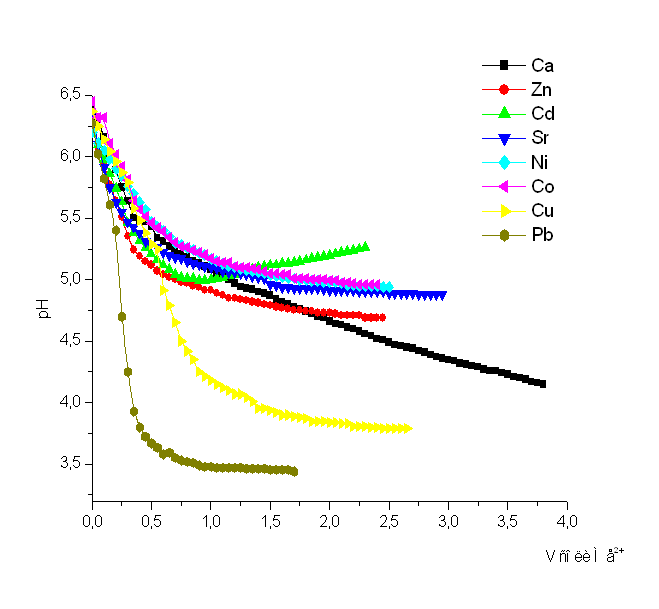
Как видно из рис. 1 – 8 при титровании идет постепенное снижение pH раствора, что свидетельствует о взаимодействии ПКЭАК с ионами металлов, при котором в раствор постепенно выделяются ионы водорода. На рис. 4 представлена кривая титрования ПКЭАК раствором Cd(CH3COO)2. Из рисунка видно, что при титровании полимера кривая постепенно идет вниз, затем, достигнув точки эквивалентности, идет вверх. Предположительно увеличение pH, после точки эквивалентности, связано с гидролизом соли, образованной слабым основанием и слабой кислотой.
Как видно из сводного графика, рис. 9, наибольшей склонностью к комплексообразованию с ПКЭАК обладает ион Pb2+. Таким образом, кривые потенциометрического титрования свидетельствуют об образовании полимер – металлических комплексов (ПМК).
Заключение
В результате проведенных исследований получены следующие результаты:
1. Методом потенциометрического титрования исследовано взаимодействие полимера с ионами металлов Co2+ и Ni2+, Pb2+, Ca2+, Zn2+, Sr2+, Cd2+, Cu2+. Полученные данные свидетельствуют о возможности использования полибетаинов: в процессах очистки питьевой воды, для извлечения ионов металлов из промышленных сточных вод, извлечения ионов металлов из загрязненных почв и т.д.
Список использованных источников
1. Френкель С. Я. Полимеры, проблемы, перспективы, прогнозы. //В кн. Физика сегодня и завтра. Л. 1973. С. 179.
2. Волькенштейн М. В. Молекулярная биофизика. М. Наука. 1975. 616с.
3. Bekturov E. A., Bimendina L. A. //J. Macromol. Sci. Rev. Macromol. Chem.Phys. 1997.C37(3).P.501.
4. Зезин А.Б., Кабанов В. А. //Успехи химии. 1982. Т. 56. С. 1447.
5. Бектуров В.А., Бимендина Л.А. Интерполимерные комплексы. Алма-Ата. Наука 1977. 264с.
6. Бектуров Е.А., Бимендина Л А., Кудайбергенов С.Е. Полимерные комплексы и катализаторы. Алма-Ата. Наука. 1982. 192 с.
7. Бектуров Е. А., Кудайбергенов С. Е., Хамзамулина Р. Э. Катионные полимеры. Алма-Ата. Наука. 1986. 159с.
8. Бектуров Е.А., и др. Молекулярные комплексы полимеров. Алма-Ата. Наука. 1988. 174с.
9. Паписов И. М. //Высокомолек. ссоед. 1997. Т. Б39. С. 562.
10. Бимендина Л. А., Бектуров Е. А., Самоорганизация молекул в растворах и на границе раздела фаз. //В. Кн. «Неравновесность и неустойчивость в эволюции динамических структур в природе » Алматы. Ғылым. 1998. С. 157.
11. Бектуров Е. А., Кудайбергенов С. Е. Катализ полимерами. Алма-Ата. Наука. КазССР. 1988. 184с.
12. Кабанов Н. М. и др. //Высокомолек. соед. 1979. Т. А21. С.209.
13. Бектуров Е. А., Бимендина Л. А., Мамытбеков Г. К.//Комплексы водорастворимых полимеров и гидрогелей.
14. Бимендина Л.А., Яшкарова М.Г., Кудайбергенов С.Е., Бектуров Е.А. Полимерные комплексы (получение, свойства, применение): Монография / под редакцией Жубанова Б.А. – Семипалатинский государственный университет имени Шакарима – Семипалатинск, 2003. – 313 с.
Таблица 1
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром Sr(NO3)2
|
V Sr(NO3)2 |
pH |
V Sr(NO3)2 |
pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Таблица 2
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром Cd(CH3COO)2
|
V Cd(CH3COO)2 |
pH |
V Cd(CH3COO)2 |
pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Таблица 3
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром ZnSO4
|
V ZnSO4 |
pH |
V ZnSO4 |
pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Таблица 4
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром CaCl2
|
V CaCl2 |
pH |
V CaCl2 |
pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Таблица 5
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром NiCl2
|
V NiCl2 |
pH |
V NiCl2 |
pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Таблица 6
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром CoCl2
|
V CoCl2 |
pH |
V CoCl2 |
pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Таблица 7
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром CuCl2
|
V CuCl2 |
pH |
V CuCl2 |
pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Таблица 8
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром Pb(NO3)2
|
Pb(NO3)2 |
pH |
Pb(NO3)2 |
pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Рисунок 1

Рисунок 2

Рисунок 3
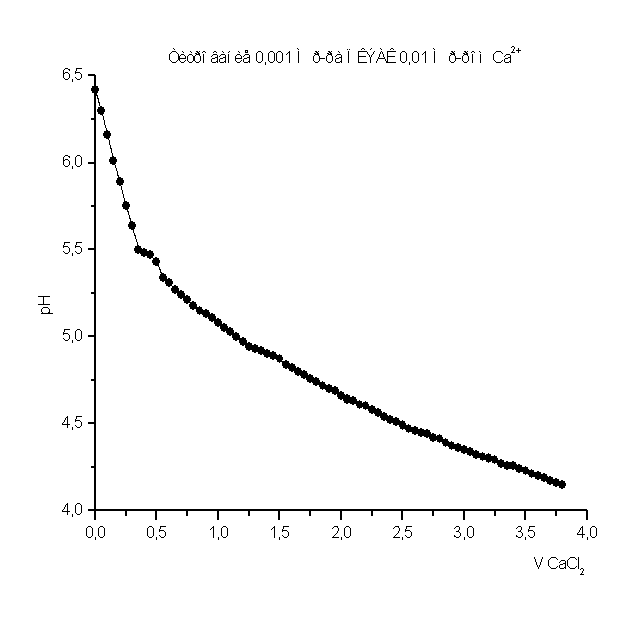
Рисунок 4

Рисунок 5
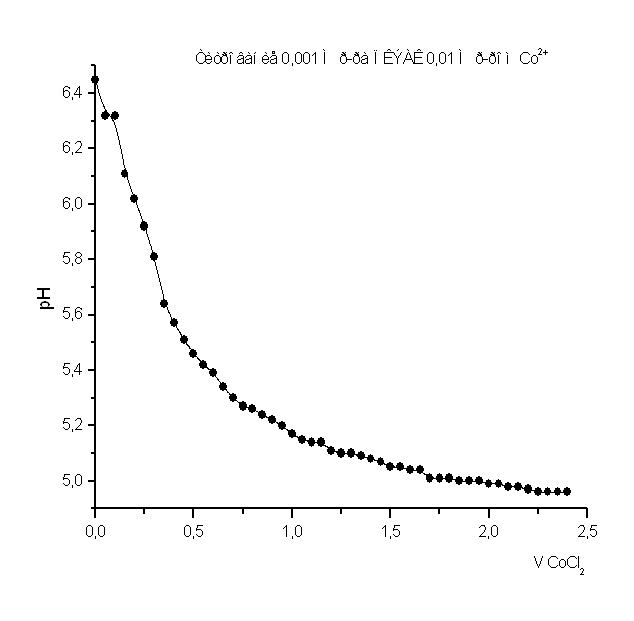
Рисунок 6

Рисунок 7

Рисунок 8

Рисунок 9