Курсовая работа: Масс-спектрометрический метод анализа
ЧЕЛЯБИНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Химический факультет
Курсовая
работа на тему
«Масс-спектрометрический метод анализа»
Выполнил:
студент группы Х-202
Меньшенин А.Н.
Проверила: Данилина Е.И.
Челябинск
2007
Содержание
1. ВВЕДЕНИЕ
2. Основы масс-спектрометрии
3. Принципиальное устройство масс-спектрометра
4. Способы ввода образца
5. Механизмы ионизации
6. Протонирование
7. Депротонирование
8. Катионизация
9. Прямой перенос заряженной молекулы в газовую фазу
10. Отрыв электрона
11. Захват электрона
12. Способы ионизации
13. Ионизация электроспрея (ESI)
14. Растворители для электроспрея
15. Устройство прибора ионизации электроспрея
16. Ионизация наноэлектроспрея (nanoESI)
17. Химическая ионизация при атмосферном давлении (APCI)
18. Фотоионизация при атмосферном давлении (APPI)
19. Лазерная десорбция/ионизация при помощи матрицы (MALDI)
20. Преимущества и недостатки метода лазерной десорбции/ионизации при помощи матрицы (MALDI).
21. Десорбция/ионизация на кремнии (DIOS)
22. Бомбардировка быстрыми атомами/ионами (FAB)
23. Электронная ионизация (EI)
24. Химическая ионизация (CI)
25. Сравнение основных характеристик способов ионизации
26. Анализаторы масс
27. Анализ масс
28. Краткий обзор принципов работы анализаторов
29. Рабочие характеристики анализаторов
30. Точность
31. Разрешение (разрешающая сила)
32. Диапазон масс
33. Тандемный анализ масс (MS/MS или MSn)
34. Скорость сканирования
35. Конкретные виды анализаторов
36. Квадрупольный анализатор
37. Квадрупольная ионная ловушка
38. Линейная ионная ловушка
39. Ограничения ионной ловушки
40. Двуфокусирующий магнитный сектор
41. Квадрупольная-времяпролётная тандемная масс-спектрометрия
42. MALDI и времяпролётный анализ
43. Квадрупольная времяпролётная масс-спектрометрия
44. Масс-спектрометрия с Фурье-преобразованием (FTMS)
45. Общее сравнение анализаторов масс, обычно используемых совместно с ES
46. Детекторы
47. Электронный умножитель
48. Цилиндр Фарадея
49. Фотоумножитель с преобразующим динодом
50. Матричный детектор
51. Зарядовый (индуктивный) детектор
52. Общее сравнение детекторов.
53. Вакуум масс-спектрометра
Список использованной литературы
ВВЕДЕНИЕ
Масс-спектрометрию описывали как мельчайшие весы в мире, не из-за размера масс-спектрометра, но из-за того, что он взвешивает – молекулы. За последнее время масс-спектрометрия претерпела потрясающий технологический подъём, позволяющий применять её для белков, пептидов, углеводов, ДНК, лекарств и многих других биологически активных молекул. Благодаря таким способам ионизации, как ионизация электроспрея (ESI) или лазерная десорбция/ионизация из матрицы (MALDI), масс-спектрометрия стала незаменимым инструментом для биохимических исследований.
Основы масс-спектрометрии
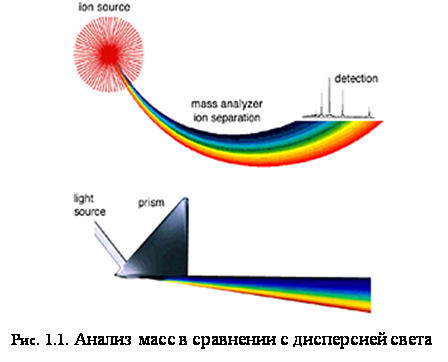
Масс-спектрометр определяет массу молекулы, измеряя отношение массы к заряду (m/z) её иона. Ионы генерируются при потере или получении заряда нейтральными частицами. После образования ионы электростатически направляются в анализатор массы, где они разделяются соответственно своему m/z и, наконец, детектируются. Результатом ионизации молекул, разделения ионов и детектирования ионов является спектр, по которому можно определить молекулярную массу и даже некоторую информацию о строении вещества. Можно провести аналогию между масс-спектрометром и призмой, как показано на рис. 1.1. В призме свет разделяется на компоненты по длинам волн, которые затем определяются оптическим рецептором. Точно так же, в масс-спектрометре сгенерированные ионы разделяются в анализаторе массы, подсчитываются и определяются в детекторе ионов (таких, как, например, электронный умножитель).
Четыре базовых компонента являются стандартными для большей части масс-спектрометров (рис. 1.2): система ввода образца, устройство иониза-
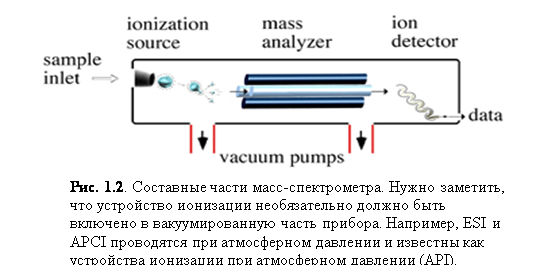
ции, анализатор массы и детектор ионов. Некоторые приборы комбинируют ввод образца и ионизацию, в других объединены анализатор массы и детектор. Однако все молекулы образца претерпевают одинаковые воздействия независимо от конфигурации прибора. Молекулы образца вводятся через систему впуска. Попав внутрь прибора, молекулы преобразуются в ионы в устройстве ионизации, а затем электростатически переносятся в анализатор массы. Ионы затем разделяются соответственно их m/z. Детектор преобразует энергию ионов в электрические сигналы, которые затем поступают в компьютер.
Способы ввода образца
Ввод образца был одной из первых проблем в масс-спектрометрии. Для проведения анализа масс образца, который первоначально находится при атмосферном давлении (760 Торр), он должен быть введён в прибор таким образом, чтобы вакуум внутри последнего остался практически неизменным (~10-6 Торр). Основными методами ввода образца являются прямое введение
зонда или подложки, обычно используемое в MALDI-MS, или прямое вливание или впрыскивание в устройство ионизации, как в методе ESI-MS. [1]
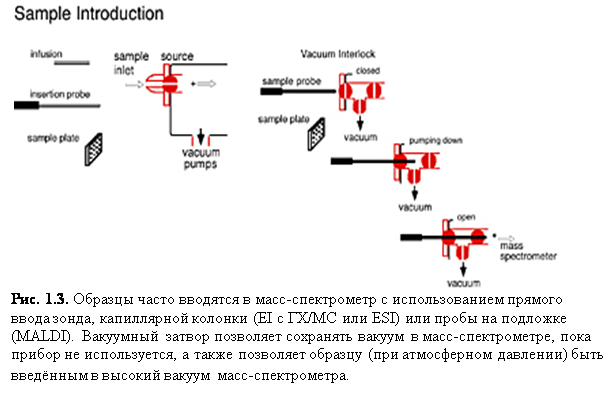
Прямое введение: использование прямого введения
зонда/подложки (рис. 1.3) – очень простой способ доставки образца в
прибор. Образец сначала размещается на зонде, а затем вводится в ионизационную
зону масс-спектрометра, обычно через вакуумный клапан. Образец после
подвергается необходимым процедурам десорбции, таким как лазерная десорбция или
прямое нагревание, чтобы обеспечить испарение и ионизацию.
Прямое вливание или впрыскивание: простой капилляр или капиллярная колонка используется для помещения образца в газообразной форме или в растворе. Прямое вливание также удобно, потому что оно позволяет эффективно вводить малые количества вещества в масс-спектрометр без нарушения вакуума. Капиллярные колонки обычно используются для разграничения систем разделения и устройства ионизации масс-спектрометра. Эти системы, включая газовую хроматографию (ГХ) и жидкостную хроматографию (ЖХ), также служат для разделения различных компонентов раствора, важных для анализа масс. В газовой хроматографии разделение различных компонентов происходит в стеклянной капиллярной колонке. Как только пары образца покидают хроматограф, они направляются прямиком в масс-спектрометр.
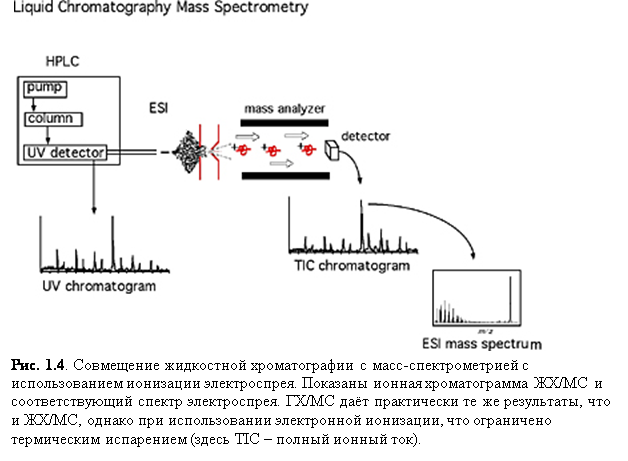
В 1980-х годах невозможность
совместного использования жидкостной хроматографии (ЖХ) с масс-спектрометрией
была обусловлена, большей частью, неспособностью устройств ионизации
справляться с непрерывным по-
током ЖХ. Однако, ионизация электроспрея (ESI), химическая ионизация при атмосферном давлении (APCI) и фотоионизация при атмосферном давлении (APPI) сейчас позволяют совмещать ЖХ и масс-спектрометрию в повседневных анализах.
Механизмы ионизации
Протонирование – механизм ионизации, при котором к молекуле присоединяется протон, сообщая ей заряд 1+ на каждый присоединённый протон. Положительные заряды обычно локализуются на основных частях молекулы, таких, как амины, с образованием стабильных катионов. Пептиды часто ионизируются при помощи протонирования. Протонирование осуществляется при MALDI, ESI и APCI.
Депротонирование – механизм ионизации, при котором отрицательный заряд 1- получается при отрыве протона от молекулы. Такой механизм ионизации обычно осуществляется при MALDI, ESI и APCI и очень полезен для определения кислотных образцов, включая фенолы, карбоновые кислоты и сульфоновые кислоты. Спектр отрицательных ионов сиаловой кислоты показан на рис 1.2.
Катионизация – механизм ионизации, в котором заряженный комплекс образуется при координационном присоединении положительно заряженного иона к нейтральной молекуле. В принципе, пртонирование тоже подпадает под это определение, поэтому катионизацией считается присоединение иона, отличного от протона, например щелочного металла или аммония. Кроме того, катионизация применима к молекулам, которые неспособны к протонированию. Связь катионов, в отличие от протонов, с молекулой менее ковалентна, поэтому заряд остаётся локализован на катионе. Это минимизирует размывание заряда и фрагментацию молекулы. Катионизация также может быть произведена при MALDI, ESI и APCI. Углеводы – лучшие вещества для такого механизма ионизации, с Na+ как обычным присоединённым катионом.
Прямой перенос заряженной молекулы в газовую фазу
Перенос соединений, уже заряженных в растворе, легко достигается при использовании десорбции или выбрасыванием заряженных частиц из конденсированной фазы в газовую. Обычно это осуществляется с использованием MALDI или ESI.
Отрыв электрона
Как видно из названия механизма, отрыв электрона придаёт молекуле 1+ положительный заряд при выбивании электрона, так что при этом часто образуются катион-радикалы. Наблюдаемый, в основном, при электронной ионизации, отрыв электрона обычно применяется для относительно неполярных соединений с низкой молекулярной массой. Также известно, что он часто приводит к образованию значительных количеств фрагментарных ионов.
Захват электрона
При захвате электрона, отрицательный заряд 1- сообщается молекуле при присоединении электрона. Этот механизм ионизации в первую очередь наблюдается для молекул с большим сродством к электрону, таких как галогенсодержащие соединения.
Таблица 1.1. Механизмы ионизации, их преимущества и недостатки.
|
Механизм ионизации |
Преимущества |
Недостатки |
| Протонирование (положительные ионы) |
· многие соединения присоединяют протон с получением заряда · многие способы ионизации, такие, как ESI, APCI, FAB, CI и MALDI производят такие частицы |
· многие соединения нестабильны в протонированной форме (например, углеводы) или с трудом присоединяют протон (например, углеводороды) |
| Катионизация (положительные ионы) |
· многие соединения присоединяют катион, такой как Na+ или K+ с получением заряда · многие способы ионизации, такие, как ESI, APCI, FAB и MALDI производят такие частицы |
· опыты тандемной масс-спектрометрии на катионизированных молекулах часто дают очень ограниченную информацию по фрагментации |
| Депротонирование (отрицательные ионы) |
· многие полезные вещества в какой-то мере являются кислотами · многие способы ионизации, такие, как ESI, APCI, FAB и MALDI производят такие частицы |
· применимо только для специфических соединений |
| Перенос заряженных молекул в газовую фазу (положительные и отрицательные ионы) |
· полезно для соединений, которые уже заряжены · многие способы ионизации, такие, как ESI, APCI, FAB и MALDI производят такие частицы |
· применимо только для уже заряженных частиц |
| Отрыв электрона (положительные ионы) | · наблюдается при электронной ионизации и даёт информацию не только о молекулярной массе, но и информацию о фрагментарных ионах |
· часто производит слишком сильную фрагментацию · может быть непонятно, является ли ион с наибольшей массой молекулярным ионом или же фрагментом |
| Захват электрона (отрицательные ионы) | · наблюдается при электронной ионизации и даёт информацию не только о молекулярной массе, но и информацию о фрагментарных ионах |
· часто производит слишком сильную фрагментацию · может быть непонятно, является ли ион с наибольшей массой молекулярным ионом или же фрагментом |
Способы ионизации
Вплоть до 1980-х электронная ионизация (EI) была основным способом ионизации для анализа масс. Однако EI ограничивала химиков и биохимиков малыми молекулами, масса которых намного ниже массы большинства биоорганических соединений. Это ограничений побудило таких учёных, как Дж. Б. Фенн, К. Танака, Ф. Хилленкамп, М. Карас, Г. Кукс и М. Барбер, разработать новое поколение способов ионизации, включая бомбардировку быстрыми атомами/ионами (FAB), лазерную ионизацию при помощи матрицы (MALDI) и ионизацию электроспрея (таблица 1.2). Эти способы совершили революцию в биомолекулярном анализе, особенно для больших молекул. Среди них, ESI и MALDI стали по-настоящему «избранными», когда дело касается биомолекулярного анализа.
Таблица 1.2.
|
Способ ионизации |
Аббревиатура |
События |
| Ионизация электроспрея | ESI | испарение заряженных капель |
| Ионизация наноэлектроспрея | nanoESI | |
| Химическая ионизация при атмосферном давлении | APCI | коронный разряд и перенос протона |
| Лазерная десорбция/ионизация при помощи матрицы | MALDI | поглощение фотона/перенос протона |
| Десорбция/ионизация на кремнии | DIOS | |
| Бомбардировка быстрыми атомами/ионами | FAB | десорбция иона/перенос протона |
| Электронная ионизация | EI | пучок электронов/перенос электрона |
| Химическая ионизация | CI | перенос протона |
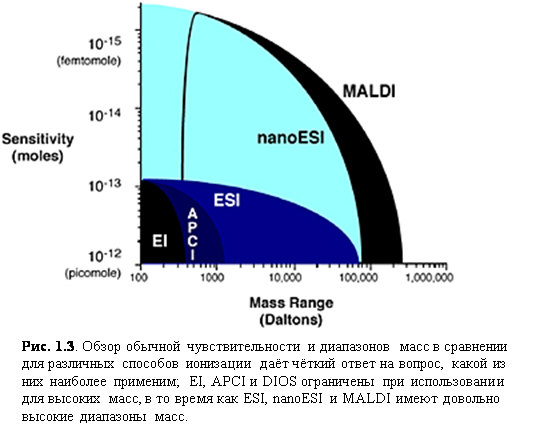 |
MALDI и ESI сейчас являются самыми распространёнными способами ионизаций для биомолекулярной масс-спектрометрии, с их превосходными диапазонами масс и чувствительностью (рис. 1.3). Следующий раздел будет посвящён основам способов ионизации, рассматривая некоторые детали в практических аспектах их применения наряду с механизмами ионизации.
Ионизация электроспрея (ESI)
Идея электроспрея, хоть и не нова, была возрождена в связи с её настоящим применением к биомолекулам. Первые эксперименты с электроспреем были проведены Чепменом в поздних 1930-х, а практическое развитие ионизации электроспрея для масс-спектрометрии было завершено Доулом в поздних 1960-х. Доул также открыл важное явление множественной зарядки молекул. Работы Фенна окончательно привели к современной технике ионизации электроспрея в масс-спектрометрии и её применению для биологических молекул.
Суть ESI заключается в следующем. Электрическое напряжение на игле приводит к большому электрическому градиенту на жидкости, который разделяет заряды на поверхности. Это вынуждает жидкость выпячиваться с иглы в форме конуса Тейлора. Верхушка конуса вытягивается в нить до тех пор, пока не достигнет предела Рэлея, при котором поверхностное натяжение и электростатическое отталкивание сравняются и сильно заряженная капля не оторвётся от нити. Капли, которые оторвались от конуса, притягиваются к входу в масс-спектрометр из-за большой разности потенциалов между иглой и входом в масс-анализатор. По мере продвижения капли к анализатору кулоновское отталкивание на поверхности превосходит поверхностное натяжение и капля «взрывается», окончательно высвобождая ионы.[3]
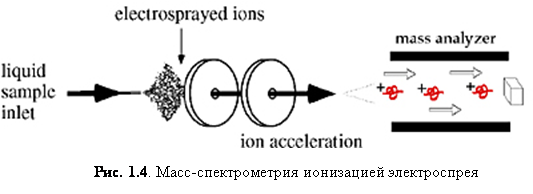
Ионизация электроспрея – метод,
который обычно применяется для пептидов, белков, углеводов, малых
олигонуклеотидов, синтетических полимеров и липидов. ESI производит газообразные заряженные молекулы прямо из
жидкого раствора. Ионизация происходит при создании тонкого спрея сильно
заряженных капель в присутствии электрического поля. Образец раствора
распыляется из области с сильным электрическим полем на конце металлической
форсунки, поддерживаемой при потенциале между 700 и 5000 В. Форсунка (или
игла), к которой приложен потенциал, служит для распыления раствора в тонкий
спрей заряженных капель. Использование сухого газа, нагревания или оба этих
способов применяется к заряженным каплям при атмосферном давлении для испарения
из них растворителя. С уменьшением размера капель возрастает плотность заряда
на их поверхности. Взаимное кулоновское отталкивание между одинаковыми зарядами
на этой поверхности становится настолько велико, что превосходит силы
поверхностного натяжения и ионы вырываются из капли через «конус Тейлора» - рис.
1.5. Другая возможность состоит в том, что капля взорвётся, высвобождая
ионы. В любом случае свободные ионы направляются в канал через
электростатические «линзы», направляясь в вакуум масс-анализатора. Так как ESI включает в себя непрерывную подачу
раствора, он применим для использования совместно с ВЭЖХ или капиллярным
электрофорезом.[4]
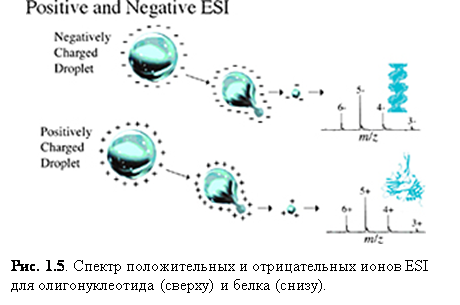 |
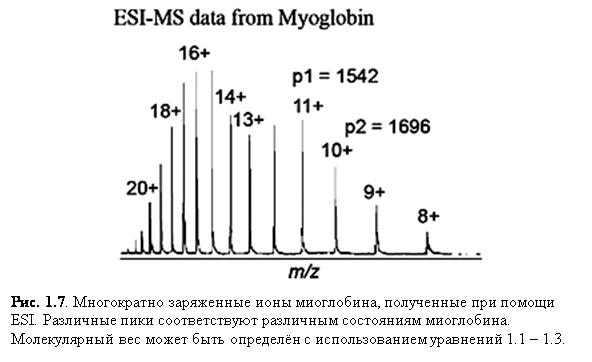
Ионизация электроспрея благоприятствует образованию единично заряженных малых молекул, но также хорошо известно образование в ходе неё многократно заряженных экземпляров больших молекул. Это важное явление, т.к. масс-спектрометр измеряет отношение массы к заряду (m/z) и поэтому многократная зарядка делает возможным наблюдать очень большие молекулы при помощи инструмента с относительно малым диапазоном масс. К счастью, программы, пригодные для всех масс-спектрометров с электроспреем, позволяют произвести вычисления молекулярной массы, необходимые для определения действительной массы многозарядных образцов. Рис. 1.6 и 1.7 показывают различные заряженные состояния двух различных белков, где каждый пик в масс-спектрах может быть соотнесён с различными зарядовыми состояниями молекулярного иона. Многократная зарядка имеет другие важные преимущества в тандемной масс-спектрометрии. Одно из преимуществ состоит в том, что после фрагментации вы наблюдаете больше фрагментарных ионов от многозарядного предшественника, чем от однозарядного.
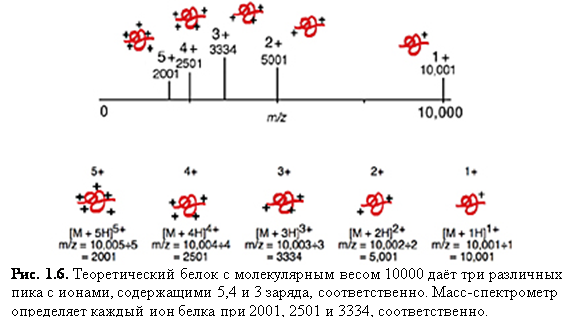
Многократная зарядка: белок с
массой 10000 дальтон и его теоретический масс-спектр с зарядами до +5 показаны
на рис. 1.8. Масса белка остаётся такой же в то время, как отношение m/z меняется в зависимости от числа зарядов на белке.
Ионизация белка есть обычно результат протонирования, что не только добавляет
заряд, но также увеличивает массу белка на число добавленных протонов. Это
действие на m/z применимо одинаково для любого
механизма ионизации молекулы, образовавшего положительно или отрицательно
заряженный молекулярный ион, включая присоединение или отрыв несущих заряд
частиц, отличных от протона (например, Na+ и Cs+). Многократные положительные заряды
наблюдаются для белков, в то время как для олигонуклеотидов типично образование
отрицательных зарядов (с ESI).
 |
Хотя масс-спектрометры электроспрея снабжены программами, которые подсчитывают молекулярный вес, понимание, как компьютер производит эти вычисления для многократно-заряженных ионов полезно. Уравнения 1.1 – 1.5 и рис. 1.9 представляют простое объяснение, где мы принимаем, что пики p1 и p2 являются соседними и различаются одним зарядом, что эквивалентно добавлению одного протона.
|
p = m/z |
(1.1) |
|
p – пик в масс-спектре z – полный заряд |
p1 – значение m/z
для p1 |
|
Уравнения 1.2. и 1.3. могут быть решены для двух неизвестных, Mr и z1. Для пиков в масс-спектре миоглобина, показанном на рис. 1.9, p1=1542, p2=1696. |
|
|
1542 z1
= Mr + z1 |
(1.4) |
Растворители для электроспрея
Многие растворители могут быть использованы в ESI и выбираются в зависимости от растворимости исследуемых соединений, летучести растворителя и способности растворителя к отдаче протона. Обычно, основными являются протонные растворители, такие, как, метанол, 50/50 метанол/вода или 50/50 ацетонитрил/вода, в то время как апротонные сорастоврители, такие, как 10% ДМСО в воде, а также изопропиловый спирт, используются, чтобы улучшить растворимость для некоторых соединений. Хотя 100% вода и используется в ESI, её относительно низкое давление пара является определяющим фактором чувствительности; лучшая чувствительность получается при добавлении летучего органического растворителя. Некоторые соединения требуют использования чистого хлороформа с добавлением 0.1% муравьиной кислоты для обеспечения ионизации. Такой подход, хоть и менее чувствительный, может быть эффективен для соединений, не растворимых другим образом.[5]
Буферы, такие, как Na+, K+, фосфат и соли представляют проблему для ESI из-за снижения давления пара капель, ведущего к ослаблению сигнала из-за увеличения поверхностного натяжения капель, ведущего к уменьшению летучести. Поэтому летучие буферы, такие, как ацетат аммония, могут быть использованы более эффективно.[6]
|
Таблица 1.3. Преимущества и недостатки ионизации электроспрея (ESI) |
||||
|
Устройство прибора ионизации электроспрея
Неосевая конфигурация ESI, которая сейчас используется во многих приборах для введения ионов в анализатор (как показано на рис. 1.10), показала себя очень эффективной при использовании с большим потоком жидкости. Основное преимущество такой конфигурации состоит в том, что скорость потока может быть увеличена без засорения или закупоривания входного отверстия. Неосевое распыление важно, потому что вход в анализатор более не насыщается растворителем, тем самым предохраняя капли от попадания во входное отверстие и его загрязнения. Наоборот, только ионы направляются ко входу. Это делает ESI ещё более совместимым с ЖХ при скоростях до мл/мин.
Ионизация наноэлектроспрея ( nanoESI)
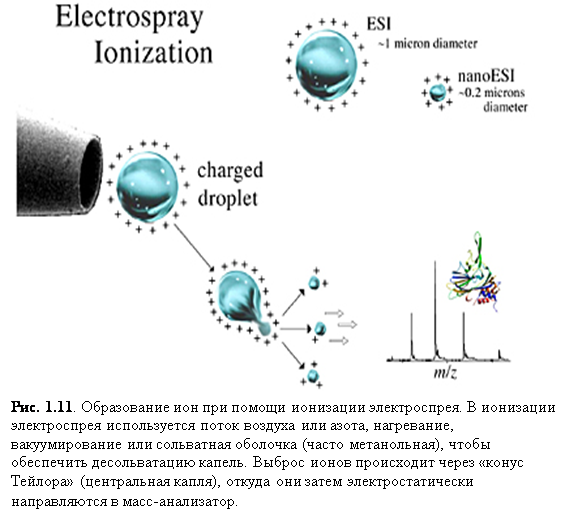 |
Электроспрей низкого потока, впервые описанный Вильмом и Манном, называли наноэлектроспреем, наноспреем и микроэлектроспреем. Такой способ ионизации является вариацией ESI, в которой игла спрея сделана очень
маленькой и расположена близко ко входу в масс-анализатор (рис. 1.11). Конечным результатом такой простой корректировки становится увеличение эффективности, которое включает уменьшение необходимого количества образца.
Скорости потока для nanoESI обычно составляют ль десятков до сотен нанолитров в минуту. Чтобы получить такие малые скорости потока, nanoESI использует источники из вытянутого и, в некоторых случаях, металлизированного стекла или плавленого кварца с малым входным отверстием (~ 5 мкм). Растворённый образец вносится в источник и к его концу прикладывается давление порядка 2 атм. Вытекание образца с очень малой скоростью позволяет достигать высокой чувствительности. Также, источники расположены очень близко ко входу в масс-анализатор, поэтому перенос ионов в масс-анализатор намного более эффективен. Например, анализ 5 mM раствора пептида при помощи nanoESI займёт одну минуту, употребив ~50 фемтомоль образца. Такой же эксперимент с обычным ESI за то же время израсходует 5 пикомоль, т.е. в 100 раз больше, чем nanoESI. К тому же, так как капли для nanoESI обычно меньше, чем для обычного ESI (рис. 1.11.), необходимое для образования ионов испарение намного меньше. Следовательно, nanoESI менее чувствительно к солям и другим примесям, т.к. меньшее испарение означает, что примеси не будут концентрироваться так сильно, как при ESI.[7]
Химическая ионизация при атмосферном давлении (APCI)
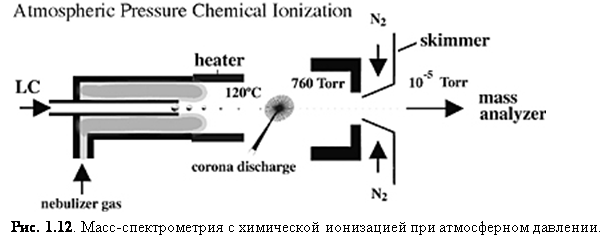
APCI также стала важным способом
ионизации, потому что она генерирует ионы непосредственно из раствора и
способна к анализу относительно неполярных соединений. Так же, как и в
электроспрее, поток жидкости для APCI (рис.
1.12) вытекает непосредственно в устройство ионизации.
Однако сходство здесь заканчивается. Капли не заряжаются и APCI устройство содержите нагретый испаритель, который обеспечивает быстрое разделение/испарение капель. Молекулы образца в паре проходят через зону ионно-молекулярной реакции при атмосферном давлении.
В APCI ионизация возникает из-за возбуждения/ионизации растворителя коронным разрядом. Т.к. ионы растворителя существуют при атмосферном давлении, химическая ионизация молекул аналита очень эффективна; при атмосферном давлении молекулы аналита сталкиваются с ионами реагента очень часто. Перенос протона (для реакций протонирования MH+) образует положительные ионы, а перенос электрона или отщепление протона ([M-H]-) даёт отрицательные. Сглаживающее влияние сольватных оболочек на ионах реагента и высокое давление газа уменьшают фрагментацию во время ионизации и ведут к образованию практически только нетронутых молекулярных ионов. Многократная зарядка обычно не наблюдается, скорее всего, потому что процесс ионизации более энергичен, чем при ESI.[8]
Фотоионизация при атмосферном давлении (APPI)
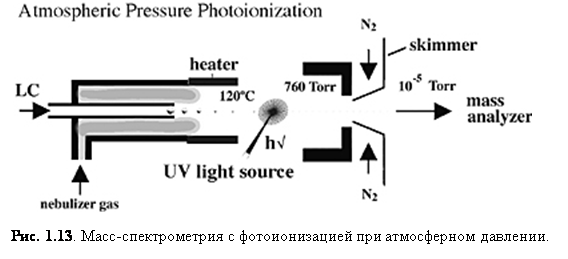
Фотоионизация при атмосферном давлении (APPI) стала сейчас важным способом ионизации, потому что она генерирует ионы непосредственно из раствора с относительно малым фоновым сигналом и способна к анализу относительно неполярных соединений. Так же, как и APCI, поток жидкости для APPI (рис. 1.13) вводится прямо в устройство ионизации.
Основное различие между APCI и APPI состоит в том, что в APPI парообразный образец проходит через ультрафиолетовый свет (обычная криптоновая лампа испускает от 10.0 эВ до 10.6 эВ). Часто APPI является намного более чувствительным, нежели ESI или APCI и показывает более высокое соотношение сигнал/шум из-за более низкой ионизации фона. Низкий сигнал фона во многом обусловлен высоким потенциалом ионизации стандартных растворителей, таких, как метанол и вода (10.85 и 12.62 эВ, соответственно), которые не ионизируются криптоновой лампой.
Недостатком ESI и APCI является то, что они образуют фоновые ионы растворителей. В дополнение к этому, ESI особенно подвержен эффектам подавления ионов, а APCI требует испарения при температурах 350-500°C, что может вызвать термическое разложение.
APPI производит ионизацию двумя механизмами. Первый – простое фотовозбуждение, инициирующее испускание электрона с образованием молекулярного катион-радикала (M+). APPI устройство воздействует светом с энергией выше, чем потенциалы ионизации (ИП) большинства целевых молекул, но ниже, чем ИП для большинства молекул растворителей и воздуха, тем самым исключая их как помехи. К тому же, из-за малой избыточной энергии, сообщаемой молекулам, достигается минимальная фрагментация.
Второй механизм – фотоиндуцированная химическая ионизация при атмосферном давлении, которая похожа на APCI в том, что она включает перенос заряда при протонировании (MH+) или потере протона ([M-H]-).
Для инициирования химической ионизации фотоионизирующийся реагент добавляется к элюенту. После фотоионизации реагента происходит перенос заряда на аналит. Типичными реагентами для положительной ионизации являются ацетон и толуол. Ацетон также служит реагентом для отрицательной ионизации.
Механизм ионизации (M+ или [M+H]+), который претерпевает молекула, зависит от сродства к протону аналита, растворителя и типа используемого дополнительного реагента.[9]
Лазерная десорбция/ионизация при помощи матрицы ( MALDI)
Масс-спектрометрия с лазерной десорбцией/ионизацией при помощи матрицы (MALDI-MS) впервые была использована в 1988 году Танакой, Карасом и Хилленкампом. С тех пор он стал широко распространённым методом для пептидов, белков и большинства других биомолоекул (олигонуклеотидов, углеводов, природных веществ и липидов). Эффективный и направленный перенос энергии во время акта индуцированной лазером десорбции при помощи матрицы приводит к большому выходу ионов незатронутого аналита и позволяет проводить измерения соединений с субпикомолярной чувствительностью. Вдобавок, удобство MALDI для анализа гетерогенных образцов делает его очень привлекательным для масс-анализа сложных биологических образцов, как, например, гидролизат белков.

Хотя точный механизм десорбции/ионизации для MALDI неизвестен, принято считать, что MALDI вызывает ионизацию и перевод образца из конденсированной фазы в газовую посредством лазерного возбуждения и индивидуализации молекул образца из матрицы (рис. 1.14). В MALDI анализе аналит сначала сокристаллизуется с большим молярным избытком матричного соединения, обычно УФ-поглощающей слабой органической кислотой. Облучение такой смеси аналита с матрицей лазером приводит к испарению матрицы, которая несёт аналит в себе. Матрица играет ключевую роль в этом методе. Сокристаллизованные молекулы образца также испаряются, но без прямого поглощения энергии лазера. Молекулы, чувствительные к лазерному излучению, поэтому защищены от прямого возбуждения УФ-лазером.
Матрица MALDI – нелетучий твёрдый материал, обеспечивающий процессы десорбции и ионизации посредством поглощения лазерного излучения. Как результат, и матрица, и любой образец, встроенный в неё, испаряются. Матрица также служит для того, чтобы минимизировать ущерб образцу от лазерного излучения, поглощая большую часть падающей энергии.
Оказавшись в газовой фазе, десорбированные заряженные молекулы затем электростатически направляются из MALDI устройства ионизации в масс-анализатор. Времяпролётные (TOF) масс-анализаторы часто используются для разделения ионов по отношению массы к заряду (m/z). Импульсная природа MALDI очень удобна для TOF анализаторов, т.к. начальный момент времени можно засекать как момент лазерного импульса.
Было разработано несколько теорий для объяснения десорбции посредством MALDI. Модель термических пиков предполагает, что выброс неповреждённых молекул обусловлен слабым колебательным взаимодействием между матрицей и аналитом, что минимизирует перенос колебательной энергии от матрицы к модам молекул аналита, тем самым минимизируя фрагментацию. Теория импульсного давления предполагает, что создаётся градиент давления, перпендикулярный поверхности, и десорбция больших молекул вызвана передачей импульса при их столкновениях с быстро движущимися молекулами матрицы. Обычно считается, что ионизация происходит посредством передачи протона или катионизации во время процесса десорбции.
Полезность MALDI для анализа биомолекул основана на её способности давать информацию о молекулярном весе неповреждённых молекул. Способность давать точную информацию может быть чрезвычайно важна для определения и характеристики белков. Например, белок часто может быть однозначно определён точным анализом масс составляющих его пептидов (полученных химическим или же ферментативным воздействием на образец).[4]
Таблица 1.4. Преимущества и недостатки метода лазернойдесорбции/ионизации при помощи матрицы (MALDI). |
|||||
|
Приготовление образца и матрицы оказывает значительное влияние на качество масс-спектров MALDI белков и пептидов (рис. 1.15). Среди большого разнообразия известных методов приготовления наиболее часто употребляемым является метод высушенной капли. В этом случае насыщенный раствор матрицы смешивается с раствором аналита так, чтобы соотношение матрицы к аналиту было около 5000:1. Аликвота (0.5-2.0 мкл) такой смеси затем помещается на место образца, где затем высушивается. Ниже приведена методика такого приготовления:
· отобрать пипеткой 0.5 мкл образца на подложку;
· отобрать пипеткой 0.5 мкл матрицы на подложку;
· перемешать образец и матрицу втягиванием их в пипетку и выпусканием;
· позволить высохнуть на воздухе.
- Для пептидов, небольших белков и большинства других соединений: насыщенный раствор α-циано-4-гидроксикоричной кислоты в 50:50 ацетонитрил:вода с 0.1% ТФА.
- Для белков и других тяжёлых молекул: насыщенный раствор синапиновой кислоты в 50:50 ацетонитрил:вода с добавлением 0.1% ТФА.
- Для гликопептидов/белков и маленьких соединений: насыщенный раствор 2,5-дигидроксибензойной кислоты (DHB) в 50:50 ацетонитрил:вода.
Рис. 1.15. Обычно используемые в MALDI матрицы и подложка для MALDI с показанным расположением матрицы. Одним из преимуществ MALDI является то, что множество образцов может быть подготовлено в одно и то же время, как видно по этой многообразцовой подложке.
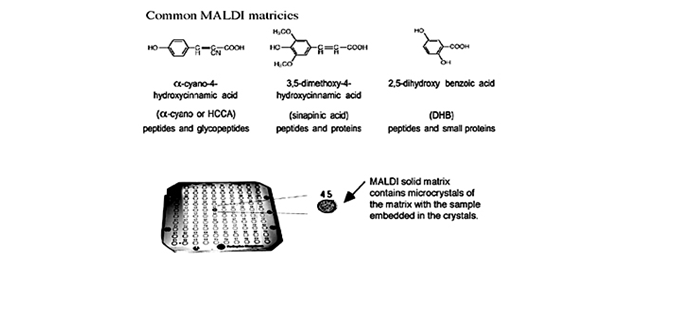
Также образцы могут быть приготовлены последовательным способом. В тонкослойном методе сначала на цель наносится гомогенная «плёнка» матрицы, а затем туда добавляется образец, который абсорбируется ей. Этот метод даёт хорошую чувствительность, разрешающую способность и точность определения. Аналогично, в толстослойном методе нитроцеллюлоза (NC) используется как добавка к матрице. После образования единого слоя NC-матрица на цели добавляется образец. Этот метод приготовления предотвращает образования щелочных аддуктов и значительно увеличивает чувствительность определения, особенно для пептидов и белков, экстрагированных из гелей. Сэндвичевый метод – другой вариант в этой категории. Тонкий слой кристаллов матрицы приготовляется как в тонкослойном методе, затем последовательно добавляются капли (a) водного 0.1% ТФА, (b) образца и (c) матрицы.
Десорбция/ионизация на кремнии ( DIOS)
DIOS – свободный от матрицы метод, который использует импульсную десорбцию/ионизацию на кремнии (рис. 1.16). Поверхности структурированного кремния, такого, как пористый кремний или кремниевое нановолокно являются УФ-поглощающими полупроводниками с большой площадью поверхности (сотни м2/см3). При применения в масс-спектрометрии с лазерной десорбцией/ионизацией, строение структурированного кремния обеспечивает каркас для накопления молекул растворителя и аналита, а поглощение УФ даёт механизм для передачи энергии лазера аналиту. Такая удачная комбинация свойств позволяет DIOS быть применимым для большого разнообразия биомолекул, включая пептиды, углеводы и небольшие органические соединения различных типов. В отличие от других прямых безматричных методов десорбции DIOS позволяет проводить десорбцию/ионизацию с малым разложением аналита или вообще без него.
DIOS сильно связан с MALDI. Оборудование для DIOS-MS требует только незначительной настройки для использования в MALDI; чип просто закрепляется на обработанной MALDI-подложке и вставляется в масс-спектрометр. Та же длина волны лазера (337 НМ), обычно применяемая в MALDI, подходит и для DIOS. Хотя DIOS сравним с MALDI в отношении чувствительности, у него есть несколько преимуществ из-за отсутствия мешающей матрицы: низкий фон на малых диапазонах массы, такое же размещение водных образцов, упрощённая подготовка образцов. Вдобавок, компоновка в чипах легко адаптируется к автоматической подготовке образца, при которой лазер быстро обрабатывает чип, переходя от одного участка к другому. DIOS может, таким образом, ускорить и упростить крупные анализы соединений с низкой молекулярной массой, так же, как MALDI для макромолекул. Так как массы многих низкомолекулярных соединений могут быть легко измерены, DIOS-MS применим для анализа превращений малых молекул, как ферментативных, так и химических. [3]
Бомбардировка быстрыми атомами/ионами ( FAB)
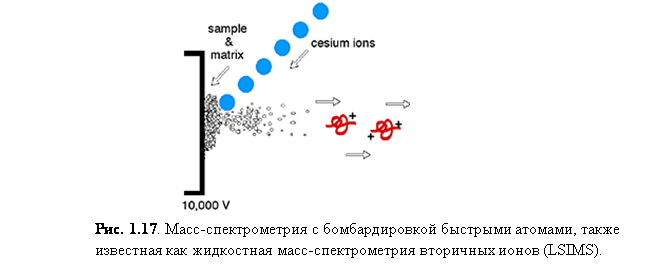
Бомбардировка быстрыми атомами/ионами, или FAB – метод ионизации, схожий с MALDI, так как в нём используется матрица и пучок высокоэнергетических частиц для десорбции ионов с поверхности. Важно, однако, обозначить различия между MALDI и FAB. В MALDI, энергетический пучок представляет собой импульсный лазерный свет, в то время как FAB использует непрерывный пучок ионов. В MALDI матрица обычно твёрдая кристаллическая, а в FAB обычно использует жидкую матрицу. Также нужно отметить, что FAB примерно в 1000 раз менее чувствителен, нежели MALDI.
Бомбардировка быстрыми атомами – мягкий способ ионизации, который требует прямого введения зонда для подачи образца и пучок нейтральных атомов Xe или ионов Cs+ для распыления образца и матрицы с поверхности зонда для подачи. Обычно в FAB спектре обнаруживаются ионы матрицы, наряду с протонированными или катионизированными (например, M+Na+) молекулярными ионами аналита.
Матрица FAB. Способствующая процессам десорбции и ионизации, матрица FAB – нелетучая жидкость, которая служит, чтобы постоянно восполнять поверхность новым образцом по мере того, как он бомбардируется пучком ионов. Поглощая большую часть падающей энергии, матрица также минимизирует разложение образца из-за высокоэнергетических частиц образца.
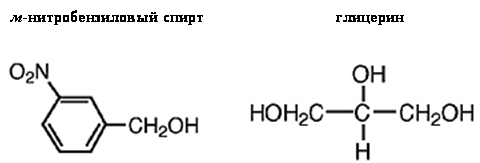 |
Две наиболее часто употребляющихся матрицы для FAB –
м-нитробензиловый спирт и глицерин.
Быстрые атомы или ионы сталкиваются с матрицей, вынуждая матрицу и аналит десорбироваться в газовую фазу. Образец может быть уже заряженным и только потом быть переведённым в газовую фазу, или же может стать заряженным в ходе десорбции посредством FAB посредством реакций с окружающими молекулами или ионами. Оказавшись в газовой фазе, заряженные молекулы могут быть электростатически перемещены в масс-анализатор. [1]
Электронная ионизация ( EI)
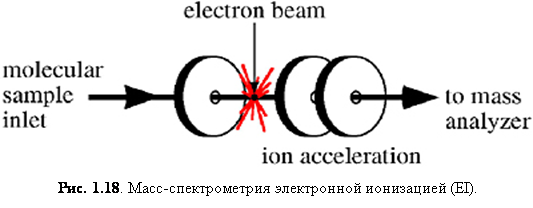 |
Электронная ионизация – один из наиболее важных способов ионизации для повседневных анализов малых гидрофобных термически стабильных молекул и до сих пор широко используется. Так как EI обычно даёт большое число фрагментарных ионов, это «жёсткий» способ ионизации. Однако, фрагментарная информация также может быть очень полезной. Например, используя базы данных, содержащие свыше 200000 масс-спектров электронной ионизации, возможно определить неизвестное соединение в течение нескольких секунд (конечно, если оно есть в базе данных). Эти базы данных, а также объём памяти и поисковые алгоритмы современных компьютеров позволяет быстро просматривать такие базы (как, например, база NIST), таким образом значительно облегчая идентификацию малых молекул.
Устройство электронной ионизации прямолинейно (рис. 1.18). Образец должен поставляться в газообразной форме, что осуществляется «выкипанием» образца посредством термической десорбции или введением газа через капилляр. Капилляр часто является выходом капиллярной колонки прибора газовой хроматографии. В этом случае капиллярная колонка обеспечивает разделение (это также известно как газовая хромат-масс-спектрометрия – GC/MS). Десорбция твердых или жидких образцов производится нагреванием в вакууме масс-спектрометра. После перехода в газовую фазу соединения переносятся в устройство электронной ионизации, где электроны возбуждают молекулу, тем самым вызывая ионизацию отрывом электрона и фрагментацию.
Применимость электронной ионизации значительно уменьшается для соединений с молекулярной массой свыше 400 дальтон, потому что необходимая термическая десорбция образца ведёт к температурному разложению до того, как происходит испарение. Принципиальными проблемами, связанными с термической десорбцией при электронной ионизации являются 1) нелетучесть больших молекул, 2) термическое разложение, 3) избыточная фрагментация.
Механизм отрыва электрона при образовании положительного иона осуществляется следующим образом:
· Образец термически испаряется.
· Электроны испускаются нагретым катодом и ускоряются электрическим полем с разностью потенциалов в 70 В, чтобы образовать непрерывный пучок электронов.
· Молекулы образца проходят через пучок электронов.
·
Электроны с кинетической энергией 70 эВ передают часть своей энергии молекулам. Эта передача вызывают ионизацию (отрыв электрона) так, что ион сохраняет обычно не более 6 эВ избыточной энергии.
·
Избыток внутренней энергии (6 эВ) в молекуле ведёт к некоторой
фрагментации.
Электронный захват обычно намного менее эффективен, чем отрыв электрона, хотя иногда используется таким же способом, с высокой чувствительностью работая для соединений с большим сродством к электрону: M + e- → M-. [1]
Химическая ионизация (CI)
Химическая ионизация (CI) применяется к образцам, сходным с анализируемыми при помощи EI, и обычно применяется, чтобы увеличить долю молекулярного иона. Химическая ионизация использует газофазные ионно-молекулярные реакции в вакууме масс-спектрометра для получения ионов из молекул образца. Процесс химической ионизации инициируется газом-реагентом, таким, как метан, изобутан или аммиак, который ионизируется электронным ударом. Высокое давление газа в устройстве ионизации приводит к ионно-молекулярным реакциям между ионами газа-реагента и его нейтральными молекулами. Некоторые продукты ионно-молекулярных реакций могут реагировать с аналитом с образованием ионов.
Возможные механизмы ионизации при CI:
Реагент (R) + e- → R+ + 2 e-
R+ + RH → RH+ + R
RH+ + Аналит (A) → AH+ + R
В отличие от EI, аналит с большей вероятностью образует молекулярный ион с меньшей фрагментацией при использовании CI. Однако, аналогично EI, образцы должны быть термически стабильными, так как испарение в CI-устройстве осуществляется при помощи нагревания.
Отрицательная химическая ионизация (NCI) обычно требует от аналита содержания остатков (например, атомов фтора или нитробензильных групп). Некоторые функциональные группы значительно увеличивают чувствительность NCI, в некоторых случаях от 100 до 1000 раз по сравнению с электронной ионизацией (EI). NCI, возможно, – один из самых чувствительных способов и применяется ко большому разнообразию низкомолекулярных соединений с единственным ограничением, что молекулы часто химически модифицируются с добавлением групп, отвечающих за захват электрона.
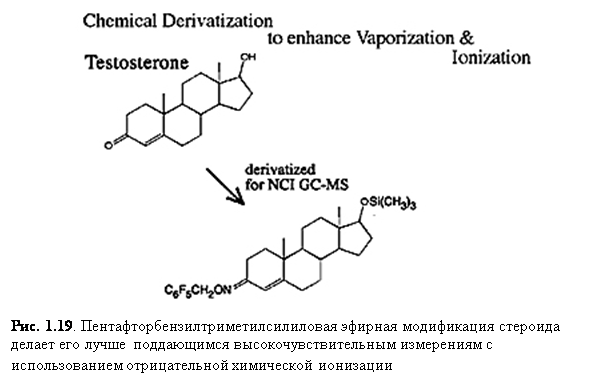
Хотя большинство соединение не образует отрицательных ионов при использовании EI или CI, многие важные соединения могут давать отрицательные ионы, и, в некоторых случаях, отрицательная EI или CI масс-спектрометрия является более чувствительной и избирательной, нежели анализ положительных ионов. Например, такие соединения, как стероиды модифицируются (рис. 1.19), чтобы усилить NCI.
Как было отмечено, отрицательные ионы могут быть получены при электронном захвате, и при отрицательной химической ионизации буферный газ (такой как метан) может замедлить электроны в электронном пучке, позволяя им быть захваченными молекулами аналита. Буферный газ также стабилизирует возбуждённые анионы и уменьшает фрагментацию. Поэтому NCI, в сущности, есть процесс электронного захвата, а не то, что обычно подразумевается под процессом «химической ионизации».[1]
Таблица 1.5. Сравнение основных характеристик способов ионизации.
|
Способ ионизации |
Обычный диапазон масс (Da) |
Влияние матрицы |
Разложение |
Сложные смеси |
Совместимость с ЖХ |
Чувствительность |
| Ионизация электроспрея (ESI) | 70000 | Нет | Нет | Несколько ограничено | Превосходно | От многих фемтомоль до нескольких пикомоль |
| Комментарии | Превосходно для совмещения ЖХ и МС; устойчивость к небольшим концентрация солей (до нескольких мМ); многократная зарядка полезна, но значительно подавлена в случае смесей; низкая устойчивость к смесям; мягкая ионизация (наблюдается мало фрагментов). | |||||
| NanoESI | 70000 | Нет | Нет | Несколько ограничено, но лучше, чем ESI | Возможно, но обеспечение низкой скорости потока может составить проблему | От многих зептомоль до нескольких фемтомоль |
| Комментарии | Очень чувствителен и очень малые скорости потока; применим для ЖХ/МС, но малые скорости потока требуют специальных систем; умеренная устойчивость к солям (до нескольких мМ); многократная зарядка полезна, но может быть подавлена в случае смесей; умеренно применим для смесей; мягкая ионизация (наблюдается мало фрагментов). | |||||
| APCI | 1200 | Нет | Термическое разложение | Несколько применимо | Превосходно | Многие фемтомоли |
| Комментарии | Превосходно для совмещения ЖХ и МС; малая устойчивость к солям (до нескольких мМ); применимо к гидрофобным образцами | |||||
| APPI | 1200 | Нет | Фотодиссоциация | Применимо | Превосходно | Многие фемтомоли |
| Комментарии | Превосходно для совмещения ЖХ и МС; малая устойчивость к солям (до нескольких мМ); применимо к гидрофобным образцами | |||||
| MALDI | 300000 | Есть | Фоторазложение и реакции с матрицей | Хорошо для сложных смесей | Возможно | От нескольких до многих фемтомолей |
| Комментарии | Несколько устойчиво к солям; превосходная чувствительность; фон матрицы может быть проблемой для ионов с малой массой; мягкая ионизация (наблюдается мало фрагментов); возможно фоторазложение; применимо к сложным смесям. Многократная зарядка весьма ограничена, так что данные не соотносятся с некоторыми другими способами. | |||||
| DIOS | 3000 | Нет | Фоторазложение | Хорошо для сложных смесей | Возможно | От нескольких фемтомоль до многих иоктомоль |
| Комментарии | Несколько устойчиво к солям; отличная чувствительность; мягкая ионизация; фоторазложение возможно; применимо к сложным смесям и низкомолекулярным соединениям | |||||
| FAB | 7000 | Есть | Реакции с матрицей и некоторое термическое разложение | Несколько применимо | Очень ограничено | Наномоль |
| Комментарии | Относительно слабочувствителен; малая фрагментация; мягкая ионизация; высокая устойчивость к солям – до 0,01 М; необходима растворимость в матрице | |||||
| Электронная ионизация (EI) | 500 | Нет | Термическое разложение | Ограничено, если не используется ГХ/МС | Очень ограничено | Пикомоль |
| Комментарии | Хорошая чувствительность; уникальные данные по фрагментации с возможностью просмотра по базам данных; термическое разложение – основная проблема для биомолекул и других высокомолекулярных соединений | |||||
| Химическая ионизация (CI) | 500 | Нет | Термическое разложение | Ограничено, если не используется ГХ/МС | Очень ограничено | Пикомоль |
| Комментарии | Более мягкий подход к ионизации по сравнению с EI, но всё равно с термическим разложением; отрицательная CI особенно чувствителен к перфторированным производным; ограниченный, но мощный подход к некоторым модифицированным молекулам, таким как стероиды. |
Анализаторы масс
Когда устройства ионизации смогли испарять и ионизировать биомолекулы, стало необходимо улучшить анализаторы масс до соответствующей скорости, точности и разрешения (рис. 2.1). Точнее, квадрупольные, квадрупольная ионная ловушка, времяпролётные (TOF), времяпролётные рефлекторные и циклотронные резонанса ионов анализаторы масс претерпели множественные модификации/улучшения за последние десять лет, чтобы соответствовать уровню MALDI и ESI. Сложнейшей проблемой оказалось совмещение устройств ионизации при атмосферном давлении (760 Торр) и анализаторов, в которых поддерживается 10-6 – 10-11 Торр, то есть, разница в давлении на 9 и более порядков. [10]
Анализ масс
Аналитические приборы обычно различаются в своих способностях в зависимости от индивидуального устройства и предназначения. Это верно и для масс-спектрометров. Хотя все масс-спектрометры содержат анализаторы масс, не все анализаторы работают одинаковым образом: некоторые разделяют ионы в пространстве, другие разделяют их по времени. В общих словах, масс-анализатор различает ионы в газовой фазе по их отношению массы к заряду (m/z), причём заряд может быть обусловлен присоединением или потерей протона(ов), катиона(ов), аниона(ов) или электрона(ов). Появление заряда заставляет молекулу подвергаться действию электрических полей, тем самым позволяя измерить её массу. Важно помнить, что анализаторы масс измеряют отношение m/z, а не массу. Часто это является камнем преткновения, так как ион оказывается многократно заряженным и m/z становится значительно меньше действительной массы (рис. 1.8 и 1.9). Например, дважды заряженный пептид массой 976.5 Да C37H68N16O142+ имеет m/z 488.3.
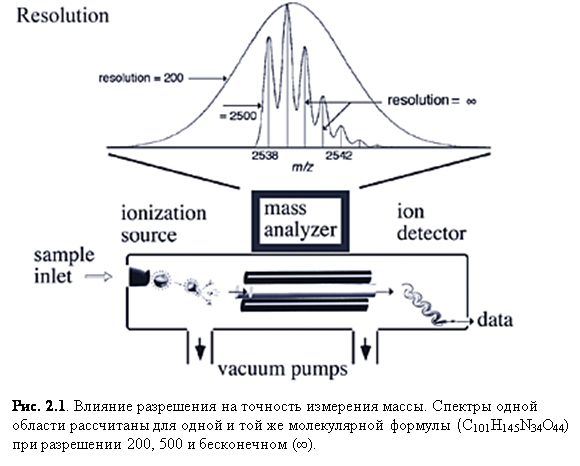
Многократная зарядка особенно характерна для ионизации электроспрея, давая многочисленные пики, относящиеся к одному образцу, но наблюдаемые при разных m/z.
Первые анализаторы масс, сделанные ещё в ранние 1900-е, использовали магнитное поле для разделения ионов по радиусу кривой, описываемой ими при прохождении через поле. Устройство современных анализаторов значительно изменилось в последние пять лет, сейчас обеспечивая намного большую точность, увеличенную чувствительность, более широкий диапазон масс и способность давать структурную информацию. Так как способы ионизации эволюционировали, анализаторы масс были вынуждены улучшиться на порядки, чтобы удовлетворить требованиям анализа большого разнообразия биомолекулярных ионов с точностью до одной миллионной и субфемтомольной чувствительностью. [11]
Таблица 2.1. Краткий обзор принципов работы анализаторов. |
||||||||||||||||
|
Рабочие характеристики анализаторов
Масс анализатор обычно оценивается по следующим характеристикам: точность, разрешение, диапазон масс, способность к тандемному анализу, скорость сканирования.
Точность
Точность – способность анализатора давать точную информацию о m/z. Точность в большой степени зависит от устойчивости прибора и от разрешения. Например, прибор с точностью 0.01% даёт информацию о 1000 Да пептиде с точностью ±0.1 Да, а для 10000 Да белка - ±1.0 Да. Точность серьёзно меняется от анализатора к анализатору в зависимости от типа анализатора и разрешения. Альтернативным способом описания точности является использование терминологии «части на миллион» (ppm), в которой 1000 Да пептид с точностью ±0.1 Да может быть также описан как 1000.00 Да пептид ±100 ppm.
Разрешение (разрешающая сила)
Разрешение – способность масс-спектрометра различать ионы с различными отношениями массы к заряду. Поэтому большее разрешение связано с прямым увеличением способности различать ионы. Стандартным определением разрешения является следующее уравнение:
Разрешение = M/ΔM (2.1)
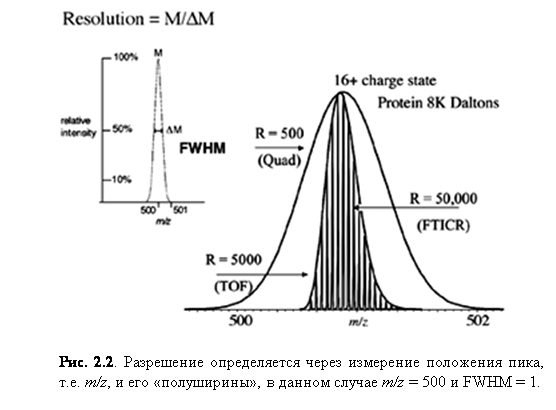 |
где M соответствует m/z, а ΔM является шириной на половине максимума (FWHM или «полушириной»).
Пример измерения разрешения показан на рис. 2.2, где пик имеет m/z 500 и полуширину 1. Получается разрешение M/ΔM = 500/1 = 500.
Разрешающая сила анализатора, в некоторой степени, определяет точность конкретного прибора, как показано на рис. 2.2. Средняя масса молекулы высчитывается с использованием эффективной массы всех изотопов каждого составляющего молекулу элемента. Моноизотопная масса рассчитывается с использованием массы изотопа элемента, имеющего наибольшую распространённость, для каждого из составляющих элементов. Если прибор не разрешает изотопы, он будет давать широкий пик, центр которого соответствует средней массе. Более высокое разрешение может даже разделить индивидуальные изотопы или же сузить пики, позволяя более точно определить их положение.
Диапазон масс
Это диапазон m/z анализатора масс. Например, квадрупольные анализаторы обычно определяют m/z до 3000. Анализатор магнитного сектора обычно определяет m/z до 10000, а времяпролётные анализаторы имеют практически неограниченный диапазон масс.
Тандемный анализ масс (MS/MS или MSn)
Это способность анализатора разделять различные молекулярные ионы, генерировать фрагментарные ионы от выбранного и измерять массы фрагментированных ионов. Фрагментированные ионы обычно используются для определения структуры исходных молекулярных ионов.
Обычно тандемная масс-спектрометрия проводится столкновением выбранного иона с молекулами инертного газа, такого как аргон или гелий, и последующим анализом образовавшихся фрагментов. Тандемный анализ масс используется для определения последовательности пептидов, структурных характеристик углеводов, малых олигонуклеотидов и липидов.
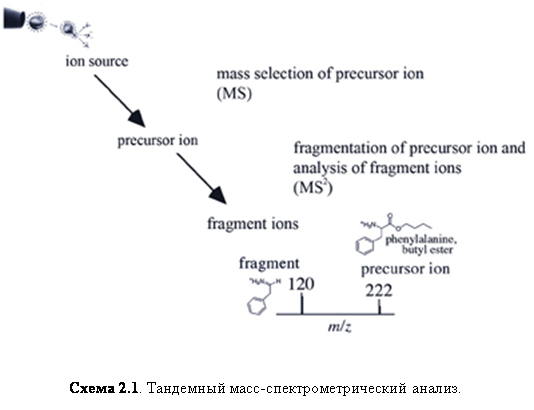
Термин «тандемный» анализ масс применяется для событий, последовательных в пространстве или во времени. Тандемный анализ масс в пространстве проводится последовательно расположенными анализаторами, тогда как тандемный во времени анализ масс осуществляется в одном и том же анализаторе, который отделяет нужный ион, фрагментирует его и анализирует фрагментарные ионы. Характеристики тандемного анализа для различных анализаторов приведены в таблице 2.2.
Скорость сканирования
Эта характеристика показывает скорость, с которой анализатор сканирует конкретный диапазон масс. Большинству приборов необходимо несколько секунд для полного сканирования, однако это время может сильно разниться в зависимости от анализатора. Времяпролётные анализаторы, например, совершают анализ в миллисекунды и даже быстрее. [12]
Конкретные виды анализаторов
Как известно, ESI и MALDI, например, генерируют ионы довольно различными способами. ESI Создаёт ионы в непрерывном потоке заряженных капель при атмосферном давлении, и ионы также создаются непрерывным потоком, по этим причинам квадрупольные анализаторы являются наиболее подходящими для ESI, так как они оба устойчивы к довольно высоким давлениям (~10-5 Торр) а и способны к непрерывному сканированию потока ионов из ESI. MALDI, с другой стороны, образует ионы посредством коротких, наносекундных, импульсов и хорошо совместимо с времяпролётным анализатором, который измеряет точно синхронизированные пакеты ионов, такие, как, например, полученные при помощи лазерного импульса.
Квадрупольный анализатор
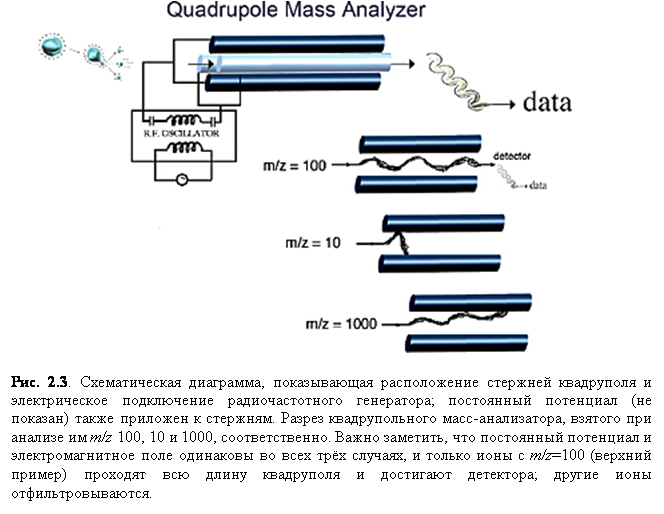
Квадрупольный анализатор масс (рис.
2.3) используется с EI-устройствами
с 1950-х и до сих пор является самым распространённым анализатором. Интересно,
что квадрупольные анализаторы оказались очень удобными для совмещения с ESI и APCI. Квадруполи имеют три основных достоинства. Они
устойчивы к относительно высоким давлениям.
Во-вторых, квадруполи имеют значительный диапазон масс – они способны к анализу до m/z порядка 4000, что удобно, так как ионизация электроспрея белков и других биомолекул обычно дают такое распределение заряда, что m/z лежит в пределах от 1000 до 3500. Наконец, квадрупольные масс-спектрометры являются относительно дешёвыми приборами. Учитывая взаимно дополняющие особенности ESI и квадруполей, неудивительно, что первый успешный коммерческий прибор электроспрея был оснащён квадрупольным анализатором масс.
Квадрупольные анализаторы параллельно соединены с радиочастотным (RF) генератором и постоянной разностью потенциалов (DC). При определённой частоте RF, только ионы с соответствующим m/z могут пройти через квадруполь, как показано на рис. 2.3, где только ионы с m/z 100 детектируются. Во всех трёх случаях на рис. 2.3 DC и RF поля одинаковы. Поэтому сканированием RF поля может быть анализирован широкий m/z - диапазон (обычно от 100 до 4000) приблизительно за одну секунду.
Для проведения тандемного анализа масс с квадрупольным прибором,
необходимо разместить три квадруполя в ряд. Каждый квадруполь иг
рает отдельную роль: первый квадруполь (Q1) используется для сканирова
ния определённого m/z диапазона и выбора нужного иона; второй квадруполь
(Q2), также известный как ячейка столкновения, фокусирует и пропускает
ионы через подаваемый на путь пролёта вспомогательный газ (аргон или ге
лий); третий квадруполь (Q3) служит для анализа фрагментарных ионов, ге
нерированных в ячейке столкновения (Q2) (рис. 2.4). Последовательная схе
ма вызванной столк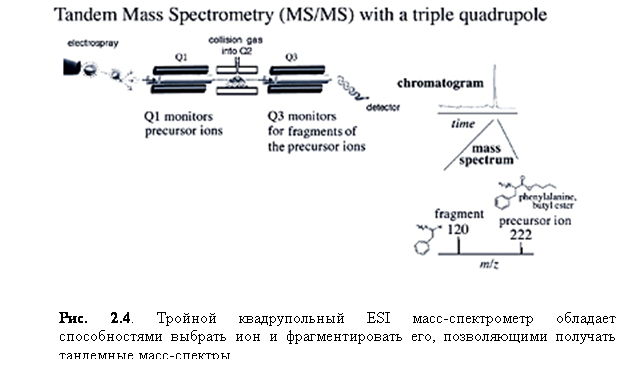
новением ионизации (CID) показана на схеме 2.1.
Квадрупольная ионная ловушка
Анализатор ионной ловушки показан на рис. 2.5 (реальным размером примерно с теннисный мяч) был придуман в то же время, что и квадрупольный анализатор масс, тем же человеком, Вольфгангом Паулом. Кстати, физика в основе обоих этих анализаторов сходна. Однако в ионной ловушке, вместо того, чтобы проходить через квадрупольный анализатор с наложенным радиочастотным полем, ионы ловятся в такое квадрупольное поле. Один из методов использования ионной ловушки для масс-спектрометрии включает в себя генерацию ионов непосредственно внутри при помощи EI, с последующим анализом масс. Другой, более популярный, метод использования ионной ловушки для масс-спектрометрии включает в себя генерацию ионов во внешнем устройстве при помощи ESI или MALDI и использование ионной оптики для введения образца в объём ловушки. Квадрупольная ионная ловушка обычно состоит из кольцевого электрода и двух гиперболических закрывающих электродов (рис. 2.5). Движение ионов, вызванное электрическим полем этих электродов, позволяет поймать или выпустить ионы из ловушки. В нормальном состоянии, радиочастота сканируется, чтобы резонансно возбудить и, вследствие этого, выпустить ионы через маленькие отверстия в «крышках» детектора. По мере того, как сканирование RF достигает более высоких частот, ионы с более высоким m/z возбуждаются, выпускаются и детектируются.
Очень полезной особенностью ионных ловушек является то, что они способны изолировать один вид ионов, выпустив все остальные из ловушки. Изолированные ионы могут быть, затем фрагментированы посредством столкновений, а фрагменты проанализированы. Основное преимущество квадрупольных ионных ловушек – то, что эксперимент с диссоциацией, вызванной многократными столкновениями, может быть проведён быстро без использования дополнительных анализаторов, так, что LC-MS/MS в реальном времени сейчас является обычным делом. Другими важными преимуществами квадрупольных ионных ловушек являются малые размеры и их способность ловить и накапливать ионы для обеспечения лучшего ионного сигнала. Квадрупольные ионные ловушки были приспособлены для ряда различных целей: от EI-MSn (рис. 2.5) биомолекул до их более современных совмещений с MALDI. MSn позволяет многократным MS/MS экспериментам проводиться с последовательными фрагментарными ионами, давая дополнительную фрагментарную информацию. Но главнейшим применением ионных ловушек является определение белков. LC-MS/MS эксперименты проводятся для белковых гидролизатов, давая информацию одновременно по MS и MS/MS. Эта информация позволяет идентифицировать белки и характеризовать пост-трансляционную модификацию. Диапазон масс (~4000 m/z) коммерческих LC-ловушек хорошо соответствует значениям m/z, генерируемым ионизацией электроспрея пептидов, а разрешение позволяет идентифицировать зарядное состояние многозарядных ионов пептидов. Масс-спектрометры квадрупольной ионной ловушки могут анализировать пептиды из трипсинового гидролизата при их содержании порядка 20-100 фмоль. Другим ценным качеством техники ионной ловушки для анализа пептидов является её способность проводить несколько стадий масс-спектрометрии, которые значительно увеличивают количество структурной информации. [13]
Линейная ионная ловушка
Линейная ионная
ловушка отличается от трёхмерной (рис. 2.6) тем, что она запирает ионы вдоль
оси квадрупольного анализатора масс, используя двумерное (2D) радиочастотное (RF) поле с потенциалами,
приложенными к концевым электродам. Основное преимущество линейной ловушки
перед 3D – больший объём анализатора, который сам по себе
значительно увеличивает динамический диапазон и улучшает диапазон количественного
анализа. 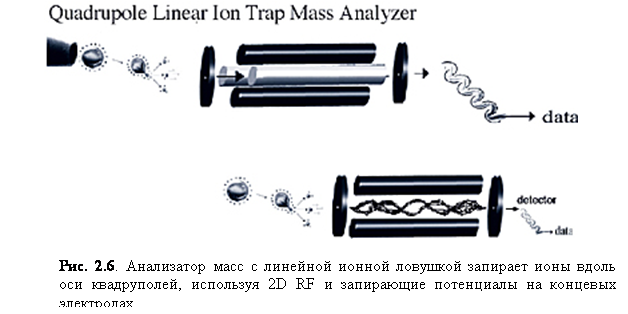
Ограничения ионной ловушки: сканирование иона-предшественника,
«правило одной трети» и динамический диапазон.
Главными ограничениями данных возможностей ионной ловушки, которые удерживают её от того, чтобы быть совершенным средством для фармакокинетики и протеомики, являются следующие: 1) способность давать высокую чувствительность одновременно для тройного квадрупольного сканирования иона-предшественника, и для экспериментов со средним затуханием невозможна для ионных ловушек. 2) Верхний предел соотношения между m/z предшественника и самого мелкого пойманного фрагмента составляет приблизительно 0.3 (также известно как «правило одной трети»). Иллюстрацией правила одной трети является то, что фрагментарные ионы от m/z 900 не будут детектироваться при m/z меньше 300, накладывая значительные ограничения на очередное секвенирование пептидов. 3) Динамический диапазон ионных ловушек ограничен тем, что при слишком большом числе ионов внутри ловушки пространственные влияние зарядов ограничит представительность анализатора. Чтобы обойти это, автоматические сканеры быстро пересчитывают ионы перед тем, как те попадут в ловушку, тем самым ограничивая число вошедших ионов. Но такой подход составляет проблему, если нужный ион сопровождается большим фоном других ионов.
Двуфокусирующий магнитный сектор
Первые анализаторы масс разделяли ионы при помощи магнитного поля. В магнитом анализе ионы ускоряются в магнитном поле при помощи электрического. Заряженные частицы, движущиеся в магнитно поле, будут двигаться по дуге, радиус которой зависит от скорости ион, силы магнитного поля и m/z иона. Масс-спектр получается сканированием магнитного поля и наблюдением того, как ионы попадают фиксированный точечный детектор. Ограничением магнитных анализаторов является относительно малое разрешение. Чтобы улучшить его, магнитные приборы были модифицированы с добавлением электростатического анализатора, чтобы сфокусировать ионы. Такие приборы называются двухсекторными. Электрический сектор служит как элемент фокусировки кинетической энергии, позволяя только ионам с определённой кинетической энергией проходить через поле, независимо от их m/z отношения. То есть, добавление электрического сектора позволяет только ионам с одинаковой энергией достигать детектора, тем самым уменьшая разброс кинетической энергии, что, в свою очередь, увеличивает разрешение. Нужно отметить, что увеличение разрешения вызывает соответствующее уменьшение чувствительности. Такие двуфокусирующие (рис. 2.7) анализаторы масс используются совместно с ESI, FAB и EI, однако они нешироко используются сейчас, в основном, из-за их больших размеров и успешности времяпролётных, квадрупольных и FTMS анализаторов с ESI и
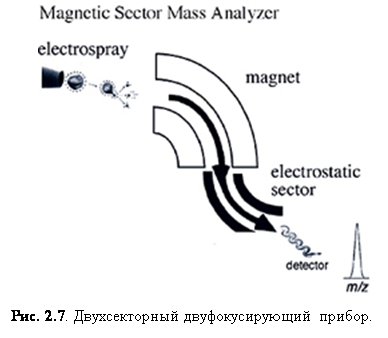 |
MALDI. [14]
Квадрупольная-времяпролётная тандемная масс-спектрометрия
Линейный времяпролётный (TOF) анализатор масс (рис. 2.7) является простейшим анализатором масс. Он пережил возрождение с изобретением MALDI и его текущее применения для электроспрея и даже газовой хроматографии с масс-спектрометрией электронной ионизацией (GC/MS). Времяпролётный анализ основан на ускорении группы ионов по направлению к детектору, при котором всем ионам сообщается одинаковая энергия при помощи ускоряющего потенциала. Так как ионы имеют одинаковую энергию, но разную массу, лёгкие ионы достигают детектора первыми из-за их большей скорости, в то время как тяжёлые ионы летят дольше из-за их большей массы и, соответственно, более низкой скорости. Поэтому анализатор был назван времяпролётным, потому что масса в нём определяется по времени прибытия ионов. Масса, заряд и кинетическая энергия – всё это вносит свой в клад в время прибытия иона к детектору. Так как кинетическая энергия (KE) иона равна ½ mv2, скорость иона может быть представлена как v = d/t = (2KE/m) ½. Ионы проходят расстояние d за время t, а t зависит от m/z. В этом уравнении v = d/t = (2KE/m) ½, принимая z = 1. Другим представлением этого уравнения, более чётко показывающим, как определяется масса, является m=2t2 KE/d2, где KE=const.
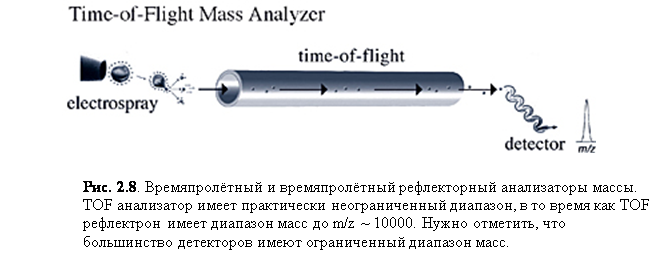
Времяпролётный рефлектрон (рис. 2.8) сейчас широко используется для ESI, MALDI, а в последнее время и для приложения электронной ионизации для ГХ/МС. Он комбинирует времяпролётную технологию и электростатическое зеркало. Рефлектрон служит для увеличения времени (t), которое нужно ионам, чтобы достичь детектора, при этом уменьшая распределение кинетической энергии, тем самым уменьшая временное распределение Δt. Так как разрешение определяется как масса пика, делённая на его ширину или m/Δm (или t/Δt, так как m пропорциональна t), увеличение t и уменьшение Δt приводит к росту разрешения. Поэтому TOF рефлектрон даёт более высокое разрешение по сравнению с простым прибором TOF посредством увеличения длины пути и фокусировки энергии посредством рефлектрона. Нужно отметить, что увеличенное разрешение (обычно выше 5000) и чувствительность на TOF рефлектроне значительно уменьшается при высоких массах (обычно при m/z свыше 5000).
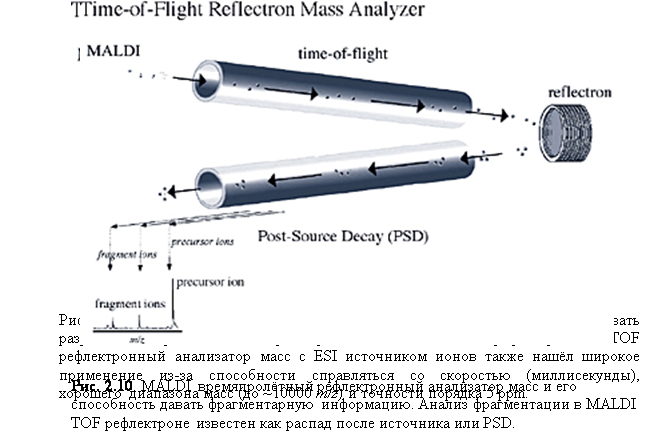
Другим типом тандемного анализа масс, MS/MS, является также возможное комбинирование MALDI и TOF рефлектрона. MS/MS осуществляется с особенности MALDI – фрагментации, которая происходит после ионизации, или распадом после источника (PSD). Времяпролётные приборы сами по себе не разделяют пост-ионизационные фрагментарные ионы от одного и того же иона-прекурсора, потому что и прекурсор, и фрагментарные ионы имеют одинаковую скорость и поэтому достигают детектора в одно и то же время. Рефлектрон даёт преимущество в том, что фрагментарные ионы имеют разную кинетические энергии и разделяются на основании того, как глубоко ионы проникают в поле рефлектрона, тем самым давая спектр фрагментарных ионов (рис. 2.9 и 2.10).
Нужно заметить, что электроспрей также был адаптирован под TOF рефлектронные анализаторы, в которых ионы из непрерывного ESI-источника накапливаются в гексаполярном (или октаполярном) ионопроводе, а затем выталкиваются в TOF анализатор. Тем самым, необходимая электростатическая импульсность создаёт точку отсчёта, с которой можно начинать измерения TOF.
MALDI и времяпролётный анализ
На начальных этапах развития MALDI-TOF, эти приборы имели относительно низкое разрешение,
которое серьёзно ограничивало их точность. Нововведением, которое оказало
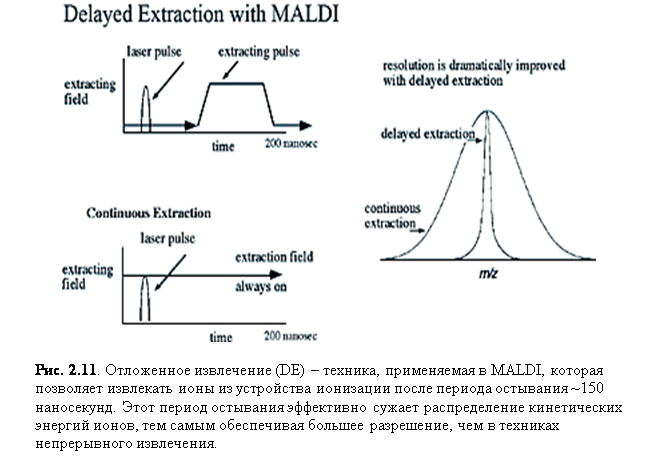
существенный эффект на увеличение разрешающей силы MALDI времяпролётных приборов было отложенное извлечение (DE), как показано на рис. 2.11.
В теории, отложенное извлечение означает просто охлаждение и фокусировку ионов
сразу после акта MALDI, но на
практике сначала было проблемой включать и выключать импульсы в 10000 вольт за
наносекунды.
В традиционных приборах MALDI, ионы ускоряются из устройства ионизации сразу после образования. Однако, отложенное извлечение ионов позволяет им «остыть» в течение ~150 наносекунд перед ускорением в анализатор. Этот период охлаждения генерирует набор ионов с гораздо меньшим распределением кинетической энергии, значительно уменьшая временной разброс ионов, когда они входят в TOF анализатор. В общем, это приводит к увеличению разрешения и точности. Выгоды отложенного извлечения значительно сокращаются для больших макромолекул, таких как белки (>30000 Да). [3]
Квадрупольная времяпролётная масс-спектрометрия
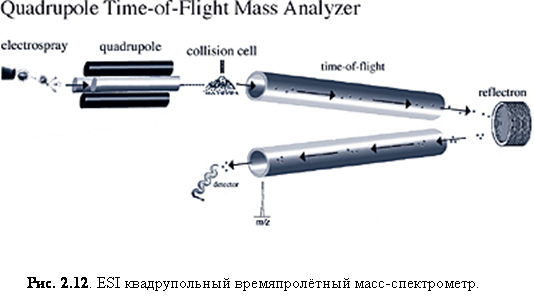
Квадрупольные времяпролётные анализаторы масс обычно совмещаются с устройствами ионизации электроспрея, а в последнее время успешно совмещаются с MALDI. ESI quad-TOF (рис. 2.12) комбинирует стабильность квадрупольного анализатора с высокой эффективностью, чувствительностью и точностью времяпролётного рефлектронного анализатора масс. Квадруполь может выступать как простой квадрупольный анализатор, чтобы сканировать определённый диапазон m/z. Однако он может быть также использован, чтобы селективно выделить ион-прекурсор и направить его в ячейку столкновения. Получившиеся фрагментарные ионы затем анализируются TOF рефлектронным анализатором масс. Квадрупольный TOF использует способность квадруполя выделять отдельный ион и способность TOF-MS совершать одновременное и точное измерение ионов по всему диапазону масс за короткий период времени. Квадрупольные TOF анализаторы выдают большую чувствительность и точность, нежели тандемные квадрупольные приборы при получении полных фрагментарных масс-спектров.
Квадрупольный TOF прибор может использовать квадрупольный или TOF анализаторы независимо или совместно для тандемных MS экспериментов. TOF компонент прибора имеет больший m/z предел, превышающий 10000. Высокая разрешающая сила (~10000) TOF также обеспечивает хорошую точность измерения массы – порядка 10 ppm. Из-за своей высокой точности и чувствительности, ESI quad-TOF масс-спектрометр внедряются в решение проблем протеомики и фармакокинетики.
 |
Масс-спектрометрия с Фурье-преобразованием (FTMS)
FTMS основана на принципе наблюдения за орбитальным движением заряженных частиц в магнитном поле (рис. 2.13-14). Пока ионы движутся по орбитам, импульсный радиочастотный (RF) сигнал используется для их возбуждения. Это RF возбуждение позволяет ионам продуцировать заметный экранирующий ток, вводя их в когерентное движение и увеличивая радиус орбиты. Экранирующий ток, генерируемый всеми ионами, может быть затем Фурье-преобразован, чтобы получить составляющие частоты различных ионов, которые соотносятся с их m/z. Так как частоты могут быть определены с высокой точностью, соответствующие им m/z также могут быть вычислены с высокой точностью. Важно отметить, что сигнал генерируется только когерентным движением ионов в условиях ультравысокого вакуума (10-11-10-9 Торр). Этот сигнал должен быть измерен за минимальное время (обычно от 500 мс до 1 секунды), чтобы обеспечить высокое разрешение. По мере увеличения давления, сигнал затухает быстрее, вследствие потери когерентности движения из-за столкновений (например, меньше чем за 150 мс) и не позволяет провести измерения с высоким разрешением (рис. 2.14). [15]
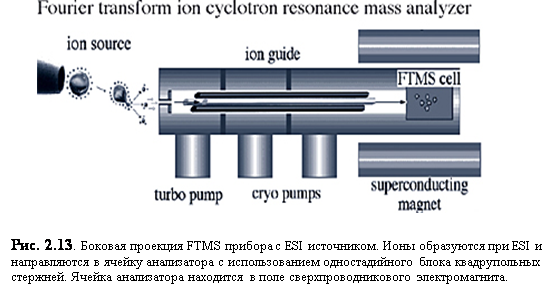 |
Ионы, находящиеся в когерентном циклотронном движении между двумя электродами изображено на рис. 2.13. По мере того, как положительно заряженные ионы двигаются от верхнего электрона и приближаются к нижнему, электрическое поле ионов вынуждает электроны внешней цепи течь и накапливаться на нижнем электроде. На другой половине циклотронной орбиты электроны покидают нижний электрод и накапливаются на верхнем электроде, когда ионы приближаются. Колебательное движение электронов внешней цепи называется экранирующим током. Когда смесь ионов с различными значениями m/z одновременно ускоряется, сигнал экранирующего тока на выходе усилителя представляет собой составной установившийся сигнал с составляющими частотам, соответствующими каждому значению m/z. Проще говоря, все ионы, запертые в ячейке анализатора, возбуждаются до высоких циклотронных орбит при помощи радиочастотного импульса. Составной установившийся сигнал экранирующего тока ионов по мере их релаксации обрабатывается компьютером, и используется преобразование Фурье для выделения индивидуальных циклотронных частот. Влияние давления на сигнал и разрешение продемонстрировано на рис. 2.14.
Вдобавок к высокому разрешению, FTMS также обладает способностью обеспечивать эксперименты с многократными столкновениями (MSn). FTMS способна к исключению всех ионов, кроме нужного. Выделенный ион затем подвергается столкновению с газом (или другой форме возбуждения: лазерному облучению или электронному захвату) для вызывания фрагментации. Анализ масс может быть затем проведён для фрагментов, чтобы получить спектр фрагментации. Высокое разрешение FTMS/MS также даёт точные измерения масс фрагментов.
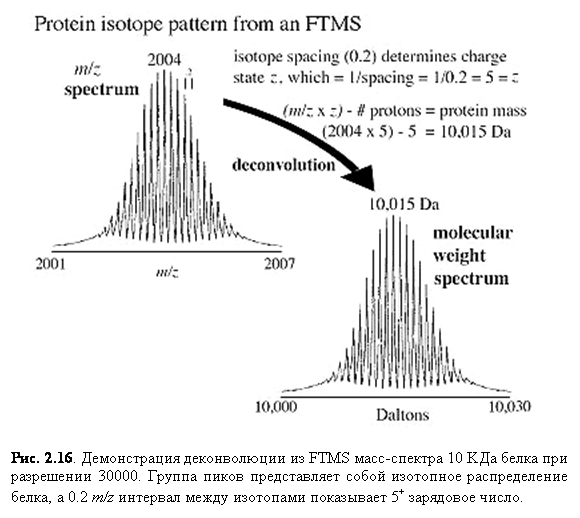
FTMS является довольно новым методом для биомолекулярного анализа, но множество её преимуществ делают её всё более и более интересной. Сейчас становится всё более обычным объединение ультравысокого разрешения (>105) FTMS с большим разнообразием способов ионизации, включая MALDI, ESI, APCI и EI. Результатом высокой разрешающей способности FTMS анализатора является высокая точность (часто порядка долей ppm) как показано для белка на рис. 2.16, где можно видеть отдельные пики изотопов. Фурье преобразование сигнала ICR значительно увеличивает удобство ICR за счёт одновременного измерения перекрывающихся частот, произведённых внутри ячейки ICR. Индивидуальные частоты могут быть затем легко и точно переведены в m/z ионов.
В общем, увеличение магнитного поля (B) оказывает благоприятный эффект на характеристики. Фурье преобразование IRC сигнала, измеряя перекрывающиеся частоты одновременно, позволяет достичь высокого разрешения и большой точности определения масс без соответствующего уменьшения чувствительности. Это – чёткое отличие от двухсекторными приборами, которые подвержены потерям чувствительности при высочайших разрешении и точности. Высокие возможности разрешения FTMS прямо связаны с полем FTMS сверхпроводящего магнита, так как увеличение разрешения прямо пропорционально полю. Ионная вместимость, так же как MS/MS эксперименты по кинетической скорости увеличиваются пропорционально квадрату величины поля, тем самым увеличивая динамический диапазон и фрагментарную информацию. Одним из препятствий в увеличении B является эффект магнитного зеркала, когда перенос ионов внутрь магнитного поля становится всё более трудным из-за магнитных силовых линий. Также, изготовление высокопольных магнитов с большими отверстиями превосходной гомогенностью поля (для IRC) становится технически всё более сложным. [16]
Магнитное поле влияет на FTMS оборудование следующими путями:
|
||||||||||||
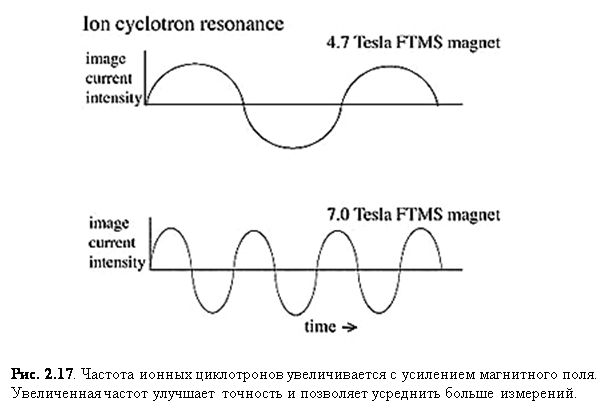
Так как частота иона = K*B*z/m, большее магнитное поле обеспечивает
большую частоту для того же m/z, поэтому генерируется больше опорных
точек для более точного определения частоты, что ещё больше увеличивает
точность (рис. 2.17).
Квадрупольная FTMS и квадрупольной ионной ловушки FTMS анализаторы масс, которые в последнее время стали использоваться, обычно объединяются с ESI устройствами. Квадрупольная FTMS комбинирует стабильность квадрупольного анализатора с высокой точностью FTMS. Квадруполь может действовать как любой простой квадрупольный анализатор для сканирования по диапазону m/z. Однако он также может быть использован для селективного избирания иона-прекурсора и направления этого иона в ячейку столкновений или на FTMS. Полученные прекурсор и фрагментарные ионы могут быть затем анализированы при помощи FTMS.
Проведение MS/MS экспериментов вне магнитного поля предоставляет некоторые преимущества, так как высокое разрешение в FTMS зависит от высокого вакуума. MS/MS эксперименты включают в себя столкновения при установившемся высоком давлении (10-6 – 10-7 Торр), которое затем необходимо уменьшить, чтобы добиться высокого разрешения (10-10 – 10-9 Торр). Проведение MS/MS экспериментов вне ячейки, тем самым, оказывается быстрее, так как в IRC ячейке может поддерживаться ультравысокий вакуум. Это делает более новую гибридную компоновку прибора оптимальной по сравнению с комбинацией FTMS/MS с методами разделения, такими как ЖХ.
Таблица 2.2. Общее сравнение анализаторов масс, обычно используемых совместно с ESI. Эти значения могут меняться в зависимости от производителя прибора.
|
|
Квадрупольный |
Ионная |
Времяпролётный |
Времяпролётный рефлектрон |
Магнитный сектор |
FTMS |
Квадрупольный TOF |
| Точность | 0.01% (100 ppm) | 0.01% (100 ppm) | 0.02 to 0.2% (200 ppm) | 0.001% (10 ppm) | <0.0005% (<5 ppm) | <0.0005% (<5 ppm) | 0.001% (10 ppm) |
| Разрешение | 4,000 | 4,000 | 8,000 | 15,000 | 30,000 | 100,000 | 10,000 |
|
Диапазон m/z |
4,000 | 4,000 | >300,000 | 10,000 | 10,000 | 10,000 | 10,000 |
| Скорость сканирования | ~ секунда | ~ секунда | миллисекунды | миллисекунды | ~ секунда | ~ секунда | ~ секунда |
| Тандемная MS |
MS2 (тройной квадруполь) |
MSn |
MS |
MS2 |
MS2 |
MSn |
MS2 |
| Комментарии к тандемной MS |
Хорошая точность |
Хорошая точность |
Практически неприменима |
Выбор иона-прекурсора ограничен широкмасс; Растущее число приложений |
Ограниченное
разрешение |
Отличная точность и разрешение ионов продуктов |
Превосходная точность Низкоэнергетические столкновения Высокая чувствительность |
| Общие комментарии |
Малая стоимость |
Малая стоимость |
Малая стоимость |
Хорошая точность Хорошее разрешение |
Прибор громоздкий |
Высокое разрешение, MSn, Высокий вакуум, сверхпроводниковый магнит, дорогой |
Известен высокой чувствительность и точностью при использовании для MS2 |
Детекторы
После того, как ионы разделены анализатором масс, они достигают ионного детектора (рис. 2.1 и 2.18-21), где генерируют токовый сигнал падающих ионов. Самым распространённым детектором является электронный умножитель, который передаёт кинетическую энергию падающих ионов на поверхность, где она, в свою очередь, генерирует вторичные электроны. Однако, существует множество подходов, зависящих от типа масс-спектрометра.
Электронный умножитель
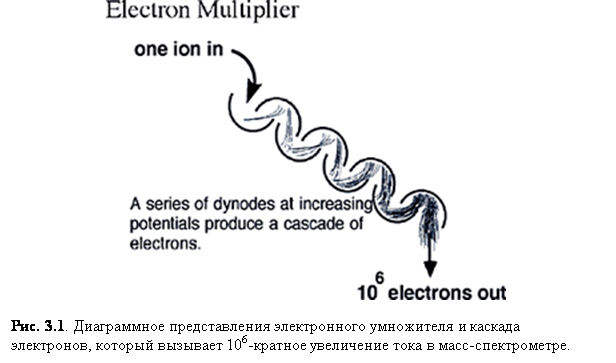
Пожалуй, большинство устройств детектирования ионов включают в себя электронный умножитель (рис. 3.1), который сделан из серии (от 12 до 24) динодов из оксида алюминия, поддерживаемых под увеличивающимся
потенциалом. Ионы ударяют в поверхность первого динода, вызывая испускание электронов. Эти электроны затем притягиваются к следующему диноду, имеющему больший потенциал, и поэтому генерируется больше вторичных электронов. В конце концов, после включения значительного числа динодов, образуется каскад электронов, который даёт общий ток больше в миллион раз и даже ещё больше.
Высокоэнергетический динод (HED) использует ускоряющее электростатическое поле для увеличения скорости ионов. Так как сигнал электронного умножителя сильно зависит от скорости иона, HED служит для увеличения интенсивности сигнала, а, следовательно, и чувствительности.
Цилиндр Фарадея
Включает в себя удар ионов по поверхности динода (BeO, GaP или CsSb), который вызывает выброс вторичных электронов. Этот временный выброс электронов вызывает положительный заряд на детекторе, и поэтому ток электронов по направлению к детектору. Такой детектор не особенно чувствителен, давая очень ограниченное усиление сигнала, но зато он устойчив к относительно высокому давлению.
Фотоумножитель с преобразующим динодом
Фотоумножитель с преобразующим динодом (рис. 3.3) не является обычно используемым электронным умножителем, хотя он похож на него по устройству: вторичные электроны ударяют в фосфоресцирующий экран вместо динода. Фосфоресцирующий экран высвобождает фотоны, которые детектируются фотоумножителем. Фотоумножители действуют так же, как электронные: в них падающий на сцинтилляционную поверхность фотон вызывает высвобождение электронов, которое усиливается по каскадному принципу. Преимуществом преобразующего динода является то, что трубка фотоумножителя герметично вакуумирована, не подвержена воздействию среды масс-спектрометра и, тем самым, исключена возможность её загрязнения. Это увеличивает срок службы таких детекторов по сравнению с обычными электронными умножителями. Обычно срок службы увеличивается на пять лет притом, что они имеют такую же чувствительность, что и электронные умножители.
Матричный детектор
Линейный детектор – группа индивидуальных детекторов, расположенных в матрицу. Матричный детектор, который пространственно определяет ионы в зависимости от их m/z, обычно используется с анализаторами масс магнитного сектора. Пространственно разделённые ионы могут быть детектированы одновременно матричным детектором. Основным преимуществом такого подхода является то, что при малом диапазоне масс, нет необходимости в сканировании, и поэтому увеличивается чувствительность. [1]
Зарядовый (индуктивный) детектор
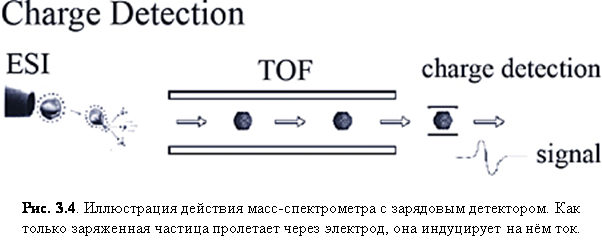
Зарядовый детектор просто распознаёт движущуюся заряженную частицу (ион) по тому, как она индуцирует ток на электроде просто из-за своего быстрого движения. Обычный сигнал показан на рис. 3.4. Этот тип детектирования широко применяется в FTMS, чтобы генерировать экранирующий ток иона. Детектирование не зависит от размера иона и поэтому может применяться к таким частицам, как целые вирусы.
Таблица 3.1. Общее сравнение детекторов.
|
Детектор |
Преимущества |
Недостатки |
|
Цилиндр |
|
|
| Фотоумножитель с преобразующим динодом (сцинтилляционный счётчик) |
|
|
| Электронный умножитель |
|
|
| Высокоэнергетический диноды с электронным умножителем |
|
|
| Матрица |
|
|
| Детектирование заряда |
|
|
Вакуум масс-спектрометра
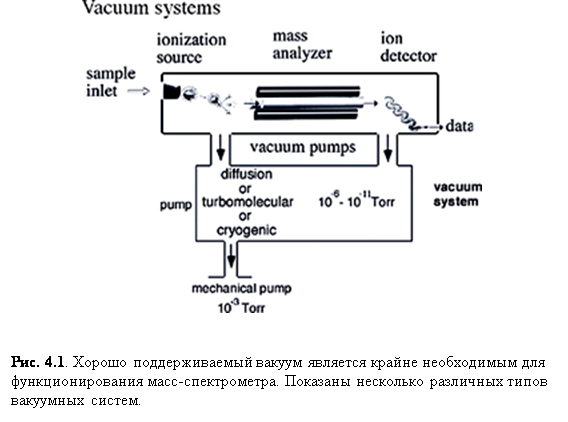
Всем масс-спектрометры нужен вакуум, чтобы ионы могли достичь детектора без столкновений с другими газообразными молекулами или атомами. Если такие столкновения случаются, прибор подвержен уменьшению разрешения и чувствительности. Высокие давления также могут вызывать разряд напряжений в землю, что может повредить прибор, его электронику или компьютерную систему, обслуживающую масс-спектрометр. Мощная утечка, и основанный на ней прорыв атмосферы внутрь прибора, может серьёзно повредить масс-спектрометр, уничтожив электростатические линзы, забрызгав оптику насосным маслом или повредив детектор. В общем, поддержание хорошего вакуума является ключевым моментом в получении высококачественных спектров.
Одним из первых препятствий, встреченных изобретателями масс-спектрометрии, было совмещение источника образцов и масс-спектрометра. Образцы, находящиеся при атмосферном давлении (760 Торр) перед помещением в вакуум масс-спектрометра (~10-6 Торр), что является разностью в давлении приблизительно в миллиард раз. Одним из подходов является введение образца через капиллярную колонку (ГХ) или через малое входное отверстие непосредственно в прибор. Другим подходом является изолирование камеры ввода образца при помощи вакуумного клапана (MALDI) и, после достижения приемлемого вакуума над образцом (<10-2 Торр) образец может быть представлен в основную часть вакуумной камеры (<10-5 Торр).
 |
Масс-спектрометр показан на рис. 4.1 с тремя альтернативными насосными системами. Все три системы способны давать высокий вакуум, и все заканчиваются механическими насосами. Механический насос служит «рабочей лошадкой» для большинства масс-спектрометров и служит для получения первоначального вакуума порядка 10-3 Торр. После получения вакуума в 10-3 Торр, могут быть активированы другие насосные системы, такие как диффузионные, криогенные или турбомолекулярные, которые позволяют достичь вакуума до 10-11 Торр. [1]
Выводы
Масс-спектрометрия становится важным методом анализа биологических и небиологических макромолекул. Она является одним из самых чувствительных и точных методов, способным определять всего лишь сотни молекул, уступая в этом только радиационным методам анализа. Разрешение некоторых методов достигает 30000, что означает точность порядка десятков ppm. Такая точность даёт возможность изотопного анализа макромолекул, таких, как белки, а также определения дефекта массы и расчёта брутто-формулы лёгких молекул и даже белков только по данным определения молекулярной массы и изотопного распределения.
Фрагментарная информация, особенно при использовании тандемной масс-спектрометрии даёт возможность определять структуру молекулы, а также, в ограниченных масштабах, механизмы газофазных реакций и реакционные центры исследуемых молекул.
Вместе с тем, масс-спектрометрия является одним из самых дорогих методов анализа, наряду с ЯМР-спектрометрией, уступая в этом только рентгеноструктурному анализу. Это обусловлено, главным образом, необходимостью организации высокого вакуума внутри прибора и связанных с этим трудностей при выборе оборудования.
Список использованной литературы
1. Dole M, Mack LL, Hines RL, Mobley RC, Ferguson LD, Alice MB. Molecular beams of macroions. Journal of Chemical Physics. 1968, 49:5, 2240.
2. Whitehouse CM, Dreyer RN, Yanashita M, Fenn JB. Electrospray interface for liquid chromatographs and mass spectrometers. Anal. Chem. 1985, 57, 675-679.
3. Tanaka K, Waki H, Ido Y, Akita S, Yoshida Y, Yoshida T. Protein and polymer analysis up to m/z 100,000 by laser ionization time-of-flight mass spectrometry. Rapid Commun. Mass Spectrom. 1988, 2, 151.
4. Karas M & Hillenkamp F. Laser desorption ionization of proteins with molecular mass exceeding 10,000 Daltons. Anal. Chem. 1988, 60, 2299.
5. Bruins AP. Mechanistic aspects of electrospray ionization. J. Chromatogr. A, 1998, 795, 345-357.
6. Fenn JB, Mann M, Meng CK, Wong SF, Whitehouse CM. Electrospray ionization - principles and practice. Mass Spectrometry Reviews. 1990, 9, 37.
7. McLafferty FW & Turecek F. Interpretation of Mass Spectra. 4th ed. Mill Valley, Calif. : University Science Books, 1993.
8. Cole R (Editor). Electrospray Ionization Mass Spectrometry: Fundamentals, Instrumentation, and Applications. New York: Wiley and Sons, 1997.
9. Cole RB. Some tenets pertaining to electrospray ionization mass spectrometry. J. Mass Spectrom. 2000, 35, 763-772.
10. Kebarle P. A brief overview of the present status of the mechanisms involved in electrospray mass spectrometry. J. Mass Spectrom. 2000, 35, 804-817.
11. Gaskell SJ. Electrospray: principles and practice. J. Mass Spectrom. 2000, 35, 677-688.
12. Cech NB and Enke CG. Practical implications of some recent studies in electrospray ionization fundamentals. Mass Spectrom. Rev. 2001, 20, 362-387.
13. Busch K.L., Glish G.L., McLuckey S.A. Mass Spectrometry/Mass Spectrometry: Techniques and Applications of Tandem. John Wiley & Sons, 1989.
14. Cotter R. Time-Of-Flight Mass Spectrometry: Instrumentation and Applications in Biological Research. Washington, D.C.: ACS, 1997.
15. McCloskey J.A. & Simon M.I. Methods in Enzymology: Mass Spectrometry. Academic Press, 1997.
16. Kinter M. & Sherman NE. Protein Sequencing and Identification Using Tandem Mass Spectrometry. Wiley-Interscience, 2000.