Курсовая работа: Методи синтезу хінолінів
Хімія гетероциклических сполук є одним з найважливіших розділів органічної хімії. Гетероциклічними сполуками, відповідно до класичного визначення, варто називати молекули, у цикл яких крім атомів вуглецю входять один або декілька гетероатомів. Найчастіше в якості гетероатомів виступають атоми азоту (N), кисню (O), сірки (S), а також фосфору (P), селен (Se), кремнію (Sі).
Як показали теоретичні й експериментальні дослідження в області гетероциклів, активна роль гетероатомов у циклічній системі визначається насамперед наявністю в них неподілених електронних пар. Особливості хімічної поведінки гетероциклічних сполук залежать від природи взаємодії неподілених електронних пар гетероатомів (або гетероатома) і електронів циклічної системи.
У даній курсовій роботі будуть розглянуті методи систезу хіноліну.
Хінолін та його похідні застосовуються як лікарські засоби, наприклад, атофан, ентеросептол, хінозол.
Мета роботи полягає в тому, щоб розглянути основні методи синтезу хінолінів.
Завдання роботи:
1) дати характеристику будови та властивостей хіноліну та його похідних;
2) навести схеми основних методів синтезу хіноліну та його похідних.
1. Хінолін: номенклатура, будова та властивості
1.1 Особливості номенклатури та будови хіноліну
За номенклатурою, прийнятою для гетероциклічних сполук, хінолін можна назвати бензо[b] піридином, а ізохінолін – бензо[з] піридином. Ця номенклатура заснована на тому, що сторонам гетероциклічного фрагмента привласнюються індекси – «а» – для зв'язку гетероатом – a‑атом вуглецю, «b» – для зв'язку, що з'єднує a і b атоми вуглецю, і так далі. При анелюванні іншого циклу до вихідного гетероциклу в квадратних дужках вказується позначення сторони, по якій відбувається анелювання.
Так само, як і піридин, хінолін і ізохінолін містяться в кам'яновугільній смолі, відкіля вони можуть бути виділені завдяки тому, що, подібно піридинові, є основами.
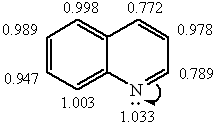
Вплив атома азоту на бензольне кільце виражений слабше, ніж на піридинове кільце. Реакції електрофільного заміщення протікають легше, ніж у піридині. Також протікають реакції нуклеофільного заміщення, і хінолін виявляє основні властивості, як піридин.
1.2 Властивості хіноліну
Хінолін – гетероциклічна сполука, у якій бензольне кільце анельовано з піридиновим через атоми вуглецю. Хінолін – стабільна, малоразчинна у воді, рідина з неприємним запахом. Його температура кипіння 237 °С, а плавлення -16 °С. Спочатку хінолін було виділено з кам'яновугільної смоли.
Хінолін – безбарвна рідина, добре змішується з водою, етанолом, діетиловим ефіром та іншими органічними розчинниками, переганяється з водяною парою.
Хінолін є ароматичною сполукою. Його молекула має плоску будову та містить замкнену спряжену π-електронну систему з 10π-електронів, яка задовольняє правилу Хюккеля.
За хімічними властивостями хінолін нагадує піридин. Йому характерні реакції за участю гетероатома, реакції електрофільного та нуклеофільного заміщення атомів водню хінолінового ядра, а також реакції окиснення та відновлення.
1. Реакції по гетероатому. Наявність у молекулі хіноліну атома азоту піридинового типу надає сполуці основних властивостей. Як основа хінолін дещо слабший від піридину (рКвн+ хіноліну в Н2О становить 4,94; pKDH+ піридину 5,25).
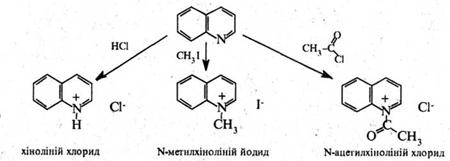
За участю гетероатома хінолін, аналогічно піридину, утворює солі з сильними кислотами, алкіл- і ацилгалогенідами:
2. Реакції електрофільного та нуклеофільного заміщення. Через електроно-акцепторний вплив гетероатома в молекулі хіноліну електронна густина зменшена у порівнянні до його бензоаналогу – нафталіну – та розподілена нерівномірно: в піридиновому кільці вона нижче, ніж у бензольному. Тому при дії електрофільними реагентами заміщення переважно іде по бензольному кільцю, а нуклеофільними – по піридиновому.
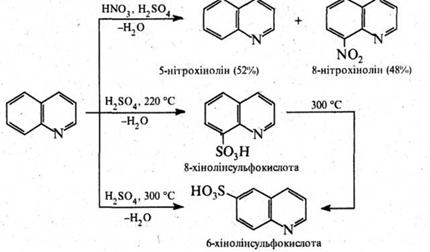
Реакції електрофільного заміщення в молекулі хіноліну проходять здебільшого в положеннях 5 і 8. Так, при нітруванні нітруючою сумішшю утворюється суміш 5- і 8‑нітрохінолінів, сульфування концентрованою сірчаною кислотою при 220 °С приводить до утворення 8‑хінолінсульфокислоти, а при 300 °С – термодинамічно вигіднішої 6‑хінолінсульфокислоти (за цих умов 5- і 8-ізомери перегруповуються в 6-ізомер).
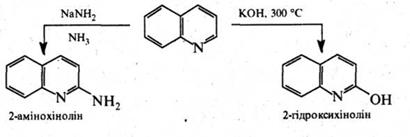
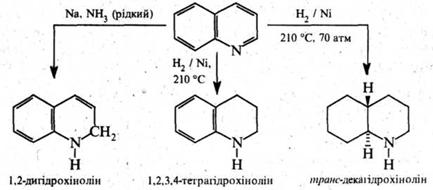
В реакції нуклеофільного заміщення хінолін вступає легше, ніж піридин. При цьому, як і в кільці піридину, нуклеофільній атаці піддається переважно положення 2. Так, при дії на хінолін амідом натрію в середовищі рідкого аміаку утворюється 2‑амінохінолін, з гідроксидом калію при 280–300 °С хінолін утворює 2‑гідроксихінолін:
3. Реакції відновлення і окиснення. Відновлення хіноліну проходить передусім у піридиновому ядрі. При дії більшості відновників з високим виходом утворюється 1,2‑дигідрохінолін, у присутності нікелю Ренея хінолін відновлюється воднем до 1,2,3,4‑тетрагідрохіноліну. Каталітичне гідрування за жорстких умов торкається також бензольного кільця.
Окиснення хіноліну та його гомологів з замісниками в бензольному ядрі дією перманганатом калію в лужному середовищі супроводжується розщепленням бензольного кільця та приводить до утворення 2,3‑піридиндикарбонової кислоти (хінолінова кислота).

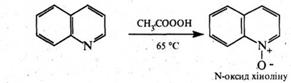
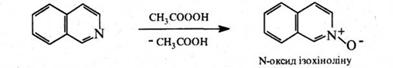
Аналогічно піридину, в присутності пероксикислот хінолін окислюється по гетероатому з утворенням N‑оксиду:
1.3 Властивості похідних хіноліну
Хінолінове ядро є структурним фрагментом молекул деяких алкалоїдів та лікарських засобів.
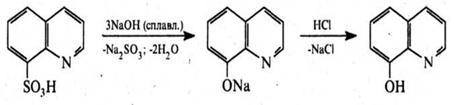
8‑Гідроксихінолін. Це безбарвна кристалічна речовина (т. пл. 75–76 °С) з характерним запахом, малорозчинна у воді, розчинна у хлороформі, діетиловому ефірі та бензолі. 8‑Гідроксихінолін добувають нагріванням орто-амінофенолу з гліцерином і сірчаною кислотою в присутності орто-нітрофенолу (синтез Скраупа) або сплавленням 8‑хінолінсульфокислоти з лугами.
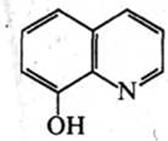
З іонами багатьох металів (Mg2+, Al3+, Zn2+, Mn2+, Со2+, Ni2+, Cu2+, Fe»+, Fe'+ та ін.) 8‑гідроксихінолін утворює малорозчинні у воді комплекси (хелати).

На цій властивості ґрунтується застосування 8‑гідроксихіноліну як аналітичного реагенту.
Ряд похідних 8‑гідроксихіноліну використовуються в медичній практиці як протимікробні засоби. До них відносяться такі лікарські препарати, як хінозол, нітроксолін (5‑НОК) і ентеросептол:
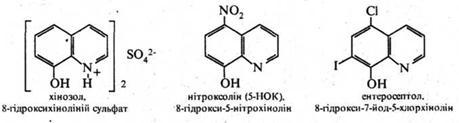
Вважають, що їх бактерицидна дія викликана зв'язуванням іонів Со2+, необхідних для життєдіяльності мікроорганізмів.
Ізохінолін (бензо[с] піридин) є ізомером хіноліну. Молекула ізохіноліну, як і хіноліну, складається з конденсованих піридинового та бензольного циклів, але, на відміну від хіноліну, цикли з'єднані вздовж зв'язку С3-С4 піридинового кільця.
Нумерацію атомів ізохінолінового ядра проводять згідно з правилами ІЮПАК наведеним способом.
Ізохінолін безбарвна кристалічна речовина (т. пл. 24,6 °С), розчинна у воді, етанолі, діетиловому ефірі, хлороформі та бензолі.
За хімічними властивостями ізохінолін мало чим відрізняється від хіноліну. За рахунок гетероатома він виявляє оснбвні властивості та легко утворює солі з кислотами, алкіл- і ацилгалогенідами. Як основа ізохінолін трохи сильніше хіноліну (рКВН+ ізохіноліну 5,14; рКВН+ хіноліну 4,94).
Реакції електрофільного заміщення, як і в ядрі хіноліну, проходять здебільшого в положеннях 5 і 8. Нуклеофільне заміщення в ізохіноліновому циклі відбувається переважно у положенні 1.
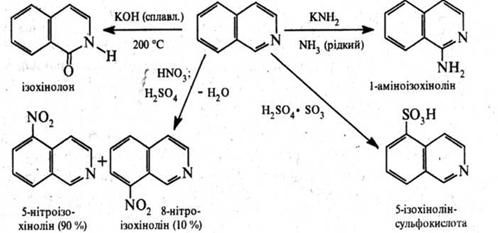
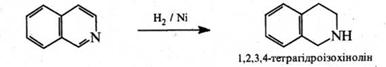
При відновленні ізохіноліну, як і у молекулі хіноліну, в першу чергу гідрується піридинове ядро. Так, при дії натрієм в етанолі або воднем над нікелевим каталізатором ізохінолін відновлюється до 1,2,3,4‑тетрагідроізохіноліну.
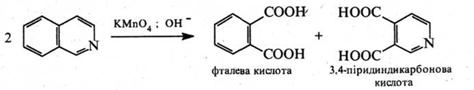
За жорсткіших умов гідруванню піддається і бензольне кільце. При окисненні ізохіноліну лужним розчином КМпО4 утворюється суміш фталевої та 3,4‑піридиндикарбонової кислот:
Під дією органічних пероксикислот ізохінолін окиснюється по гетероатому, утворюючи N‑оксид.
Ядро ізохіноліну є структурним фрагментом молекул алкалоїдів ізохінолінового ряду – папаверину, морфіну, кодеїну та ін.
1.4 Застосування хінолінів
Хінолінова циклічна система значно поширена в природі. Хіноліновий кістяк протягом тривалого часу був основою для пошуку синтетичних противомалярійних препаратів. Один з таких препаратів – хлорохін. Ціанінові барвники також складають значну частку в комерційній продукції на основі хінолінової сировини. Вони застосовуються для сенсибілізації фотографічних емульсій до червоних і інфрачервоних променів, що не діють на бромисте срібло без сенсибілізації. Найпростішим барвником цього типу є етиловий червоний. Тетрагідропохідна оксамніхін використовується для боротьби із шистосомой, що служить основною причиною захворювання в тропічних регіонах. На основі синтезу похідних хіноліну з ізатину, можна одержати багато інших хіміко-фармацевтичних препаратів. 8‑оксихінолін (оксин) широко використовується в аналітичній хімії для виявлення багатьох металів, що дають з ними внутрікомплексні солі оксинати (хелати) за рахунок участі вільної пари електронів азоту, а також як дезинфікуючі засоби (хіназол), 5‑хлор‑7‑йод‑8‑Оксихінолін (ентеросептол) застосовується для боротьби з кишковими захворюваннями. Він настільки повно зв'язує іонний кобальт (кобаламіну – вітаміну B12), що вижитти бактерій неможуть. Хінолін часто використовується в лабораторії в якості висококиплячого основного розчинника.
2. Характеристика методів синтезу хінолінів
2.1. Синтез хіноліну Скраупа
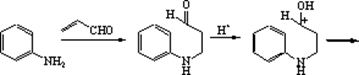
Основним методом одержання хіноліну є синтез Скраупа, що полягає у взаємодії аніліну або заміщених анілінів із гліцерином, у присутності сірчаної кислоти й окислювача, у якості якого часто використовують нітробензол, мета-нітробензолсульфокислоту, а іноді і просто кисень повітря.
На першій стадії гліцерин під дією сірчаної кислоти дегідратується з утворенням акролеїну. Далі відбувається приєднання аніліну до акролеїну по типу реакції Михаеля. Унаслідок протонування альдегідної групи, що утвориться в інтермедіаті відбувається її активація як електрофіла, що приводить до замикання гетероциклу в результаті електрофільного заміщення в орто-положення бензольного кільця. Наступна дегідратація приводить до дигідропохіного хіноліну, а потім окисляється окислювачем за наявності в реакційному середовищі у хінолін. Використовуваний як окислювач нітроарен відновлюється у відповідний анілін.
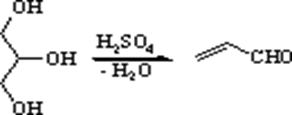
Методика виконання роботи.
Сірчанокисле залізо, мірна кислота, їдкий натр, азотистокислий натрій, диетиловий ефір.
У круглодонную колбу, ємністю 250 мл до суміші аніліну, нітробензолу, гліцерину, і 2,5 г сірчанокислого заліза при перемішуванні додають 11 мл концентрованої сірчаної кислоти. Вміст колби ретельно перемішують і, з'єднавши трубку зі зворотним холодильником. Нагрівають на азбестовій сітці.
Як тільки реакція почнеться (це можна помітити по раптовому виділенню з рідини пухирців пари), нагрівання припиняють і чекають закінчення бурхливої реакції без зовнішнього підігріву. Як тільки рідина перестане кипіти, нагрівання відновляють і кип'ятять вміст колби ще протягом 2–3 годин. Потім суміш не прохолоджуючи переносять у колбу для перегонки з водяною парою. Реакційну колбу обполіскують невеликою кількістю води, що доливають до реакційної суміші і відганяють не прореагувавший нітробензол. Перегонку ведуть доти, поки в дистилят не перестануть переходити маслянисті краплі нітробензолу (дистилят повинен стати прозорим). Припинивши перегонку, у ще теплу рідину обережно доливають 50 мл 40-% розчину їдкого натру (до лужної реакції) і знову ведуть перегонку з водяною парою. При цьому в дистилят не перестають виділилися при підлужненні у вигляді вільних основ хінолін і анілін.
Отриманий дистилят для звільнення від аніліну підкисляють 14 мл концентрованої сірчаної кислоти, охолоджують до 50С доливають до охолодженого розчину 10%-ний розчин азотистокислого натрію до появи реакції на вільну азотисту кислоту (посиніння йодкрахмального папірця при нанесенні на неї краплі розчину). При цьому анілін діазотується, а хінолін як третинна основа залишається без змін. Реакційну суміш після діазотування нагрівають на водяній бані до припинення виділення пухирців азоту. Діазосполука, отримана з аніліну, при нагріванні розкладається з виділенням азоту й утворенням фенолу.
Розчин знову подлужнюють 40%-ним розчином їдкого натру. Фенол переходить у фенолят, що не переганяється з водяною парою, а хінолін виділяється у вигляді вільної основи і переганяється з водяною парою. З дистиляту після перегонки з водяною парою хінолін витягають екстрагуванням ефіром. Ефірний шар відокремлюють у ділильній лійці і сушать твердим лугом. Після просушки ефірний розчин переносять у колбу Вюрца і відганяють на водяній бані ефір. Потім заміняють водяний холодильник на повітряний і переганяють хінолін, нагріваючи колбу на газовому пальнику з азбестовою сіткою. Збирають фракцію 234–240 0С.
2.2 Синтез хіноліну по Дебнеру-Мілеру
У реакцію Скраупа можуть бути внесені і a, b‑ненасичені кетони. Модифікацією методу Скраупа є синтез Дебнера-Мілера. У цьому випадку в реакцію з аніліном вводять аліфатичні альдегіди в присутності кислот. Цей метод часто застосовується для одержання хінальдину‑2‑метилхіноліну. Він мало чим відрізняється від вищезгаданого синтезу. Принципова відмінність тільки в тому, що тут замість гліцерину беруться α, β-ненасичені альдегіди і кетони. Це істотно розширює коло можливості методу при синтезі різних похідних хіноліну, що містять замісники в піридиновому кільці. Даний метод не вимагає застосування нітробензолу, тому що сам альдегід служить окислювачем (акцептором водню).
При цьому на першій стадії відбувається кротонова конденсація альдегіду з утворенням a, b‑ненасиченого альдегіду, що далі реагує з аніліном за схемою, приведеною вище. При такому варіанті проведення реакції немає необхідності у використанні додаткового окислювача, роль якого в цьому випадку виконує вихідний альдегід.

2.3 Синтез хіноліну по Фрідлендеру
Тут здійснюється конденсація о-амінобензальдегіду з ацетальдегідом у присутності NaOH з наступною циклізацією продукту, що утворився.
Оскільки о-ациланіліни важкодоступні, використовують конденсацію о-нітрокарбонільних попередників з активними метиленовими компонентами з наступним відновлення нітрогрупи.
Фрідлендера синтез, одержання похідних хіноліну конденсацією ароматичних ортоамінокарбонільних сполук з речовинами, що містять у молекулі угруповання CH2C(O), напр.:
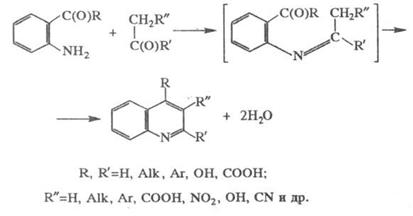
Звичайно суміш реагентів в етанолі нагрівають декілька годин у присутності каталітичних NaOH, KOH, K2CO3 або піперидину. Реакцію з альдегідами частіше проводять без каталізатора; у деяких випадках (напр., при одержанні 2‑метилхіноліну) найбільші виходи досягаються при використанні кислих каталізаторів під час відсутності розчинника. Реакція не йде з 1,2‑дифенілетаноном, глюкозою і левуліновою ксилотою. Виходи коливаються в дуже широких межах (Макс. – 70–80%).
Фрідлендера синтез має найбільше значення для синтезу хінолінів, заміщених у піридиновому кільці (насамперед 3‑замещених хінолінів, які важко одержати іншими методами). У випадку несиметричних метилкетонів група CH3 займає в хіноліні положення 2. У деяких випадках будова продуктів, що утворяться, залежить від умов здійснення реакції, напр.:
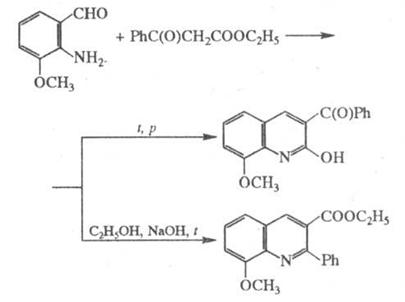
Основні побічні продукти – смоли, що утворюються в результаті олігомеризації вихідних продуктів.
Вважається, що фрідлендера синтез включає дві стадії – на першій утвориться основа Шиффа, на другий відбувається замикання циклу (при цьому виділяється H2O за рахунок карбонільного атома О та атомів H інших компонентів).
Модифікація Борше-Ріда: використання основ Шиффа замість менш стійких орто-амінокарбонильних сполук, що особливо зручно при синтезі хінолінів, заміщених у бензольному ядрі., напр.:
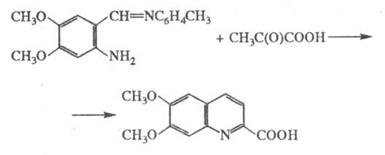
Фрідлендера синтез застосовують у лабораторній практиці. Відкрита П. Фрідлендером у 1882.
2.4 Інші методи синтезу
Синтез хіноліну по Кнорру. Цей метод включає конденсацію аніліну з ацетооцтовим ефіром у сильнокислой середовищі (конц.H2SO4) при 80–100 °С.
Синтез Кнорра, таким чином, здійснюється в результаті нуклеофільної атаки по складній-ефірній групі ефіру β-кетокислоти.
Синтез Конрада-Лимпаха. На відміну від синтезу Кнорра, тут йде атака нуклеофіла по кетонній групі через утворення проміжного енаміну (олія, 240–250 °С):
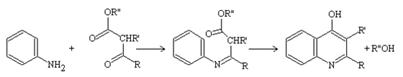
Синтез хінолінів по Пфитцингеру. Тут відбувається конденсація ізатину або ізатинової кислоти з карбонільним сполуками, що містять β-метиленову групу. Альдегіди звичайно використовують у вигляді оксимів. З несиметричних кетонів утворюються суміші ізомерних цинхонінових кислот. У метилкетонів, як правило, у конденсацію вступає метильна група. Основний побічний процес – автоконденсація карбонільної сполуки.
Ця хінолінова кислота декарбоксилюється при нагріванні в хінолін.
2.5 Синтез похідних хіноліну
Ізохінолін міститься в хіноліновій фракції кам'яновугільної смоли (близько 1%), з якої його здобувають у вигляді солі (гідросульфату).
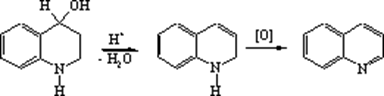
Одним з поширених способів синтезу ізохіноліну та його похідних є реакція Бішлера-Напіральського (1893 p.), котра ґрунтується на циклізації N‑ацильних похідних (3‑фенілетиламінів у 3,4‑дигідроізо-хіноліни та дальшому перетворенні останніх на ізохіноліни шляхом каталітичного дегідрування над паладієм на вугіллі. Циклізацію N‑ацильних похідних здійснюють частіше в присутності Р2О5 або РОСl3 в ксилолі.
Протіканню циклізації по Бишлеру-Напиральскому не перешкоджає і введення в бензольне кільце электроноакцепторной нитрогруппы, правда вихід продукту циклізації при цьому помітно знижується (< 10%). Слід зазначити, що і не утримуючого заступника в бензольному кільці b‑фенілацетамід циклізується у відповідне дигідропохідне з виходом всього 23%. Низький вихід похідних ізохіноліну компенсується приступністю вихідних сполук.

Велике значення в синтезі алкалоїдів, що є похідними ізохіноліну, має метод Пікте-Шпенглера, у якому в циклізацію вводять не ацетамідні похідні, як у методі Бишлера-Напіральского, а іміни, що утворяться при взаємодії альдегідів з b‑фенілетиламінами. У тому випадку, коли в бензольному кільці присутні активуючі замісники, реакція циклізації відбувається в дуже м'яких, іноді навіть у фізіологічних умовах (рН середовища, температура, концентрації реагентів), і приводить до гідрованих похідних ізохіноліну з високим виходом.

Висновок
Основним методом одержання хіноліну є синтез Скраупа, що полягає у взаємодії аніліну або заміщених анілінів із гліцерином, у присутності сірчаної кислоти й окислювача, у якості якого часто використовують нітробензол, мета-нітробензолсульфокислоту, а іноді і просто кисень повітря.
Хіноли і його похідні являють собою практично самостійний клас сполук, добре вивчених у теоретичному відношенні. Однак у більшості хімічних проявів хінолін сильно нагадує піридин. До найбільш відомих методів одержання хіноліну відносяться синтези Скраупа і Дебнера-Мілера. Обидва синтези включають стадію утворення дигідрохінолінових похідних.
Хнолін одержують за допомогою таких синтезів: синтез по Фрідлендеру, синтез хіноліну по Кнорру, синтез Конрада-Лимпаха, синтез хінолінів по Пфитцингеру.
Одним з поширених способів синтезу ізохіноліну та його похідних є реакція Бішлера-Напіральського (1893 p.), котра ґрунтується на циклізації N‑ацильних похідних (3‑фенілетиламінів у 3,4‑дигідроізо-хіноліни та дальшому перетворенні останніх на ізохіноліни шляхом каталітичного дегідрування над паладієм на вугіллі.
Список використаних джерел
1. Артеменко А.И. Органическая химия. – М.: Высшая школа, 1998.
2. Грандберг И.И. Органическая химия. – М.: Высшая школа, 1980.
3. Гудкова А.С. От простого к сложному. – М.: Изд-во Моск. ун-та, 1983.
4. Марч Дж. Органическая химия. В 4‑х т. – М.: Мир, 1985.
5. Моррисон Р., Бойд Р. Органическая химия. – М.: Мир, 1974.
6. Нейланд О.Я. Органическая химия. – М.: Высшая школа, 1990.
7. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. В 2‑х кн. – М.: Химия, 1974.
8. Потапов В.М., Татаринчик С.Н. Органическая химия. – М.: Химия, 1980.
9. Робертc Дж., Касерио М. Основы органической химии. – М.: Мир, 1978. т. 1, 2.
10. Сайкс П. Механизмы реакции в органической химии. М.: Химия, 1991.
11. Справочник химика. В 6‑ти томах. – Л.: Химия, 1968.
12. Терней А. Современная органическая химия. В 2‑х томах. – М: Мир, 1981.
13. Тюкавкина Н.А. Органическая химия. – М: Медицина, 1998.
14. Химическая энциклопедия. В 5‑ти томах. – М.: Советская энциклопедия – Большая Российская энциклопедия, 1988–1998.
15. Химический энциклопедический словарь. – М.: Советская энциклопедия, 1983.
16. Шабаров Ю.С. Органическая химия. В 2‑х т. – М.: Химия, 1994.