Курсовая работа: Микробиологические трансформации стероидов. Методы проведения
Содержание
Введение
1. Микробиологические трансформации органических соединений
2. Микробиологические трансформации стероидов
2.1 Стерины
2.2 Основные микробиологические превращения стероидов
2.2.1 Введение гидроксильной группы
2.2.2 Дегидрогенизация стероидов
2.2.3 Микробиологическое восстановление
2.2.4 Окисление гидроксильной группы в кетогруппу
2.2.5 Гидролиз эфиров стероидов
2.2.6 Отщепление боковых цепей стероидов
3. Методы проведения процессов микробиологических трансформаций
4. Примеры промышленного использования микробиологических трансформаций
Список используемой литературы
Введение
Микробиологическая трансформация – использование ферментативной активности жизнеспособных клеток микроорганизмов, результатом чего является некоторое изменение молекулярной структуры трансформируемого субстрата.
В области превращений стероидных соединений достоинства биологических катализаторов проявляются наиболее ярко. Долгое время микробиологическая трансформация считалась специфическим методом химии стероидов.
Первые
сообщения о трансформации стероидов микроорганизмами появились задолго до того,
как было установлено строение основных представителей стероидов. Еще в конце XIX в. Было известно, что бактериальная
флора кишечника млекопитающих превращает холестерин в копростерин, а холевую
кислоту — в дезоксихолевую. К 1913 г. Относится открытие полного расщепления
холестерина микобактериями. И лишь в 30-х годах, когда была установлена
структура основных стероидных гормонов, известных к тому времени, начались
попытки применять трансформирующую способность микроорганизмов для
препаративного получения этих соединений. В 1948 г. Впервые осуществлено
введение гидроксильной группы в молекулу стероида микробилогическим путем. Но
только после получения 11![]() -гидроксипрогестерона из
прогестерона при ферментации последнего с культурой Rhizopus nigricans микробиологические трансформации стероидов привлекли широкое
внимание.
-гидроксипрогестерона из
прогестерона при ферментации последнего с культурой Rhizopus nigricans микробиологические трансформации стероидов привлекли широкое
внимание.
Данная трансформация ярко продемонстрировала преимущества микробиологических методов перед химическими: введение кислородной функции в определенное положение молекулы стероида заменялось единственной стадией ферментативного гидроксилирования. Открытие в эти же годы терапевтической ценности кортизона наряду с указанными успехами микробиологического процесса гидроксилирования привлекло огромное внимание микробиологов, химиков и врачей к данной области.
Внедрение микробиологического синтеза в процессы получения стероидных гормональных препаратов вызвало переворот в фармацевтической промышленности, позволив сразу во много раз удешевить ценные препараты.
1. Микробиологические трансформации органических соединений
Область синтетического применения микроорганизмов можно условно разделить на два направления:
1) полный биосинтез микроорганизмами важных биологически активных веществ и продуктов (антибиотиков, ферментов, витаминов, стеринов, аминокислот и др.) осуществляемый клетками с помощью компонентов питательной среды;
2) микробиологические трансформации, то есть совместное использование отдельных химических и микробиологических стадий в многостадийном целенаправленном синтезе лекарственных препаратов и других ценных для народного хозяйства продуктов.
Применение микроорганизмов в качестве носителей активных полиферментных систем, способных переводить экзогенные органические соединения в разнообразные полезные продукты и физиологически активные вещества основано на том, что они могут осуществлять в одну стадию важнейшие превращения, требующие при синтезе 20 химических стадий. Кроме того, удается легко проводить реакции, трудно или пока совсем не осуществимые методами чисто химического синтеза.
Метод
микробиологических превращений имеет явные преимущества перед химическими
реакциями: возможность тонких перестроек сложных молекул, удобство и экономичность
технологических процессов. Особенно ярко проявляются они в области химии
стероидов. Дело в том, что сложность и громоздкость молекул стероидов
затрудняет даже незначительные модификации их химическим путем. Микроорганизмы
могут осуществлять уникальные реакции в синтезе лекарственных препаратов
стероидной природы, а именно 1,2-дегидрирование, 11![]() -гидроксилирование. Промышленный
синтез таких важнейших лекарств, как гидрокортизон, преднизон, преднизолон,
дексаметазон стал возможен только после разработки микробиологических способов
их получения. Эти препараты широко применяются при лечении тяжелых
ревматических заболеваний, бронхиальной астмы, воспалительных процессов и
хронических кожных заболеваний.
-гидроксилирование. Промышленный
синтез таких важнейших лекарств, как гидрокортизон, преднизон, преднизолон,
дексаметазон стал возможен только после разработки микробиологических способов
их получения. Эти препараты широко применяются при лечении тяжелых
ревматических заболеваний, бронхиальной астмы, воспалительных процессов и
хронических кожных заболеваний.
Большинство процессов микробиологической трансформации приводит к незначительной перестройке молекулы субстрата, осуществляемой одним или несколькими ферментами. Однако имеются микробиологические процессы, существенно изменяющие структуру трансформируемого соединения. Общей чертой всех процессов микробиологической трансформации является то, что их результат — изменение молекулярной структуры трансформируемого вещества, а не синтез молекулы de novo.
К микробиологическим трансформациям относится также синтез метаболитов из предшественников, если при этом структура продукта реакции определяется, в основном, структурой молекул предшественников (например, синтез некоторых нуклеотидов из гетероциклических оснований, пентоз и фосфатов).
В настоящее время принята классификация микробиологических трансформаций по типу возникновения и отщепления функциональных групп.
Основные процессы микробиологической трансформации: окисление, восстановление, декарбоксилирование, дезаминирование, образование гликозидов, гидролиз, метилирование, этерификация, дегидрирование, диспропорционирование, конденсация, аминирование, ацетилирование, амидирование, деметоксилирование, нуклеотидация, галогенирование, деметилирование, асимметризация, рацемизация, изомеризация.
2. Микробиологические трансформации стероидов
2.1 Стерины
Природные стерины — сырье для получения ценных лекарственных препаратов. [1]
Большой класс стероидов характеризуется наличием в молекуле специфического циклического скелета — циклопентанпергидрофенантрена, построенного из четырех колец, три из которых шестичленные (А, В и С) и одно — пятичленное (D). Для обозначения различных положений этого кольца принята следующая нумерация. К стеринам (стеролам) относятся стероиды, несущие в положении С-3 гидроксильную группу:
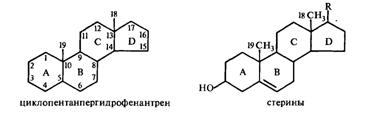
Одним из наиболее важных и хорошо изученных стеринов является холестерин (класс зоостеринов), имеющий бруттоформулу С27Н46О. Он обнаруживается почти во всех органах и тканях животных и человека. Холестерин принимает участие в физиологических процессах, происходящих в живой клетке, без его участия не может развиваться растущий организм. Желчные камни человека на 99% состоят из холестерина, богаты этим соединением надпочечники и другие органы. Спинной мозг и мозг рогатого скота представляет собой наилучший материал для промышленного получения холестерина. Он считался специфическим животным стерином до тех пор, пока он не был обнаружен в некоторых растениях и в морских красных водорослях. Точная структурная формула этого соединения была установлена лишь в 1932 г., хотя впервые он был выделен из желчных камней в 1782 г.
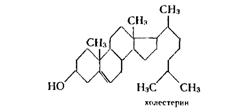
Другие стерины встречающиеся в природе, отличаются от холестерина или по длине боковой цепи, или по степени насыщенности.
Стерины растений (фитостерины). Очень важный класс соединений, они служат источником получения многих ценных стероидных препаратов.
Эргостерин по структуре отличается от холестерина дополнительной метильной группой в боковой цепи при С-24, а также имеет две дополнительные двойные связи: одна из них при С-7, другая в боковой цепи при 22- и 23-углеродных атомах. Эргостерин является провитамином витамина D. Строение эргостерина было установлено в 1934 г.
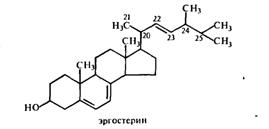
Он встречается у многочисленных представителей растительного мира, а также у грибов, микроорганизмов и других представителей живого мира. Особенно велико содержание эргостерина у дрожжевых микроорганизмов. Для промышленного получения эргостерина чаще всего используются пекарские дрожжи, содержание эргостерина в них колеблется в зависимости от расы, питательной среды и культивирования от 0,2 до 15% на сухую массу.
Стигмастерин С29H48О — один из наиболее распространенных фитостеринов, он содержится в большом количестве в соевом масле и сахарном тростнике. По структуре стигмастерин отличается от холестерина наличием двойной связи между 22 и 23-углеродными атомами и наличием этильной группы в положении 24:
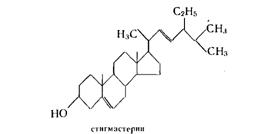
Другим
широко распространенным растительным стерином является ![]() -ситостерин С29Н50О.
По строению он сходен со стигмастерином, отличаясь от него лишь отсутствием
двойной связи в боковой цепи:
-ситостерин С29Н50О.
По строению он сходен со стигмастерином, отличаясь от него лишь отсутствием
двойной связи в боковой цепи:
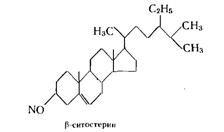
Ситостерины встречаются в хлопковом и соевом маслах, в зародышах пшеницы и натуральном каучуке, в сахарном тростнике и другом растительном материале. Коммерческим источником ситостеринов чаще всего являются тростник и хлопковое масло. Ситостерины и стигмастерин — наиболее перспективные и дешевые исходные продукты для получения стероидных гормонов.
Стерины необходимы для осуществления физиологических и биохимических функций живого организма. Предполагается, что стерины требуются для образования мембранных систем, клеточных оболочек и других структурных образований клетки. Есть данные о том, что стерины являются защитным фактором против токсического действия многих природных соединений.
Основные пути биосинтеза стероидных гормонов из холестерина. В организме животных и человека из холестерина образуются три важные группы гормонов: прогестины, половые гормоны и гормоны коры надпочечников (кортикостероиды). Основные пути биосинтеза этих гормонов показаны на схеме:
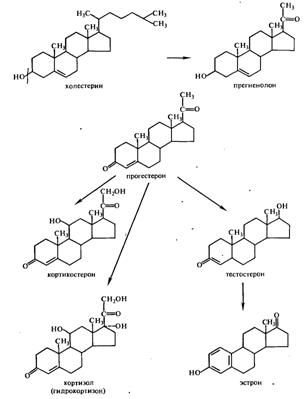
При образовании стероидных гормонов из холестерина сначала образуется прегненолон — основной промежуточный продукт биосинтеза стероидов и кортикостероидов. Окисление 3ОН-группы прегненолона в С=0 сопровождается перемещением двойной связи; продуктом этой кетостероидизомеразной реакции является прогестерон — гормон плаценты и желтого тела.
Прегненолон является также предшественником мужских половых гормонов (тестостерона) и женских половых гормонов (эстрогенов — эстрона, эстрадиола). В коре надпочечников прогестерон превращается в кортикостерон и кортизол (гидрокортизон): секреция кортизола достигает у взрослого человека 15—30 мг в день. Эти вещества были первоначально выделены из коры надпочечников в кристаллическом виде.
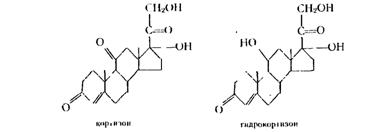
Кортизол (гидрокортизон) и его синтетические аналоги такие, как преднизолон или дексаметазон, принадлежит к числу современных средств экстренной терапии, благодаря их уникальному противовоспалительному, десенсибилизирующему и противошоковому действию. По своему химическому строению они могут быть разделены на 11-дезоксистероиды, 11-гидроксистероиды, 11,17-дигидрокснстероиды (к последним относятся кортизон и гидрокортизон):
2.2 Основные микробиологические превращения стероидов
Промышленный
синтез названных выше ценных лекарственных препаратов стал возможен только с
развитием методов микробиологической химии и, в частности, метода
микробиологической трансформации. В качестве сырья для получения указанных
лекарственных средств используется диосгенин (из растения диоскореи),
стигмастерин из соевых бобов, в последние годы интенсивно изучается ![]() -ситостерин как
потенциально дешевый и доступный источник. В таблице приведены некоторые
трансформации стероидов, имеющие промышленное значение.
-ситостерин как
потенциально дешевый и доступный источник. В таблице приведены некоторые
трансформации стероидов, имеющие промышленное значение.
Таблица
Микробиологические трансформации стероидов, имеющие промышленное применение
| Реакция | Субстрат | Продукт | Микроорганизм трансформатор |
|
11 |
Прогестерон |
11 |
Rhizupus nigricans |
|
11 |
Вещество S Рейхштейна (4-прегнен-17 |
Гидрокортизон | Carvularia lunata |
|
16 |
9 |
9 |
Streptomyces roscochrcmogenus |
| 1,2-Дегидрирование | Гидрокортизон | Преднизолон | Arthrobacter simplex |
| Расщепление боковой цепи |
|
Андростадиендион и (или) андростендион | Mycobacterium spp. |
Модифицированные тем или иным способом стероиды сами могут служить субстратами для проведения соответствующих целенаправленных трансформаций. [2]
2.2.1 Введение гидроксильной группы
Микробиологическое гидроксилирование — это наиболее важный и часто применяемый метод. Наличие гидроксильных групп в 3, 11, 16, 17 положениях молекулы стероида, как правило, обусловливает физиологическую активность большинства гормональных стероидных препаратов.
Гидроксилирование стероидов осуществляется очень многими микроорганизмами, чаще всего грибами, даже конидии некоторых грибов обладают гидроксилирующей активностью. Гидроксилирование стероидов при помощи гриба Rh. Nigricans — яркий пример сочетания, специфичности и разнообразия действия микроорганизмов.
11![]() -Гидроксилирование
как один из важнейших путей получения кортизона изучено наиболее детально и
давно применяется в промышленности, выходы продуктов трансформации очень
высоки. Многие микроорганизмы образуют смесь 11
-Гидроксилирование
как один из важнейших путей получения кортизона изучено наиболее детально и
давно применяется в промышленности, выходы продуктов трансформации очень
высоки. Многие микроорганизмы образуют смесь 11![]() - и 11
- и 11![]() -эпимеров, соотношение которых
существенно зависит от фазы развития культуры.
-эпимеров, соотношение которых
существенно зависит от фазы развития культуры.
Наличие
в молекуле стероидов 11![]() -гидроксильной группы
обусловливает физиологическую активность гидрокортизона (кортизола) и
преднизолона. Гидроксилированию подвергаются субстраты самого различного
строения — от производных эстрана до сложных молекул стеринов, сапогенинов и т.
П. Причина этого — очень широкая субстратная специфичность гидроксилаз, которую
демонстрируют многие микроорганизмы. Например, штамм Cunninghamella blakesleeana, который вводит оксигруппу в 11
-гидроксильной группы
обусловливает физиологическую активность гидрокортизона (кортизола) и
преднизолона. Гидроксилированию подвергаются субстраты самого различного
строения — от производных эстрана до сложных молекул стеринов, сапогенинов и т.
П. Причина этого — очень широкая субстратная специфичность гидроксилаз, которую
демонстрируют многие микроорганизмы. Например, штамм Cunninghamella blakesleeana, который вводит оксигруппу в 11![]() -положение обширного набора
стероидов — различных производных эстрана, тестостерона, кортексолона,
прогестерона и т. Д.
-положение обширного набора
стероидов — различных производных эстрана, тестостерона, кортексолона,
прогестерона и т. Д.
Получение
14![]() -гидроксипрогестерона
при помощи Bacillus cereus является одним из немногих примеров гидроксилирования при
помощи бактерий. 15
-гидроксипрогестерона
при помощи Bacillus cereus является одним из немногих примеров гидроксилирования при
помощи бактерий. 15![]() -гидроксилирование осуществляется
также многими микроорганизмами, основное место среди которых занимают Fusarium и Penicillium.
-гидроксилирование осуществляется
также многими микроорганизмами, основное место среди которых занимают Fusarium и Penicillium.
Главным препятствием, стоящим на пути дальнейшего развития промышленного микробиологического гидроксилирования стероидов, так же как и вообще микробиологических трансформаций этих соединений, является низкая производительность ферментаций, несмотря на высокий процентный выход по субстрату. Это обусловлено, с одной стороны, нерастворимостью стероидных субстратов в воде, с другой — токсичностью растворителей, применяемых при внесении стероида и невозможностью использования высоких концентраций субстрата.
2.2.2 Дегидрогенизация стероидов
Наличие двойных связей коренным образом влияет на физиологическую активность препаратов. Используя эту реакцию, получают такие эффективные препараты, как преднизолон. Чаще всего микроорганизмы дегидрируют положения 1,2 и 4,5, но описано и введение двойной связи в положения 7,8; 8,9; 9,11; 16,17; 17,20. Реакции дегидрогенизации осуществляют бактерии и актиномицеты, особенно часто это микоформы Arthrobacter, Corynebacterium, Nocardia. Широкая субстратная специфичность дегидрогеназ показана на большом экспериментальном материале; она позволяет использовать в качестве субстратов ацетаты стероидов, которые являются полупродуктами во многих технологических схемах получения стероидов. Например, Mycobacterium globiforme 193, дегидрирующая 1,2-связь в кортизоне, так же эффективно превращает и кортизонацетат в преднизонацетат с выходом 86%. Исследование показало, что для этой культуры характерна максимальная удельная трансформирующая активность в период снижения удельной скорости роста.
Реакция дегидрогенизации позволяет получать преднизолон из кортизона, дианабол из метилтестостерона, преднизолон из гидрокортизона. Продукты 1,2-дегидрирования образуются с высокими выходами — до 86%. Распространенность этой реакции объясняется не только наличием соответствующих дегидрогеназ у большого числа микроорганизмов, но и химическими свойствами данного участка стероидной молекулы, ее нестабильностью, особенно при наличии кетогруппы в 3-м положении и (или) двойной связи 4,5. Этими свойствами стероидной молекулы объясняется и доступность связи 1,2 для микробных оксидоредуктаз. Во многих случаях показана обратимость реакций дегидрогенизации и восстановления.
2.2.3 Микробиологическое восстановление
Этот процесс используется в меньшей степени, чем дегидрирование. Он осуществляется главным образом дрожжами и анаэробными бактериями, представителями микрофлоры кишечника млекопитающих, осуществляющими превращение холестерина в копростерин:
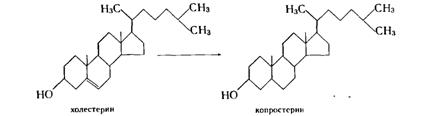
Описаны процессы насыщения двойных связей также и аэробными культурами, широко известными как окислители — актиномицетами, микоформами и даже грибами. Например, культура Aspergillus flavus восстанавливает ароматическое кольцо некоторых стероидов:
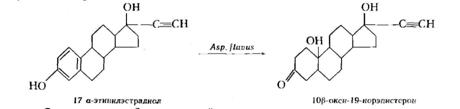
2.2.4 Окисление гидроксильной группы в кетогруппу
Одна из наиболее частых реакций, осуществляемых микроорганизмами (бактериями, актиномицетами, грибами). Наибольший практический интерес представляют окислительные превращения гидроксильных групп у 3, 17 и 20-го атомов стероидной молекулы. Окисление гидроксила в третьем положении легко осуществляется у соединений с ненасыщенным кольцом А, а также при наличии двойной связи в положении 4. К этому же типу окислительных превращений относят введение кетогруппы в молекулу стероида.
2.2.5 Гидролиз эфиров стероидов
Микробиологический гидролиз эфиров стероидов был открыт в 1938 г. Практическая ценность этой реакции определяется тем, что ацилированные стероиды являются обычными промежуточными продуктами химического синтеза, в котором используется ацильная защита функциональных групп. Хотя гидролиз ацильной группы легко осуществим химическим путем, он часто приводит к побочным нежелательным продуктам.
Микробиологическое расщепление эфирной связи осуществляется представителями различных таксономических групп, в частности флавобактериями. Культура Вас. Megaterium обладает специфической активностью по отношению к 21-ацетатам стероидов с диоксиацетоновой цепочкой:
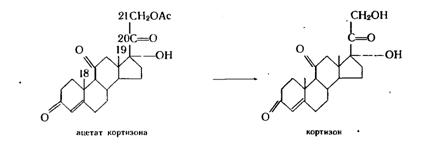
Дезацилирующая способность часто встречается среди микоформ, мукоровых и несовершенных грибов, актиномицетов. Особенность приведенной реакции состоит в том, что она проводится обычно одновременно с другими процессами – гидроксилированием, дегидрогенизацией и др. Ценность представляют как культуры, избирательно отщепляющие ацильную группу, так и микроорганизмы, способные наряду с гидролизом эфирной связи осуществлять еще какую-либо практически важную реакцию.
Культуры, гидролизующие эфирные связи без побочных реакций, обнаружены в разных таксономических группах. Очень интенсивно проводят реакцию дезацетилирования представители видов Actinomucor corymbosus, Mucor lamprosporus, Actinomyces flavis, A. pheochromogenes, Nocardia sp. и Arthrobacter simplex. Выход реакций достигает 95%. [3]
2.2.6 Отщепление боковых цепей стероидов.
Представляет огромный интерес как путь получения ценных продуктов из относительно дешевых природных стероидов животного и растительного происхождения — стеринов, желчных кислот, сапогенинов.
Возрастающая потребность в производстве стероидных препаратов, а также истощение сырьевой базы делает все более актуальным поиск новых источников сырья. Стоимость диосгенина, получаемого из различных видов диоскореи, за последние годы возросла более чем в 10 раз в результате истощения запасов этих растений. В связи с этим возрос интерес к более доступным природным стеринам.
Основная трудность при использовании фитостеринов заключается в необходимости селективного удаления насыщенной алифатической боковой цепи с сохранением целостности стероидного скелета. Удовлетворительных методов химического расщепления до сих пор не удалось разработать, перспективными считаются лишь микробиологические способы. Однако промышленный интерес представляют только процессы расщепления боковой цепи, не затрагивающие стероидного ядра.
Проблема расщепления боковой цепи стеринов с сохранением стероидного скелета может быть решена следующими способами:
1)
синтезом модифицированных стеринов, заместители в кольце А или В которых не
позволяют микроорганизмам осуществлять 1,2-дегидрирование или 9![]() -гидроксилирование;
-гидроксилирование;
2)
инкубацией стеринов в присутствии соединений, ингибирующих действие ферментов 9![]() -гидроксилазы
или 1,2-дегидрогеназы,
-гидроксилазы
или 1,2-дегидрогеназы,
3) получением мутантных штаммов, не способных осуществлять определенные стадии расщепления самого стероидного ядра.
Эти три способа, а иногда и их комбинации в сочетании с оптимальными условиями режима ферментации позволили получить из ряда стеринов большой спектр промежуточных соединений, применяемых для химического синтеза высокоактивных стероидных препаратов.
3. Методы проведения процессов микробиологических трансформаций
Несмотря на разнообразие биотрансформаций стероидов, методы проведения микробиологических реакций довольно единообразны. При поисковых работах, где не требуется или нет возможности применять большие количества вещества, ограничиваются проведением реакции в колбах на качалках, загрузка стероида в колбу составляет 100—200 мг. Для загрузок порядка 1—2 г стероида применяют стеклянные ферментеры. В промышленности и на опытных установках применяют стальные аппараты, оборудованные аэрирующими и перемешивающими устройствами.
Собранный стеклянный ферментер стерилизуют и загружают стерильной питательной средой с заранее внесенной в нее в асептических условиях трансформирующей культурой. Особое внимание уделяют соблюдению асептики во всех операциях. Стерилизацию в зависимости от объекта осуществляют автоклавированием питательной среды при 110—120°С в боксах, освещаемых бактерицидными лампами. Операции по загрузке, отбору проб проводят в пламени газовой горелки. Загрузка питательной среды в ферментер, как правило, осуществляется передавливанием стерильным сжатым воздухом. Время роста культуры микроорганизма-трансформатора определяется появлением максимальной трансформирующей активности и может колебаться от нескольких часов для одних культур до нескольких суток для других. Для многих культур-трансформаторов характерна максимальная трансформирующая активность в период снижения удельной скорости роста культуры.
Растворимость стеринов в воде очень низка. В настоящее время стерины, предназначенные для окисления, в небольшой концентрации (порядка 1 г/л) вносят растворенными в малотоксичном, смешивающемся с водой растворителе (ацетоне, спирте, диметилформамиде). При более высоких концентрациях стеринов (выше 1 г/л) их вносят в среду в виде мелкоизмельченной пудры; для этого кристаллы стерина растирают в специальной аппаратуре или разрушают ультразвуком.
Другой
способ внесения стеринов для биотрансформации состоит в том, что стерин, например
![]() -ситостерин,
растворяют в смеси гептан/этиленхлорид, добавляют при перемешивании воду и
отгоняют растворитель нагреванием смеси до 95°С. При таком методе концентрация
ситостерина в водной суспензии может достигать 140 г/л.
-ситостерин,
растворяют в смеси гептан/этиленхлорид, добавляют при перемешивании воду и
отгоняют растворитель нагреванием смеси до 95°С. При таком методе концентрация
ситостерина в водной суспензии может достигать 140 г/л.
Трансформация стеринов микроорганизмами основана на их использовании в качестве источника углерода, поэтому стимуляция роста трансформирующих штаммов должна приводить к увеличению выхода продуктов расщепления стеринов. Процесс стимулируется насыщением среды кислородом. Добавление в питательную среду некоторых масел в количестве 1—3 мас.% (соевого, арахисового, рапсового, оливкового) повышает выход продукта трансформации. Аналогичные результаты получены с применением глицеридов животного и растительного происхождения (тристеарин, триолеин, трипальмитин). Механизм стимуляции роста глицеридами, вероятно, состоит в устранении гидрофобности стеринов, т. Е. глицериды действуют так же, как неионные ПАВ (твин), обычно применяемые для микробиологических процессов трансформации. Температурный режим микробиологических трансформаций стероидов не отличается от принятых для других микробиологических процессов и составляет 24—33°С. Условия рН определяются при отборе штамма культуры-трансформатоа и колеблются в широком интервале.
Микробиологический контроль осуществляется только на стадии выращивания трансформирующей культуры. Аналитический контроль реакции трансформации ведется путем отбора проб через определенные временные интервалы и анализа их методом тонкослойной хроматографии на силуфоле в присутствии «свидетелей» — исходного стероида, целевого продукта трансформации и некоторых промежуточных и побочных продуктов, если они участвуют в данном процессе.
После завершения трансформации культуральная жидкость, отделенная от мицелия (или другой биомассы), экстрагируется несмешивающимся с водой органическим растворителем, пригодным для растворения соответствующего стероида (этилацетат, метиленхлорид или хлороформ). Экстракт, отделенный от водной фазы, проходит требуемую очистку (окрашенные примеси обычно отделяют обработкой с активированным углем, затем уголь отфильтровывают); далее его концентрируют в вакууме и полученный осадок стероида перекристаллизовывают из подходящего растворителя. В препаративных целях при работе с небольшими количествами стероидов очистку продукта трансформации можно проводить методом колоночной хроматографии.
Специфической особенностью процесса микробиологических трансформаций является использование чистых культур микроорганизмов-трансформаторов. Поэтому необходимым условием технологического режима является соблюдение мер для предотвращения развития посторонней микрофлоры. Последняя постоянно присутствует в воздушных потоках, циркулирующих в производственных помещениях, и представлена в основном мезофильными микроорганизмами, оптимальная температура развития которых находится в пределах 24—30°С. Такой же температурный оптимум характерен, как правило, и для микроорганизмов-трансформаторов.
Все операции по подготовке и выращиванию трансформирующих культур проводят в стерильных условиях с соблюдением правил и норм, разработанных и утвержденных для производств микробного синтеза. Однако внесение стероидного субстрата на трансформацию (в растущую на полноценной питательной среде культур при использовании бактерий или в водную суспензию неразмножающихся клеток — в случае применения грибного мицелия) и сам процесс трансформации, как правило, проводят не стерильно. Для уменьшения вероятности загрязнения используют стерильную воду при приготовлении суспензии стероидных субстратов, поскольку сами стероиды обычно неустойчивы в условиях автоклавирования. Одним из вариантов решения этой проблемы может служить способ внесения стероидного субстрата в питательную среду до засева ее трансформирующей культурой в момент, когда температура среды после автоклавирования снизится до 80°С и безопасна для субстрата. После выдержки в течение 30 мин среду со стероидом охлаждают до 33°С и в нее стерильно вносят трансформирующую культуру.
Используют культуру-трансформатор в стадии замедления роста, когда питательные компоненты среды в значительной степени израсходованы, а сильно разросшаяся культура подавляет рост других микроорганизмов. Однако и эти меры не полностью предохраняют трансформационную среду от загрязнения посторонней микрофлорой. В последней могут оказаться виды, способные отрицательно влиять на ход трансформации.
Применяемая в лабораторных условиях стерилизация суспензий стероидов ультразвуком неприемлема для промышленных масштабов.
4. Примеры промышленного использования микробиологических трансформаций
Получение гидрокортизона (кортизола) из вещества S осуществляется с помощью С. Linata.
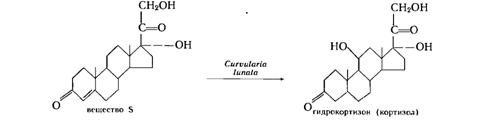
Процесс включает следующие стадии:
1. Выращивание трансформирующей культуры (I стадия) производят путем трех последовательных генераций на питательной среде, содержащей сахарозу, дрожжевой автолизат и сложный набор неорганических солей:
Крышку инокулятора перед засевом обрабатывают водным раствором формалина, аппарат и все помещение облучают бактерицидной лампой и весь процесс выращивания трансформирующей культуры проводят в стерильных условиях. Далее полученная трансформирующая культура поступает в сепаратор, откуда отделенный мицелий в виде водной суспензии передается в ферментер для проведения основной реакции трансформации вещества S.
2. Трансформация вещества S (II стадия) также начинается со стерилизации ферментера и воздушного фильтра водным раствором формалина. Особое внимание уделяется размолу стероида на микромельнице и получению суспензии его в стерильной воде с содержанием стероида 1 г/л. Для предотвращения развития посторонней микрофлоры используется добавка антибиотика. Перемешивание и аэрация осуществляются, как и на предыдущей стадии, так же используются и пеногасители.
3. Выделение продукта трансформации — гидрокортизона (III стадия). Культуральная жидкость вместе с мицелием после II-й стадии поступает на сепарацию. Отделенный мицелий промывается, промывные воды присоединяются к основной культуральной жидкости. Далее производится экстракция-сепарация продукта трансформации из водной среды органическим растворителем. Осветленный активированным углем экстракт подвергается многократному упариванию с различными растворителями, осветлению, снова упариванию досуха и промывке подходящим растворителем. Последние приемы обработки готового технического продукта обычны для технологии получения многих органических веществ и лекарственных препаратов. Получение чистых лекарственных форм гидрокортизона проводится традиционными методами.
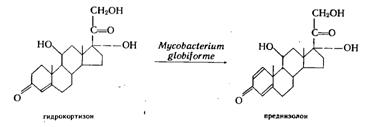
Трансформация гидрокортизона в преднизолон
Выращивание трансформирующей культуры М. gtobiforme осуществляется такими же последовательными этапами и в тех же аппаратах при тех же условиях аэрации и перемешивания, далее проводится трансформация гидрокортизона с помощью названной дегидрирующей культуры. Выделение готового продукта — преднизолона, осуществляется также путем экстракции-сепарации из культуральной жидкости, отличаясь лишь набором растворителей.
В настоящее время интенсивно разрабатываются методы использования мелкокристаллических стероидных субстратов. Микронизация субстрата до размеров частиц в несколько микрометров и внесение в ферментационную среду без растворителя позволяет повысить исходную концентрацию стероидного субстрата до 20—50 г/л.