Реферат: Характеристика алкадієнів
АЛКАДІЄНИ
1. Номенклатура. Класифікація
Назви алкадієнів утворюються як похідні від назв відповідних алканів при заміщенні суфікса -н закінченням -дієн, після якого через дефіс зазначаються локанти, тобто номери атомів карбону, з яких починаються подвійні зв¢язки. При цьому головний ланцюг нумерують таким чином, щоб до нього входили обидва подвійних зв¢язки, а атоми карбону, сполучені подвійними зв¢язками, одержали найменші номери.
Для деяких алкадієнів користуються тривіальною номенклатурою, наприклад:
CH3
½
CH2=CH-CH=CH2 CH2=C-CH=CH2 CH3-CH=CH-CH=CH2
Бутадієн-1,3 2-Метилбутадієн Пентадієн-1,3
(дивініл) (ізопрен) (піперилен)
Залежно від взаємного розміщення подвійних зв¢язків алкадієни поділяються на три групи:
-ізольовані, в яких подвійні зв¢язки в ланцюгу розділені одним чи декількома sp3-гібридизованими атомами карбону:
>C=CH-(CH2)n-CH=C<, де n = 1,2,3…;
Ізольовані алкадієни виявляють хімічні властивості, подібні до звичайних алкенів з тією лише різницею, що у реакцію може вступати не один, а два подвійних зв¢язки незалежно один від одного;
-кумульовані алкадієни, в яких обидва подвійні зв¢язки знаходяться поруч і належать одному атому карбону, наприклад:
СН2=С=СН2
Пропадієн (ален)
Цю групу алкадієнів часто називають аленовими вуглеводнями за першим членом гомологічного ряду; аленові вуглеводні є нестійкими сполуками, вони швидко ізомеризуються в алкіни, тому не мають самостійного значення;
-спряжені алкадієни, в яких подвійні зв¢язки розділені лише одним s-зв¢язком С-С:
>C=CH-CH=C<.
Саме спряжені алкадієни мають найважливіше значення в органічному синтезі.
2. Електронна будова спряжених алкадієнів
Спряжені сполуки з почерговим розміщенням подвійних і одинарних зв¢язків між атомами карбону в ланцюгу відрізняються за хімічними властивостями від інших ненасичених вуглеводнів, що зумовлюється наявністю електронного ефекту спряження.
Спряження – це виникненя єдиної π-електронної хмари внаслідок перекривання негібридизованих рZ-орбіталей атомів карбону, які одночасно утворюють подвійні та одинарні зв¢язки С-С.
Найпростішим спряженим алкадієном є бутадієн-1,3, в якому всі чотири атоми карбону перебувають у sp2-гібридизованому стані і складають s-скелет молекули (рис.1). Причому осі sp2-гібридизованих орбіталей знаходяться на одній площині, а негібридизовані рz-орбіталі кожного атома карбону перпендикулярні до площини s-скелета і паралельні одна відносно одної. Це створює умови їх взаємного перекривання не тільки між атомами С1-С2 і С3-С4, але й частково між С2-С3. Завдяки такому боковому перекриванню чотирьох рz-орбіталей утворюється єдина p-електронна хмара – так зване p,p-спряження зв¢язків, при якому p-електрони вже не належать окремим зв¢язкам, а делокалізуються по спряженій системі в цілому.
 |
Делокалізація електронної густини – це її розподілення по всій спряженій системі, по всіх зв¢язках і атомах.
Рисунок 1 – Утворення спряженої системи в молекулі бутадієну-1,3: жирним пунктиром показане перекривання негібридизованих рz-орбіталей над і під площиною s-скелета
Делокалізація p-електронів супроводжується виділенням енергії. Оскільки спряжені системи мають менший запас енергії, вони виявляють більшу стійкість порівняно з ізольованими алкадієнами. Енергія, що вивільняється за рахунок спряження, називається енергією делокалізації, або енергією спряження; для бутадіну-1,3 вона складає 15кДж/моль.
У результаті утворення спряженої системи довжини зв¢язків частково вирівнюються і стають меншими, ніж довжина одинарного зв¢язку в алканах (0,154нм), але більшими, ніж довжина подвійного зв¢язку в алкенах (0,133нм):
Н Н
½ ½
![]() Н 0,137 нм
С 0,146 нм С
Н 0,137 нм
С 0,146 нм С
С С 0,137 нм Н
½ ½
Н Н
Схематично ефект спряження та вирівнювання довжин зв¢язків зображують стрілками чи крапками:
СН2===СН---СН===СН2
![]() СН2 СН
СН СН2
СН2 СН
СН СН2
3. Ізомерія алкадієнів
Алкадієни здатні виявляти структурну і просторову (геометричну) ізомерію. Наприклад, для складу С7Н12 ізомери можуть відрізнятися різним положенням як подвійного зв¢язку і бокових радикалів, так і різним просторовим розташуванням вуглецевого ланцюга.
Приклади структурних ізомерів:
СН2=СН-СН-СН=СН–СН3 СН3-С=СН-СН=СН-СН3
½ ½
СН3 СН3
3-Метигексадієн-1,4 2-Метилгексадієн-2,4
Просторові ізомери гептадієну–2,4
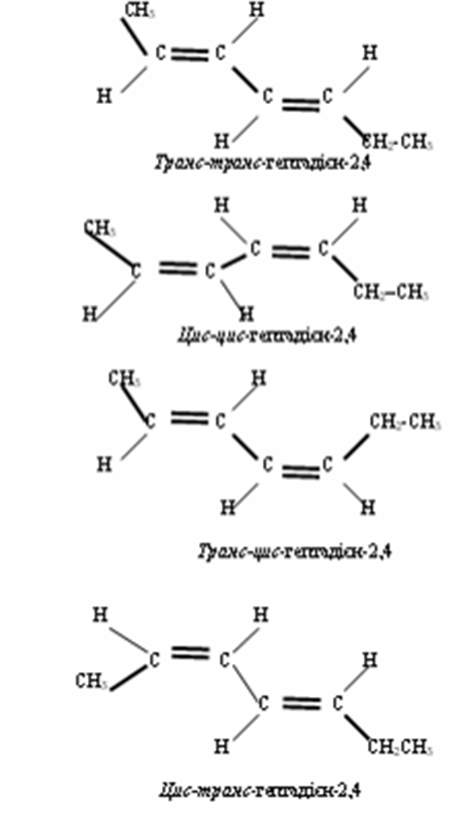
4. Фізичні властивості
За звичайних умов тільки ізомери С4Н6 перебувають у газовому стані, ізопрен – рідина, решта дієнових вуглеводнів є рідинами чи твердими речовинами залежно від довжини і розгалуженості вуглецевого скелета. Всі вони малорозчинні у воді, але добре розчиняються в органічних розчинниках.
5. Хімічні властивості спряжених алкадієнів
Для алкадієнів найбільш характерними є реакції електрофільного приєднання АЕ, однак на відміну від алкенів наявність спряженої системи дає деякі особливості в реакціях АЕ. Це зумовлює можливість одержання двох продуктів. Один з них отримується за рахунок приєднання за місцем будь-якого подвійного зв¢язку – такий шлях реакції позначають терміном 1,2-приєднання. А інший продукт утворюється внаслідок приєднання до крайніх атомів С, що складають спряжену систему, – так зване 1,4-приєднання. Переважний напрямок проходження реакції залежить від умов її проведення та природи реагентів.
І Реакції електрофільного приєднання АЕ.
1 Гідрування при використанні паладієвого каталізатора проходить за 1,2-положенням. Якщо гідрування проводять за допомогою водню у момент його виділення (наприклад, внаслідок дії натрієм на спирт), то реакція проходить переважно за 1,4-положенням. На першій стадії утворюються алкени:
+Н2 [Pd]
![]() -------------------à CH3-CH2-CH=CH2
-------------------à CH3-CH2-CH=CH2
1,2-Приєднання Бутен-1
СН2=СН-СН=СН2---–
Бутадієн-1,3
+Н2 (2С2Н5ОН +2Na)
-----------------------àCH3-CH=CH-CH3.
1,4-Приєднання Бутен-2
При надлишку водню відбувається повне гідрування з утворенням алканів:
Pt
СН2=СН-СН=СН2+ 2Н2(надл.)--------à CH3-CH2-CH2-CH3.
Бутадієн-1,3 Бутан
2 Галогенування. Залежно від будови дієнового вуглеводню, природи галогену і умов проведення реакцій можуть утворюватися різні продукти. Найчастіше приєднання стехіометричної кількості (1:1) хлору Cl2 приводить до приблизно однакового виходу 1,2- і 1,4-дихлоралкенів, а при бромуванні переважає 1,4-продукт.
1,4-Приєднання
![]() -------------------à CH2-CH=CH-CH2
-------------------à CH2-CH=CH-CH2
½ ½
СН2=СН-СН=СН2 + Hal2--- Нal Нal
Дивініл 1,4–Дигалогенбутен–2
1,2-Приєднання
--------------------à CH2-CH-CH=CH2
½ ½
Нal Нal
3,4-Дигалогенбутен–1
При надлишку галогену утворюються тетрагалогеналкани:
СН2=СН-СН=СН2 + 2Br2 (надл.)à H2Br-CHBr-CHBr-CH2Br.
Дивініл 1,2,3,4- Тетрабромбутан
3 Гідрогалогенування. Приєднання галогеноводнів підлягає тим самим закономірностям. Якщо реакція проходить за 1,2-положенням, то діє правило Марковникова:
1,4-Приєднання
![]() -----------------------à CH3-CH=CH-CH2Br
-----------------------à CH3-CH=CH-CH2Br
1-Бромбутен-2
СН2=СН-СН=СН2 + HBr---
Дивініл 1,2-Приєднання
-------------------------à CH2=CH-CHBr-CH3
3-Бромбутен-1
1,4-Приєднання
![]() -----------------à
CH3-CH2-CHBr-CH2Br
-----------------à
CH3-CH2-CHBr-CH2Br
1,2-Дибромбутан
СН2=СН-СН=СН2 + 2HBr----
Дивініл (надл.) 1,2-Приєднання
-------------------à CH3-CHBr-CHBr-CH3
2,3-Дибромбутан
4 Гіпогалогенування на відміну від попередніх реакцій АЕ проходить переважно у 1,2-положенні згідно із правилом Марковникова:
d- d+ 1,2-
CH2=CH-CH=CH2 + HO-Br -----à CH2Br-CH(OH)-CH=CH2
Дивініл 4- Бромбутен-1-ол-3
ІІ Синхронні (молекулярні) реакції
Прикладом синхронних реакцій, при яких розрив хімічних зв’язків проходить одночасно в обох вихідних речовинах, є синтез Дильса-Альдера – нагрівання дієнових вуглеводнів з алкенами чи іншими сполуками, які містять один подвійний зв¢язок >C=C< у ланцюгу. Цей процес широко використовується для одержання шестичленних циклів.
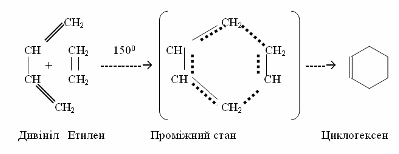
ІІІ Ди- і полімеризація
1Димеризація - це сполучення двох молекул алкадієну,
причому одна з молекул реагує за 1,2-, а інша – за 1,4-положенням, наприклад:
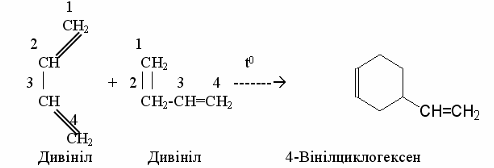
Таким чином можна одержувати штучні терпени, наприклад, дипентен:
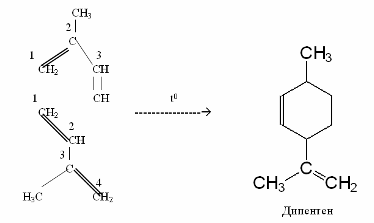
2 Полімеризація. Алкадієни легко піддаються полімеризації з утворенням каучукоподібних полімерів.
Приєднання молекул мономеру одна до одної може проходити як за 1,2-, так і за 1,4-положенням – залежно від умов проведення реакції та природи каталізатора.
Al(C2H5)3 × TiC
n CH2=CH-CH=CH2 -------------------à (-CH2-CH=CH-CH2-)n
Дивініл Бутадієновий каучук
ІV. Окиснення
1 Реакція Вагнера приводить до багатоатомних спиртів
[O] CH2-CH-CH-CH2
CH2=CH-CH=CH2 ------------à ½ ½ ½ ½
KMnO4, H2O OH OH OH OH
Дивініл Бутантетрол-1,2,3,4
2 Сильні окисники руйнують подвійні зв¢язки:
[O] CH2-CH-CH-CH2
CH2=CH-CH=CH2 ------------à ½ ½ ½ ½
KMnO4, H2O OH OH OH OH
Дивініл Бутантетрол-1,2,3,4
3 Озонування (реакція Гарієса) дозволяє встановити будову вихідного алкадієну за складом продуктів, що утворилися, наприклад
![]() O O
O O
CH2=C-CH=CH2 + 2О3 –> CH2 C–CH CH2 à
½ O––O ½ O––O
CH3 CH3
Ізопрен Озонід ізопрену
2H2O
–––––––––> 2HCHO + CH3-C-CHO + 2H2O2
(Zn) ½½
O
Метаналь 2-Оксопропаналь
(формальдегід)
6. Одержання алкадієнів
Завдяки великому промисловому значенню алкадієнів розроблено багато способів їх добування.
1 Ступеневе дегідрування бутану та ізопентану над
змішаним каталізатором – оксидом хрому (ІІІ) на оксиді алюмінію:
t0, kat t0, kat
СН3-СН2-СН2-СН2 –––––à CH3-CH2-CH=CH2 –––––à
–H2 –H2
––––––> CH2=CH-CH=CH2.
2Реакція Лебедєва – одночасне дегідрування і дегідратація етанолу:
4400C
2СН3-СН2-ОН –––––––à CH2=CH-CH=CH2 + 2H2O + H2.
ZnO/Al2O3
Лабораторні способи
-дегалогенування віцинальних тетрагалогеналканів за допомогою цинку чи магнію:
CH2Br-CHBr-CHBr-CH2Br +2 Zn à CH2=CH-CH=CH2 +2 ZnBr2.
1,2,3,4-Тетрабромбутан Дивініл
-дегідрогалогенування 1,4-дигалогеналканів спиртовим розчином лугу:
CH2Br-CH2-CH2-CH2Br+2КОН(спирт.)à
1,4-Дибромбутан ––––>CH2=CH-CH=CH2+2KBr+ 2H2O.
Дивініл
-дегідратація g-гліколів (двоатомних спиртів з гідроксильними групами в 1,4-положеннях):
СН2-СН2-СН2-СН2 t0
½ ½ –––––––––à CH2=CH-CH=CH2 + 2H2O.
OH OH H2SO4(к)
Бутандіол-1,4
7. Застосування алкадієнів
Алкадієни (ізопрен, дивініл) використовуються для одержання синтетичних каучуків.
Натуральний каучук – високоеластичний матеріал природного походження, який одержують із латексу – соку каучуконосних рослин (гевея, гваюла, кок-сагиз, тау-сагиз та ін.) - при дії на нього коагулянтом – оцтовою кислотою.
За складом і будовою натуральний каучук являє собою ізопреновий полімерний ланцюг із цис-конфігурацією, при якій всі однакові групи (у даному випадку –СН2–) розміщені з одного боку від подвійного зв¢язку. Такий полімер називається стереорегулярним:
 ---СН2 СН2---
---СН2 СН2---
С===С
СН3 Н n
Макромолекула натурального каучуку складається у середньому з 250 елементарних ланок, а молекулярна маса коливається у межах 150000-500000.
Для надання каучуку міцності та стійкості до зношування, перепадів температур, дії розчинників і агресивних хімічних реагентів, його піддають вулканізації – нагріванню із сіркою (вулканізатор) у суміші з наповнювачем (найчастіше це сажа), внаслідок чого ланцюги нормальної будови зшиваються у сітчасті тривимірні макромолекули. Вулканізований каучук називають гумою. Гума містить значно менше подвійних зв¢язків, ніж каучук, оскільки частина їх руйнується при взаємодії із сіркою (рис. 2).
Якщо вміст сірки досягає 32%, подвійних зв¢язків не залишається, окремі ланцюги фіксуються сульфідними містками, а каучук перетворюється на ебоніт –– тверду речовину з іншими властивостями.
Натуральний каучук – дефіцитний дорогий продукт, тому розроблені способи добування синтетичних каучуків із заданими властивостями. Для цього застосовують процес сополімеризації – сумісної полімеризації алкадієнів з іншими ненасиченими сполуками, які можна розглядати як похідні етилену: з вінілхлоридом СН2=СНСl, стиреном СН2=СН-С6Н5, акрилонітрилом СН2=СН-CN.
Наприклад, сополімер бутадієну і стирену – бутадієнстиреновий каучук, який завдяки великій міцності та стійкості до зношування використовується для виробництва автомобільних шин. Схема сополімеризації:
n CH2=CH-CH=CH2 + n CH2=CH ---à
½
C6H5
Бутадієн-1,3 Стирен
С6Н5
½
–––––> (-CH2-CH=CH-CH2-CH-CH2-)n
Бутадієнстиреновий каучук (БСК)
Із галогенопохідних дієнових вуглеводнів також одержують цінні види каучуків, наприклад, хлоропреновий каучук, який має високу світло- і термостійкість, а також стійкість до дії розчинників, бензинів, олій, тому на його основі виробляють бензопроводи, шланги для нафтопромислів тощо.
n CH2=CH-C=CH2 -------à (-CH2–CH=C-CH2- )n
½ ½
Cl Cl
2-Хлорбутандієн-1,3 Хлоропреновий каучук
(хлоропрен)
½ ½
СH3 S H3C S H3C
![]()
![]()
![]() ½ ½
½ ½
½
½ ½
½ ½
½
…--CH2—C—CH—CH2—CH2—C==C—CH2—CH2––C––CH––CH2—…
½ ½
H3C S CH3 H3C S
![]()
![]()
![]() ½ ½
½ ½ ½
½ ½
½ ½ ½
…--CH2—C—CH — CH2—HC ==C—CH–– CH2— CH==C—CH—CH2–…
½ ½
S S
½ ½
Рисунок 2 – Схема утворення сітчастої структури внаслідок вулканізації натурального каучуку (пунктиром показані межі елементарних ланок)
| Оксисоединения | |
|
Под ми понимают органические соединения содержащие в составе своей структурной формулы одну или несколько гидроксильных групп (OH). Таковыми являются ... Под ми понимают органические соединения содержащие в составе своей структурной формулы одну или несколько гидроксильных групп (OH). Cl CH3 CH=CH2 R°C°OH + HC=CH R°C°O°CH=CH2 |
Раздел: Рефераты по химии Тип: реферат |
| Программа для поступающих в вузы (ответы) | |
|
Программа по химии для абитуриентов Предмет химии. Явления химические и физические. Атомно-молекулярное учение. Атомы. Молекулы. Молекулярное и ... CH3-CH=CH2 + HBr = CH3-CHBr-CH3 СH3-CHO CH3-CH(OH)-CN CH3-CH(NH2)-CN |
Раздел: Рефераты по химии Тип: реферат |
| Выделение жирных кислот из растительных масел | |
|
Московский Государственный Университет Пищевых Производств. Учебно-исследовательская работа. "Выделение жирных кислот из растительных жиров и масел ... CH O C R + 3CH3OH CH OH + 3R C O CH3 СH2 O C (CH2)7 CH CH (CH2)7 CH3 H2 |
Раздел: Рефераты по химии Тип: реферат |
| Обмін ліпідів | |
|
Обмін ліпідів План 1. Перетворення ліпідів у харчовому тракті людини. 2. Окислення гліцерину 3. Окислення вищих жирних кислот 4. Обмін кетонових тіл 5 ... CH2-OH фосфоліпаза С, Н2О CH-OH+HO-P-O-CH2-CH2-N(CH3)3 CH-O-C(O)-C17H35 + (CH3)3-N-CH2-CH2-O-P-O-Р-О-Ц |
Раздел: Рефераты по химии Тип: контрольная работа |
| Промышленные синтезы на основе углеводородов | |
|
... сырья". ПЛАН РЕФЕРАТА: 1.Народнохозяйственное значение. 2.Синтез мономеров. 3.Вулканизация натурального каучука. 4.Резина, её применение в ... Поскольку натуральный каучук - полимер диенового углеводорода, то Лебедев воспользовался так же диеновым углеводородом, только более простым и доступным - бутадиеном CH2=CH-CH=CH2. H OOC- -COOH и двухатомный спирт этиленгликоль HO-CH2-CH2-OH. |
Раздел: Рефераты по химии Тип: реферат |