Учебное пособие: Типы химических связей
Типы химических связей. Электростатическая, ковалентная связь. Ковалентная связь в органических соединениях. Строение метана. Строение молекул с N, O-атомами с неподеленной парой электронов. Строение и физико-химические свойства органических соединений.
Связь между частицами лучше всего определять через энергию, которую система теряет при образовании соединения - аддукта.
1. Электростатическая связь
1.1 Ионная связь
1.2 Ион-дипольное взаимодействие
1.3 Диполь-дипольное взаимодействие
ИОННАЯ СВЯЗЬ
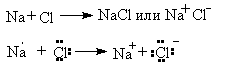
Ион-дипольное взаимодействие
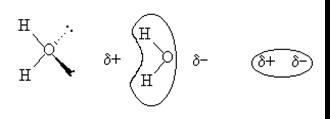
Диполь-дипольное взаимодействие
2. КОВАЛЕНТНАЯ СВЯЗЬ - связь, образованная двумя электронами
Переход от ковалентной связи к ионной
| ковалентная связь | полярная ковалентная связь | ионная связь |
| А:А |
d+В:Аd- |
М+ А- |
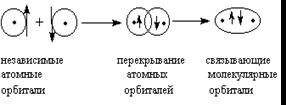
2.1 Молекулярные орбитали - атомные орбитали
Молекула водорода Н2
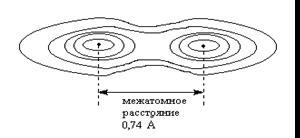
Длина связи
Энергетическая диаграмма для разрыхляющей и связывающей орбиталей
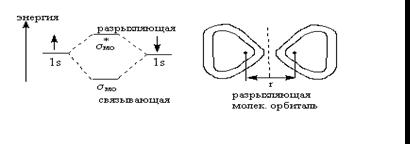
3. Структуры Льюиса
Связь между атомами обеспечивается электронными парами (американский химик Джилберт Льюис)
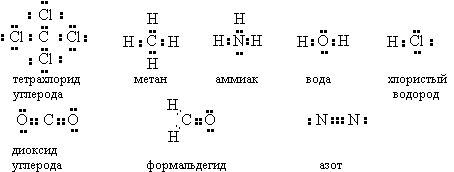
4. Некоторые свойства ковалентных связей (длина связи, полярность связи и энергия связи)
4.1 Длина связи
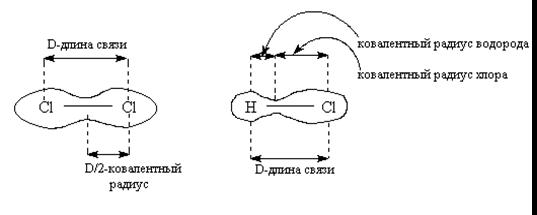
Минимальное расстояние между атомами отвечает минимальной потенциальной энергии системы.
Кривая потенциальной энергии (энергетический профиль)
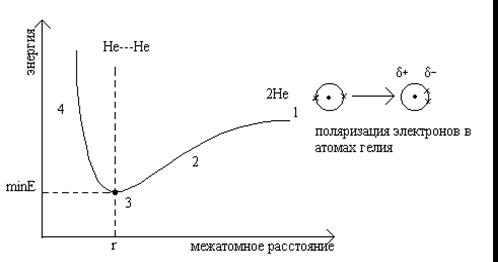
2 - участок притяжения, вызванного индуцированной поляризацией (дисперсионые силы Лондона).
Половина расстояния, разделяющего атомы в точке 3, соответствует вандерваальсову радиусу.
Вандерваальсовы радиусы
| Атом или группа | Вандерваальсов радиус, Е |
| Br | 1,35 |
| CH2 | 2,0 |
| CH3 | 2,0 |
| Cl | 1,8 |
| F | 1,35 |
| H | 1,2 |
| I | 2,15 |
| N | 1,15 |
| O | 1,4 |
4.2 Полярность связи
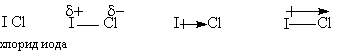
Диоксид углерода, представляющий собой линейную молекулу, имеет нулевой дипольный момент, а дипольный момент диоксида серы, нелинейной молекулы, равен 1,6 Д.
![]()
Дипольный момент может быть рссчитан по формуле:
m = e · l
e-элементарный заряд
l-расстояние между центрами положительных и отрицательных зарядов.
Дипольный момент измеряют в дебаях (Д). 1 дебай равен 10-18 е·см
Средняя величина дипольных моментов связей и функциональных групп
| Структурная единица | Дипольный момент, Д |
| H-Br | 0,74 |
| H-Cl | 1,03 |
| H-N | 1,3 |
| H-O | 1,5 |
| H-S | 0,7 |
| C-Cl | 1,9 |
| C-N | 1,0 |
| C-O | 1,2 |
| C=O | 2,7 |
| C-NO2 | 4,0 |
4.3. Энергия связи
Процесс, в результате которого разрывается ковалентная связь и каждый из фрагментов сохраняет один электрон, называется «гомолизом» или «гомолитическим расщеплением».
X-Y ® X· + Y· гомолитическое расщепление
Энергия, требующаяся для гомолитического расщепления отдельной связи и образования двух нейтральных атомов, называется энергией диссоциации (ккал/моль).
Средняя величина энергии, необходимая для разрыва отдельной связи называется энергией связи.
Энергия связей, ккал/моль
| H-C | 99 |
| C-C | 80 |
| C-O | 81 |
| C-N | 62 |
| C-S | 65 |
| H-N | 84 |
| C-F | 102 |
| C-Cl | 77 |
| C-I | 56 |
| H-O | 110 |
Энергетический профиль образования А2
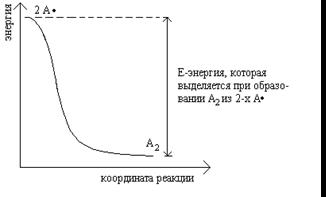
5. Связь в органических соединениях
Ковалентная связь характерна для соединений углерода, именно эта связь имеет основное значение в химии органических соединений.
Примеры написания моделей связей.

атомные орбитали углерода
Элементы пространства, в котором наиболее вероятно нахождение электрона, называют орбиталью. Орбитали отличаются формой и энергией.
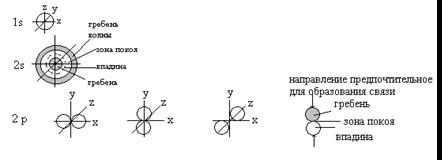
6. Строение метана
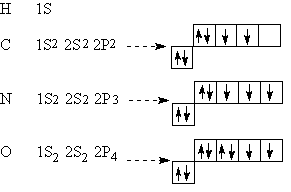
Электронная конфигурация основного состояния изолированного атома углерода:
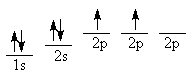
Рассмотрение электронного строения метана дает основание утверждать, что углерод 2-х валентен и должен образовывать соединения строения СН2, однако в метане углерод соединение 4 атомами углерода. Чтобы получить 4-х валентный углерод, необходимо иметь следующую схему распределения электронов:
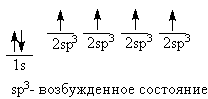

Возбужденное состояние атома включает образование четырех новых внешних орбиталей путем «гибридизации» 2s-орбитали и всех трех 2р-орбиталей. Четыре гибридные орбитали обладают одинаковой энергией, и каждая из них обозначается 2sp3. Гибридные орбитали обладают наибольшей степенью направленности, они точно эквивалентны друг другу. Главные оси четырех гибридных орбиталей направлены к углам правильного тетраэдра - расположение, при котором орбитали максимально удалены друг от друга.
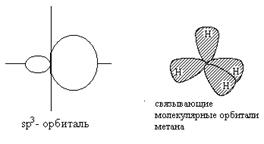
Угол связи (109,50) определяется условием максимального перекрывания гибридных орбиталей с орбиталями водорода.
Длина связи в метане 1,09 A.
Энергия связи 102 ккал/моль (417,05•103Дж/моль)
В отличии от ионной связи, прочность которой одинакова по всем направлениям, ковалентная связь является направленной.
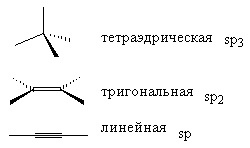
Для углерода возможны три типа гибридизации:
7. Строение молекул с n, o-атомами с неподеленной парой электронов
NH3

Энергия связи 103 ккал/моль (431,24•103Дж/моль)
Н2О

Энергия связи 103 ккал/моль (431,24•103 Дж/моль)
Наличие свободных электронов у аммиака и воды придает им основные свойства, более сильные у аммиака.
8. Строение и физико-химические свойства
Т пл., Т кип., растворимость.
Физические свойства дают информацию о строении вещества. Строение позволяет предсказать физические свойства.
Сравнить ионные и неионные соединения:
NaCl Т пл 8010С
СН4 Т пл. -1830С
Межмолекулярные силы
Диполь-дипольное взаимодействие, вандерваальсовы силы (индуцир. диполь)
NaCl Т кип 14130С (ионная пара - газообразное состояние)
CH4 Т кип -161,50С
H2O 1000С
NH3 -330С
Растворимость
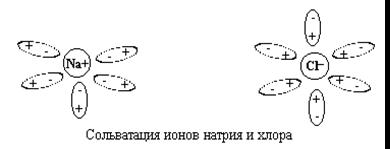
Ион-дипольное взаимодействие
Na+ НОН
сольватация гидратация

Подобное растворяется в подобном. Растворимость определяется полярностью.
СН4 и CCl4 нерастворимы в воде
СН3ОН растворим в воде.