Реферат: Физико-химия конкретных промышленных каталитческих процессов
Физико-химия конкретных промышленных каталитческих процессов.
Окислительный аммонолиз пропилена. Окислительное хлорирование этилена. Основные особенности процессов окисления в псевдоожиженном слое катализатора. «Воздушный» и «кислородный» процессы. Рециркуляционные технологии. Кинетика и механизм реакций.
Окислительный аммонолиз пропилена.
C3H6 + NH3 + 1,5O2 = C3H3N + 3H2O
C3H6 + NH3 + nO2 Þ CH3CN, HCN, CO, CO2,H2O
C3H3N + m O2 Þ CH3CN, HCN, CO, CO2,H2O
![]()
![]() 1 C3H3N
1 C3H3N
![]() C3H6 3
C3H6 3
2 CH3CN, HCN, CO, CO2,H2O
Температура – 4300С, давление – близкое к атмосферному.
Состав смеси на входе в реактор
C3H6 – 10%
O2 - 16,8%
NH3 - 10%
N2 - 63,2%
Возможность подавать в реактор смесь, состав которой лежит внутри пределов взрываемости – следствие пламягасящих свойств псевдоожиженного слоя.
Сохранение постоянной активности катализатора в реакторе как результат его истирания и уноса с компенсирующей подпиткой свежего катализатора.
Катализаторы – Bi-Mo-O, U-Sb-O, Fe-Sb-O, Sn-Sb-O
Промышленные катализаторы на территории СНГ (псевдоожиженный слой)
С-41 (Саратов, Нитрон) – Bi-Mo-Fe-Ni-Co-Na-P-O/SiO2 (SOHIO)
A-112 (Новополоцк, Полимир) – Bi-Mo-O/SiO2 (ASAHI Chemical)
Приготовление катализатора методом распылительной сушки.
![]()
![]() 1 C3H3N
1 C3H3N
![]() C3H6 3
C3H6 3
2 CH3CN, HCN, CO, CO2,H2O
![]()
![]()
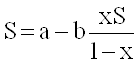
Псевдоожиженный слой по двухфазной модели характеризуется коэффициентом массообмена между фазами b и безразмерным параметром j=(k1+k2)/ b.
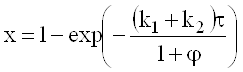
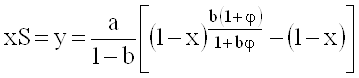
Если активность катализатора ниже стандартной в 2 раза, например, вместо k=k1+k2=1сек-1 получили образец с k=0,5сек-1, то для t=1сек, b=0,2сек-1 (т.е. при j=5) конверсия уменьшается с 0,965 до 0,943.
Если доокисляющая способность выше стандартной в два раза, например, b вместо 0,01 равно 0,02, то выход уменьшается с 0,79 до 0,65.
Механизм реакции по данным меченых атомов и кинетическому изотопному эффекту.
Дейтерирование пропилена показало, что лимитирует скорость реакции отрыв метильного водорода. Эти же эксперименты, а также эксперименты с изотопами углерода, показали, что образующееся на поверхности соединение – симметричное. Распределение дейтерия в продуктах показывает, что образуется p-, а не d-комплекс.
Результаты опытов с изотопами кислорода над висмут-молибденовыми катализаторами.
Окислительное хлорирование этилена.
С2H4 + 2HCl + 0,5O2 = C2H4Cl2 + H2O
2 C2H4Cl2 = C2H3Cl + HCl
С2H4 + Cl2 = C2H4Cl2
2 С2H4 + Cl2 + 0,5O2 = 2C2H3Cl + H2O
Катализатор – CuCl2/Al2O3
Температура 220-2700С.
Давление 3,5-4,5 атм.
Состав смеси на входе в реактор
HCl – 30%
С2H4- 15,5%
O2 – 11%.
Остальное – азот («воздушный» процесс) или азот + диоксид углерода («кислородный» процесс).
Преимущества (уменьшение выбросов дихлорэтана и потерь этилена) и недостатки (затраты на разделение воздуха и на циркуляцию смеси) «кислородного» процесса.
Механизм процесса по данным стационарных и нестационарных кинетических измерений.
Окисление этилена в окись этилена. Основные направления развития «кислородного» процесса. Механизм влияния соединений хлора на селективность и активность.
C2H4 + 0,5O2 = C2H4O + 27 ккал/моль
C2H4 + 3O2 = 2CO2 + 2H2O + 330 ккал/моль
Температура 220-2700С
Давление 20 и более атмосфер.
Катализатор – 11-13% Ag с добавками/Al2O3 (корунд)
Роль добавок и особенности приготовления катализаторов.
Состав смеси на входе в реактор
«воздушный» процесс
O2 – 7%
C2H4- 4% (конверсия этилена – 0,3)
CO2 – 7%
остальное – азот;
«кислородный» процесс
O2 – 7% (конверсия килорода – 0,3)
C2H4- выше 15%
CO2 – 7%
остальное – азот и (или) метан.
Влияние хлорсодержащих соединений на процесс.
Роль теплосъема, “runaway”, “decomp”.
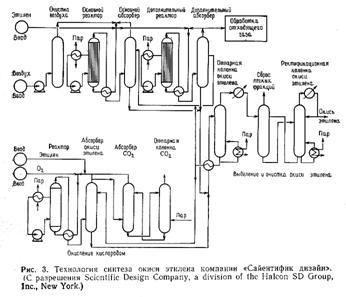
Окисление бутана в малеиновый ангидрид. Окисление метанола в формальдегид на серебряных катализаторах.
Особенности процессов в реакторах с восходящим потоком и в условиях, когда реакция определяется внешним тепло- и массопереносом.
Окисление бутана в малеиновый ангидрид.
C4H10 + 3,5O2 = C4H2O3 + 4H2O
C4H10 + 5O2 = 3CO + CO2 + 5H2O
C4H10 + 3,5O2 = 2CO + 2CO2 + H2O
Катализатор – (VO)2P2O7 с добавками K, Cr или других металлов.
Особенности приготовления катализатора. Потери фосфора и компенсация этих потерь.
Температура – 380-4700С.
Давление – до 4 атм.
Состав смеси на входе в реактор
- неподвижный слой
C4H10 - 1,6%
воздух – остальное;
- псевдоожиженный слой
C4H10 - 4,5%
O2 – 16%
азот – остальное.
Восходящий поток. Особенности процесса.
Механизм реакции по данным меченых атомов и изотопных эффектов.
Окисление метанола в формальдегид на серебряных катализаторах.
CH3OH = CH2O + H2
CH3OH + 0,5O2 = CH2O + H2O
CH3OH + nO2 = CO, CO2, H2O
CH2O + mO2 = CO, CO2, H2O
Катализатор – Ag/пемза, мулит.
Температурный профили в адиабатическом реакторе для процесса, протекающего в области внешней диффузии.
Особенности процессов, протекающих во внешнедиффузионной области.
Реакции с участием СО, включая синтеза из СО и водорода, и синтез метанола.
Получение газов из углеводородного сырья на примере метана.
Очистка метана от сернистых соединений - деструктивное гидрирование на кобальт-молибденовых катализаторах до сероводорода (температура 350-4000 С, давление 10-40 атм) в адиабатическом реакторе, например,
С4Н4S + 4H2 = C4H10 + H2S
и поглощение сероводорода с помощью ZnO
ZnO + H2S = ZnS + H2O
Паровая (порокислородная, углекислотная) конверсия метана -
CH4 + H2O = CO + 3H2 - 50 ккал/моль
CO + H2O = CO2 + H2 + 10 ккал/моль
CH4 + CO2 = 2CO + 2H2 - 60 ккал/моль
2CH4 + O2 = 2CO + 4H2 + 7 ккал/моль
Условия реакции - температура 800-8500 С, давление 10-40 атм, катализатор - никель на окиси алюминия, или магний-алюминиевой шпинели (магниевая соль алюминиевой кислоты). Почему высокое давление? Почему избыток пара? Мембранный реактор.
Синтез метанола.
CO2 + 3H2 = CH3OH + + H2O 10 ккал/моль
CO + H2O = CO2 + H2 + 10 ккал/моль
Условия реакции - температура 210-2800 С, давление 40-90 атм, катализатор - медь-цинк-алюминиевый.
Факториал (H2 - CO2)/( CO2 + CO) = 2,0 - 2,2 (для синтеза метанола), для синтеза высших спиртов и в оксосинтезе H2/CO = 0,7 - 1,0, для синтеза углеводородов (процесс Фишера-Тропша) H2/CO = 2,0 - 2,2.
Каталитические процессы в нефтепеработке.
Глубина переработки нефти.
Газы нефтепеработки: природный газ, попутный газ (растворен в нефти), газы процессов (например, каталитического крекинга).
Продукты нефтепеработки: моторные топлива, реактивные топлива, кокс, масла, асфальт, СК.
Октановые и цетановые числа.
Октановые числа:
н-гептан 0
2- метилгексан 41
2,2-диметилпентан 89
2,2,3-триметилбутан 113
метилциклогексан 104
толуол 124
Процессы нефтепеработки:
первичная перегонка,
гидроочистка ( обессеривание, деазотирование, деметаллирование), каталитический крекинг,
гидрокрекинг,
платформинг,
алкилирование,
олигомеризация
изомеризация.