Реферат: Функциональные и молекулярные резервы организма
Реферат
по биологии
на тему:
«Функциональные и молекулярные резервы организма»
Адаптация организма к условиям среды в общебиологическом плане необходима для сохранения как каждого индивидуума, так и каждого вида. А для человека, который является объектом не только биологическим, но прежде всего социальным, приспособление обязательно еще и для обеспечения психического комфорта и работоспособности.
Одним из путей защиты от неблагоприятных условий окружающей среды, особенно если они угрожают жизни, является стремление устраниться от них. Животное это делает инстинктивно, а человек — сознательно. Человек прибегает к различным средствам: сменяет легкую одежду на теплую и наоборот, пользуется отоплением, искусственным освещением, бесперебойным водоснабжением, вентиляцией, применяет кислородные или иные изолирующие от среды аппараты и т. п. Животное этих средств лишено.
Первым и наиболее древним способом устранения от вредоносных влияний среды, возникшим еще при переходе живых существ от водного к наземному образу жизни, является анабиоз, свойственный беспозвоночным животным, а также некоторым рыбам, амфибиям и рептилиям. Анабиоз — такое состояние организма, при котором жизненные процессы настолько замедлены, что признаки жизни видимо не проявляются. Анабиоз возникает под влиянием как низких температур, так и высоких, сопровождающихся большим недостатком воды. Иначе говоря, в первом случае это обратимое замерзание, а во втором — обратимое высыхание. При возвращении условий среды к совместимым с существованием происходит и восстановление активной жизни организма. Так, при таянии речного льда оживают вмерзшие в него простейшие, например инфузории, насекомые, паукообразные и низшие ракообразные. При увеличении влажности возрождаются находившиеся в состоянии теплового анабиоза яйца и куколки насекомых, а также некоторые другие беспозвоночные низшие организмы.
Общим условием впадения в состояние анабиоза является значительная потеря воды клетками, что резко снижает интенсивность обмена веществ: все химические реакции его происходят в водных растворах, а многие и с участием воды — химического компонента реакции. В состоянии анабиоза даже амфибии и рептилии, не говоря уже о беспозвоночных, теряют от !/г ДО 3Д воды, содержащейся в их организме; при этом оставшаяся вода находится в переохлажденном состоянии, превращаясь в однородную стекловидную массу. Это может произойти и при осторожном постепенном замораживании, и при быстром действии очень низких температур (порядка 90 и даже 160 °С). В прочих условиях вода кристаллизуется в лед и разрушает клеточные структуры.
Другими, более мягкими способами устранения от неблагоприятных условий среды являются оцепенение рыб, амфибий и рептилий, зимняя и летняя спячка млекопитающих и зимний сон их. Зимнее оцепенение пойкилотермных, как и зимняя спячка млекопитающих, связано со снижением температуры среды и недостатком пищи, летняя — с нехваткой влаги в засушливое (жаркое) время года. У одних животных оцепенение наступает уже при 15 °С, у других — около 0 ºC и характеризуется неподвижностью, снижением газообмена и замедлением физиологических функций. Двоякодышащие рыбы в период свойственного им летнего оцепенения при высыхании водоемов зарываются в ил и даже окружают себя капсулой, предохраняющей от потери влаги.
Если оцепенению подвергаются пойкилотермные, то зимняя и летняя спячка присуща гомойотермным животным, физиологические и молекулярные механизмы которой отличаются от оцепенения. Внешние проявления их одинаковы: снижение температуры тела почти до температуры окружающей среды (только при зимней спячке, при летней этого нет) и интенсивности обмена веществ (в 10 — 15 раз), сдвиг реакции внутренней среды организма в щелочную сторону, уменьшение возбудимости дыхательного центра и урежение дыхания до 1 вдоха за 2.5 мин; резко падает и частота сердечных сокращений (например, у летучих мышей с 420 до 16 ударов/мин). Причина этого — в возрастании тонуса парасимпатической нервной системы и уменьшении возбудимости симпатической. Самое же главное, что при зимней спячке выключается система терморегуляции. Причинами этого являются падение активности щитовидной железы и снижение содержания в крови тиреогормонов. Гомойотермные животные становятся как бы пойкилотермными.
Механизмы зимней спячки выработались в процессе исторического развития животного мира, и главные побудительные стимулы к ней исходят из центральной нервной системы. Если, например, у ежа разрушить область межуточного мозга, связанную с регуляцией вегетативных функций и обмена веществ, то возможность спячки утрачивается. Характерное для спячки торможение центральной нервной системы намного глубже, чем при нормальном сне, однако зимоспящее животное можно разбудить и в разгаре спячки путем механического раздражения.
Сурки, суслики, хомяки, бурундуки проводят спячку в норах, где температура все же несколько выше наружной и где нет охлаждающего действия ветра. Нередко норы бывают весьма глубокими: у сурков и сусликов, например, до 3 м. Летучие мыши зимуют в пещерах, штольнях и на чердаках. Во время спячки животные обходятся без воды и пищи. Лишь хомяки и бурундуки изредка просыпаются и едят запасы, заготовленные с осени. Остальные же зимоспящие поддерживают свои резко сниженные жизненные процессы за счет окисления резервного жира организма, который они приобрели за лето. В результате за время спячки они теряют 1/2 массы тела.
Пробуждение от зимней спячки происходит рефлекторно под действием повышения температуры окружающей среды, а также рефлексов с растянутого мочевого пузыря; от летней спячки — под влиянием снижения температуры и возрастания влажности. При пробуждении тонус парасимпатической нервной системы падает, а симпатической — возрастает, что стимулирует и обмен веществ, и вегетативные функции.
С зимней спячкой не следует путать зимний сон таких животных, как медведи, барсуки, енотовидные собаки. Основное отличие сна в том, что при нем не снижается температура тела и по длительности он короче: 1-2 мес., тогда как зимняя спячка может продолжаться до 3 мес. и дольше.
Еще одним способом самоустранения организма от неблагоприятных влияний среды являются миграции, происходящие инстинктивно. Различают миграции регулярные (сезонные) и нерегулярные (экстренные). Причины регулярных миграций — смена времен года, ухудшение условий питания и сезонные физиологические изменения в организме, побуждающие миграционный инстинкт. Например, птицы совершают перелеты на многие сотни и тысячи километров от мест гнездования; так, кулики из северо-восточной Сибири мигрируют в Австралию за 10 000 км. В зимние месяцы киты из Северной Атлантики и северных районов Тихого океана откочевывают в субтропические и тропические зоны, котики с Командорских островов — в более теплое Японское море.
Большие сезонные миграции совершают и рыбы от мест обычного обитания в нерестилища. Европейские угри преодолевают 7000—8000-километровый путь в Саргассово море, а личинки их — обратно в Европу по течению Гольфстрима. Многие морские лососевые и осетровые рыбы для нереста поднимаются по рекам со скоростью до 100 км/сут., проходя расстояние 3000—4000 км. Существуют и миграции по вертикали: горные копытные зимой опускаются в более низкие зоны, где снег не так глубок.
Нерегулярные миграции связаны с внезапными изменениями условий существования: недостатком пищи, засухами, наводнениями, высокой численностью вида в данной зоне и т. п. Примерами таких миграций служат перелеты саранчи в Азии или «походы» муравьев в Южной Америке. При этом мигрировавшие животные могут или вернуться в прежнее место обитания, или прочно освоить новый район, как белки в 20-х гг. заселили Камчатку.
Молекулярные основы миграции пока неизвестны. И мы вынуждены довольствоваться данными физиологии и зоопсихологии на уровне организма как целого.
Если от неблагоприятных условий среды организм не может устраниться, то он должен экстренно (а в дальнейшем и более прочно) приспособиться к ним. Какими же резервами для этого он обладает? Эти резервы можно разделить на две группы: функциональные и молекулярные. Под первыми мы понимаем диапазон изменений интенсивности той или иной функции, под вторыми — энергетические ресурсы организма, возможности регуляции биохимических процессов в нем и изменения структур биологически активных молекул.
Обращаясь к сердечнососудистой системе, мы видим, что резервы ее очень велики. Частота и сила сердечных сокращений могут возрастать в 3—4 раза против уровня в оптимальных для организма условиях, ударный объем (т. е. количество крови, выбрасываемое в сосудистую систему при каждом сердечном сокращении) — с 60 до 200 мл, а минутный объем (объем крови, выбрасываемый за 1 мин) — с 4 до 38 л. Существенно может увеличиваться и сеть функционирующих кровеносных капилляров. Например, в покоящихся мышцах на 1 см2 приходится 35 действующих капилляров с поверхностью 3— 8 см2, а остальные закрыты и в кровоснабжении мышцы не участвуют. При интенсивной же работе мышц количество их достигает 3000, а поверхность — до 360—370 см2. Значительно могут возрастать и скорость кровотока, и объем циркулирующей крови. В состоянии, не требующем функционального напряжения, в кровообращении не участвует до 30% всего объема крови. Эта кровь находится в так называемых кровяных депо: в селезенке (у собаки — от 10 до 20%, у человека — от 8 до 12%), в сосудах кожи (10%) и в печени (20%). По мере надобности эта кровь может поступать в общее кровяное русло, увеличивая объем циркулирующей крови, что приводит, в частности, к возрастанию кислородной емкости организма, т. е. количества кислорода, поглощаемого кровью и переносимого ею от легких к тканям и органам. Поскольку поступивший в легкие кислород присоединяется к красящему веществу красных кровяных телец — гемоглобину, то, чем больше будет абсолютное содержание его в крови, тем больше кислорода сможет перенести кровь.
Значительно могут возрастать и параметры дыхательной системы: частота дыхания — в 3—4 раза, объем легочной вентиляции — в 8 раз, газообмен — в 20 — 30, максимальное поглощение кислорода — в 2.5— 3 раза. Столь же значительны резервы и других функциональных систем; так, мочеотделение может увеличиваться в 10 — 15 раз, потоотделение — в 10—12 раз. Словом, функциональные резервы организма достаточно велики.
Каковы же пути включения этих резервов? Прежде всего, это нервные, рефлекторные механизмы, регулируемые центральной нервной системой, но могут они осуществляться и гормонами или продуктами обмена веществ через кровь, т. е. гуморально. Так, адреналин вызывает учащение сердечных сокращений, а от концентрации углекислоты в крови зависит возбудимость дыхательного центра в продолговатом мозгу, а значит, частота и глубина дыхания, и т. д.
Рассмотрим молекулярные и субклеточные резервы организма. Прежде всего это запасы источников энергии, необходимой для жизнедеятельности и осуществления различных физиологических функций. Первым и наиболее легко используемым является животный крахмал — гликоген, построенный из цепей глюкозных остатков, которые по отщеплении от гликогена могут окисляться (а следовательно, генерировать необходимую организму АТФ и тепло) как аэробно, так и анаэробно, гликолитически. В том или ином количестве гликоген содержится во всех клетках организма, но особенно много его в печени (от 4 до 8% ее массы), скелетных мышцах (от 0.3 до 0.8%), сердечной мышце (от 0.25 до 0.3%) и головном мозгу (от 0.2 до 0.25%). Гликоген нервной системы, сердечной и скелетных мышц используется в первую очередь для собственной потребности этих органов, но в критических ситуациях, при понижении содержания гликогена в миокарде и головном мозгу, гликоген скелетных мышц может расщепляться до глюкозы, которая, поступая в кровь, и переносится в эти жизненно важные органы. Главным же резервом гликогена в организме является печень. Содержащийся в ней гликоген, расщепляясь под действием фермента гликогенфосфорилазы, служит для поддержания уровня глюкозы в крови и снабжения ею всех тканей и органов. В печени человека до 500 г гликогена, в скелетных мышцах — до 200, в сердечной мышце и головном мозгу — около 90 г. Окисляясь до углекислоты и воды, гликогенные запасы организма могут обеспечить около 11 055 кДж, так как окисление 1 г глюкозы дает 13.7 кДж.
Другим, еще более мощным запасом является резервный жир. В организме человека он составляет 10 — 20% от массы тела, а у некоторых животных — до 50%. На каждый килограмм живой массы приходится в среднем 90 г жира. Но не весь этот жир используется как источник энергии. При смерти от полного голодания в организме остается еще 23 г жира на 1 кг массы тела. Это так называемый плазматический жир (главным образом жироподобные вещества — фосфолипиды), входящий в состав субклеточных структур, и прежде всего в различные биологические мембраны. Таким образом, на долю резервного жира остается 67 г на 1 кг массы тела, т. е. у человека с массой 70 кг он составляет около 5 кг. Жиры, точнее образующиеся из них жирные кислоты, могут окисляться только аэробно, но зато они дают больший выход энергии: 30.2 кДж/г. При окислении всего резервного жира организм получает 155 775 кДж.
Наконец, существуют и резервные белки — некоторые белки плазмы крови, печени и скелетных мышц. В организме человека их около 5 кг. Правда, в основном они служат резервом для синтеза различных функционально важных белков — структурных и ферментных, но в тяжелых условиях часть образующихся из них аминокислот, теряя свои азотсодержащие аминогруппы, может подвергаться окислению, снабжая организм дополнительно еще около 40 200 кДж (окисление 1 г белка дает 13.7 кДж). Таким образом, запасы энергии организма человека составляют суммарно около 207 030 кДж. По мере уменьшения этих запасов они пополняются за счет продуктов питания, а при полном голодании постепенно используются, поддерживая жизнь в течение того или иного времени. Чем интенсивнее идут процессы обмена веществ, тем быстрее они расходуются.
Интенсивность обмена веществ зависит от массы и относительной поверхности тела: чем масса меньше и отношение поверхности к массе выше, тем обмен веществ интенсивнее. Сравним мышь и слона. Масса тела первой составляет 20 г, а второго — 3.7 · 106 г. Потребление же кислорода, отражающее интенсивность обмена веществ, у мыши равно 1.70 мл/(г · ч), а у слона — 0.11 мл/(г · ч), т. е. почти в 15 раз ниже! Еще примеры. При полном голодании человек теряет за 1 сут. 0.6% массы тела, собака — 1.9, кошка — 3.1, морская свинка — 5.2, мышь — 7.5%. Соответственно этому выживаемость при голодании различна: мышь (масса тела 20—30 г) погибает на 2-4-е сут, морская свинка (300—500 г) — на 8—10-е, кошка (2.0-2.5 кг) - на 14-21-е, собака (20 кг) - на 30-40-е, а человек (масса тела 70 кг) — на 40—75-е сут.
В зависимости от условий среды и функциональной активности организма существенно варьирует и интенсивность обмена веществ. Например, при мышечной деятельности максимальной и субмаксимальной мощности расход энергии (а значит, и обмен веществ) может возрастать в 100—150 раз, а при зимней спячке снижаться в 10—15 раз. Соответственно в широком диапазоне активируются и энергопоставляющие процессы: аэробное окисление глюкозы и жирных кислот Может повышаться более чем в 10 раз, а анаэробное использование глюкозы (гликолиз) — в 100 раз. В большой степени может увеличиваться и транспорт источников энергии из депо в органы потребители: содержание глюкозы в крови — в 3.5—4 раза, жирных кислот — в 8 раз. В широких пределах может изменяться и содержание в крови различных регулирующих веществ, прежде всего гормонов: глюкокортикоидов — в 4 раза, альдостерона — в 15, адреналина и норадреналина — почти в 10, глюкагона — в 2, соматотропина — в 10 раз. Эти сдвиги напряженности обмена веществ связаны главным образом с активностью ферментов (скоростью катализируемой ими реакции), которая может повышаться в 5—6 раз и более.
Активность фермента зависит прежде всего от количества субстрата, т. е. вещества, подлежащего химическому превращению в процессе реакции. Всякая ферментативная реакция протекает по уравнению Ц + С = ФС = Ц -f-+ Р, где Ц — фермент, С — субстрат, ФС — фермент-субстратный комплекс, Р — продукт реакции. Началом реакции является образование этого комплекса (ФС) — присоединение субстрата к активному центру фермента. Затем внутри этого комплекса происходит химическое превращение субстрата в продукт реакции (например, расщепление его на два новых вещества), и комплекс распадается с освобождением продукта реакции и фермента, готового к взаимодействию с новой молекулой субстрата. Естественно, чем больше субстрата, тем полнее насыщены им молекулы фермента и тем большим будет эффект реакции. При полном насыщении всех имеющихся молекул фермента скорость реакции максимальна. Но еще большее увеличение концентрации субстрата может препятствовать расщеплению комплекса ряда ферментов с их субстратами и тем снижать скорость ферментативной реакции. Это явление получило название субстратного угнетения (ингибирования) активности ферментов.
Активность ферментов зависит также от температуры и реакции среды. У каждого фермента определенный температурный оптимум, при котором скорость реакции наивысшая. Для большинства ферментов животного организма термический оптимум лежит в области температуры тела: 35—40 °С. Но для ферментов тканей, соприкасающихся с внешней средой (кожа, дыхательные пути, легкие, слизистые оболочки пищеварительного тракта) он более широк, чем для ферментов внутренних органов, и расположен в области более значительного температурного диапазона. Это одно из проявлений приспособления организма к условиям среды. Так, у птиц, температура тела которых выше (40—41°С), чем у млекопитающих (36 —37 °С), более высокие и термические оптимумы ферментов.
При увеличении температуры выше 45—50 0C ферменты становятся неактивными вследствие денатурации их молекул. При глубоком охлаждении (от —20 до —40°С) они тоже теряют активность, но обратимо. Даже после охлаждения до —196 0C ферменты при оптимальной температуре снова проявляют свою активность в полной мере. Значит, высокие температуры вызывают необратимую, а низкие — обратимую денатурацию молекул ферментов.
Оптимум реакции среды для разных ферментов варьирует в весьма широких пределах. Реакция среды зависит от соотношения в ней кислых ионов водорода (H+) и щелочных ионов гидроксила (ОН~). Концентрации этих ионов — величины сопряженные: увеличение концентрации H+ влечет за собой снижение концентрации OH-, и наоборот. Реакция среды измеряется водородным показателем рН от 1 до 14. При нейтральной реакции, когда концентрации H+ и OH- одинаковы, он равен 7, при повышении концентрации H+ — ниже 7 (кислая реакция), а при увеличении концентрации OH- — больше 7 (щелочная реакция). Есть ферменты, оптимум активности которых лежит при кислой реакции. Например, оптимум активности пепсина — фермента желудочного сока, расщепляющего белки, при рН 2. Есть ферменты с нейтральным или щелочным оптимумом. Так, оптимум амилазы — фермента, расщепляющего крахмал, при рН 7, а щелочной фосфатазы печени — при рН 10. Для большинства тканевых ферментов оптимум их рН находится в слабощелочной (рН между 7 и 8) или в нейтральной (рН 7) реакции, но некоторые тканевые ферменты (например, кислые гидролазы лизосом) имеют оптимум при кислой реакции среды.
Биологический смысл нахождения оптимума рН тканевых ферментов не в нейтральной, а в слегка кислой или слегка щелочной среде, в том, что при функциональной активности клетки реакция ее внутренней среды может сдвигаться в ту или другую сторону (чаще в кислую) — и тогда активность ферментов ее против состояния покоя возрастает. На активность ферментов могут влиять и различные активаторы, например ионы металлов: Na+, K+, Ca2+, Mg2+, Mn2+ и др., а также Cl-.
Особый интерес представляет аллостерическая активация. Установлено, что ряд ферментов наряду с активным каталитическим центром — участком молекулы, присоединяющим субстрат, имеет еще один центр, способный взаимодействовать с каким-либо другим веществом, отличающимся по своему строению от субстрата, но способствующим такому изменению третичной структуры ферментного белка, какое сопровождается смещением взаиморасположения атомных групп активного центра, приводящим к активации фермента. Такие ферменты получили название аллостерических (от греческих слов Ьллпт — другой, иной и уфЭсепт — пространство), связываемое вещество — аллостерического эффектора, а место связывания — аллостерического центра. В качестве эффекторов могут выступать многие вещества, содержащиеся в клетке или приносимые к ней кровью: АМФ, глюкозо-6-фосфат, различные продукты обмена веществ, гормоны и пр.
Активность ферментов регулируется не только путем ее повышения, но и угнетения (ингибирования) от сравнительно небольшого до полного. Вещества, при посредстве которых это осуществляется, называются ингибиторами. Ингибирование может быть обратимым и необратимым. Естественные ингибиторы (И), содержащиеся в организме, действуют, как правило, обратимо, т. е. способны не только присоединяться к ферменту (Ф); но и снова отщепляться от него: Ц + И ^ ФИ. Как правило, необратимо действующие ингибиторы — различные яды, используемые в опытах с изучением структуры и действия ферментов.
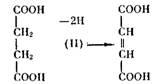
Ингибирование может быть конкурентным. Это происходит в том случае, когда ингибитор по своей структуре близок к субстрату и способен вместо него занять активный центр. Такой ингибитор настолько близок по строению к субстрату, что может плотно блокировать активный центр, однако имеющиеся отличия мешают ему подвергнуться тем же превращениям, что и субстрат. Заняв «чужое» место, он уподобляется «собаке на сене»: и сам не претерпевает изменений, и мешает превращениям субстрата. Примером такого конкурентного ингибитора может служить малоновая кислота (I) — ингибитор
фермента сукцинатдегидрогеназы, катализирующей окисление янтарной кислоты (II):
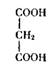 (I)
(I)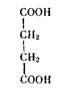 (H)
(H)
Как видим, структура обеих кислот весьма близка, но окисляться, как янтарная кислота — с образованием фумаровой (III), — малоновая не может из-за наличия в ней только одной группы = СНг:
 (HI)
(HI)
Ингибирующим может быть и аллостерический эффект, подобный аллостерической активации, с той лишь разницей, что с присоединением к ферменту аллостерического ингибитора активный центр фермента изменяется так, что активность фермента понижается или утрачивается.
Если рассмотренных путей активации ферментов при той или иной ситуации оказывается недостаточно, то это может явиться стимулом усиления синтеза данного фермента. В зависимости от условий скорость синтеза ферментов способна широко варьировать: от нескольких минут до часов. Все находящиеся в клетке ферменты принято разделять на две группы: конститутивные, в том или ином количестве всегда присутствующие в клетке, и адаптивные (или индуцибельные), синтезируемые только в ответ на появление в клетке соответствующего субстрата. Гены адаптивных ферментов находятся в состоянии репрессии и вступают в действие только под влиянием индуктора и дерепрессора — вещества, удаляющего репрессор с соответствующего участка ДНК. Индукторами могут быть различные вещества, нередко — продукты обмена веществ (метаболиты) и даже сам субстрат данного фермента. Например, повышение в мышечном волокне концентрации аминокислоты орнитина индуцирует весьма быстрый синтез фермента орнитин декарбоксилазы.
Но повышенно синтезироваться могут и конститутивные ферменты, если того требуют вызванные влиянием внешней среды изменения обмена веществ и если наличная популяция (количество молекул) фермента «не справляется» с потоком субстратов или не обеспечивает необходимого количества продуктов. Дело в том, что белок - синтезирующий аппарат в обычных условиях работает не в полную силу, а при повышении концентрации субстрата той или иной реакции или при недостатке тех или иных продуктов, являющихся субстратами последующих реакций, он дополнительно активируется и обеспечивает увеличение содержания фермента в клетке за счет его повышенного синтеза.
Конечно, это не значит, что синтез конститутивных ферментов происходит лишь при каких-то особых обстоятельствах. То, что было сказано выше, относится к усилению синтеза ферментов, приводящему к повышению содержания их в клетке. Каждому ферменту, как и любому веществу в организме, свойствен определенный «период жизни». Все вещества в организме (а особенно белки) постоянно разрушаются и синтезируются, обновляя свой состав. При этом в обычных условиях сколько вещества расщепляется, столько и синтезируется, и содержание того или иного химического соединения в клетке остается неизменным. Все это в полной мере свойственно и конститутивным ферментам. Как видим, возможности организма в приспособлении его к условиям среды достаточно велики и разнообразны.
Необходимо отметить, что все изменения обмена веществ, вызываемые условиями существования, контролируются нервной системой, интегрирующей их в интересах организма как целого. Это можно наглядно продемонстрировать расчетами немецких физиологов В. Холльмана и Т. Хеттингера. Рассматривая рабочие резервы организма (его мышечной и нервной системы), авторы разделили их на четыре группы: используемые при автоматизированных движениях («15%); физиологические («20%); специальные, расходуемые в различных сложных ситуациях, например при мышечной деятельности очень высокой интенсивности или длительности, охлаждении организма, пребывании его в условиях гипоксии и т. п. («35%), и автоматически защищаемые («30%), снижение которых опасно для жизни. Между расходованием третьей и четвертой группы резервов и стоит на страже центральная нервная система, накладывающая вето на использование «неприкосновенного запаса». Конечно, этот запрет — охранительное торможение, возникающее в центральной нервной системе и влекущее за собой снижение функциональной активности, в известных условиях может быть преодолен (например, при стремлении животного уйти от преследователя). Однако последствия этого могут не только спасти организм, но и привести его к гибели.