Курсовая работа: Синтез 4-бром-4’-гидроксибифенила
Синтез 4-бром-4’-гидроксибифенила
Содержание
Введение
1. Литературный обзор
2. Экспериментальная часть
3. Обсуждение результатов
Выводы
Список литературы
Введение
Настоящая работа посвящена синтезу 4-бром-4’-гидроксибифенила. Это соединение является важным реагентом для синтеза ферроценсодержащих жидких кристаллов. Введение в молекулу ферроцена бифенильного заместителя способствует поляризации молекулы и межмолекулярной ассоциации.
Синтетические подходы к замещенным производным ферроценилбифенила. На базе которого могут быть созданы жидкие кристаллы. Разработаны недостаточно. Препятствием. Стоящим на пути к необходимым производным ферроценилбифенила является синтез 4,4’-дизамещенных бифенилов. Наиболее рентабелен синтез этих соединений, исходя из дешевого бифенила, реакциями электрофильного замещения.
4-Бром-4’-гидроксибифенил может быть использован как арилирующий агент в реакции кросс-сочетания с производным трис(4-ферроценилбороксинами) в присутствии солей палладия.
Аналогичное применение в синтезе жидких кристаллов могут найти сложные эфиры 4-бром-4’-гидроксибифенила.
1. Литературный обзор
Получение 4,4’ замещенных производных бифенила.
Существует три основных метода получения 4,4’-дизамещенных бифенилов. Первый основан на бензидиновой перегруппировке, но он почти не используется, в связи с высокой канцерогенностью бензидина. Два других метода - это реакции электрофильного замещения в бифениле и создание бифенильной системы реакциями кросс-сочетания, которые используют в настоящее время. Ниже рассмотрены методы получения 4,4’-дизамещенных бифенила с помощью реакций электрофильного замещения.
Исходным веществом для получения 4,4’ замещенных производных бифенила часто служит 4-нитробифенил.
В работе[1] авторы получали 4-нитробифенил из бифенила:
![]()
кипячением бифенила с концентрированной азотной кислотой в растворе ледяной уксусной кислоты был получен 4-нитробифенил [1] (т.пл. 1120-1130)
В работе [2] авторы получали 4-бром-4’-нитробифенил при перемешивании смеси при нагревании 4-нитробифенила в растворе ледяной уксусной кислоты с бромом в отсутствие катализатора, причем продолжительное нагревание уменьшало выход (выход 80%).
![]()
Получили достаточно чистый продукт для использования в последующих стадиях. т. пл. 173-1760
4-бром-4’-нитробифенил авторы работы[3] использовали для получения 4-циано-4’-гидроксибифенила:

4-нитробифенил получали по описанной в работе [1] методике. 4-Бром-4’-нитробифенил получали нагреванием смеси 4-нитробифенила, ледяной уксусной кислоты и брома, охлаждали и фильтровали осадок 4-бром-4’-нитробифенила, затем, его перекристаллизовывали из ледяной уксусной кислоты. 4-амино-4’-бромбифенил получали восстановлением 4-бром-4’-нитробифенила порошкообразным железом с соляной кислотой в этиловом спирте. Затем полученный амин диазотировали нитритом натрия с соляной кислотой при 00 и получали хлорид диазония, который затем превращали в тетрафторборат. Тетрафторборат 4-бромбифенил-4’-диазония нагревали с трифторуксусной кислотой и получали 4-бром-4’-гидроксибифенил, который кипятили в диметилформамиде с цианидом меди (1).
В работе [4] из п-нитробифенила (т. пл. 112-1130) при восстановлении избытком выделяющегося водорода был получен п-аминобифенил. т. пл. 490.
![]()
Паранитробифенил был получен кипячением бифенила с концентрированной азотной кислотой в растворе ледяной уксусной кислоты[5].
Ряд галогенозамещенных был получен авторами в работе [6]. 4-амино – 4’-галогенбифенилы получали исходя из нитропроизводного галогенбифенила:
![]()
X= Cl
Br
При получении 4-амино-4’-хлорбифенила , 4- нитро-4’-хлорбифенил восстанавливали чистым железом с соляной кислотой в 90% этаноле и, затем, перекристаллизовывали в петролейном эфире (т. кип. 80-1000). т. пл. 1280[6].
В работе [7] авторы, также, получали 4-амино-4’-хлорбифенил восстановлением 4-нитро-4’-хлорбифенила порошкообразным железом в присутствии соляной кислоты.
4-амино-4’-бромбифенил авторы получали восстановлением соответствующего нитросоединения по методике [8]. К спиртовому раствору 4-бром-4’-нитробифенила добавляли раствор хлорида олова (II) в концентрированной соляной кислоте. Смесь нагревали в течение 4х часов на водяной бане при температуре 1000. К плоченной соли аминобифенила добавляли KOH и перемешивали в течение 5 часов. Т. пл.1460[6]
4-амино-4’-йодбифенил получали по следующей схеме

4-амино-4’-нитробифенил получали добавлением гидрата сульфида натрия и серы к кипящему спиртовому раствору 4,4’-динитробифенила. Полученный 4-амино-4’-нитробифенил отделяют, перекристаллизовывают из ацетона, а затем диазотируют в ледяной уксусной кислоте нитритом натрия при 100. Раствор соли диазония разлагают с йодидом калия при нагревании на водяной бане. Затем полученный 4-йод-4’-нитробифенил восстанавливали при кипячении в растворе этанола с концентрированной соляной кислотой добавлением маленькими порциями порошкообразного цинка. Полученный продукт экстрагировали эфиром, затем перекристаллизовывали петролейным эфиром. Получили 4-амино-4’-йодбифенил т. пл. 1650[6].
При получении 4-амино-4’-фторбифенила использовали терафтороборат бифенилдиазония:

К бифенилдиазоний-хлориду добавляли раствор тетрафторбората натрия, затем нитровали и восстанавливали порошкообразным цинком с соляной кислотой и перекристаллизовывали из петролейного эфира. т. пл. 1200[6]
В работе [9] авторы получали 4-амино-4’-нитробифенил из 4,4’-динитробифенила, но ввиду плохой растворимости 4,4’-динитробифенила в спирте его восстанавливали в растворе пиридина. К кипящему раствору 4,4’-динитробифенила в пиридине при встряхивании по каплям добавляли раствор полисульфида натрия. Осадок продукта обработали водой упарили, а потом экстрагировали кипящей соляной кислотой и перекристализовали гидрохлорид амина. Для переведения гидрохлорида в свободный амин продукт обработали минимальным количеством пиридина, и добавили большое количество воды, затем осадок перекристаллизовали из метанола Получили чистый 4-амино-4’-нитробифенил, т. пл. 2040.
Также синтез 4,4’ замещенных производных бифенила проводят исходя из бензидина.
Синтез 4-метокси-4’-аминобифенила проводили по следующей схеме[10]
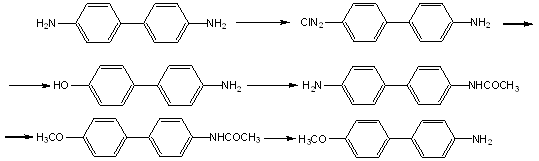
Сначала бензидин растворяют в соляной кислоте, к раствору при охлаждении добавляют нитрит натрия. Соль диазония разлагают интенсивно кипящей водой. Полученный 4-гидрокси-4’-аминобифенил экстрагируют 1%м раствором щелочи(расход щелочи 5-6 литров на 50г бензидина). После очистки получается чистый продукт, т.пл. 272,5-224. 4-гидрокси-4’-ацетиламинобифенил получают ацилированием 4-гидрокси-4’-аминобифенила ледяной уксусной кислотой. Алкилируют путем добавления KOH, а, затем, йодистого метила, с последующим гидролизом смесью уксусной и соляной кислот с водой.
4-амино-4’-хлорбифенила проводят по следующей схеме[11]

На первой стадии сначала получают раствор бензидина в концентрированной соляной кислоте, который затем охлаждают и диазотируют. Раствор соли диазония по каплям прибавляют к свежеприготовленной однохлористой меди. Продукт экстрагируют соляной кислотой (7-8%) при кипячении. Для выделения из соли свободного 4-амино-4’-хлорбифенила продукт обрабатывают раствором 10%-го аммиака.
Приемлемым способом получения замещенных биарилов является катализируемая благородными металлами реакция кросс-сочетания. Катализируемая палладием реакция кросс-сочетания между борорганическими соединениями и органическими галогенидами, трифторацетатами или иодониевыми солями является прекрасным методом для создания связи С-С. Наибольшее распространение в качестве борорганических соединений, используемых в данного рода реакциях, получили борные кислоты. Реакции кросс-сочетания обладают рядом преимуществ, такими как нечувствительность к присутствию воды, толерантность по отношению к широкому кругу функциональных групп и регио- и стерео-специфичность. Кроме того, неорганические продукты нетоксичны и легко отделяются.
В работе [12] изучалось кросс-сочетание пара-толилборной кислоты и 4-нитродифенилиодоний бромида при катализе солями двухвалентного палладия.
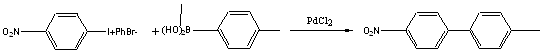
Данную реакцию кросс-сочетания проводят с использованием оснований, в качестве которых применяют [12] Na2СОз, NaOH, NaOEt, t-BuOK. Чем более стерически усложнены субстраты, тем больший выход дают более сильные основания.
Реакция кросс-сочетания может быть проведена при комнатной температуре, но она протекает очень медленно, поэтому обычно реакционную смесь нагревают до 60°-110°С, особенно если используют стерически затруднённые субстраты.
2. Экспериментальная часть
Получение 4-бром-4’-нитробифенила.
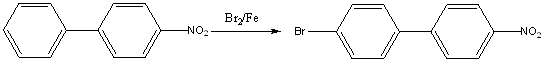
К 19,9 г(0,1 моль) 4-нитробифенила прибавили 60мл хлороформа, 6,5мл (20,2 г; 0,13моль) брома и 0,73г порошкообразного железа, Полученную смесь осторожно нагрели до начала бурной реакции , затем, кипятили в течение 2ч. Добавили еще 0,25г железа и кипятили еще 1ч. Реакционную смесь охладили до комнатной температуры, прибавили к ней водный раствор сульфита натрия (10г Na2SO3 в 50мл воды) и перемешивали полученную смесь для удаления избытка брома. Осадок продукта, окрашенного примесями в серо-коричневый цвет, отфильтровали, промыли водой и высушили на воздухе. Дополнительную порцию продукта получили после упаривания хлороформного раствора и перекристаллизации остатка из уксусной кислоты с добавлением активированного угля. Обе порции объединили и поместили в патрон аппарата Сокслета. Продукт экстрагировали петролейным эфиром(70/100о). Экстракцию продолжали до тех пор, пока петролейный эфир не начал окрашиваться в оранжевый цвет. Получили 4-бром-4’-нитробифенил в виде желтоватых кристаллов, т.пл -174-176о. Масса продукта составила 15,34г (выход 61%). Лит.данные [2]: т.пл. 173-176о
Получение 4-бром-4’-аминобифенила.
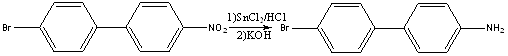
К 15,02г (0,054моль) 4-бром-4’-нитробифенила в 120мл спирта прибавили раствор 54г (0,24моль) дигидрата хлорида олова(II) в 60мл концентрированной соляной кислоты. Смесь нагревали 2ч на кипящей водяной бане при перемешивании. Затем раствор охладили, разбавили трехкратным объемом воды. Образовавшийся осадок соли амина отфильтровали, к нему прибавили раствор 50г KOH в 70мл воды. Смесь перемешивали в течение двух часов, затем добавили 100мл воды и отфильтровали осадок амина. Осадок промыли водой до нейтральной реакции и высушили на воздухе. Масса 4-бром-4’-аминобифенила составила 12,24г (выход 91%), т.пл. – 145-1470. Лит.данные [3]: т.пл. 143-145о
Тетрафтороборат 4-бромбифенил – 4’ диазония.

![]()
К 12,24г 4-бром-4’-аминобифенила прибавили 384мл воды и 48мл концентрированной соляной кислоты. Смесь охладили льдом до 20, а затем прибавили к ней в течение 15 минут по каплям при перемешивании на магнитной мешалке раствор 3,93г ( 0,057 моля) нитрита натрия в 52мл воды. При добавлении нитрита натрия реакционная смесь желтеет. После добавления всего раствора нитрита натрия перемешивание при температуре 1-1,5о продолжили еще в течение 30 мин. К полученному диазо-раствору прибавили раствор 5,99г тетрафторобората аммония в 48мл воды. При добавлении тетрафторбората аммония смесь разогревается до 30 и становится белой. Осадок тетрафторбората 4-бромбифенил–4’-диазония отфильтровали на воронке Бюхнера и высушили на воздухе в течение двух дней. Масса продукта составила 15,52г (выход 91%), т.пл. – выше 128о разлагается.
4. Получение 4-бром-4’-гидроксибифенила
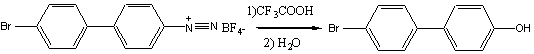
К 3,2г (0,022моль) прокаленного карбоната калия при охлаждении льдом (0оС) осторожно добавили 9,2 мл трифторуксусной кислоты и затем – в один прием - 15,52г (0,045моль) тетрафторбората 4-бромбифенил–4’-диазония. Полученный раствор кипятили при перемешивании в тетение 1,5 ч с защитой от влаги, до отрицательной реакции на соль диазония с β-нафтолом (реакционную смесь защищали от влаги хлоркальциевой трубкой, наполненной хлористым кальцием). К полученному раствору добавили 260 мл воды и перемешивали при комнатной температуре в течение 1 ч. Охладили до-5о и отфильтровали образовавшийся осадок продукта, осадок промыли водой до нейтральной реакции. Перекристаллизовали из спирта. Получили 5,57г (выход 57%) 4-бром-4’-гидроксибифенила. т. пл. 163-1650. Лит.данные [3]: т.пл. 164-166о.
3. Обсуждение результатов
Целью данной работы был синтез 4-бром-4’-гидроксибифенила. Мы рассмотрели три возможные способы его получения: 1) реакция кросс-сочетания; 2) ацилирование 4-бромбифенила с последующей реакцией Байера-Вилигера; 3) из соли 4-бромфенилдиазония. Поскольку в литературе описан только последний способ, то он и был выбран нами для получения целевого продукта.
В работе [3] была использована следующая схема получения 4-бром-4’-гидроксибифенила
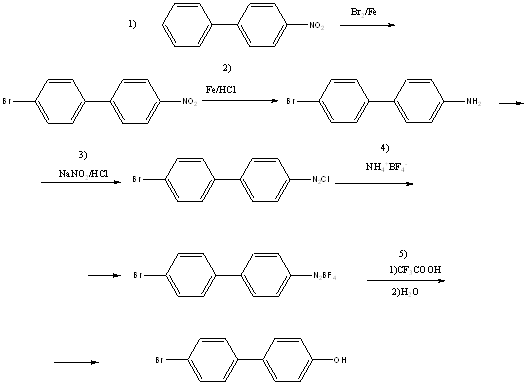
Эта схема и была выбрана нами для получения целевого продукта. На первой стадии во время проведения синтеза реакция шла не так интенсивно, как ожидалось, поэтому мы добавили дополнительное количество катализатора (0,25г железа). Очистке 4-бром-4’-нитробифенила экстракцией в аппарате Сокслета проводили до тех пор, пока экстракт не стал окрашиваться в светло-коричневый цвет, это потребовало прекратить экстракцию. Еще порцию вещества получали перекристаллизацией из ледяной уксусной кислоты остатка из капсулы аппарата Сокслета.
В отличие от работы [3], восстановление 4-бром-4’-нитробифенила мы проводили не железом, а хлоридом олова(II) в кислой среде, как описано в работе [8]. После восстановления мы получили гидрохлорид 4’-бром-4-бифениламина. Методика выделения свободного 4-бром-4’-аминобифенила была разработана ранее в лаборатории КМОС. Она требовала длительного перемешивания гидрохлорида со щелочью (5ч). Мы использовали эту методику, но уменьшили время перемешивания до 2ч. Это практически не изменило выход 4-бром-4’-аминобифенила и не сказалось на чистоте продукта: т. пл. 145-1460 (лит. данные [3]: т.пл. 144-1450).
Получение целевого фенола мы осуществили по следующей схеме:
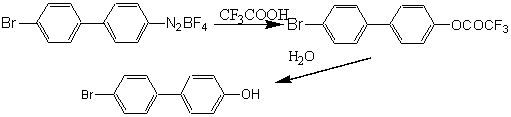
Получающийся вначале трифторацетат фенола легко гидролизуется при действии воды с образованием конечного продукта. В нашем эксперименте мы получили загрязненное вещество, что потребовало дополнительной кристаллизации из этанола. Поэтому выход чистого 4-бром-4’-гидроксибифенила после перекристаллизации составил только 57% (лит. данные [3]: выход 80%).
Выводы
1. Синтезирован 4-бром-4’-гидроксибифенил с общим выходом по трем стадиям 29%.
2. Вещество охарактеризовано по температуре плавления, которая соответствует литературным данным.
3. На стадии выделения свободного 4-бром-4’-аминобифенила из его гидрохлорида достаточно перемешивания со щелочью в течение 2ч, а не 5ч, как было предложено ранее.
Список литературы
[1] T. Carnellce, J. Schleselman. "Amidodiphenylsulphonic acid and aro-dies from diphenyl". // J. Chem. Soc., 1886, vol.49, 380
[2] J. Wood, E. Turner. "Orientation Effects in the Diphenil series. Part III". // .J. Chem. Soc., 1926, 2041
[3] C.S. Hsu, J. M. modgiguez-Parada, and V. Vercec. "Liquid Crystalline Polymers Containing Heterocycloalkane Mesogens". J. Polym. S., vol.25, 2425-2432
[4] R. Belcher, A. J. Nutten, and W. I. Stephen. "Substituted Benzidinez and Related reagent Compounds Part I. ". // J. Chem. Soc. 1952, 1334.
[5] E. Tauber, diese Ber.1894, 2629
[6] R. Belcher, A. J. Nutten, and W. I. Stephen. "Substituted Benzidinez and Related reagent Compounds Part II. Reagent for the Precipitation of Sulphate ". // J. Chem. Soc. 1953, 1334.
[7] А.Я. Желтов, В.Я. Родионов, Б.И. Степанов. "Исследование в ряду ароматических дисульфидов III." Журн. Орган. Химии 1970, т. 6, 2562
[8]P. Gelmo. "Ueber Galogenderivate des p-Amido-biphenyls und der p’Amido- p biphenyloxaminsaure". Ber. 1906, 4175
[9] Л.М. Литвиненко и А.П. Греков. "Пространственно строение и реакционная способность. I. Ацилирование аминопроизводных бифенила". Укр. Хим. Ж. 1954, т. 20, 194.
[10] Методы получения химических реагентов и препаратов. 1965, 130.
[11] Л.М. Литвиненко, В.М. Зикранец. "4-амино-4’-хлорбифенил". Методы получения химических реагентов и препаратов. 1965, 132.
[12] Suzuki A. // J. Organometal. Chem. 1999. V. 576. P. 147.