Курсовая работа: Методика обнаружения нитратов в растениях
ВВЕДЕНИЕ
Интенсификация сельскохозяйственного производства – естественный процесс, присущий эпохе научно-технического прогресса. По сути, это качественно новый уровень антропогенного воздействия на окружающую среду, при котором достижения науки и техники направлены на увеличение уровня производства пищевых продуктов. По данным Института питания Академии медицинских наук нашей страны, годовая потребность в овощах в различных районах нашей страны составляет от 128 до 146 кг в год на душу населения. Поэтому особняком в пищевой промышленности стоят продукты растительного происхождения. В основе решения проблемы, связанной с производством достаточного количества продуктов лежат современные агротехнические приемы, а также применение регуляторов роста, химических средств борьбы с болезнями и вредителями растений и внесение минеральных удобрения. Это принесло свои плоды в плане повышения урожаев, но в свою очередь породило другую проблему – необходимость обеспечения химической безопасности и высокого качества продуктов питания.
Большой интерес в последнее время гигиенисты проявляют к вопросу об остаточном содержании нитратов в продуктах питания и тем нарушениям в состоянии здоровья человека, которые могут быть вызваны нитратным загрязнением.
Глава 1. НИТРАТЫ, НИТРИТЫ И ПУТИ СНИЖЕНИЯ ИХ СОДЕРЖАНИЯ В ОВОЩАХ
Соли азотной кислоты, нитраты, являются элементом питания растений и естественным компонентом пищевых продуктов растительного происхождения. Их высокая концентрация в почве абсолютно не токсична для растений, напротив, она способствует усиленному росту надземной части растений, более активному протеканию процесса фотосинтеза, лучшему формированию репродуктивных органов и в конечном итоге – более высокому урожаю. Например, если в период вегетации в растениях салата и шпината нитратов будет меньше 2000 мг/кг, то высокого урожая не жди: листья будут мелкие, грубые, непригодные для реализации. Во время массового образования кочанов и черешков листьев капусты нитратов должно быть 2000–3000 мг/кг.
Поскольку в органические соединения растений включается только аммонийный азот, нитрат-анионы, поглощенные растением, должны восстановиться в клетках до аммиака. Образованием аммиака завершается и распад органических веществ – аминокислот, амидов, белков. По образному выражению академика Д.Н.Прянишникова, аммиак «есть альфа и омега в обмене азотистых веществ у растений».
Нитраты, поступившие в растения, восстанавливаются по схеме:
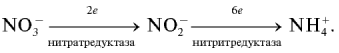
Первый этап восстановления нитрата протекает в соответствии с уравнением:
![]()
где NAД(Р)H – никотинамидадениндинуклеотидфосфат восстановленный, NAД(Р)+ – никотинамидадениндинуклеотидфосфат окисленный.
Нитратредуктаза – фермент класса оксидоредуктаз, синтезируемый в клетках в ответ на поступление NO3–; им особенно богаты молодые листья и кончики корней.
Образующиеся нитриты не накапливаются, а быстро восстанавливаются до NH4+ с помощью фермента – нитритредуктазы:
![]()
где ФД – ферредоксин – железосодержащий белок, выполняющий функции переносчика электронов.
Нитритредуктаза – фермент, активность которого в 5–20 раз выше, чем нитратредуктазы. Эффективность этого фермента так высока, что свободные промежуточные продукты при восстановлении NO2– до NН4+ (гипонитрит (HNО)2, гидроксиламин NН2ОН) в растении не накапливаются. Нитритредуктаза может содержаться и в листьях, и в корнях.
Аммиак, поступивший в растение извне, образовавшийся при восстановлении нитратов или в процессе фиксации молекулярного азота, далее усваивается растениями с образованием различных аминокислот и амидов. Таким образом, нитраты являются естественным азотистым компонентом растительного организма.
В то же время у животных и человека высокие дозы нитратов могут вызвать отравление и даже привести к смерти. Токсическое действие нитратов связано с восстановлением их до нитритов, аммиака, гидроксиламина под влиянием микрофлоры пищеварительного тракта и тканевых ферментов. Если в организм человека поступают высокие дозы нитратов, через 4–6 ч появляются тошнота, одышка, посинение кожных покровов, диарея. Одновременно ощущается общая слабость, головокружение, боли в затылке и сердцебиение. Первой медицинской помощью при этом является обильное промывание желудка, прием активированного угля и солевых слабительных. Употребление в течение долгого времени пищи и воды с высоким содержанием нитратов вызывает также аллергию, нарушение деятельности щитовидной железы, приводит к возникновению многочисленных болезней в результате нарушения обмена веществ, опорно-двигательного аппарата и нервной системы.
Чем же обусловлено такое токсическое действие на организм нитратов? Дело в том, что нитраты, превратившись в желудочно-кишечном тракте в нитриты, попадают в кровь и окисляют двухвалентное железо гемоглобина в трехвалентное. При этом образуется метгемоглобин, не способный переносить кислород к тканям и органам, в результате чего может наблюдаться удушье.
Выявлены два способа окисления гемоглобина HbFe2+. При прямом окислении роль окислителя играют нитрит-анионы:
3HbFe2+ + 2NO2– + 14H+ = 3HbFe3+ + 2NH3 + 4H2O.
Во время косвенного окисления гемоглобина сначала нитриты окисляются до нитратов с образованием пероксида водорода, затем последний вступает в реакцию с железом гемоглобина:
NO2– + О2 + Н2О = NO3– + Н2О2,
HbFe2+ + 2Н2О2 + 4Н+ = HbFe3++ 4Н2О.
Угрозой для жизни является накопление в крови 20% и более метгемоглобина (HbFe3+).
Наибольшая же опасность повышенного содержания нитратов в организме заключается в способности нитрит-иона участвовать в реакции нитрозирования аминов и амидов, в результате которой образуются нитрозосоединения, обладающие канцерогенным и мутагенным действием.
Образование нитрозосоединений происходит при взаимодействии азотистой кислоты с вторичными аминами как в продуктах питания в процессе их кулинарной обработки, так и внутри организма:
(R2)NH + НNO2 = (R)2N–NO + Н2О.
N-нитрозосоединения имеют общую структуру:
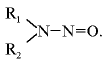
Их можно разделить на два класса с различными свойствами: нитрозамины, где R1 и R2 – алкильные или арильные группы, и нитрозамиды, где R1 – алкильная или арильная группа, R2 – ацильная группа.
Проведенные на животных опыты показали, что N-нитрозосоединения способствуют образованию опухолей во всех органах, кроме костей.
Чаще всего контролируют наличие в продуктах N-нитрозодиметиламина (НДМА) и N-нитрозодиэтиламина (НДЭА).
Допустимое суточное потребление нитратов для человека не должно превышать 5 мг на 1 кг массы тела, т. е. не более 350 мг в сутки для человека массой 70 кг.
В организм человека нитраты поступают (в %): с овощами – 70, с водой – 20, с мясными, молочными и консервированными продуктами – 6. Наиболее опасно отравление нитратами, растворимыми в воде, т. к. это увеличивает скорость всасывания их в кровь, поэтому содержание нитрат-аниона в воде не должно превышать 45 мг/л.
Содержание нитратов и нитритов в продуктах животноводства невелико, например в молоке и молочных продуктах их содержится не более 10 мг/кг. Нитраты и нитриты используют как консерванты при производстве сыров, и их суммарное содержание не превышает 50 мг/кг. При изготовлении ветчинно-колбасных изделий нитраты и нитриты добавляют не только для подавления деятельности болезнетворных бактерий, но и для того, чтобы придать мясным изделиям красно-коричневый оттенок. Содержание этих веществ в мясной продукции также не представляет опасности для здоровья людей (нитраты – 1–5 мг/кг, нитриты – 0,8–2,2 мг/кг).
Больше всего нитратов в организм человека поступает с овощами и картофелем. Это послужило причиной того, что во многих странах мира, в том числе и в нашей, в 1988 г. были разработаны предельно допустимые концентрации (ПДК) нитратов в сельскохозяйственной продукции. ПДК нитратов в овощной продукции разных стран колеблются в значительных пределах, причем у нас установлены самые низкие ПДК по сравнению с зарубежными странами.
В табл. 1 (см. с. 2) приведены данные, характеризующие способность различных сельскохозяйственных культур накапливать нитраты.
Следует отметить, что содержание нитратов в разных частях растений неодинаково. Больше всего нитратов в тех частях растения, которые содержат большое количество тканей, служащих для проведения воды и минеральных солей к листьям и органам (ксилемные ткани). В жилках листьев, листовых черешках, стеблях нитратов больше, чем в мякоти листьев и плодах; в кожице и поверхностных слоях плодов они преобладают над внутренними слоями; в генеративных органах (органы полового размножения растений) эти вещества отсутствуют или имеются в меньших количествах, чем в вегетативных.
Меняется содержание нитратов в растениях и в течение суток. Это объясняется интенсивностью восстановления нитрат-ионов до аммиака. Ночью и рано утром активность ферментов, участвующих в восстановлении NО3–, низка, что ведет к их накоплению. С повышением температуры и интенсивности освещения активность этих ферментов, в первую очередь нитратредуктазы, возрастает, что ведет к снижению содержания нитратов. В связи с этим сбор овощей лучше вести днем, когда содержание NО3– уменьшается на 30–40% по сравнению с утренними часами.
Уменьшается количество нитратов и при хранении овощей и фруктов. Например, во время зимнего хранения содержание нитратов в картофеле снижается на 20%. В первый период хранения происходит послеуборочное дозревание, и нитрат-анионы, восстановившись до аммиака, включаются в состав органического вещества. Во второй период хранения, когда клубень выходит из состояния покоя и начинает прорастать, нитраты расходуются на построение новых органов (листья, корни).
Агробиологи насчитывают около 30–40 факторов, влияющих на накопление нитратов в растениях, основным из которых является чрезмерное внесение удобрений, особенно их нитратных форм (аммиачная, калийная, натриевая селитра). Подкармливать растения лучше амидными или аммонийными формами удобрений (карбамид или мочевина, сульфат аммония), т. к. аммиачный азот поглощается растениями и сразу включается в аминокислоты и белки без накопления нитратов.
Увеличение количества нитратов в продукции можно получить и при избыточном удобрении почвы органикой. Важный фактор регулирования содержания NО3– – совместное применение органических и минеральных удобрений. Уменьшение содержания нитрат-ионов при этом связано с тем, что органические удобрения обогащают почвы полезной микрофлорой, которая временно поглощает лишний азот, стимулируя тем самым замедление процесса нитрификации в почве в начальный период развития растений.
Таблица 1 Содержание нитратов, мг/кг сырой массы товарной части растения

Подкормка азотом незадолго (за 1–2 недели) до уборки урожая также ведет к увеличению содержания нитратов в растительной продукции. Наоборот, чем больше срок между внесением удобрений и уборкой урожая, тем меньше NО3– содержится в растении. Наиболее эффективны подкормки азотом в период интенсивного роста растений. В это время азот быстро вовлекается в процесс роста и поэтому не накапливается в виде нитратов. При снижении интенсивности роста, вызванном старением растения или действием неблагоприятных внешних факторов, азот перестает вовлекаться в обмен веществ и накапливается в виде NО3–-ионов.
Хороший эффект дает применение медленно действующих форм азотных удобрений (карбамидформ урамик, оксамид, уреа–Z и др.), которые, постепенно растворяясь, обеспечивают более равномерное азотное питание растений.
Наряду c азотом для нормального роста и развития растений необходимы фосфор и калий. При дефиците этих питательных элементов затормаживается образование органического вещества в процессе фотосинтеза, в результате чего снижается расход поступившего азота на процессы роста. Это приводит к увеличению концентрации нитратного азота в органах растений. Следует избегать одностороннего преобладания минерального азота: его надо использовать с учетом обеспеченности растений фосфором, калием и другими элементами.
Из микроэлементов наиболее важным для предотвращения накопления нитратов является молибден, т. к. этот металл входит в состав нитратредуктазы и, следовательно, принимает участие в восстановлении нитратов.
Из остальных агротехнических факторов выращивания растений немаловажное влияние на концентрацию нитратов оказывают освещенность, влагообеспеченность, температура выращивания и сроки уборки урожая.
При слабой освещенности нитраты не полностью превращаются в аминокислоты, особенно в листовых овощах, редисе, огурцах, выращиваемых в закрытом грунте. При посадке овощных культур не следует заглушать посевы, необходимо следить за правильным формированием растений, не допуская избыточной листовой массы.
В засушливые годы при внесении высоких доз азотных удобрений в почву растения накапливают больше нитратов, поэтому необходим регулярный полив овощей, чтобы азотное питание было умеренным и равномерным.
Температурный фактор особенно влияет на содержание нитратов у растений, выращенных в условиях короткого светового дня (редис, салат, шпинат, лук). Если в теплице поддерживается умеренная температура (13–23 °С), то овощи содержат меньше нитратов, чем при более низкой (8–18 °С) или более высокой (20–28 °С) температуре.
Помните, что в недозрелых овощах содержание нитратов значительно выше, чем в спелых. Однако не следует допускать и перезревания овощей. Часто переросшие корнеплоды столовой свеклы, кабачки содержат повышенное количество нитратов. У моркови лучшее качество корнеплода отмечено при массе его 100–200 г.
Накопление нитратов различными культурами имеет наследственно закрепленный характер, т. е. они обладают сортовой спецификой, которая выявлена у ряда овощных культур. Сортовые различия могут быть обусловлены разной реакцией на условия окружающей среды и режимом минерального питания, а также генетически закрепленным уровнем активности нитратредуктазы, разной продолжительностью вегетационного периода сортов. Безусловно, каждый сорт любой культуры уникален по своим характеристикам, в том числе и по способности накапливать нитраты. Однако можно выделить некоторые общие тенденции:
· ранние сорта овощей содержат больше нитратов, чем поздние;
· овощи закрытого грунта склонны к большему накоплению нитратов, чем открытого;
· пчелоопыляемые гибриды огурца накапливают нитратов вполовину меньше, чем партенокарпические (самоопыляемые);
· из партенокарпических гибридов огурца короткоплодные накапливают нитратов примерно на 17% больше, чем длинноплодные;
· более ярко окрашенные сорта корнеплодов (в частности, морковь) содержат NO3– меньше, чем бледно окрашенные;
· сорта зеленой стручковой фасоли склонны к накоплению большего количества нитратов, чем желтой.
В табл. 2 указаны сорта некоторых овощных культур, в которых содержание нитратов в период сбора урожая значительно отличается друг от друга.
Таблица 2 Сорта и гибриды овощей, отличающиеся содержанием нитратов в период сбора урожая

От избытка нитратов в овощной продукции можно избавиться и после сбора урожая. При варке, бланшировании, консервировании, солении, квашении и очистке уровень нитратов в овощах и фруктах значительно снижается. Так, очистка картофеля от кожуры снижает концентрацию NO3– примерно на 30–40%. При приготовлении овощей в пищу, особенно при употреблении их в свежем виде, места концентрации нитратов (кожура, плодоножки, сердцевины корнеплодов, черешки, места переходов корнеплодов в корни, кочерыги) надо удалять.
Квашение, консервирование, соление, маринование имеют свою специфику в случае изменения уровня нитрат-ионов в овощах. Первые 3–4 дня идет усиленный процесс восстановления нитратов до нитритов, поэтому нельзя употреблять свежезасоленные капусту, огурцы и другие овощи раньше, чем через 10–15 дней.
При длительном (в течение 2 ч) вымачивании листовых овощей из них вымывается 15–20% NO3–.
Чтобы снизить на 25–30% содержание нитратов в корнеплодах и капусте, достаточно в течение часа подержать их в воде, предварительно нарезав на небольшие кусочки.
При варке картофель теряет NO3– до 80%, морковь, капуста, брюква – до 70%, столовая свекла – до 40%.
Наличие повышенного содержания нитратов в зелени обезвреживается значительным количеством в ней аскорбиновой кислоты (витамин С), поэтому полезно вводить свежую зелень в состав овощных блюд.
Салаты и плодоовощные соки желательно употреблять свежеприготовленными. Хранение их не очень длительное время даже в холодильнике способствует размножению в них микрофлоры, восстанавливающей NO3– -ионы до опасных для человека NO2– -ионов.
Глава 2. ЛАБОРАТОРНЫЕ МЕТОДЫ ОБНАРУЖЕНИЕ НИТРАТОВ В РАСТЕНИЯХ
Последнее время весьма актуальной стала проблема, связанная с контролем содержания нитратов в сельскохозяйственных растениях. Серьезный разговор по этой проблеме сегодня ведется на страницах прессы, по радио, телевидению. Высок интерес к ней и школьников. В связи с этим мы считаем целесообразным проведение в школе на уроках биологии лабораторного занятия по обнаружению нитратов в растениях.
Такое занятие было проведено нами с учащимися IX—X классов средней школы № 95 г. Харькова, занимающихся углубленным изучением биологии. Лабораторные и практические занятия в этих классах проводятся на базе кафедры ботаники естественного факультета Харьковского государственного педагогического института. Однако опыты по обнаружению нитратов могут быть успешно осуществлены и в школьных условиях, а результаты использоваться на уроках, при проведении деловой или ролевой игры по экологии.
После сообщения темы занятия учащимся предлагаются следующие вопросы: назовите и запишите на доске формулы известных вам неорганических соединений азота. Что такое нитраты? Каковы источники азота в почве? (Учащиеся называли фиксацию азота атмосферы симбиотическими и несимбиотическими азотофиксаторами; разложение органических веществ животного и растительного происхождения, минеральные удобрения.)
Далее следует рассказ учителя о путях превращения нитратов в растениях, об условиях, необходимых для этого превращения. Учитель сообщает, что корневые системы растений хорошо усваивают нитраты. В растении происходит восстановление нитратов до аммиака. (Учитель записывает на доске схему этого восстановления — см. схему № 1.) Он сообщает также, что в восстановлении нитратов принимают участие ферменты и углеводы. Аммиак, образующийся в процессе восстановления, реагирует с некоторыми органическими кислотами (пировиноградной, щавелевоуксусной и др.).
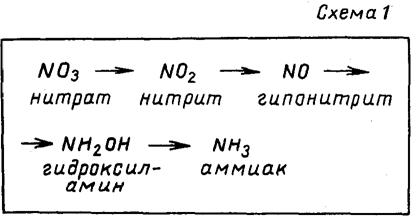
В результате такого взаимодействия образуются триаминокислоты: глутаминовая, аспарагиновая и аланин. Этот процесс носит название первичного амминирования. Учащиеся вспоминают, что такое аминокислоты, сколько аминокислот известно. Учитель сообщает также, что аминокислоты, которые образуются в результате первичного амминирования, и их производные — амиды являются материалом для построения остальных 17 аминокислот в процессах пере-амминирования (см. схему № 2). Если по каким-либо причинам цепь этих превращений нарушается (например, в результате избытка азотных удобрений в почве), то нитраты не успевают полностью превратиться в аминокислоты. Часть их может пройти через паренхиму корня, подняться с восходящим током и отложиться в различных органах растения. Аминокислоты безвредны, они являются строительным материалом для белков, из которых построено все живое на Земле. Нитраты же в больших количествах вредны. В желудочно-кишечном тракте они превращаются в соли азотистой кислоты — нитриты, которые отравляют организм. При этом снижается работоспособность человека, возникает головокружение и даже потеря сознания, в крови увеличивается содержание молочной кислоты, холестерина, лейкоцитов, снижается количество белков, блокируется гемоглобин; нитриты могут вступать во взаимодействие с гемоглобином, образуя метгемогло-бин (вещество, угнетающее дыхательный центр).
После сообщения учителя и беседы с учащимися проводится лабораторное занятие. Школьникам предлагается, используя специальную методику, определить примерное содержание нитратов в листьях капусты белокочанной, в корнеплодах моркови, в клубне картофеля, в яблоке, тыкве; зафиксировать полученные результаты и сделать вывод.

нитрат растение влияние организм
Материал и оборудование
Раствор дифениламина в серной кислоте (0,1 г дифениламина растворяют в 10 мл крепкой серной кислоты), который хранят в темной склянке; пипетки; ступка с пестиком; предметное стекло; стеклянная палочка; растительные объекты, в которых будут определяться нитраты.
Определение нитрат иона в почве
Приготовление водной вытяжки
Водные вытяжки могут быть приготовлены при любом соотношении воды и почвы (или грунта). Однако принято готовить водные вытяжки при соотношении 1:5, т.е. на 1 часть навески брать 5 частей воды. Берут 30 г почвы и 150 мл дистиллированной воды. Затем производили перемешивание на магнитной мешалке в течение 10 минут и фильтровали через плотный бумажный фильтр (синяя лента).
Колориметрическое определение нитрат иона с салицилатом натрия.
Определение основано на реакции нитратов с салицилатом натрия в среде серной кислоты, сопровождающейся образованием окрашенной в желтый цвет соли нитросалициловой кислоты без разбавления можно определить 0,1 до 20 мг/л NОз-.
Ход определения: к V1 = 10 мл пробы прибавляют 1 мл раствора салицилата натрия и выпаривают в фарфоровой чашке на водяной бане досуха. После охлаждения сухой остаток увлажняют 1 мл серной кислоты и оставляют на 10 минут. Содержимое чашки разбавляют дистиллированной водой, переносят количественно в мерную колбу V = 50 мл, прибавляют 7 мл 10 н раствора NаОН, доводят дистиллированной водой до метки и тщательно перемешивают. После охлаждения до комнатной температуры вновь доводят объем до метки и окрашенный раствор колориметрируют при lmax = 400 нм. По значению оптической плотности из калибровочного графика (построение калибровочного графика проводится с использование стандартных растворов) находим концентрацию NO3- в мг/л.
Определение нитрат-иона в овощах
Экстракция нитратов из овощей
При анализе всех культур, кроме, капусты, отбирают пипеткой 10 мл сока в стакан вместимостью 100 мл, приливают 50 мл раствора алюмокалиевых квасцов (1% экстрагирующий раствор), перемешивают и получают готовую для ионометрического исследования пробу.
При анализе капусты отбирают10 мл сока в стакан вместимостью 100 мл прибавляют 50 мл экстрагирующего раствора приготовленного для капусты (растворяют 10 г алюмокалиевых квасцов в дистиллированной воде, затем добавляют 1 г марганцовокислого калия, добавляют 0,5 мл концентрированной серной кислоты и доводят водой до 1 литра) перемешивают в течение 3 минут. Затем при перемешивании добавляют по каплям (3-5капепь) 33%раствор перекиси водорода до обесцвечивания раствора, после чего получают готовую к проведению анализов пробу.
Измерение концентрации нитрат-иона с помощью ионселективных электродов.
Перед измерениями прибор (Ионометр ЭВ-74) калибруется по стандартным приготовленным растворам KNO3.
После подготовки прибора к измерениям (калибровки) в стаканчик с готовой пробой опускаются электрод сравнения (хлорсеребряный) и электрод измерения (нитратный) и затем снимают показания прибора.
Для перевода концентрации нитрат иона в массовую долю нитратов в мг/кг используют специальные таблицы [5], взятые из методического руководства. Полученные значения концентраций нитрат иона сравнивают с ПДК нитратов в продуктах растениеводства, приведенных в этом же руководстве и делают заключение о качестве овощей.
Экспериментальные результаты и их обсуждение
Проанализируем результаты согласно поставленной цели, т.е. сначала поговорим о содержании нитратов в овощах и о распределение нитратов по зонам, а потом о влиянии нитратов содержащихся в почве на количество нитратов присутствующих в растениях.
Для проведения исследований о содержании нитратов и зонном распределении нами были взяты кабачок, свекла, огурец и капуста. Пробы для двух различных анализов были взяты в соответствии с рекомендациями.
Все овощи разрезается по горизонтальной (кабачки и огурцы) или вертикальной (свекла и капуста) оси. Затем две диагональные четверти трутся на пластмассовой терке и из них отжимается сок для анализа на содержание нитрата в овоще. А две другие делятся на зоны и из каждой зоны готовится сок, а затем анализируется.
Анализы на нитраты были проведены в соответствии с приведенными методиками. Таким образом были получены результаты, которые для наглядности представлены в виде таблицы №1 «Содержание нитратов в овощах» и №2 «Распределение нитратов по зонам в овощах» также см. Приложение I (зоны считать: огурец и кабачок от плодоножки; свекла от корня; капуста: кочерыжка – 1, центр – 2 и наружные зеленые листья – 3)
Таблица №1. Содержание нитратов в овощах.
|
Название овоща |
Концентрация нитрат иона, мг/кг |
ПДК, мг/кг |
| Огурцы | 50 | 150 |
| Кабачок | 304 | 400 |
| Свекла | 510 | 1400 |
| Капуста | 452 | 500 |
Таблица №2. Распределение нитратов по зонам, мг/кг.
|
Зоны |
Огурец |
Кабачок |
Свекла |
Капуста |
|
1 |
78 | 370 | 935 | 461 |
|
2 |
65 | 249 | 545 | 277 |
|
3 |
56 | 216 | 457 | 449 |
|
4 |
51 | 205 | 410 | |
|
5 |
49 | 198 | 492 | |
|
6 |
47 | 200 | 431 | |
|
7 |
40 | |||
|
ПДК |
150 | 400 | 1400 | 500 |
По результатам исследований распределение нитратов сходны у огурца и кабачка, т.е. их концентрация повышается в направление от верхней части плода, где был цветок, к плодоножке, где достигает максимального значения. У свеклы так же концентрация нитратов повышается от верхней части корнеплода к корню. У капусты же концентрация пульсирует максимум в кочерыжке, чуть меньше в зеленых верхних листьях и почти в полтора раза меньше в центре.
Таким образом чтобы при употреблении пищи избавиться от лишних нитратов следует срезать те части овощей в которых их концентрация максимальна. То есть в капусте это кочерыжка и зеленые верхние листья, в корнеплодах это низ (корень), а в огурцах и кабачках это место крепления плодоножки. Кроме этого желательно учесть время сбора, температурный режим (в теплые дни нитратов в растениях больше, чем в холодные), а также размер и сорта овощеводческих культур.
Теперь поговорим о взаимосвязи питания (азотного) растений с тем сколько нитратов оно будет содержать после снятия его с корня.
Эксперимент проводился в течение 2,5 месяцев следующим образом: до посадки была отобрана проба почвы на азот, затем были посажены четыре кустика капусты, каждый из которых поливали следующим образом: №1 – водой, №2 – мочевиной, №3 – селитрой, №4 – вытяжкой из навоза (фотографии, сделанные в процессе эксперимента, в Приложении II) после снятия кочанов была проанализирована земля из под каждого растения. В процессе роста с капусты снимались верхние листы и анализировались на содержание нитратов первый раз через 4 недели после посадки, второй и третий через 6 и 8 со дня посадки и последний раз через 11 недель. Конечно по результатам эксперимента нельзя судить о содержании нитратов в капусте (в верхних зеленых листьях концентрация повышена), но о динамике изменений и о различиях связанных с разным поливом говорить можно.
Таблица №3. Содержание нитратов в почве.
|
Проба |
N, мг/кг |
| Почва до посадки | 19,40 |
| Почва, поливаемая водой | 18,06 |
| Почва, поливаемая мочевиной | 73,39 |
| Почва, поливаемая силитрой | 203,23 |
| Почва, поливаемая вытяжкой из навоза | 32,74 |
| Средние содержание от малого до хорошего | £ 40 до 60 |
В таблице приведены значения содержания нитратного азота в почве (измерена концентрация нитратов и затем переведена в массовое содержание элемента азота в почве).
Таблица №4. Содержание нитратов в капустных листьях.
| Проба |
Содержание NO3-, мг/кг |
||||
| 30.06 | 29.07 | 12.08 | 26.08 | 16.09 | |
| 1. Вода | 750 | 1800 | 1405 | 1126 | 614 |
| 2. Мочевина | 1059 | 7499 | 5306 | 5300 | 3301 |
| 3. Селитра | 1188 | 8410 | 5306 | 5301 | 4620 |
| 4. Вытяжка из навоза | 944 | 6680 | 3757 | 3348 | 2230 |
| ПДК | 900 | 900 | 900 | 900 | 500 |
ЛИТЕРАТУРА
1. Дискаленко А.П., Опополь Н.И., Добрянская Е.В., Трофименко Ю.Н. Охрана природы в условиях интенсивной химизации сельскохозяйственного производства. – Кишинев, 1983.
2. Зарубин Г.П., Дмитриев М.Т., Приходько Е.И., Мищихин В.А. Гигиена и санитария – 1984. - №7.
3. Кауричев И.С. Почвоведение. – М.: Агропромиздат, 1989.
4. Лурье Ю.Ю. Унифицированные методы анализа вод. –М.: Химия 1973.
5. Методические указания по определению нитратов и нитритов в продукции растениеводства, Москва 1989г.


| Безопасность жизнедеятельности и здоровье человека | |
|
Воздушная среда закрытых помещений Воздушная среда современных жилых зданий имеет многокомпонентный химический состав, зависящий от степени ... Изучение воздушной среды газифицированных помещений показало, что при горении газа в воздухе помещений концентрация веществ составляла: окись углерода, в среднем - 15 мг/м3 ... Существует такой показатель как перманганатная окисляемость (норматив 5 мг О2/л, не более, это общая концентрация кислорода, соответствующая количеству иона перманганата (МnО4 ... |
Раздел: Рефераты по безопасности жизнедеятельности Тип: учебное пособие |
| Земледелие | |
|
Содержание Введение........................2 Глава I Краткая характеристика агроклиматических условий Зауралья...3 Глава II Факторы жизни растений и ... При благоприятных условиях нитрификации, например в паровом поле на черноземах, может накапливаться от 30 до 50 мг и более нитратного азота на 1 кг почвы, что соответствует 90- 150 ... Приближенно содержание этого элемента в доступной форме устанавливают химическими методами, в частности методом Тюрина - Кононовой, которым определяется в почве содержание ... |
Раздел: Рефераты по технологии Тип: реферат |
| Чем опасны нитраты? | |
|
Содержание 1. Нитраты и болезни людей 2. Нитраты как социально - экономическая проблема 3. Метаболизм нитратов в организме человека 4. Отравление ... Подобная закономерность обнаружена на пойменной почве с капустой, морковью, столовой свеклой, В то же время в других случаях применение калийных удобрении повышало содержание ... Эффективным средством снижения содержания нитратов в растении являются ингибиторы нитрификации (сероуглерод, дициандиамиддидин, КМП), использование которых даже при высоком уровне ... |
Раздел: Рефераты по медицине Тип: курсовая работа |
| Изучение влияния соединений тяжёлых металлов на почву и растения (на ... | |
|
Оглавление Введение 1. Тяжёлые металлы в почве и методы изучения их подвижности 1.1 Механизмы поглощения и трансформации ионов тяжёлых металлов ... 3. Методом биоиндикации изучить эффективность различных способов снижения фитотоксичности ионов ТМ в системе "почва - растение". Ионы металлов вводили в почву в количествах, кратных 20 ПДК и 60 ПДК (ПДК Cd (II) = 3 мг/кг [18], ПДК Pb (II) = 1 мг/кг [13]) по схеме: |
Раздел: Рефераты по ботанике и сельскому хозяйству Тип: дипломная работа |
| Свойства азота | |
|
Abstract Given term paper contains in itself description of the chemistries of the nitrogen and some its join. Comprises of it 33 pages, 17 points, is ... При этом оставшийся азот высвобождается в виде аммиака (NH3) или ионов аммония (NH4+) Из сложных неорганических соединений азота наибольшее значение имеют азотная кислота HNO3, ее соли нитраты, а также азотистая кислота HNO2 и ее соли нитриты. |
Раздел: Рефераты по химии Тип: курсовая работа |