Учебное пособие: Респираторный дистресс-синдром у новорожденных
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ УЗБЕКИСТАН
ТАШКЕНТСКИЙ ПЕДИАТРИЧЕСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ
РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ У НОВОРОЖДЕННЫХ
Методические рекомендации
Ташкент - 2010
Составители:
Гулямова М.А., Рудницкая С.В., Исмаилова М.А.,
Ходжиметова Ш.Х., Амизян Н.М., Рахманкулова З.Ж.
Рецензенты:
1. Мухамедова Х. Т.д. м. н., профессор, зав. кафедрой Неонатологии ТашИУВ
2. Джубатова Р.С. д. м. н., директор РСНПМЦ Педиатрии
3. Шомансурова Э.А. доцент, зав. кафедрой Амбулаторной медицины ТашПМИ
"Респираторный дистресс-синдром у новорожденных"
Методические рекомендации предназначены для магистров и врачей-неонатологов.
Методические рекомендации утверждены:
1. На Проблемной комиссии педиатрического совета ТашПМИ, протокол №
2. На Ученом совете ТашПМИ, протокол №
Секретарь Ученого совета Шомансурова Э.А.
Список сокращений
CPAP - continuous positive airway pressure
FiO2 - содержание кислорода во вдыхаемой смеси
PaCO2 - парциальное давление углекислого газа в артериальной крови
PaO2 - парциальное давление кислорода в артериальной крови
PCO2 - парциальное давление углекислого газа в смешанной (капиллярной) крови
PIP - (ПВД) пиковое (верхняя граница) давления на вдохе
PO2 - парциальное давление кислорода в смешанной (капиллярной) крови
SaO2 - показатель насыщения гемоглобина кислородом, измеренный в артериальной крови
SpO2 - показатель насыщения гемоглобина кислородом, измеренный чрезкожным датчиком
АД - артериальное давление
БГМ - болезнь гиалиновых мембран
БЛД - бронхолегочная дисплазия
ВЧО ИВЛ - высокочастотная осцилляторная искусственная вентиляция легких
ДВС - диссеминированное внутрисосудистое свертывание
ДН - дыхательная недостаточность
ДО - дыхательный объем
ЖКТ - желудочно-кишечный тракт
ИВЛ - искусственная вентиляция легких
ИЭЛ - интерстициальная легочная эмфизема
КОС - кислотно-основное состояние
Л/С - лецитин/сфингомиелин
МАР - среднее давление в дыхательных путях, см. вод. ст.
МОС - система цитохрома Р-450
ПОЛ - перекисное окисление липидов
РАСПМ - Российская ассоциация специалистов перинатальной медицины
РДС - респираторный дистресс - синдром
САМ - синдром аспирации меконием
СДР - синдром дыхательных расстройств
ССН - сердечно-сосудистая недостаточность
СУВ - синдром утечки воздуха
ТБД - трахеобронхиальное дерево
ФОЕ - функциональная остаточная ёмкость легких
ЦНС - центральная нервная система
ЧДД - частота дыхательных движений
ЭКГ - электрокардиограмма
ЯНЭК - язвено-некротический энтероколит
Определение
РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ (англ. distress тяжелое недомогание, страдание; лат. respiratio дыхание; синдром - совокупность типовых симптомов) - неинфекционные патологические процессы (первичные ателектазы, болезнь гиалиновых мембран, отечно-геморрагический синдром), формирующиеся в пренатальном и раннем неонатальном периодах развития ребенка и проявляющиеся нарушением дыхания. Симптомокомплекс тяжелой дыхательной недостаточности, возникающий в первые часы жизни ребенка в связи с развитием первичных ателектазов легких, гиалиново-мембранной болезни, отечно-геморрагического синдрома. Чаще встречается у недоношенных и незрелых новорожденных детей.
Частота развития респираторного дистресса зависят от степени недонашивания, и составляет в среднем 60% у детей, родившихся при сроке беременности менее 28 нед., 15-20% - при сроке 32-36 нед. и 5% - при сроке 37 нед. и более. При рациональном выхаживании таких детей летальность приближается к 10%.
Эпидемиология.
РДС является наиболее частой причиной возникновения дыхательной недостаточности в раннем неонатальном периоде. Встречаемость его тем выше, чем меньше гестационный возраст и масса тела ребёнка при рождении. Однако на частоту встречаемости РДС сильно влияют методы пренатальной профилактики при угрозе преждевременных родов.
У детей, родившихся ранее 30 недель гестации и не получавших пренатальной профилактики стероидными гормонами, его частота составляет около 65%, при наличии пренатальной профилактики - 35%; у детей, родившихся на сроке гестации 30-34 недели без профилактики - 25%, при наличии профилактики - 10%.
У недоношенных детей, родившихся на сроке более 34 недель гестации, его частота не зависит от пренатальной профилактики и составляет менее 5%. (Володин Н.Н. и соавт. 2007)
Этиология.
· дефицит образования и выброса сурфактанта;
· качественный дефект сурфактанта;
· ингибирование и разрушение сурфактанта;
· незрелость структуры легочной ткани.
Факторы риска.
Факторами риска РДС являются все состояния, приводящие к дефициту сурфактанта и незрелости легких, а именно: асфиксия плода и новорожденного, морфо-функциональная незрелость, нарушение легочно-сердечной адаптации, легочная гипертензия, обменные нарушения (ацидоз, гипопротеинемия, гипоферментоз, изменения электролитного обмена) [8], не леченный сахарный диабет беременной, кровотечения у беременных, кесарево сечение, мужской пол новорожденного и рождение вторым из двойни.
Внутриутробное развитие легких.
Система трахеобронхиального дерева начинается как зачаток легкого, которое в последующем непрерывно делится и развивается, проникая в мезенхиму, и расширяется к периферии. Этот процесс проходит 5 фаз развития (рис.1):
1. Эмбриональная фаза (< 5 недели)
2. Псевдограндулярная фаза (5-16 недели)
3. Каналикулярная фаза (17-24 недели)
4. Фаза развития терминального мешка (24-37 недели)
5. Альвеолярная фаза (с конца 37 недели до 3 лет).
Зачаток респираторного тракта появляется у 24-дневного эмбриона, в последующие 3 дня формируются два первичных бронха. Первые хрящевые элементы в бронхах появляются на 10-й неделе, а на 16-й неделе практически заканчивается внутриутробное формирование всех генераций бронхиального дерева, хотя хрящи продолжают появляться до 24-й недели гестационного периода.
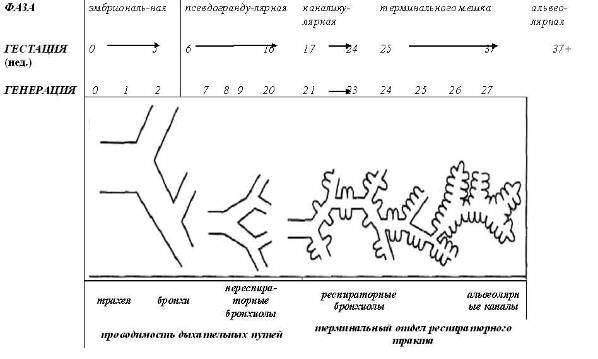
Рисунок 1. Пять фаз развития трахеобронхиальных дыхательных путей. (adapted from Weibel ER: Morphomeiry of the Human Lung. Berlin, Springer-Verlag, 1963.)
Асимметрия главных бронхов отмечается унте с первых дней их развития; зачатки долевых бронхов различимы у зародыша 32 дней, а сегментарных - 36 дней. К 12-и неделе легочные доли уже различимы.
Дифференцировка легочной ткани начинается с 18-20-й педели, когда возникают альвеолы с капиллярами в стенках. В возрасте 20 нед обычно накапчивается и канализация бронхов, просвет которых выстилает кубический эпителий.
Альвеолы возникают как выросты на бронхиолах, причем с 28-й недели они увеличиваются в числе. Поскольку новые альвеолы могут формироваться в течение всего внутриутробного периода, в легких новорожденных можно обнаружить концевые воздушные пространства, выстланные кубическим эпителием.
Зачаток легкого кровоснабжается вначале через парные сегментарные артерии, отходящие от дорсальной части аорты. Сосудистые элементы легкого начинают формироваться из мезенхимы с 20-недельпого возраста как ветви этих артерий. Постепенно легочные капилляры теряют связь с сегментарными артериями, и их кровоснабжение обеспечивается ветвями легочной артерии, которые в целом следуют за ветвлением дыхательной трубки. Анастомозы между системой легочной и бронхиальной артерий сохраняются до рождения и у недоношенных детей первых недель жизни могут функционировать.
Уже у эмбриона 28-30 дней кровь из легких оттекает в левое предсердие, где формируется венозный синус.
На 26-28-й неделе внутриутробного периода капиллярная сеть легкого тесно смыкается с альвеолярной поверхностью; э этого момента легкое приобретает способность к газообмену.
Развитие артерий легкого сопровождается прогрессивным увеличением их просвета, который вначале не превышает нескольких микрометров. Просвет долевых артерий увеличивается лишь на 10-й неделе внутриутробного периода, а просвет терминальных и респираторных артериол - только на 36-38-й неделе. Относительное увеличение просвета артерий наблюдается в течение первого года жизни.
Лимфатические сосуды, окружающие бронхи, артерии и вены, к моменту рождения достигают альвеол; эта система закладывается у 60-дпевного вибриона.
Слизистые железы в трахее закладываются путем вторичной инвагинации эпителия на 7-8-й неделе, бокаловидные клетки - на 13-14-й неделе. На 26-й неделе внутриутробной жизни слизистые железы начинают выделять слизь, содержащую кислые гликозаминогликаны (мукополисахариды).
Реснички эпителия в трахее и главных бронхах возникают о 10-й, а в периферических бронхах - с 13-й недели. В бронхиолах наряду с клетками реснитчатого эпителия имеются цилиндрические клетки, содержащие в верхушечной части секреторные гранулы.
Наиболее периферический слой внутренней выстилки респираторного тракта представлен альвеолоцитами двух типов, появляющихся с 6-го месяца внутриутробного периода. Альвеолоциты I типа покрывают до 95% поверхности альвеол; остаток площади занимают альвеолоциты II типа, имеющие развитый пластинчатый комплекс (аппарат Гольджи), митохондрии и осмиофильные включения. Основная функция последних - продукция сурфактанта, который появляется у плодов массой 500-1200 г; дефицит сурфактанта тем выше, чем меньше гестационный возраст новорожденного. Сурфактант в первую очередь образуется в верхних долях, затем в нижних.
Другой функцией альвеолоцитов II типа является пролиферация и трансформация в альвеолоциты I типа при повреждении последних.
Сурфактант, продуцируемый альвеолоцитами II типа, основу которого составляют фосфолипиды (главным образом дипальмитоил фосфатидилхолин), выполняет важнейшую функцию - стабилизирует терминальные воздухсодержащие пространства. Образуя тонкую сплошную выстилку альвеол, сурфактант изменяет поверхностное натяжение в зависимости от радиуса альвеол. При увеличении радиуса альвеол на вдохе поверхностное натяжение возрастает до 40-50 дин/см, существенно повышая эластическое сопротивление дыханию. При низких объемах альвеол натяжение падает до 1-5 дин/см, что обеспечивает стабильность альвеол на выдохе. Дефицит сурфактанта у недоношенных детей является одной из ведущих причин РДС.
Синтез сурфактанта.
Сурфактант (Surfactant (англ.) - Surface Active Agent) - поверхностно-активное вещество, синтезируемое альвеолоцитами II типа (покрывающими около 3% поверхности альвеол) и безволосковыми бронхиолярными клетками (клетки Клара). Он на 90% состоит из липидов и 10 % сухого веса сурфактанта - белки. Липиды на 90 % состоят из фосфолипидов: фосфатидилхолин (лецитин) - 70 % (4 5 - 5 0 % - окисленный, насыщенный и 20 - 25 % - ненасыщенный), фосфатидилглицерол - 6% и другие фосфолипиды - 6 %; 10% - нейтральные липиды. Белки: протеины А, В, С, D.
Сурфактант обладает следующими основными функциями:
· препятствует спадению альвеол на выдохе;
· защищает альвеолярный эпителий от повреждений и способствует мукоцилиарному клиренсу;
· обладает бактерицидной активностью против грамположительных микробов и стимулирует макрофагальную реакцию в легких;
· участвует в регуляции микроциркуляции в легких и проницаемости стенок альвеол, препятствует развитию отека легких.
Важную роль в выполнении указанных функций сурфактанта играют белки, из которых A (SpA) и D (SpD) - гидрофильные - вовлекаются в защитные механизмы организма ребенка (не содержатся в сурфактантах легких животных), а протеины В (SpB) и С (SpC) - гидрофобные - снижают поверхностное натяжение альвеол за счет стимуляции абсорбции фосфолипидов на поверхности аэрогематического барьера и способствуют равномерному распределению сурфактанта на поверхности альвеол (содержатся в сурфактантах, полученных из легких животных). Гены, определяющие синтез сурфактантных белков SpA и SpD, находятся на 10-й хромосоме, a SpB - на 2-й и SpC - на 8-й. SpA появляется в околоплодной жидкости человека на 19-й неделе гестации, a SpB - на 31-й; в дальнейшем уровень их непрерывно нарастает.
При этом согласно современным представлениям, наиболее важным среди этих белков является сурфактантный протеин В, ибо его наследственный или врожденный дефицит является летальным для человека. Наследуется дефицит SpB по ayтосомно-рецессивному типу и проявляется у доношенных детей клиникой типичного РДС недоношенных с длительной потребностью в ИВЛ. Заместительная терапия животными сурфактантами оказывает лишь транзиторный эффект. Возможное лечение - трансплантация легких.
Синтез сурфактантных протеинов стимулируют глюкокортикоиды, тиреоидные гормоны, эстрогены, адреналин и норадреналин, тормозит - инсулин.
Сурфактант начинает вырабатываться у плода с 20 - 24-й недели внутриутробного развития альвеолярными клетками II типа. Он накапливается в них в виде осмиофильных гранул, мигрирующих на поверхности альвеол, где образует тонкую пленку в гипофазе. Особенно интенсивный сброс сурфактанта происходит в момент родов, что способствует процессу первичного расправления легких. Период полураспада сурфактанта - 10 - 20 ч.
Существуют два пути синтеза основного фосфолипидного компонента - фосфатидилхолина (лецитина):
1) метилирование фосфатидилэтаноламина (кефалина) при помощи метилтрансферазы (источник метильной группы метионин);
2) синтезирование из цитидиндифосфатхолина в присутствии фосфохолинтрансферазы, вступающего в реакцию с диглицеридом.
Установлено, что до 33-35-й недели внутриутробного развития синтез сурфактанта в основном осуществляется путем метилирования этаноламина, а позднее - при помощи фосфатидилхолинтрансферазы.
Первый путь синтеза сурфактанта легко истощается под влиянием гипоксии, ацидоза, гипотермии. Поэтому считают, что полностью система сурфактанта созревает к 35-36-й неделе внутриутробного развития.
У ребенка, родившегося до этого срока, имеющиеся запасы сурфактанта обеспечивают начало дыхания и формирования функциональной остаточной емкости легких, но из-за отставания синтеза сурфактанта от темпов его распада возникает недостаток этого вещества, что приводит к спадению альвеол на выдохе, резкому возрастанию работы дыхательных мышц, поскольку из-за неустановившейся функциональной остаточной емкости легких, повышенной их жесткости усилия, необходимые для каждого последующего раздувания легких, должны быть такими же, как и для первого дыхания. Кроме того, вследствие спадения альвеол, непрерывного газообмена в легких не происходит, что провоцирует развитие гипоксемии и гиперкапнии.
Уточним, что наряду с фосфатидилхолином (таблица 1) для нормального функционирования сурфактанта имеют значение и другие его компоненты, особенно фосфатидилглицерин и фосфатидилинозитол. Например, в смывах с легких детей, умерших от РДС, родившихся от матерей с сахарным диабетом количество лецитина и сфингомиелина и соотношения между ними нормальные, но имеется дефицит фосфатидилглщерина. С другой стороны, у глубоко недоношенного ребенка при низком уровне лецитина в околоплодных водах, но нормальном содержании фосфатидилглицерина РДС не развивается. При РДС, помимо исчезновения фосфатидилглицерина из сурфактанта, в нем снижено количество насыщенного фосфатидилхолина и увеличено содержание фосфатидилсерина и сфингомиелина.
Таблица 1.
| Риск развития РДС (функциональный коэффициента амниотической жидкости лецитин/сфингомиелин (L/S) и фосфатидилглицерол (PG)) |
|
Амниотической жидкости Риск РДС L/S>2.0* <.05% L/S < 1.0 100% L/S 1.0 до 2.0 ß как L/S Ý PG имеется <.05% L/S>2.0; PG отсутствует > 80% L/S>2.0; PG имеется 0 * В течение беременности осложненной диабетом или изосерологической несовместимости крови матери и плода, риск РДС с L/S между 2 и 3 - приблизительно 13%. (Contemporary Diagnosis and Management of Neonatal Respiratory Diseases. USA, 1995) |
Факторы снижающие синтез сурфактанта:
· холодовая травма, в том числе использование при ИВЛ не подогретой кислородно-воздушной смеси;
· патологический ацидоз;
· гиповолемия;
· полицитемия;
· гипоксемия;
· гипероксия;
· баротравма и волюмотравма легких;
· инфекции, как анте-, так интра-, постнатальные.
Перечисленные факторы повреждают альвеолы, активируют синтез провоспалительных цитокинов, систему комплемента и хемокинов (анафилотоксины, брадикинин и др.), что приводит к повышенной проницаемости эндотелия и отеку альвеол.
Инактивации сурфактанта, его разрушению способствуют:
· инфекции (особенно грамотрицательные, микоплазменная);
· белки плазмы, протекшие в альвеолы;
· патологический ацидоз;
· избыток оксидантов, перекисных соединений, провоспалительных цитокинов.
Патогенез РДС.
Вследствие неполноценной вентиляции легких развиваются гипоксия и ацидоз. Возникают рефлекторный спазм легочных артериол, отек стенок альвеол, нарушается проницаемость альвеолокапиллярной мембраны. Последнее может привести к выходу плазмы из легочных капилляров в альвеолы, с последующим выпадением на поверхности альвеол фибрина и образованием так называемых гиалиновых мембран (гиалиново-мембранная болезнь). В некоторых случаях гиалиновые мембраны возникают без предшествующих ателектазов легких и еще больше нарушают процесс синтеза сурфактанта, способствуя развитию ателектазов легочной ткани. Вследствие легочной гипертензии, ацидоза нарушается обычная для раннего неонатального периода перестройка кровообращения, в связи, с чем сохраняются фетальные коммуникации - овальное отверстие в межпредсердной перегородке, артериальный (боталлов) проток, соединяющий легочный ствол с аортой. Наличие этих сообщений еще более усугубляет гипоксию. При выраженной гипоксии происходит диссеминированное внутрисосудистое свертывание крови, развивается отечно-геморрагический синдром.
Образование гиалиновых мембран возможно и в результате снижения фибринолитической активности крови. Отмечается также отсутствие или резкое снижение активности антиателектатического фактора (сурфактанта), что способствует возникновению ателектазов. Определенное значение имеет дефицит плазминогена, 2-макроглобулина и развитие локального или диссеминированного внутрисосудистого свертывания крови. Отмечаются недоразвитие эластической ткани легкого, незрелость альвеол, аспирация околоплодной жидкости и слизи, особенно у глубоконедоношенных детей.
Характер и степень выраженности патологических изменений при респираторном дистресс-синдроме во многом зависят от индивидуальных особенностей организма новорожденного. Патогенез РДС рассмотрен на схеме 1.
респираторный дистресс синдром новорожденный
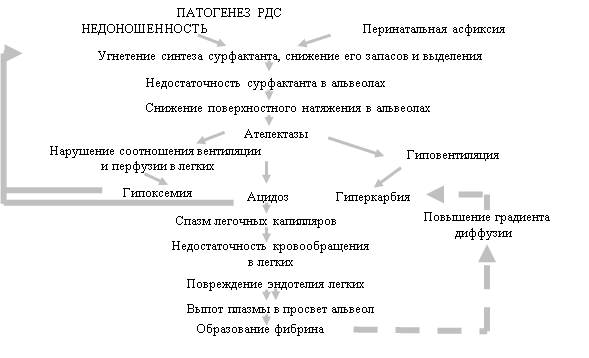
Схема_1
Патофизиология.
Новорожденным с РДС необходим дополнительный кислород и у них увеличена работа дыхания. И то, и другое обусловлено прогрессирующим ателектазированием альвеол вследствие дефицита сурфактанта и чрезмерной податливостью грудной клетки. Пневмоциты ІІ типа довольно чувствительны к гипоксическим инсультам в перинатальном периоде и разрушаются под их воздействием. Созревание этих клеток задерживается при наличии у плода гиперинсулиемии и ускоряется под воздействием хронической внутриутробной гипоксии, обусловленной такими факторами, как гипертония беременных, задержка внутриутробного развития, двойня. Сурфактант, состоящий преимущественно из фосфолипидов и белков, продуцируется и откладывается в пневмоцитах ІІ типа. Этот липопротеин высвобождается в просвет дыхательных путей, где он путем уменьшения поверхностного натяжения и поддержания альвеол в расправленном состоянии при физиологических уровнях давления.
А. Дефицит сурфактанта (рис 2). При отсутствии сурфактанта дыхательные пути с узким просветом и альвеолы спадаются при каждом выдохе, приводит к прогрессирующему ателектазированию легких. Белковый экссудат и эпителиальный дебрис (эпителиальные остатаки), скапливаются в дыхательных путях. Это ведет к уменьшению общей емкости легких. При окрашивание гистологических препаратов этот материал приобретает характерный вид эозинофильных "гиалиновых мембран", дающих основание для установления паталогоанатомического диагноза болезни гиалиновых мембран.
Б. Чрезмерно податливая грудная клетка. Большая величина отрицательного давления, генерируемого для расправления спавшихся дыхательных путей, вызывает появление втяжений и деформаций грудной клетки с незрелыми структурами, формирующими ее каркас (вместо расправления ригидных легких).
В. Шунтирование. Наличие или отсутствие шунтирования крови через открытый артериальный проток и/или овальное окно может оказывать влияние на клинические проявления и течение заболевания. БГМ приводит к развитию ацидоза и гипоксии, которое повышает сосудистое сопротивление в легких. Когда давление в малом круге кровообращения (справа) начинает превышать системное артериальное давление (слева), появляется шунтирование крови справа налево.
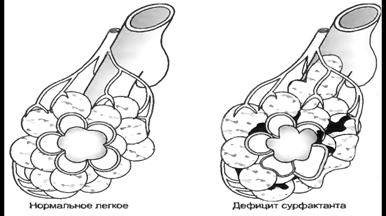
Рис.2. Неравномерно расправившееся легкое со спавшими альвеолами при дефиците сурфактанта.
Г. Низкое внутрилегочное давление. У новорожденных с гестационным возрастом менее 30 недель часто уже сразу после рождения развивается дыхательная недостаточность вследствие неспособности генерировать внутрилегочное давление, необходимое для расправления легких без сурфактанта. Кроме того, заболевание нередко осложняется отеком легких, что связано с выраженным левоправым шунтированием крови через открытый артериальный проток или овальное окно. У некоторых новорожденных с дефицитом сурфактанта шунт крови может быть праволевым.
Классификация.
Синдром дыхательных расстройств или "респираторный дистресс синдром" новорождённого представляет тяжёлое расстройство дыхания у детей в первые дни жизни, обусловленное первичным дефицитом сурфактанта. В соответствии с МКБ-10 (Класс XVI "Отдельные состояния перинатального периода", код P22.0) термин "синдром дыхательных расстройств" (СДР.) в настоящее время рассматривается как синоним термина "болезнь гиалиновых мембран" (БГМ). Деление СДР на 2 типа имеет историческое значение и в настоящее время в неонатологии не используется. Согласно МКБ-10, исторически 2-й тип СДР обозначается термином "транзиторное тахипное новорождённых" (код P22.1). В случаях отсутствия дополнительной информации о причине дыхательных расстройств в первые часы жизни может быть использован термин "дыхательное расстройство не уточненное" (код P22.9). Однако на практике его можно применять только в качестве предварительного диагноза. Во избежание терминологической путаницы, для обозначения СДР и БГМ, в качестве синонима этого заболевания, будет использован термин "респираторный дистресс синдром" (РДС).
В настоящие время в Российской федерации пользуются следующей классификацией.
По этиологическому принципу: гипоксической, инфекционной, эндотоксической, инфекционно-гипоксической, генетической (патология сурфактант-ассоциированных протеинов) и т.д. этиологии.
По течению: абортивное, острое, подострое. Наиболее важный вклад в течение рассмотренного заболевания будут вносить врожденные пороки развития сердечно сосудистой системы с изменением кровенаполнения легких, водный баланс на фоне проводимой терапии, изменение реологии крови, функциональное состояние экскреторных систем.
По стадии и тяжести процесса: стадии РДС 0, 1, 2, 3, 4, 5.
0. Стадию повреждения, протекающую внутриутробно или интранатально, позволяющую проводить более ранние лечение и профилактику.
1. Стадию инкубации или скрытую, во время которой компенсаторных механизмов ребенка бывает достаточно для прерывания процесса и самоизлечения.
2. Стадию ”изолированного легочного" поражения, при которой наиболее эффективными элементами вмешательства будут рано начатые респираторная терапия и заместительная терапия сурфактантом.
3. Стадию тотального поражения или шока у новорожденного, в течение которой одна респираторная терапия уже не сможет решать все поставленные задачи и ведение больного требует более сложного медикаментозно-мониторного и лабораторного обеспечения.
4. Стадию полиорганной недостаточности, или ранней постреанимационной болезни, тактика ведения больного в которой должна значительно отличаться в зависимости от преобладания определенного синдрома на определенном промежутке времени.
5. Стадию остаточных проявлений или поздней постреанимационной болезни, протекающей по варианту преобладания легочного, церебрального, трофического, смешанного или иного органического повреждения.
По наличию осложнений: синдром утечки воздуха из легких (пневмоторакс, пневмомедиастинум, пневмоперитонеум, итерстициальная легочная эмфизема), пневмония, ССН, поражение ЦНС (энцефалопатия), поражения ЖКТ (ЯНЭК), ДВС-синдром, шок (гиповолемический, инфекционно-токсический, кардиогенный), генерализованная инфекция.
По исходам и остаточным проявлениям: выздоровление без остаточных проявлений, формирование гиперреактивности бронхов, формирование нейроэндокринной дисфункции, нарушения иммунного статуса, формирование хронического неспецифического заболевания легких (пневмофиброз, хроническая пневмония, буллёзная эмфизема и. т.д.).
Клиническая картина.
Большинство детей рождаются в состоянии асфиксии и врожденной гипоксии.
Расстройство дыхания может наблюдаться с момента рождения (при первичных ателектазах легкого) или спустя несколько часов (при гиалиново-мембранной болезни).
Степень тяжести дыхательной недостаточности
|
Частота дыхания (дыхания в минуту) |
Грантинг или втяжение грудины |
Степень тяжести |
|
Более 90 |
Присутствует |
Тяжелая |
|
Более 90 |
Отсутствует | Средней тяжести |
| 60 - 90 |
Присутствует |
Средней тяжести |
| 60 - 90 | Отсутствует | Легкая |
РДС проявляется дыхательной недостаточностью с втяжением грудины и “хрюканьем” при выдохе (грантингом), которые, в свою очередь, часто сопровождаются апноэ. Состояние ребенка ухудшается в течение первых двух дней, не изменяется в течение следующих одного или двух дней, и начинает улучшаться в течение последующих четырех - семи дней. Обычно РДС проявляется у маловесных детей (менее 2.5 кг при рождении или родившиеся до 37 недели беременности) с первых часов жизни. Если у маловесного ребенка дыхательная недостаточность сопровождается выше изложенными признаками, лечите его как больного с РДС средней тяжести.
Основные симптомы респираторного дистресса и их интерпретация:
1. Тахипноэ (частота дыхания (ЧД) более 60 в минуту).
Увеличение ЧД обычно свидетельствует о неадекватной оксигеннации или вентиляции. Одышка возникает в ответ на повышение PaCO2 и снижение РаО2 в крови.
2. Цианоз.
Свидетельствует об увеличении содержания ненасыщенного кислородом гемоглобина в крови новорожденного, обычно более 30-50 г/л. Это сопровождается декомпенсацией сердечной деятельности и угнетением центральной нервной системы, и метаболическими нарушениями.
3. Участие вспомогательной мускулатуры в акте дыхания.
Является компенсаторным усилием группы мышц, функционально связанных с грудной клеткой: межреберных, надключичных, передней брюшной стенки, и направлено на увеличение вентиляции. Количество вовлеченных групп мышц свидетельствует о тяжести дыхательной недостаточности, которую новорожденный ребенок стремиться компенсировать.
4. Шумный стонущий выдох.
Прохождение воздуха через частично суженую голосовую щель. Это бессознательное усилие младенца направлено на увеличение объема легких на выдохе с целью продления альвеолярного газообмена. Этот симптом наиболее часто наблюдается при РДС, однако может возникнуть при любом заболевании, сопровождающимся уменьшением альвеолярного обмена.
5. Апноэ.
Дыхательная пауза длительностью более 15 сек.; или менее 15 сек., но, если она сопровождается брадикардией менее 100 ударов в минуту. Несмотря на то, что апноэ является обычным симптомом для большинства недоношенных младенцев, его возникновение в течение первых 24-48 часов жизни обычно свидетельствует о наличии тяжелого заболевания.
6. Раздувание крыльев носа.
Раздувание крыльев носа на вдохе, как и участие вспомогательных мышц, отображает увеличенные дыхательные усилия и часто является одним из первых симптомов респираторного дистресса.
7. Снижение двигательной активность.
Сниженная двигательная активность не расценивается как симптом респираторного дистресс-синдрома, так как является неспецифическим симптомом, который может сопровождать как нарушения со стороны центральной нервной системы, так и сепсис. Тем не менее, он должен рассматриваться в ряду остальных симптомов, характерных для РДС. Чаще всего у новорожденных с тяжелым поражением легких все другие виды активности, кроме дыхательной, заметно угнетены.
Оценка тяжести дыхательных расстройств у новорожденных определяется по шкале Сильвермана-Андерсена (табл.2, рис.3).
Респираторный дистресс-синдром новорожденных часто осложняется присоединением вторичной инфекции с развитием пневмонии, иногда возникает пневмоторакс.
Типичные осложнения у детей с РДС.
Системные:
· декомпенсированный тяжелый ацидоз, шок смешанного генеза, декомпенсированный ДВС-синдром;
· внутрижелудочковые кровоизлияния;
· синдром персистирующей фетальной циркуляции;
· транзиторная гипераммониемия;
· гипогликемия;
· некротизирующий энтероколит;
· ретинопатия недоношенных;
· почечная недостаточность.
Местные, легочные:
· синдромы утечки воздуха;
· отек легких;
· пневмонии;
· кровоизлияния в легкие;
· бронхолегочная дисплазия;
· расстройства, связанные с неправильным положением или закупоркой дыхательных трубок, поражения гортани и трахеи (сужение подсвязочного пространства, отеки, стенозы, эрозии, гранулема).
Таблица 2.
Шкала Сильвермана. *
| Стадия 0 | Стадия I | Стадия II |
|
Верхняя часть грудной клетки (при положении ребенка на спине) и передняя брюшная стенка синхронно участвуют в акте дыхания |
Отсутствие синхронности или минимальное опущение верхней части грудной клетки при подъеме передней брюшной стенки на вдохе |
Заметное западание верхней части грудной клетки во время подъема передней брюшной стенки на вдохе |
| Отсутствие втяжения межреберий на вдохе | Легкое втяжение межреберных промежутков на вдохе | Заметное втяжение межреберных промежутков на вдохе |
| Отсутствие втяжения мечевидного отростка грудины на вдохе | Небольшое втяжение мечевидного отростка грудины на вдохе | Заметное западание мечевидного отростка грудины на вдохе |
| Отсутствие движения подбородка при дыхании | Опускание подбородка на вдохе, рот закрыт | Опускание подбородка на вдохе, рот открыт |
| Отсутствие шумов на выдохе |
Экспираторные шумы ("экспираторное хрюканье") слышны при аускультации грудной клетки |
Экспираторные шумы ("экспираторное хрюканье") слышны при поднесении фонендоскопа ко рту или даже без фонендоскопа |
* Каждый симптом в графе "Стадия I" оценивается в 1 балл, в графе "Стадия II" - в 2 балла. При суммарной оценке в 10 баллов у новорожденного наблюдается крайне тяжелый РДС, 6-9 балов - тяжелый, 5 баллов - средней тяжести, ниже 5 - начинающийся РДС.
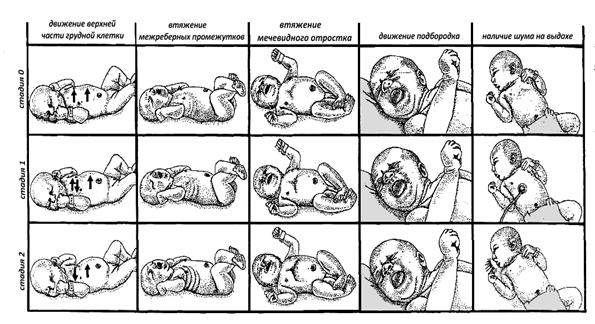
Рисунок 3. Шкала Сильвермана-Андерсона. (Maternal and Neonatal nursing // Family-Centereal Care)
Пневмопатии - патология, обусловленная незрелостью легочной ткани, характеризующаяся недостаточным содержанием в альвеолах антиателектатического фактора - сурфактанта.
К пневмопатиям относят гиалиновые мембраны, отечно - геморрагический синдром, диссеминированные ателектазы легких и отечный синдром.
Наиболее тяжелой формой пневмопатий являются гиалиновые мембраны. Они чаще наблюдаются у детей менее зрелых, развивающихся в условиях патологического течения беременности и родов. С первых часов после рождения быстро нарастают классические симптомы синдрома дыхательной недостаточности (РДС) II или III степени. Учащаются приступы асфиксии, нарастают отечный синдром и сердечно - сосудистая недостаточность. Клинические симптомы дыхательной недостаточности сопровождаются декомпенсированным метаболическим или смешанным ацидозом, гипоксемией, гипоксией, снижением параметров внешнего дыхания и значительным угнетением функционального состояния ЦНС.
На рентгенограмме легких гиалиновые мембраны обусловливают образование нодозно - ретикулярной сетки. Затем усиливается общий гипопневматоз с распространенными очаговыми ателектазами и отечными изменениями в легких. Уменьшается четкость контуров сердца и диафрагмы, формируются так называемые белые легкие с воздушной бронхограммой. Исчезновение гиалиновых мембран сопровождается повышением прозрачности на отдельных участках и огрубением рисунка легких в прикорневых и нижнемедиальных отделах.
У умерших детей при морфологическом исследовании гиалиновые мембраны определяют в просветах альвеолярных ходов, альвеол, реже в просвете внутрилегочных бронхов как ацидофильные, рыхлые, комковатые или уплотненные массы, лежащие в просвете свободно или выстилающие стенки дыхательных путей. В составе гиалиновых мембран обычно можно обнаружить фибрин, мукопротеиды, кислые мукополисахариды, липопротеины.
При электронно-микроскопическом исследовании легких детей с гиалиновыми мембранами выявляют значительные ультраструктурные изменения состояния легочной ткани.
Ателектазы легких чаще всего наблюдаются у недоношенных, так как незрелые легкие легко спадаются вследствие недоразвития эластической ткани, незрелости антиателектатической системы сурфактанта. Также причиной их возникновения могут быть нарушения акта дыхания, связанные с внутричерепными кровоизлияниями при асфиксии и родовой травме. Ателектазы могут быть субсегментарными, сегментарными, полисегментарными, долевыми и тотальными. Различают ателектазы первичные, не расправившегося после рождения легкого, и вторичные, ранее дышавшего легкого. Первичные тотальные ателектазы обоих легких наблюдаются у мертворожденных. Очаговые первичные ателектазы встречаются у новорожденных при неполном расправлении легкого. При аспирации околоплодного содержимого развиваются обтурационные вторичные ателектазы. Рассеянные ателектазы легких почти всегда сочетаются с отечными и другими гемодинамическими изменениями, а также признаками незрелости легких.
В зависимости от распространенности и генеза ателектазов развивается РДС I-II степени, реже РДС III степени. Приступы асфиксии и цианоза наблюдаются редко. Обращают на себя внимание одышка, повышение ригидности верхней трети грудной клетки, притупление перкуторного звука разной интенсивности на пораженной стороне, ослабление дыхания, единичные влажные хрипы, пульсация в области сердца и сосудов, дыхательный или смешанный ацидоз.
На рентгенограмме у детей с полисегментарными ателектазами, обусловленными неполным расправление легких после рождения, сегмент или несколько сегментов легких имеют диффузно - гомогенный или мозаичный вид, уменьшены в объеме. Мелкие рассеянные ателектазы легких почти всегда можно обнаружить на рентгенограммах детей гиалиновыми мембранами.
Первичные ателектазы легких на морфологических препаратах чаще встречаются в виде мелких, рассеянных ателектазов в пределах ацинуса, доли, реже сегмента. Морфологически они представлены в виде безвоздушных полей мезенхимы, богатой стромальными клеточными элементами. Среди волокон мезенхимы обнаруживают щелевидные просветы альвеолярных ходов. Просвет мелких бронхов спавшийся, часто заполнен десквамированным эпителием. Эластические волокна не выявляются.
Длительность РДС в этой группе детей составляет 5-7 дней.
Отечно - геморрагический синдром. Клиническая картина отечно - геморрагического синдрома типична для РДС. Однако тяжесть течения и исходы заболевания значительно легче, чем у детей с гиалиновыми мембранами. В анамнезе матери часто имеются указания на сердечно - сосудистые и аллергические заболевания. Состояние детей средней тяжести или тяжелое, характерны пенистые выделения изо рта. Ригидность грудной клетки и параметры внешнего дыхания снижены. Перкуторный звук укорочен в медиальных отделах грудной клетки. Дыхание ослаблено, выслушивается масса мелких влажных хрипов. Пульс учащен, ослаблен, нет четкости границ относительной тупости сердца, нередко выслушивается систолический шум. Отмечают увеличение размеров печени и общие отеки на фоне метаболического ацидоза и гиперкапнии. Коэффициент Л/С околоплодной жидкости меньше 2. На рентгенограммах отчетливо видно обеднение легочного рисунка, нежное, однородное затемнение прикорневых и нижнемедиальных отделов легких, без четких границ. Длительность течения отечно - геморрагического синдрома от 5 до 20 дней.
Морфологическая картина отечно - геморрагического синдрома характеризуется резким кровенаполнением сосудов всех калибров, особенно капилляров. Просвет альвеолярных ходов и альвеол заполнен отечной жидкостью и кровью, межуточная ткань отечна.
Массивные легочные кровоизлияния обычно сопровождаются коллапсом, резким цианозом, снижением уровня гемоглобина и гематокритного показателя. Массивные кровоизлияния в легкие могут быть обусловлены ДВС синдромом, развивающимся при асфиксии или внутриутробном инфицировании. Морфологически при этом могут быть обнаружены рассеянные тромбы в сосудах легких, почек, мозга и мелкие ишемические некрозы.
Аспирационный синдром. В анамнезе матери при этой патологии нередко имеются указания на применение в родах анальгетиков, общего наркоза, кесарева сечения и др. У детей с массивной аспирацией и массивными кровоизлияниями определяют приступы вторичной асфиксии, отдышку, притупления перкуторного звука, повышение ригидности грудной клетки, массу мелких и крупных влажных хрипов на фоне жесткого или ослабленного дыхания. Метаболические сдвиги умеренные. Аспирационный синдром развивается чаще у более зрелых и достаточно крупных новорожденных, что объясняет более легкой возбудимостью дыхательного центра у них при различных воздействиях на материнский организм. Однако и у недоношенных аспирация играет значительную роль в возникновении дыхательных расстройств в первые дни и в развитии пневмонии в дальнейшем. Если у доношенных аспирация' чаще происходит до рождения, то у недоношенных она может наступить и после рождения, особенно при неправильном кормлении и уходе, неадекватном лечении острых респираторных заболеваний, родовой травме и в других ситуациях.
Аспирация может вести к выключению отдельных сегментов легких из дыхательной функции, способствовать возникновению гиалиновых мембран и отека легких, увеличивающих ригидность легочной ткани и ухудшающих газообмен. Кроме того, аспирация способствует инфекционному поражению легких.
На рентгенограмме видны сливные очаги уплотненной легочной ткани, преимущественно правосторонней локализации, напоминающие воспалительную инфильтрацию легких, возможно образование обтурационных ателектазов легких.
Морфологически респираторные отделы легких заполнены базофильными массами с примесью роговых чешуек, детрита, слизи, пушковых волос. В участках, соответствующих обтурированным бронхам, легочная ткань остается ателектазированной. Массивная аспирация с обтурацией просвета бронхов иногда может быть причиной тяжелой асфиксии в первые часы после рождения.
При менее интенсивной аспирации могут развиваться макрофагальная реакция эпителия бронхов (в наиболее зрелых участках дыхательных путей) и асептический лейкоцитарный альвеолит. Инфицирование аспирационных масс нередко сопровождается развитием бактериальной пневмонии.
Синдром аспирации меконием (САМ) чаще наблюдается у переношенных или доношенных новорожденных, которые подверглись внутриутробной антенатальной и/или интранатальной гипоксии и родились в асфиксии, приведшей к спазму сосудов брыжейки, усилению перистальтики кишечника, расслаблению анального сфинктера и пассажу мекония - выходу его в околоплодные воды. Обвитие пуповины вокруг шеи, сдавливание ее стимулирует вагусную реакцию и пассаж мекония даже при отсутствии асфиксии.
Аспирированный меконий (это может произойти внутриутробно до родов) вызывает воспалительную реакцию в трахее, бронхах, легочной паренхиме (максимум ее наблюдается через 36-48 ч) - химический пневмонит (за счет содержащихся в нем липидов, протеолитических ферментов, повышенной его осмолярности), а также ателектазы как из-за закупорки бронхов, так и из-за инактивации сурфактанта с последующим спадением альвеол на выдохе. Помимо воспаления и ателектазов, в легких при аспирации мекония возникает отек, нередко пневмоторакс и другие виды "утечки воздуха".
Клиническое течение САМ по высоте поражения легких, как правило, тяжелое, с выраженными явлениями дыхательной недостаточности, вовлечением вспомогательной мускулатуры в акт дыхания, обилием хрипов в легких. На рентгенограмме легких отмечают сочетание участков апневматоза (крупные, неправильной формы затемнения), отходящих от корней легких,
с вкраплениями эмфизематозных областей. Легкие вначале выглядят эмфизематозными, диафрагма уплощена, переднезадний размер грудной клетки увеличен.
Для обильной аспирации характерны рентгеновский симптом "снежной бури" и кардиомегалия, развивающийся в первые сутки пневмоторакс.
Диагностика.
Диагноз респираторного дистресса основывается на данных клинической картины. Его можно предположить на основании изучения содержания лецитина или тромбопластической активности околоплодных вод. В течение первых часов жизни каждый час проводится клиническая оценка ребенка по шкале Silverman (Таблица 2, рис.2) или модифицированной шкале Downes (Таблица 3), на основании которых делается вывод о наличии и динамике РДС и необходимом объеме респираторной помощи. Оценка производится в динамике каждые 6 ч на протяжении 2-3 дней.
Таблица №3
Оценка тяжести РДС (модифицировавшая шкала Downes)
| Баллы | Частота дыхания в 1 мин | Цианоз | Втяжение грудной клетки | Затруднен-ный выдох | Характер дыхания при аускуль-тации |
| 0 | <60 |
нет при 21% О2 |
нет | нет | пуэрильное |
| 1 | 60-80 |
есть, исчезает при 40% О2 |
умеренное | Выслуши-вается стетоско-пом | изменено или ослаблено |
| 2 | >80 или апноэ |
исчезает при О2 > 40% |
Значи-тельное | слышно на расстоянии | плохо проводится |
Оценка в 2-3 балла соответствует легкой тяжести РДС, в 4-5 баллов - средней тяжести РДС, 6 и более баллов - тяжелому РДС.
Пренатальный диагноз основан на том, что легочная жидкость плода из воздухоносных путей попадает в околоплодные воды, и по фосфолипидному составу ее можно судить о зрелости легких плода. Околоплодные воды получают либо путем амниоцентеза, либо собирают вытекающие воды из родовых путей матери. Если уровни лецитина и сфингомиелина, насыщенного фосфатидилхолина в околоплодных водах, превышают 5 мг/л или фосфатидилглицерина - 3 мкмоль/л, РДС развивается очень редко (менее 1% случаев). Если соотношение лецитин/сфингомиелин (Л/С) более 2,0, вероятность РДС - 2%, если менее 2,0, но более 1, 0, - 50%, а если менее 1,0, - 75%. При задержке внутриутробного развития отношение Л/С не всегда правильно отражает функциональную зрелость легких плода, а потому в этих случаях рекомендуют руководствоваться вышеупомянутыми абсолютными уровнями насыщенного фосфатидилхолина и фосфатидилглицерола, а также сурфактантных протеинов А. В некоторых неонатальных центрах для оценки зрелости легких плода прибегают к исследованию тромбопластической активности околоплодных вод и подсчету оранжевых клеток, но это не общепринято. (Шабалов Н.П. 2004)
Пенный тест Клеменса - наиболее простой тест на зрелость легких. Для производства теста используют околоплодные воды или 1 мл желудочного содержимого, полученного при помощи полиэтиленового катетера в первый час жизни. Тест выполняют следующим образом: к 0,5 мл околоплодных вод или желудочного содержимого добавляют 0,5 мл абсолютного этанола (95%). Стеклянную пробирку (диаметр 1 см) энергично встряхивают в течение 15 с, через 15 мин оценивают результат теста, приблизив пробирку к черной бумаге. Тест положительный, если на поверхности имеется одиночное или двойное кольцо пузырьков. Тест отрицательный, если пузырьков нет, и слабо положительный, если вокруг мениска имеются единичные мелкие пузырьки, заполняющие 1/3 окружности или менее. В случае положительного теста вероятность БГМ - около 4%, слабо положительного - 20%, отрицательного - 60%.
Рентгенологические признаки РДС.
В литературе нет указаний на наличие специфических признаков РДС, но наиболее типичными считаются:
Умеренное снижение пневматизации легких, различимы воздушные бронхограммы, границы сердца чёткие (Рис.4).
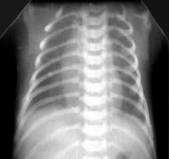
Рисунок 4Рентгенограмма грудной клетки в прямой проекции в горизонтальном положении. (Диагностика и лечение РДС недоношенных // метод. Рекомендация, 2007)
Снижение пневматизации легких, воздушные бронхограммы, границы сердца на рентгенограмме ещё различимы (Рис.5).
Выраженное снижение пневматизации легких, воздушные бронхограммы, границы сердца практически не различимы, стёрты (Рис.6).
Резкое снижение пневматизации легких, воздушные бронхограммы, границы сердца не различимы, "белые лёгкие" (Рис.7).
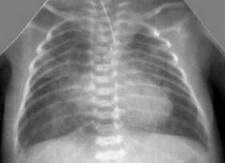
Рисунок 5. РДС. Рентгенограмма в прямой проекции, в горизонтальном положении. Верхние доли легких и средняя доля справа неоднородно слабоинтенсивно затемнены, корни легких расширены, не структурны. Сосудисто-интерстициальный рисунок легких деформирован, усилен, размыт. Тень средостения с нечётким контуром, протекционно смещена влево за счёт подворота. (Диагностика и лечение РДС недоношенных // метод. рекомендация, 2007)
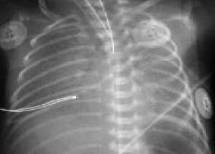
Рисунок 6. РДС. Рентгенограмма грудной клетки в прямой проекции, в горизонтальном положении. Интенсивное мелкоточечное затемнение легочных полей - с-м "матового стекла", на фоне которого не дифференцируется тень средостения. Визуализируются линейные просветления, обусловленные заполненными воздухом бронхами - "воздушная бронхограмма". (Диагностика и лечение РДС недоношенных // метод. рекомендация, 2007)
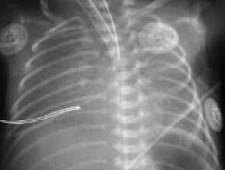
Рисунок 7. РДС. Рентгенограмма грудной клетки в прямой проекции, в горизонтальном положении. Интенсивное мелкоточечное затемнение легочных полей - симптом "матового стекла", на фоне которого не дифференцируется тень средостения. Визуализируются линейные просветления, обусловленные заполненными воздухом бронхами - "воздушная бронхограмма". (Диагностика и лечение РДС недоношенных // метод. рекомендация, 2007)
Дифференциальная диагностика.
Транзиторное тахипное новорождённых (синдром влажных легких, респираторный дистресс - синдром II типа). Диагноз ставится на основании данных анамнеза (кесарево сечение, астма у матери, избыточное назначение жидкости) и характерной рентгенологической картины (Рис.8). Заболевание чаще всего протекает доброкачественно и не требует инвазивной респираторной поддержки.
Синдром острого легочного повреждения (респираторный дистресс - синдром взрослого типа (Рис.9)). Всегда осложнение другого заболевания (пневмония, мекониальная аспирация, сепсис, шок, длительное экстракорпоральное кровообращение).
Идиопатическая легочная гипертензия новорождённых (синдром персистирующего фетального кровообращения) (Рис.10). Диагноз ставится на основании рентгенологической картины (обеднение сосудистого рисунка, "синдром чёрных легких") и данных эхокардиографии (право - левый шунт или бидиректоральный ток крови по фетальным коммуникациям).
Дифференциальный диагноз проводят с дыхательными расстройствами как легочного (пневмонии, пороки развития легких и др.), так и нелегочного генеза (вторичные дыхательные расстройства - внутричерепная родовая травма головного или спинного мозга, врожденные пороки сердца, диафрагмальная грыжа, полицитемия, метаболические нарушения и др.). Дифференциальная диагностика с пневмониями изложена ниже.
Агенезия хоан обусловливает невозможность дышать носом и появление цианоза, расстройств дыхания после нормального первого вдоха. Типичны обильные слизистые выделения, заполняющие нос. Порок развития становится очевидным, когда не удается провести катетер или зонд через нос в носоглотку. Лечение хирургическое, но сразу же вводят воздуховод в рот.
Трахеопищеводные свищи клинически проявляются поперхиванием, приступами цианоза, кашлем, появлением хрипов в легких в момент кормления или сразу после него. Контрастное исследование пищевода (с водорастворимым контрастным веществом) и бронхоскопия подтвердят диагноз.
Диафрагмальная грыжа выявляется при рождении или вскоре после него нарастающим тяжелым расстройством дыхания.
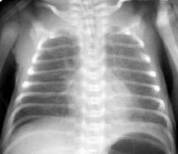
Рисунок 8. Синдром задержки жидкости в легких. Рентгенограмма в прямой проекции, в горизонтальном положении. Сосудисто-интерстициальный рисунок легких размыт на фоне симметричного слабоинтенсивного снижения прозрачности легочных полей. Контуры средостения нечёткие. (Диагностика и лечение РДС недоношенных // метод. рекомендация, 2007)
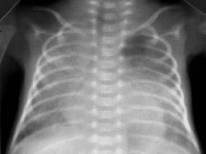
Рисунок 9. РДС взрослого типа. Рентгенограмма в прямой проекции, в горизонтальном положении. Визуализируется слабоинтенсивное затемнение верхней и средней доли правого лёгкого и нижней доли слева. На фоне затемнения дифференцируются более плотные участки, сосудисто-интерстициальный рисунок нечёткий (Диагностика и лечение РДС недоношенных // метод. рекомендация, 2007)
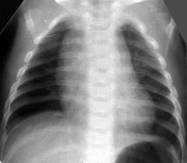
Рисунок 10. Персистирующая легочная гипертензия новорождённого. Рентгенограмма грудной клетки в прямой проекции. Тень средостения расширена в верхнем этаже, имеет чёткие, не ровные контуры. (Диагностика и лечение РДС недоношенных // метод. рекомендация, 2007)
Типичен малый ладьевидный живот, втянутая передняя брюшная стенка при рождении. При осмотре обращают на себя внимание асинхронные движения правой и левой половины грудной клетки и смещение верхушечного толчка сердца, чаще вправо (ибо левосторонняя диафрагмальная грыжа встречается в 5 - 1 0 раз чаще, чем правосторонняя), резкое укорочение перкуторного тона в нижнем отделе легкого и отсутствие здесь же дыхательных шумов, внезапный цианоз при положении ребенка на здоровом боку. Решающее диагностическое значение имеет рентгенография грудной клетки, которая показывает наличие в грудной клетке структур, ей несвойственных (кишечник, печень и др.). Лечение хирургическое.
У детей с родовой травмой головного и спинного мозга, наряду с расстройствами дыхания, отмечаются и признаки поражения ЦНС. Помогают своевременной диагностике патологии мозга и вспомогательные исследования: нейросонография, рентгенография позвоночника, люмбальная пункция и др.
Врожденные пороки сердца синего типа и синдром персистирующей фетальной циркуляции иногда трудно отличить от РДС. Однако в первые часы жизни у детей с РДС зачастую обычный цвет кожных покровов. При использовании 100% кислорода для дыхания в течение 10-15 мин, особенно при постоянном положительном давлении в воздухоносных путях, у детей с РДС РаО2 повышается, иногда даже выше 100, тогда как при пороках сердца синего типа этого не происходит. Безусловно, имеют значение и данные клинического осмотра, аускультации, оценка по шкале Сильвермана, а также дополнительных исследований (рентгенография грудной клетки, ЭКГ, результаты эхокардиографии).
Пневмонии, вызванные стрептококками В, другими стрептококками (пептострептококки, энтерококки), дают клиническую картину, практически не отличимую от БГМ, ибо вызывают ингибирование сурфактанта и отсюда его дефицит. Диагностическое значение в этом случае имеет выявление других инфекционных очагов (менингит и др.), результаты клинических анализов крови, посевов крови, содержимого трахеи.
Прогнозирование.
Наиболее часто РДС отмечается у глубоко недоношенных детей при гестационном возрасте менее 34 недель. Однако существует группа угрожаемых по развитию РДС новорожденных, родившихся в более поздние сроки беременности. К ним относятся дети, родившиеся у матерей с сахарным диабетом и другими эндокринопатиями при многоплодной беременности, изосерологической несовместимости крови матери и плода, при кровотечениях в связи с отслойкой и предлежанием плаценты. Большую группу составляют новорожденные с морфофункциональной незрелостью, возникшей под влиянием неблагоприятных факторов внешней среды или в результате плацентарной недостаточности, врожденной и наследственной патологии плода, а также дети, родившиеся в асфиксии. Прогностическим критерием является определение в крови беременных женщин уровня альфа-фетопротеина (Таблица №3). Повышение его концентрации выше 75-го перцентиля указывает, помимо нарушения процесса формирования и развития плода во II и в начале III триместра, на отставание зрелости плода по отношению к гестационному возрасту.
Таблица № 3
Перцентили альфа-фетопротеина
| Срок беременности, недель | Перцентили | ||||||
| 3 | 10 | 25 | 50 | 75 | 90 | 97 | |
| 13-14 | 1.76 | 3.89 | 7.38 | 12.9 | 20.1 | 27.8 | 36.4 |
| 14-15 | 2.29 | 4.93 | 9.17 | 15,8 | 24.3 | 33.2 | 43.1 |
| 15-16 | 2.95 | 6.22 | 11.4 | 19.3 | 29.3 | 39.7 | 51.2 |
| 16-17 | 3.79 | 7.83 | 14.1 | 23.6 | 35.4 | 47.6 | 60.9 |
| 17-18 | 4,85 | 9.83 | 17.4 | 28.8 | 42.8 | 57.1 | 72.7 |
| 18-19 | 6.17 | 12.3 | 21.5 | 35.2 | 51.8 | 68.7 | 86.8 |
| 19-20 | 7.84 | 15.4 | 26.6 | 43 | 62.7 | 82.6 | 104 |
| 20-21 | 9.93 | 19.2 | 32.8 | 52.5 | 75.9 | 99.5 | 125 |
| 21-22 | 12.5 | 24 | 40.5 | 64.1 | 92 | 120 | 150 |
| 22-23 | 15.8 | 29.8 | 49.9 | 78.3 | 112 | 145 | 180 |
| 23-24 | 19.2 | 35.8 | 59.2 | 92.2 | 131 | 169 | 208 |
| 24-25 | 21.9 | 40.4 | 66.4 | 102 | 144 | 185 | 228 |
| 25-26 | 24.8 | 45.2 | 73.6 | 113 | 158 | 202 | 248 |
| 26-27 | 27.7 | 50 | 80.7 | 123 | 171 | 218 | 266 |
| 27-28 | 30.4 | 54.4 | 87.2 | 132 | 183 | 232 | 283 |
| 28-29 | 32.9 | 58.3 | 92.8 | 139 | 192 | 243 | 295 |
| 29-30 | 35 | 61.5 | 97.2 | 145 | 199 | 251 | 304 |
| 30-31 | 36.6 | 63.8 | 100 | 149 | 203 | 255 | 308 |
| 31-32 | 37.6 | 65.1 | 102 | 150 | 204 | 255 | 308 |
| 32-33 | 38 | 65.3 | 101 | 149 | 201 | 251 | 302 |
| 33-34 | 37.7 | 64.4 | 99.3 | 145 | 196 | 244 | 292 |
| 34-35 | 36.8 | 62.5 | 95.8 | 139 | 187 | 233 | 278 |
| 35-36 | 35.4 | 59.7 | 91.1 | 132 | 177 | 219 | 261 |
| 36-37 | 33.5 | 56.1 | 85.2 | 123 | 164 | 202 | 241 |
| 37-38 | 31.3 | 52 | 78.6 | 113 | 150 | 185 | 220 |
| 38-39 | 28.8 | 47.6 | 71.7 | 102 | 136 | 167 | 198 |
| 39-40 | 26.3 | 43.2 | 64.2 | 92.2 | 122 | 149 | 177 |
Пренатальная профилактика.
Всем беременным со сроком гестации 24-34 недели при угрозе преждевременных родов назначается один курс кортикостероидов и могут использоваться 2 схемы пренатальной профилактики РДС.
При угрозе преждевременных родов предпочтительнее антенатальное введение бетаметазона. Его использование продемонстрировало более быструю стимуляцию "созревания" в легких плода системы синтеза сурфактанта. Максимальный профилактический эффект при использовании бетаметазона наблюдается на 24 часа раньше, чем при использовании дексаметазона (через 48 часов против 72 часов от начала курсового введения). В отличие от дексаметазона, в многоцентровых исследованиях показана профилактическая эффективность однократного введения бетаметазона (неполный курс) и относительная безопасность при повторных курсах антенатального лечения. Кроме того, антенатальное введение бетаметазона способствует снижению частоты ВЖК и ПВЛ у недоношенных детей с гестационным возрастом более 28 недель, приводя к достоверному уменьшению их перинатальной заболеваемости и смертности.
Бетаметазон - 12мг В/М через 12 часа, всего 2 дозы на курс
Дексаметазон - 6мг В/М через 6 часов, всего 4 дозы на курс
Лечение должно ограничиваться одним курсом.
Показано, что повторные курсы дексаметазона увеличивают риск развития ПВЛ и тяжёлых нервно-психических нарушений к 2-х летнему возрасту.
При возникновении преждевременных родов в сроке 24-34 недели гестации следует предпринять попытку торможения родовой деятельности путём применения токолитиков. При этом преждевременное излитие околоплодных вод не является противопоказанием к торможению родовой деятельности и профилактическому назначению кортикостероидов.
Лечение.
Основные методы респираторной терапии РДС новорождённых.
Диапазон методов поддержания газообмена у детей с дыхательными расстройствами достаточно широк и поэтому требует систематизации.
Все методы респираторной терапии можно подразделить на несколько групп и, по мере увеличения их интенсивности, расположить в следующем порядке:
| Метод | Поток и концентрация | Преимущества | Недостатки |
|
Носовые канюли |
Маленький = 0.5л/мин. Средний = 0.5-1 л/мин. Большой = >1 л/мин. |
Требуется низкий поток кислорода Если использовать правильно, создается постоянная концентрация кислорода |
Необходимо иметь специальные канюли для новорожденных Необходимо иметь специальный дозатор маленького потока кислорода Подача холодного кислорода в легкие ребенка |
|
Носовой катетер |
Маленький = 0.5л/мин. Средний = 0.5-1 л/мин. Большой = >1 л/мин. |
Требуется низкий поток кислорода Если использовать правильно, создается постоянная концентрация кислорода |
Необходимо иметь специальный дозатор маленького потока кислорода Подача холодного кислорода в легкие ребенка |
| Кислородная палатка (кислородный колпак) |
Маленький = 3 л/мин. Средний = 3-5 л/мин. Большой = >5 л/мин. |
Согревает кислород Можно создать высокую концентрацию |
Требуется высокий поток кислорода, чтобы достичь желаемую концентрацию |
|
Лицевая маска |
Маленький = 1 л/мин. Средний = 1-2 л/мин. Большой = >2 л/мин. |
Можно быстро осуществить подачу кислорода Удобна для подачи кислорода в течение короткого времени |
Возможно накопление углекислого газа, если поток кислорода или маска слишком маленькие Трудно кормить ребенка, когда наложена маска Трудно фиксировать маску на месте |
| Инкубатор |
Если внутри инкубатора используется кислородный колпак, см. выше Если кислород подается непосредственно в инкубатор, следуйте инструкции производителя |
Согревает кислород |
Неудобства подачи кислорода в инкубатор: Требуется высокий поток кислорода, чтобы создать желаемую концентрацию Трудно поддерживать концентрацию кислорода, дверца инкубатора открыты для ухода за ребенком и выполнения процедур |
(Решение проблем новорожденных, ВОЗ, Женева 2005)
Применение CPAP в терапии РДС новорождённых.
Определение и принцип действия. СРАР - continuous positive airway pressure - постоянное (т.е. непрерывно поддерживаемое) положительное давление в дыхательных путях. Препятствует спадению альвеол и развитию ателектазов. Может быть установлено в качестве положительного давления в конце выдоха при проведении ИВЛ или являться самостоятельным методом респираторной поддержки у новорождённых с сохранённым спонтанным дыханием.
Постоянное положительное давление увеличивает функциональную остаточную ёмкость легких (ФОЕ), снижает резистентность дыхательных путей, улучшает растяжимость легочной ткани, способствует стабилизации и синтезу эндогенного сурфактанта.
Существует большое количество специального оборудования для проведения СРАР у новорождённых.
СРАР может проводиться через:
Интубационную трубку, установленную в трахеи (в настоящее время не рекомендуется)
Мононазальную канюлю (назофарингеальную трубку)
Назальную маску
Биназальные канюли
По данным рандомизированных исследований проведение СРАР через биназальные канюли или назальную маску обеспечивает наименьшую работу дыхания у новорождённого.
Специализированные системы разделяют на классические полуоткрытые и открытые. В полуоткрытых системах СРАР выдох производится в дыхательный контур, который запирается клапаном выдоха, создающий положительное давление в дыхательных путях. Таким устройством может быть механический клапан или обычный сосуд с водой. В открытых системах выдох производится во внешнюю среду, и положительное давление создаётся за счёт противопотока, т.е. выдох совершается против основного потока, поступающего к пациенту.
Постоянное положительное давление может генерироваться:
Аппаратом ИВЛ
Водяным замком (Buble CPAP) (Рис.11)
Генератором вариабельного потока
Очень важную роль играет характеристика потока, поступающего к пациенту в такой системе. В классических системах, как правило, поток постоянный. Для создания давления необходимо устанавливать скорость потока от 3 до 7 литров в минуту. В открытых системах поток постоянно изменяет своё направление либо к пациенту, либо в сторону выдоха пациента, поэтому его называют изменчивым или вариабельным. Такая характеристика потока в большей степени облегчает выдох новорождённого и таким образом снижает работу дыхания пациента (рис.12). В открытых системах СРАР для создания адекватного давления требуется больший поток от 6 до 10 литров в минуту.
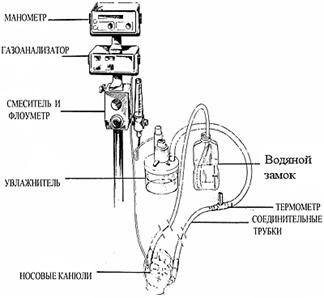
Рисунок 11. Система СРАР с водяным замком (Buble CPAP)
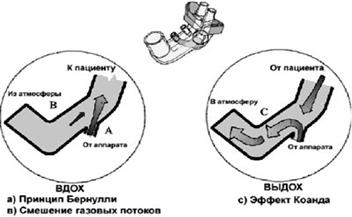
Рисунок 12. Принцип работы генератора вариабельного потока
Преимущества и недостатки различных способов проведения назального CPAP представлены в таблице 4.
Таблица 4
Сопоставление преимущества и недостатков различных способов проведения назального CPAP у новорождённых детей
| Оборудование и канюли | Теоретические преимущества |
| Bubble СРАР - Короткие назальные канюли - Длинные назальные канюли Обычный вентилятор - ЭТТ - Назальные канюли Вариабельный поток (IF) - Назальные канюли - Назальная маска |
Bubble СРАР - Дёшево Вызывают осцилляции, которые не влияют на элиминацию СО2 Обычный вентилятор - Дёшево Вариабельный поток (IF) - Наиболее стабильное давление CPAP - Наименьшая работа дыхания |
(Диагностика и лечение РДС недоношенных // метод. Рекомендация, 2007)
Показания и противопоказания.
Профилактическое или раннее (в течение первых 30 минут жизни) применение СРАР - характеризуется началом терапии в родильном зале сразу после рождения и применяется для профилактики и лечения РДС.
Показания: всем новорождённым с гестационным возрастом 32 недели и менее при наличии у них самостоятельного дыхания, необязательно регулярного. При отсутствии у недоношенного самостоятельного дыхания рекомендуется проведение масочной ИВЛ, а после восстановления самостоятельного дыхания начинается СРАР.
Применение СРАР в родильном зале противопоказано детям:
· С атрезией хоан или другими ВПР челюстно-лицевой области, препятствующими правильному наложению назальных канюль
· С диагностированным пневмотораксом
· С врождённой диафрагмальной грыжей
· С врождёнными пороками развития, несовместимыми с жизнью (аненцефалия и т.п.)
· Родившимся в тяжёлой асфиксии (в состоянии шока)
Терапевтическое использование СРАР - показано в случаях, когда у ребёнка начинают развиваться дыхательные нарушения и нарастает зависимость от кислорода.
Перевод на назальный СРАР после экстубации - позволяет сократить длительность искусственной вентиляции легких и снизить риск повторной интубации.
Показания:
· наличие регулярного самостоятельного дыхания
· FiO2 менее 30-35%
· МАР менее 7 см Н2О
Применение СРАР для предотвращения апноэ - используется у самостоятельно дышащих новорождённых, имеющих эпизоды апноэ любого генеза не более шести раз в час.
Мониторинг. После начала СРАР необходимо организовать непрерывное наблюдение за ребёнком с использованием стандартного и специального (контроль функции дыхания) неонатального мониторинга, а также назначить рентгенологическое исследование легких.
Порядок и варианты проведения CPAP.
При проведении новорождённому метода СРАР обязательна постановка зонда в желудок для декомпрессии. Стандартный алгоритм изменения параметров СРАР может применяться при любом способе проведения данной методики. Основным условием лечения с применением СРАР является наличие самостоятельного дыхания. Терапию начинают с 4 см вод. ст. Далее, в зависимости от реакции больного на применение постоянного расправляющего давления, следует изменять параметры. Если состояние ребёнка не улучшается, возможно, увеличение положительного давления в конце вдоха на 1 см вод. ст. до 5-6 см вод. ст. Следующим шагом может быть увеличение фракции кислорода во вдыхаемой смеси.
При стабилизации состояния, больного оставляют на СРАР в течение нескольких часов или дней и продолжают мониторировать основные витальные функции. По мере стабилизации состояния, первым шагом является уход от высоких концентраций кислорода во вдыхаемой смеси, а затем снижается положительное давление в конце выдоха.
Алгоритмы применения CPAP у недоношенных детей различной массы тела представлены в таблицах 5 и 6.
Таблица 5
Алгоритм изменения режимов СРАР при терапии РДС недоношенным с массой тела менее 1200 граммов
|
стартовое давление - 4 см вод. ст., FiO2 21-25%
|
* У детей с гестационным возрастом менее 26 недель процедура INSURE не проводится. Если ребёнок требует введения сурфактанта, то после введения рекомендуется продолжить ИВЛ до стабилизации пациента и формирования у него достаточных респираторных усилий. (Диагностика и лечение РДС недоношенных // метод. Рекомендация, 2007)
Таблица 6
Алгоритм изменения режимов СРАР при терапии РДС недоношенным с массой тела более 1200 граммов
|
стартовое давление 4 смН2О, FiO2 21-25%
|
(Диагностика и лечение РДС недоношенных // метод. Рекомендация, 2007)
Осложнения
1. Синдром утечки воздуха.
Профилактикой этого осложнения является как своевременный уход от давления в дыхательных путях при улучшении состояния пациента, так и своевременный переход на более высокий уровень респираторной поддержки при ужесточении параметров СРАР.
2. Баротравма пищевода и желудка.
Редко встречающееся осложнение, как правило, возникающее у недоношенных при неадекватной декомпрессии. Использование желудочных зондов с большим просветом, а так же полиуретановых и/или силиконовых желудочных зондов с большим просветом для глубоко недоношенных позволяет профилактировать данное осложнение.
3. Некроз и пролежни носовой перегородки.
При правильном наложении назальных канюль и адекватном уходе это осложнение встречается крайне редко.
Несколько практических советов по уходу за ребёнком на CPAP:
1. Необходимо использовать носовые канюли максимально возможно большего размера для предотвращения потери положительного давления.
2. Шапочка должна закрывать лоб, уши и затылок.
3. Ленточки, фиксирующие носовые канюли, должны крепиться на шапочке сзади наперёд, чтобы удобнее усиливать или ослаблять крепление.
4. В процессе лечения следует менять канюли на канюли большего размера в процессе роста ребёнка, или если его ноздри стали широкими, или при невозможности поддерживать в контуре устойчивое давление.
5. Канюли должны плотно входить в носовые отверстия и держаться без всякой поддержки. Они НЕ должны давить на нос ребёнка.
6. Нельзя санировать носовые ходы из-за возможной травматизации слизистой и быстрого развития отека носовых ходов. Если в носовых ходах имеется отделяемое, то нужно по 0,3 мл физиологического раствора влить в каждую ноздрю и санировать через рот. Для проверки проходимости носовых ходов следует закапать по 1-2 капли физиологического раствора в каждую ноздрю. При нормальной проходимости физиологический раствор уходит в носоглотку легко, без препятствий.
7. Температура увлажнителя устанавливается 37 градусов С.
8. Пространство за ушами следует ежедневно осматривать и протирать влажной салфеткой.
9. Пространство около носовых отверстий должно быть сухим во избежание воспаления.
10. Носовые канюли следует менять ежедневно.
11. Камера увлажнителя и контур должны меняться еженедельно.
12. Для профилактики ВЖК особенно важно не давать маловесным детям плакать. С этой целью используется соска.
13. У маловесных детей между щекой и фиксирующей лентой необходимо подкладывать мягкую прокладку (можно вату).
Заместительная терапия сурфактантом.
Заместительная терапия сурфактантом - патогенетический метод лечения респираторного дистресс-синдрома. Данная терапия направлена на восполнение дефицита сурфактанта и её эффективность доказана в многочисленных рандомизированных контролируемых исследованиях.
Применение сурфактантов возможно на всех этапах оказания экстренной помощи новорождённым.
Обязательные условия для применения препаратов сурфактанта
Сурфактант должен вводиться только специально подготовленным и обученным врачом
Во время введения сурфактанта за больным должна наблюдать специально подготовленная медицинская сестра
Сурфактант должен вводиться в учреждении, имеющем необходимое оборудование и персонал для лечения критически больных новорождённых
В каждом учреждении должен существовать написанный протокол введения препаратов сурфактанта
Если лечебное учреждение не удовлетворяет вышеперечисленным критериям и отсутствует возможность немедленного перевода больного в соответствующее лечебное учреждение, сурфактант должен вводиться под контролем или после консультации. После введения сурфактанта ребёнок должен быть переведён, как только появится такая возможность, в учреждения 1 и 2 уровня.
Показания и основные подходы к назначению сурфактанта.
Экзогенные сурфактанты назначаются как для профилактики, так и для лечения респираторного дистресс - синдрома новорождённых.
Описано несколько стратегий применения препаратов сурфактанта:
Профилактическое введение
Раннее терапевтическое
Отсроченное терапевтическое
Профилактическим считается применение сурфактанта до развития клинических симптомов респираторного дистресс - синдрома. В группу пациентов для профилактического ведения должны включаться новорождённые с наиболее высоким риском развития РДС.
Показанием для профилактического применения сурфактанта могут служить анамнестические данные, указывающие на высокую вероятность выраженного нарушения синтеза сурфактанта в легких ребёнка к моменту рождения. К основным из них относятся:
Наличие у матери сахарного диабета.
Отсутствие или неполный курс антенатальной стероидной терапии.
Гестационный возраст менее 28 недель.
Масса тела при рождении менее 1250 граммов.
При комбинации 3-х последних факторов, риск развития РДС достигает 80%. Пациентам, родившимся на сроке гестации < 28 недель и требующим интубации трахеи для проведения ИВЛ в родильном зале, оптимальным будет введение сурфактанта в течение ближайших 10 - 15 минут после интубации. При отсутствии в родильном зале необходимых условий и оборудования сурфактант следует вводить в ПИТН. В случае более позднего введения сурфактанта на фоне ИВЛ у этого контингента эффективность сурфактантной терапии снижается.
Раннее терапевтическое применение сурфактанта.
Ранним введением называется применение сурфактанта после начала ИВЛ или назального СРАР на фоне нарастания дыхательной недостаточности. Клинический опыт целого ряда европейских стран свидетельствует о целесообразности введения сурфактанта на фоне назального СРАР лишь при нарастании признаков РДС:
Одышка, втяжение грудины, уступчивых мест грудной клетки, раздувание крыльев носа и т.д.
Наличие рентгенологических признаков РДС (если есть возможность сделать рентгеновский снимок)
Потребность в МАР 6 см вод. ст. и FiO2 0,35 - 0,4 для поддержания удовлетворительной оксигенации. (МАР =5 см вод. ст. и FiO2 0,3 у детей менее 1200г).
На основании проведённых многоцентровых исследований показано, что раннее введение сурфактанта, приводит к достоверному снижению частоты развития пневмоторакса, ИЭЛ, БЛД и неонатальной смертности.
Отсроченное терапевтическое применение сурфактантов
Если новорождённому сурфактант не вводился с профилактической целью, то при наличии клинических и рентгенологических признаков РДС, заместительная терапия должна быть проведена как можно раньше. Эффективность позднего терапевтического применения сурфактанта существенно ниже, профилактического и раннего терапевтического введения.
Лечебное введение сурфактанта рекомендуется всем новорождённым (вне зависимости от гестационного возраста) с рентгенологически подтверждённым диагнозом РДС и признаками нарастающей дыхательной недостаточности на фоне СРАР или ИВЛ:
МАР более 6-7 см вод. ст.
FiO2 более 0,4 см вод. ст.
Имеющим показатели:
SpO2 менее 88%
РаО2 менее 50 мм рт. ст.
РаСО2 более 65 мм рт. ст.
При отсутствии или недостаточном эффекте от введения первой дозы проводят повторное введение сурфактанта. Оно показано всем новорождённым детям, получившим первую дозу, у которых сохраняются (см. выше) или нарастают признаки дыхательной недостаточности - МАР при традиционной ИВЛ более 6-7 см вод. ст. и FiO2 более 0,3-0,4, а также рентгенологические признаки респираторного дистресс-синдрома. Обычно повторно сурфактант вводят через 6 до 12 часов после введения предыдущей дозы. Повторное применение сурфактанта при тяжёлом течении РДС способствует повышению оксигенации, снижению частоты развития пневмоторакса и улучшение клинического прогноза.
Стратегия "INSURE".
Стратегия "INSURE" - (от английского - INtubation-SURfactant-Extubation - интубация-сурфактант-экстубация) - впервые была использована в Кувейте в конце 80-х годов прошлого столетия в больнице, где попросту отсутствовали аппараты ИВЛ. Недоношенным с РДС эндотрахеально болюсно вводили сурфактант и тут же экстубировали. При этом у подавляющего числа пациентов купировались проявления РДС. Впоследствии эту методику популяризировали в Дании и с успехом стали применять у детей, находящихся на СРАР и развивающемся РДС.
Эту стратегию можно использовать как с профилактичекой целью у глубоко недоношенных, так и с лечебной т. е при появлении признаков РДС.
Крупное мультицентровое рандомизированное исследование свидетельствует о том, что раннее проведение INSURE у детей на СРАР предпочтительней позднего. При этом ранним считалось введение сурфактанта при достижении у ребёнка потребности в FiO2 = 0,37 - 0,45, а поздним - при FiO2 = 0,50 - 0,6.
Основными критериями эффективности применения сурфактанта являются следующие:
1. Порозовение кожных покровов (приобретает розовый оттенок).
2. Улучшение экскурсий грудной клетки.
3. Увеличение комплайнса и уменьшение сопротивляемости дыхательных путей.
4. Уменьшение основных параметров ИВЛ (FiO2, МАР).
Противопоказания для назначения сурфактанта.
Абсолютных противопоказаний для назначения препарата сурфактанта нет. Относительными противопоказаниями являются легочное кровотечение и/или отек легких. В такой ситуации необходимо дождаться стабилизации состояния, увеличив ПДКВ до 5-6 см вод. ст. и остановки кровотечения. Сурфактант можно применять не ранее, чем через 6-8 часов. К относительным противопоказаниям можно отнести артериальную гипотензию, гипотермию, тяжёлый ацидоз на фоне метаболических нарушений, шок. Прежде, чем вводить сурфактант, необходимо стабилизировать состояние больного.
Причины неадекватной реакции на введение сурфактанта
Неадекватная реакция на введение сурфактанта может наблюдаться при неправильной постановке диагноза (дыхательная недостаточность у новорождённого вызвана не дефицитом сурфактанта, а другими причинами). Необходимо проведение дифференциальной диагностики со следующими нозологическими формами:
1. Гипоплазия легких
2. Внутриутробная пневмония/сепсис
3. Отек легких
4. Врождённый порок сердца синего типа
При терапии препаратами сурфактантов следует учитывать следующие аспекты, которые могут повлиять на снижение его эффективности:
1. Неправильно подобрана доза сурфактанта (недостаточно препарата) - может не быть адекватного ответа больного на введённый препарат.
2. Высокое (выше уровня ключиц) положение эндотрахеальной трубки - возможно неравномерное распределение препарата в легких, формирование участков с повышенным комплайнсом (растяжимостью легочной ткани) - формирование воздушных ловушек, эмфизем.
3. Возможно однолегочное введение сурфактанта, преимущественно, в правый главный бронх - очень высокий риск развития пневмоторакса или интерстициальной легочной эмфиземы.
4. Возможно введение сурфактанта в пищевод - в этом случае вообще не будет эффекта.
5. Введение сурфактанта ребёнку, находящемуся в шоке, гипотермии, с декомпенсированным ацидозом - результат от терапии сурфактантом в данном случае может быть ничтожным или вообще отсутствовать.
Побочные эффекты и осложнения, связанные с терапией сурфактантами.
Большинство побочных эффектов при использовании сурфактантов связаны с обструкцией дыхательных путей: транзиторная гипоксия и брадикардия, а так же с рефлюксом препарата, сопровождающимся гиперкапнией и тахикардией. Прямым осложнением заместительной терапией сурфактантом является легочное кровотечение, на фоне гемодинамически значимого открытого артериального протока.
При применении ЭТТ с небольшим диаметром возможны случаи обструкции трубки или дыхательных путей (если препарат имеет не гомогенную структуру).
Методика введения сурфактанта в палате интенсивной терапии
1. При поступлении ребёнка проводится клиническая и лабораторная оценка его состояния. Оценивается равномерность проведения аппаратного дыхания, определяется КОС, показатели красной крови и глюкозы, уровня основных электролитов.
2. Выполняется рентгенологический контроль с целью оценки пневматизации легких, положения интубационной трубки и исключения синдрома утечки воздуха.
3. После принятия решения о необходимости заместительной терапии сурфактантом, подготавливается его раствор.
4. Метод введения должен быть максимально щадящим для новорождённого, и зависит от его состояния:
А. Состояние ребёнка стабильное.
1. Обязательным перед введением препарата должно быть проведение санации ТБД.
2. Введение сурфактанта осуществляется быстро, болюсно при помощи катетера, отключив пациента от ИВЛ. В этом случае проводится ИВЛ саморасправляющимся мешком после введения препарата в течение 1-2 минут.
3. При применении препарата "Куросурф" повороты головы больного не приводили к лучшему распределению сурфактанта.
4. Обязательный контроль КОС в течение 30 минут после завершения процедуры и повторный рентгенологический контроль через 6 часов.
5. Мониторинг витальных функций и снижение параметров ИВЛ.
Б. Состояние ребёнка нестабильное
1. Параллельно с заместительной терапией сурфактантом проводится коррекция гемодинамических, метаболических и других нарушений, осуществляется постоянный мониторинг витальных функций.
2. В индивидуальном порядке решается вопрос о необходимости санации ТБД перед введением препарата.
3. Введение сурфактанта проводится без отсоединения ребёнка от ИВЛ - медленно болюсно, за 1-2 минуты, через боковое отверстие в интубационной трубке или с использованием специальной интубационной трубки с внутренним каналом.
4. Обязательный контроль КОС в течение 30 минут после завершения процедуры и повторный рентгенологический контроль через 6 часов.
5. Продолжение мониторинга и постепенное снижение параметров ИВЛ.
Методика проведения стратегии "INSURE"
Применять стратегию "INSURE" с помощью препарата "Сурфактант BL" не рекомендуется.
Для выполнения стратегии "INSURE" в ПИТН требуется следующее:
1. Согреть до температуры 37°С Сурфактант
2. Рассчитать дозу сурфактанта
3. Эндотрахеальную трубку необходимого размера
4. Проверить работоспособность ларингоскопа
5. Обеспечить рабочее место аппаратом ИВЛ или устройством безопасной вентиляции легких с клапаном положительного давления конца выдоха
6. Проверить работоспособность саморасправляющегося мешка для ИВЛ
7. Обеспечить венозный доступ для введения медикаментов
8. Положение больного на спине с небольшим валиком, помещённым под плечи для облегчения интубации трахеи
Медикаменты 1. Сурфактант
2. Морфин (фентанил, промедол)
3. Эуфиллин (кофеин)
4. Налоксон
Порядок выполнения процедур:
1. Введение внутривенно струйно-наркотического анальгетика (морфин 0,2 мг/кг)
2. Введение внутривенно эуфиллина (6-8мг/кг в/в внутривенно медленно струйно) или кофеина бензоата натрия (20мг\кг стуйно медленно)
3. Интубация трахеи
4. Проверка и при необходимости коррекция глубины стояния эндотрахеальной трубки
5. Начало управляемой ИВЛ (мешком или аппаратом ИВЛ)
6. Болюсное введение сурфактанта (куросурф 100-200мг/кг)
7. Контроль витальных функций пациента
8. Введение налоксона (0,1 мг/кг внутривенно, возможно повторное введение через 3-5 минут при отсутствии эффекта)
9. При появлении регулярного самостоятельного дыхания экстубация
10. Перевод на назальный СРАР
11. Продолжение мониторинга витальных функций и коррекция параметров СРАР
Особые указания.
Следует помнить, что в связи с ужесточением контроля над использованием наркотических препаратов, рутинное использование описанной выше методики может быть организовано только в условиях специализированного акушерского стационара или перинатального центра.
Традиционная ИВЛ при РДС.
Несмотря на достаточно широкое внедрение в интенсивную неонатологию высокочастотной вентиляции легких и неинвазивного СРАР, традиционная ИВЛ остаётся пока основным методом лечения дыхательной недостаточности у новорождённых.
Большинство неонатальных вентиляторов генерируют постоянный поток в дыхательном контуре. При закрытии клапана вдоха давление в дыхательном контуре повышается, становится больше альвеолярного, и поток поступает в дыхательные пути. Осуществляется искусственный вдох. Выдох при традиционной ИВЛ осуществляется пассивно.
При проведении традиционной ИВЛ чаще всего применяются следующие режимы ИВЛ:
IMV (IPPV) - аппарат проводит ИВЛ со строго заданными параметрами. Частота дыхания, время вдоха и выдоха каждого дыхательного цикла жёстко заданы. В промежутке между аппаратными вдохами в контур поступает поток свежего газа. Из этого потока может осуществляться самостоятельное дыхание пациента.
Триггерные режимы ИВЛ характеризуются наличием в конструкции респиратора специального датчика, который фиксирует попытки самостоятельного дыхания пациента. В некоторых случаях, кроме регистрации факта попытки дыхания, датчик может фиксировать также такие параметры, как время вдоха, дыхательный объём и скоростные характеристики потока через датчик. Наличие такого устройства позволяет наладить гибкое взаимодействие пациента и респиратора.
SIMV (SIPPV) - частота дыхания респиратора жёстко задана, но респиратор синхронизирует время начала аппаратного вдоха с попыткой самостоятельного дыхания пациента.
Assist/Control (A/C, PTV) - каждую попытку самостоятельного вдоха пациента респиратор поддерживает с заданными параметрами.
Основной причиной ДН (гипоксемия, гиперкапния) у детей с РДС является нарушение вентиляционно-перфузионных отношений. Оксигенация при ИВЛ в основном будет определяться концентрацией кислорода в дыхательной смеси (FiO2) и величиной среднего давления в дыхательных путях (МАР). МАР в свою очередь будет увеличиваться с повышением пикового давления на вдохе (PIP), положительного давления в конце выдоха (РЕЕР или ПДКВ) и изменением соотношения времени вдоха к времени выдоха (Твд/Твыд). Выведение углекислого газа прямо пропорционально дыхательному объёму (или PIP) и частоте дыхания респиратора и больного.
Условия, необходимые для эффективного и безопасного проведения ИВЛ.
В любом отделении, где проводится респираторная терапия новорождённых с использованием ИВЛ, необходимо следующее:
1. Вентилятор со следующими возможностями:
Генерирование постоянного потока с возможностью плавного изменения PIP, РЕЕР, FiO2, ЧД (до 120-150 в мин), Твд, (или соотношения Твд/Твыд).
снабжённый режимом IMV, и режимами A/C, SIMV, PSV, измеряющий дыхательный объём, МОВ, динамическую растяжимость, аэродинамическое сопротивление, имеющий графический мониторинг.
Обладающий многочисленными системами тревог (например: высокого и низкого давления, высокой концентрации кислорода, потери напряжения, потери давления от источника кислорода или воздуха и т.д.).
2. Серво-регулируемый увлажнитель, желательно с нагреваемым элементом в инспираторной части дыхательного контура.
3. Флоуметр, дыхательный мешок и маски различных размеров.
4. Оборудование для санации ТБД.
5. Трубки для дренирования плевральной полости различных размеров.
6. Пульсоксиметр.
7. Кардиореспираторный монитор.
8. Монитор для измерения дыхательного объёма при отсутствии этой функции в аппарате ИВЛ
9. Возможность провести рентгенограмму органов грудной клетки 24 часа в сутки.
10. КОС.
11. Персонал, способный осуществить эндотрахеальную интубацию.
Лабораторными показаниями к ИВЛ являются:
- РаО2< 50 мм рт. ст. при FiО2> 0.6;
- РаО2< 50 мм рт. ст. при НСРАР> 7 - 8 см вод. ст.;
- РаСО2 >60 мм рт. ст. при рН< 7.2-7.25;
- рН< 7.2.
Клиническими показаниями к ИВЛ являются:
- Апноэ с брадикардией и цианозом, если отсутствует или слабая реакция на масочную ИВЛ.
- Тахипное.
- Бледность/цианоз кожного покрова.
- Раздувание крыльев носа.
- Стонущее дыхание.
- Втяжение податливых мест грудной клетки.
- Чрезмерная работа дыхания.
- Шок.
Чаще всего наличие одного клинического признака не будет указывать на необходимость проведения ИВЛ, но присутствие двух или более, особенно в сочетании с отрицательной динамикой (нарастание дыхательного или метаболического ацидоза, увеличение потребности в кислороде, снижение АД и т.д.), будет служить показанием к ИВЛ.
Оценка тяжести РДС по различным шкалам не должна использоваться как решающий критерий для выбора метода респираторной поддержки, а может служить методом объективного сравнения тяжести дыхательной недостаточности у больных при включении их в научные исследования.
Противопоказания. При наличии показаний для проведения ИВЛ противопоказания отсутствуют.
Порядок проведения:
После интубации трахеи начать ИВЛ со следующими параметрами (режимы IMV/SIMV):
o FiO2 - 0,3-0,4 (обычно на 10% больше, чем при CPAP);
o Тin - 0,25 - 0,35 с;
o РЕЕР - + 4 - 5 см вод. ст.;
o ЧД - 60 в мин;
o PIP - 15 - 20 см. вод. ст.
o Поток - 6-8 л/мин
В режиме assist/control (A/C) частота дыхания определяется пациентом. Аппаратная частота устанавливается на 20% меньше спонтанного дыхания пациента.
Дальнейшие шаги:
1. Если при стартовых режимах ИВЛ экскурсии грудной клетки неудовлетворительны, необходимо увеличивать PIP на 1 см вод. ст. каждые несколько дыханий до появления видимой на глаз экскурсии грудной клетки. При возможности мониторировать дыхательный объём - целевое значение ДО должно составлять 5 - 7 мл. /кг.
2. Если SрO2 = 95%, снижать FiО2 каждые 5-10 мин;
3. Если ИВЛ начата по экстренным показаниям до начала инфузионной терапии - катетеризировать периферическую или пупочную/центральную вену.
4. При необходимости - катетеризировать пупочную артерию или периферическую артерию.
5. Обеспечить анальгезию/седацию (не обязательно в дозах, приводящих к угнетению самостоятельного дыхания пациента).
6. Обеспечить охранительный режим.
7. Через 15 мин определить КОС. Исходя из данных КОС, изменить параметры ИВЛ (см. табл.7,8).
Если подбором параметров не удаётся синхронизировать ребёнка с респиратором, назначают обезболивающие и седативные препараты (промедол - доза насыщения 0,5 мг/кг, поддерживающая доза 20-80 мкг/кг/ч; мидазолам - доза насыщения 150 мкг/кг, поддерживающая - 50-200 мкг/кг/ч; диазепам доза насыщения 0,5 мг/кг).
Таблица 7
Принципы регулировки параметров ИВЛ
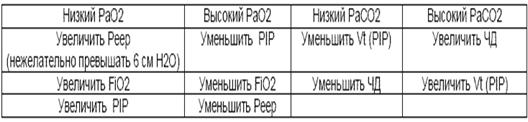
(Диагностика и лечение РДС недоношенных // метод. Рекомендация, 2007)
Таблица 8
Влияние параметров ИВЛ на РаО2 и РаСО2
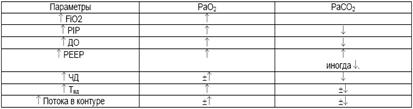
(Диагностика и лечение РДС недоношенных // метод. Рекомендация, 2007)
Принципы подбора адекватных параметров ИВЛ.
У недоношенных новорождённых с РДС крайне важно поддерживать стабильный дыхательный объём во время проведения респираторной терапии. С этой целью не следует снижать РЕЕР ниже 4-5смН2О и использовать минимальное пиковое давление, необходимое для поддержания дыхательного объёма на уровне 4-6мл/кг при достаточной частоте респиратора (40-60 и более в минуту). Желательно контролировать дыхательный объём. При этом допустимым является уровень РаСО2 55 - 60 mm Hg при Ph > 7,2.
Пиковое давление вдоха (PIP)
Большинство осложнений, связанных с ИВЛ, обусловлены неправильным подбором PIP.
Низкое PIP:
гиперкапния;
гипоксемия;
ателектазы.
Высокое PIP
баротравма/волюмтравма легких;
снижение сердечного выброса;
повышение легочного сосудистого сопротивления.
PIP подбирают в зависимости от:
эффективного ДО (объёма выдоха); Наиболее приемлемы в острую фазу заболевания легких - 4-6 мл/кг.
величины экскурсий грудной клетки;
аускультативной картины, интенсивности дыхательных шумов;
данных КОС.
Положительное давление в конце выдоха (РЕЕР, ПДКВ)
Основные положительные эффекты:
увеличивает ФОЕ;
улучшает вентиляционно-перфузионные отношения;
перемещает жидкость из альвеолярного в интерстициальное пространство;
препятствует спадению альвеол и мелких дыхательных путей;
В острой фазе РДС обычно применяют РЕЕР 4-6 см вод ст. У новорождённых с РДС такая величина РЕЕР обычно не оказывает отрицательного влияния на легочную механику и сердечно-сосудистую систему.
Потенциальные отрицательные эффекты высокого РЕЕР:
баротравма легких;
снижение венозного притока к сердцу;
повышение легочного сосудистого сопротивления;
перераспределение легочного кровотока в невентилируемые альвеолы;
Исследования, проведённые в 80-х годах прошлого века, показали, что повышение ЧД более 60 в мин приводит к лучшей синхронизации пациента с дыханием вентилятора, улучшает обмен газов в легких и снижает частоту баротравмы. При не медикаментозной синхронизации дыхания пациента и вентилятора, в острую фазу РДС, иногда используют ЧД 80-120 в мин (Твд > 0.3 с). Однако необходимо помнить, что подобная стратегия может приводить к гипервентиляции с дыхательным алкалозом, отрицательными последствиями которой будут:
Снижение сердечного выброса.
Спазм мозговых сосудов.
Нарушение вентиляционно-перфузионных отношений.
В режиме А/С больной сам выбирает частоту принудительного дыхания, что является определённым преимуществом этого режима.
Соотношение Твд/Твыд
В настоящее время более важными считаются абсолютные величины Твд и Твыд, а не их соотношение. Минимальное Твд должно быть таково, чтобы пациент получил необходимый дыхательный объём, а короткое Твыд не должно приводить к появлению auto-PEEP. Учитывая короткую константу времени у больных РДС, вполне адекватным Твд будет 0.35 с, а у детей массой менее 1000 г менее 0.3 с. При превышении ЧД 60 в мин, для контроля за возможным развитием "auto-PEEP" желательно иметь графический монитор.
Особенности обеспечения синхронности дыхания пациента и аппарата ИВЛ.
У большинства новорождённых при проведении ИВЛ сохраняется спонтанное дыхание, но часто не синхронное с принудительными вдохами вентилятора. Сохранение самостоятельного дыхания чаще всего положительно влияет на обмен газов в легких и гемодинамику, но может и снижать эффективность ИВЛ. Это происходит, если новорождённый дышит:
1) с частотой дыхания отличной от установленной на вентиляторе и/или 2) с нерегулярным ритмом дыхания, а также в том случае если частота дыхания пациента и вентилятора одинаковы, но 3) не совпадают фазы вдоха и выдоха. Как правило, новорождённый форсированно дышит или "борется" с респиратором, если аппарат ИВЛ не обеспечивает ему адекватную минутную вентиляцию. Т.к. известно, что минутная вентиляция равна произведению дыхательного объёма на частоту, синхронизировать пациента с аппаратом ИВЛ можно, увеличив частоту респиратора или дыхательный объём (Piр), в случае если последний не превышает 6-7 мл\кг.
Существует два основных способа достижения синхронности дыхания пациента и вентилятора: перевод на принудительную ИВЛ (IMV) и пациент-триггерная вентиляция.
При IMV синхронизация достигается глубокой седатацией или миорелаксацией. Каждый из этих методов имеет свои специфические недостатки:
Анальгезия/седатация:
- Депрессия сердечно-сосудистой системы.
Увеличение продолжительности ИВЛ.
Миорелаксация:
- Мышечная гипо/атрофия.
Увеличение продолжительности ИВЛ.
Спонтанное дыхание во время ИВЛ периодически снижает внутригрудное давление и способствует венозному притоку к сердцу, наполнению правого и левого желудочков, повышает сердечный выброс.
Принудительная вентиляция легких является оправданной только у пациентов:
с грубыми неврологическими нарушениями и т. н. "гипервентиляционным" синдромом, когда неконтролируемо высокая частота самостоятельных дыханий больного приводит к грубой гипервентиляции
с декомпенсированным метаболическим ацидозом
с сохраняющейся на пациент - триггерной вентиляции гипоксемией.
В остальных случаях предпочтительнее использовать пациент-триггерную вентиляцию.
Особые указания. При подборе параметров необходимо помнить, что:
1. Основными агрессивными параметрами ИВЛ, которые следует снижать в первую очередь, являются: PIP и FiO2 (> 40%).
2. За один раз давление меняется не более чем на 1-2смН2О, а частота не более чем на 5 вдохов. Лишь FiO2 может меняться под контролем SatO2 (88-92%) ступенчато на 5-10%.
Необходимый мониторинг
1) Параметры ИВЛ:
FiO2, ЧД (принудительная и спонтанная), Твд, соотношение Твд/Твыд.
PIP, РЕЕР, МАР.
Дыхательный объём
2) Мониторинг газов крови:
Периодическое определение газов крови в артериальной, капиллярной или венозной крови.
Постоянное определение оксигенации: SpO2 или ТсО2.
Рекомендуется постоянный мониторинг ТсСО2 или ЕtСО2.
3) Мониторинг гемодинамики:
ЧСС (ЭКГ).
АД (инвазивное или неинвазивное).
ЦВД (желательно).
4) Клинический показатели:
Температура.
Цвет кожи.
Экскурсии грудной клетки.
Аускультативные данные.
Симптомы повышения работы дыхания.
Динамика изменения массы тела.
Объём, цвет секрета из ТБД.
5) Периодическая оценка данных рентгенограммы органов грудной клетки. Обязательно при интубации или ухудшении состояния. Следует планово выполнять рентгенограмму органов грудной клетки каждые 1-3 дня при стабильном состоянии пациента, а также в случае ухудшения состояния, после повторной интубации, постановки центрального венозного катетера или дренажей в плевральную полость.
6) Температура и увлажнение вдыхаемого газа.
7) Клинический анализ крови. Глюкоза, электролиты в сыворотке крови.
Критерии эффективности ИВЛ
Возможность поддерживать у пациента приемлемые показатели газов крови: РаО2 50-70 мм рт. ст., SаО2 88% -92%, РаСО2 35-50 мм рт. ст., рН> 7.2.
Уменьшение клинических проявлений ДН.
Дыхательный объём 4-6 мл/кг или видимое увеличение дыхательного объёма (по экскурсии грудной клетки) и аускультативное улучшение аэрации легких.
Отсутствие беспокойства и синхронность дыхания пациента и вентилятора. Это должно достигаться в первую очередь подбором адекватного режима и параметров ИВЛ.
Уход в динамике от высоких концентраций кислорода (более 60%).
Рентгенологическое увеличение объёма легких.
Критерии неэффективности
При сохраняющейся гипоксемии и/или дыхательном ацидозе - ВЧ ИВЛ, Ингаляция NO, ЭКМО.
Осложнения ИВЛ при РДС у новорождённых.
Синдромы утечки воздуха.
Нозокомеальные инфекции (пневмония, трахеобронхит, сепсис).
БЛД.
ВЖК.
Ретинопатия.
Связанные с эндотрахеальной интубацией:
o Ларинготрахеобронхомаляция.
o Подсвязочный стеноз.
o Пролежни трахеи.
Профилактика осложнений
Введение сурфактанта.
По возможности избегать PIP> 20-25 см вод. ст. у детей весом менее1500 г., 25-30 см вод. ст. детям более 1500 г.
Поддерживать дыхательный объём 4-6 мл/кг.
Избегать РаСО2 < 35 мм рт. ст.
Высокочастотная традиционная ИВЛ (ЧД >60 в мин).
Ранняя экстубация.
Отучение от респиратора. Перевод на самостоятельное дыхание. Экстубация.
Отлучение ребёнка от респиратора следует начинать через несколько часов после того как состояние больного становиться стабильным: показатели КОС удовлетворительны (рН >7.25, РаСО2< 55-60 мм рт. ст.), произошло разрешение или значительное улучшение причины, которая обусловила перевод больного на ИВЛ, удовлетворительны показатели гемодинамики (дозы допамина и добутрекса не превышают 5 мкг/кг/мин), у больного - относительно адекватный неврологический статус. В первую очередь следует снизить потенциально опасные параметры ИВЛ: FiO2 > 0.6, PIP > 25 см вод. ст., РЕЕР > 5 см вод. ст., до относительно безопасного уровня: FiO2 > 0.4, PIP > 20 см. вод. ст., PEEP до 2-4 см. вод. ст. При достижении FiO2 < 0,3, Pip < 16-17 см Н2О, MAP < 6-7 см Н2О и частоты респиратора < 25-20 вдохов в минуту, а так же при наличии активного самостоятельного дыхания, возможна экстубация пациента на назальный СРАР. Газовый состав крови перед экстубациией должен быть удовлетворительным. Раннее и, при необходимости, повторное применение сурфактанта позволяет экстубировать пациентов в короткие сроки.
Методы перевода на самостоятельное дыхание:
Режим IMV/SIMV. Постепенно снижается PIP и ЧД до - 20 в мин. Экстубация в палатку, либо на назальный СРАР.
Режим А/С. Устанавливается контролируемая часть частоты дыхания, обычно на 10-20 дыханий меньше, чем частота спонтанного дыхания у больного. Постепенно снижается PIP до 15-17 см вод. ст. Экстубация.
Режим SIMV + PSV. Постепенно снижается частота SIMV до нуля, после этого снижается уровень PSV до 12-14 см вод. ст. Экстубация.
Режим PSV. Больной сам выбирает ЧД. Постепенно снижается PSV до 12-14 см вод. ст. Экстубация.
После перевода на самостоятельное дыхание необходимо следить за следующими клиническими и лабораторными данными:
приемлемые оксигенация и вентиляция: SaO2 8 90% при FiO2 7 0.40; PaCO2 не более 60 мм рт. ст.;
западение податливых мест грудной клетки, раздувание крыльев носа;
цвет кожных покровов;
аускультативная картина;
спонтанная частота дыхания;
ЧСС (появилась брадикардия или тахикардия);
артериальное давление (гипотензия или гипертензия);
неврологический статус;
рентгенологическая картина (ателектаз/ателектазы, отек легких, пневмония, БЛД, легочное перерастяжение или гиповентиляция);
динамика массы тела, ребёнка со значительной потерей или прибавкой массы затруднительно перевести на полное самостоятельное дыхание вследствие отеков или дефицитного питания.
Условия успешной экстубации:
значительная положительная динамика заболевания вызвавшего необходимость проведения ИВЛ;
SaO2 = 90% при FiO2< 0.4.
pH = 7.25, PаСО2< 60 мм рт. ст.;
PIP< 18 см вод. ст.;
отсутствие эпизодов длительных апноэ, судорог;
нет значительных метаболических нарушений (в сыворотке крови нормальный уровень глюкозы, Na, K, Са);
адекватный сердечный выброс (нормальное АД, периферическое кровообращение, диурез);
отсутствие или минимальный уровень седатации;
отсутствуют признаки чрезмерной работы дыхания;
нормальное количество секрета в ТБД, нет необходимости в частых санациях ТБД (каждые 2 часа или чаще);
отсутствует тяжёлая анемия;
наличие защитных рефлексов с дыхательных путей.
При подготовке к экстубации за 4 часа следует отменить энтеральное питание. Непосредственно перед экстубацией удалить содержимое желудка, выполнить санацию ТБД. После санации сделать несколько искусственных дыханий мешком или респиратором. Удалить эндотрахеальую трубку. Очистить рото - и носоглотку. Начать назальный СРАР (5 см вод. ст.) с FiO2 на 10-20% больше чем больной получал до экстубации. Перевод на кислородную палатку сразу после экстубации нежелателен так как исследования показали, что экстубация на СРАР чаще бывает успешной. Определить КОС через 20-30 мин, затем через 1 час и через 3 часа, далее в зависимости от клинического состояния.
Показания для реинтубации обычно следующие:
частые эпизоды апное (более 2 в час, или требующее ИВЛ маской),
ацидоз (pH< 7.25),
гиперкапния (РаСО2 более 60 мм рт. ст.),
FiO2 более 0.5-0.6, несмотря на повышение в динамике уровня давления СРАР,
нарастание клинических признаков высокой работы дыхания.
Для успешной экстубации у маловесных пациентов рекомендуется использовать метилксантины с целью стимуляции регулярного дыхания и предотвращения апноэ. Наибольший эффект от назначения метилксантинов отмечается у детей < 1000г причём именно в первую неделю жизни. С этой целью могут назначаться:
o кофеин-бензоат натрия из расчёта 20 мг/кг - нагрузочная и 5мг/кг - поддерживающая дозы.
Эуфиллин 6-8 мг/кг/ - нагрузочная и 1,5-3мг/кг - поддерживающая дозы, через 8 - 12 часов
Причинами, затрудняющими отучение от ИВЛ, являются:
Отек легких;
Интерстициальная эмфизема, пневмоторакс;
Внутрижелудочковые кровоизлияния;
Функционирующий артериальный проток;
Бронхолегочная дисплазия.
Постэкстубационные осложнения
Обструкция верхних дыхательных путей вследствие отека трахеи, гортани, голосовых связок.
Бронхоспазм.
Ателектазы.
Аспирация.
Гиповентиляция.
Повышенная работа дыхания.
Отсутствие кашлевого рефлекса.
Избыточная секреция дыхательных путей.
Слабость дыхательной мускулатуры.
Отек легких (часто при ОАП).
Высокочастотная осцилляторная ИВЛ (ВЧО ИВЛ)
Определение. Высокочастотной осцилляторной искусственной вентиляцией легких называется механическая вентиляция малыми дыхательными объёмами с высокой частотой. В основе ВЧО ИВЛ лежат шесть механизмов газообмена, основными из которых являются прямая альвеолярная вентиляция и молекулярная диффузия. Чаще всего в неонатальной практике используется частота ВЧО ИВЛ от 8 до 12 герц (1 герц = 60 дыханий в минуту). Основным отличием осцилляторной ИВЛ является наличие активного выдоха.
В литературе описано три группы показаний для проведения ВЧО ИВЛ
В качестве стартового метода респираторной поддержки, когда всем детям, имеющим показания для проведения ИВЛ, проводят дыхательную терапию ВЧО-респиратором
Стратегия терапевтического применения ВЧО ИВЛ, когда ребёнок переводится на осцилляторный респиратор необходимости при ужесточении параметров традиционной ИВЛ (наиболее популярный подход). В этом случае в качестве показаний к началу осцилляторной ИВЛ могут использоваться следующие критерии:
увеличение FiO2 до 60% и выше, при этом МАР
13см Н2О и выше у детей с массой более 2500 гр.
10см Н2О и выше у детей с массой 1000 - 2500 гр.
8см Н2О и выше у детей с массой менее 1000 гр.
индекс оксигенации (OI) = 12
Рассчитывается по формуле:
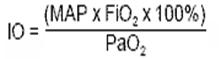
где: МАР - среднее давление в дыхательных путях, см. вод. ст.
FiO2 - фракция вдыхаемого кислорода, 0,21-1,0
PaO2 - напряжение кислорода в артериальной крови, мм. рт. ст.
Определяется по двум анализам артериальной крови с промежутком в 3 часа.
"Реанимационное" применение осцилляторной ИВЛ. При таком подходе ребёнок переводится на осцилляторную ИВЛ только тогда, когда никакие параметры традиционной ИВЛ не позволяют адекватно корригировать нарушения газообмена.
Преимущества применения ВЧО ИВЛ в качестве стартового метода респираторной поддержки до сих пор остаются предметом дискуссий т.к. данные исследований противоречивы, хотя этот метод и имеет ряд сторонников.
При проведении высокочастотной осцилляторной ИВЛ чаще всего используют две стратегии:
Стратегия оптимизации легочного объёма. Суть этой стратегии состоит в подборе таких параметров ВЧО ИВЛ, при которых в дыхание вовлекается максимальное количество альвеол. Критерием успеха этой стратегии будет подбор таких параметров ВЧ ИВЛ, при которых удаётся добиться минимальной зависимости пациента от кислорода. Эта стратегия рекомендуется при диффузных заболевания легких (РДС, пневмония)
Стратегия ограничения легочного объёма, при которой параметры подбираются таким образом, чтобы давление и поток в дыхательных путях были минимальными, чаще всего на фоне увеличения концентрации вдыхаемого кислорода. Эта стратегия рекомендуется для обеспечения респираторной поддержки у больных с синдромом утечки воздуха (пневмоторакс, интерстициальная легочная эмфизема).
Параметры ВЧО ИВЛ
МАР (среднее давление в дыхательных путях) - напрямую влияет на уровень оксигенации. Устанавливается на 2-4 см Н2О выше, чем при традиционной ИВЛ.
Частота вентиляции в большинстве терапевтических ситуаций варьирует в пределах 8-12 Гц (1 Гц = 60 вдохам в минуту) и зависит от массы пациента. Чем меньше вес пациента тем больше выставляется частота. Снижение частоты вентиляции приводит к увеличению дыхательного объёма и в некоторой степени улучшает элиминацию углекислого газа.
Время вдоха (регулируется только на респираторах Sensor Medics 3100 A) - 33% и не меняется в течение всего курса респираторной терапии при ВЧО ИВЛ.
DP (амплитуда осцилляторных колебаний) напрямую влияет на вентиляцию - обычно подбирается таким образом, чтобы у пациента определялась видимая на глаз вибрация грудной клетки. Для более точного установления стартового уровня DP рекомендуется использовать формулу:
DP = 4М + 25
Где DP - оптимальный стартовый уровень осцилляторных колебаний
М - масса тела пациента при рождении
4 и 25 - коэффициенты уравнения
FiO2 (фракция кислорода во вдыхаемой газовой смеси). Устанавливается такой же, как при традиционной ИВЛ.
Основной поток - У недоношенных детей он обычно составляет 10-15 литров в минуту, а у доношенных - 12-20 литров в минут Вентиляцию следует начинать с малых значений потока. Увеличение потока приведёт к усилению элиминации углекислого газа, а также к увеличению МАР. Рекомендуется оставлять основной поток постоянным в течение всего курса терапии. В некоторых моделях аппаратов ВЧ ИВЛ поток остаётся неизменным.
Подбор параметров ВЧО ИВЛ
Перед переводом на ВЧО ИВЛ желательно провести рентгенологическое исследование грудной клетки - для уточнения нозологии, оценки степени растяжения легких, подбора стартовых параметров.
Стратегия и тактика:
Клинически о достижении оптимального объёма легких можно судить по уменьшению зависимости пациента от кислорода. Рентгенологически легочный объём оценивается по степени раздувания легких. С другой стороны, при использовании довольно мощных респираторов легко получить перераздувание легких. В норме правый купол диафрагмы должен находиться на уровнена уровне 8-9 межреберья по среднеключичной линии. Поэтому необходимо запланировать проведение рентгенологического исследования через 30-60 минут после установки начальных параметров ВЧ ИВЛ. Интерпретировать полученные данные можно на основании следующих критериев:
Перераздувание:
Повышенная прозрачность лёгочных полей
Уплощение диафрагмы
Правый купол диафрагмы расположен ниже 10 ребра в проекции среднеключичной линии
Сужение тени средостения и сердца
Недостаточное расправление:
Ателектазы Правый купол диафрагмы выше уровня 8 ребра по среднеключичной линии
Оксигенация
Уровень оксигенации при проведении ВЧ ИВЛ зависит от МАР и FiO2. Для достижения адекватной оксигенации уровень МАР увеличивается до оптимального расправления легких, выявленного рентгенологически или до момента снижения зависимости пациента от кислорода (появляется возможность снизить FiO2). Далее необходимо снижать FiO2 ступенчато на 5% таким образом, чтобы уровень SpO2 оставался в пределах 88-94%.
При оптимальной степени раздувания легких, но сохраняющейся потребности в FiO2 > 40%, увеличить МАР на 1-2 см вод. ст. Желательно оценивать степень раздувания легких каждые 12 часов.
Если ребёнку требуется FiO2 > 40%, а МАР = 18 см вод. ст., следует исключить гиповолемию, снижение сократительной функции миокарда или легочную гипертензию. В этом случае рекомендуется допплерометрическое исследование центральной гемодинамики и определение сократительной функции миокарда.
Как только FiO2 снижено до 30%, следует начинать снижение МАР на 1-2 см Н2О каждые 2-4 часа под контролем газового состава крови. Если уход от MAP осуществляется слишком быстро, могут развиться ателектазы, и показатели газового состава крови ухудшатся. Если это случилось, следует вернуть МАР на 2 см вод. ст. выше уровня, при котором был начат уход. В дальнейшем снижение следует осуществлять медленнее.
Если на рентгенограмме, выполненной через час после начала ВЧОВ отмечаются признаки недостаточного расправления легких, увеличить МАР на 2-3см Н2О. Повторить рентгеновское исследование через 6 часов. При оптимальной степени растяжения легких - действовать, как указано выше. При наличии признаков избыточного растяжения легких, снизить PAW на 1-2 см Н2О, далее - как указано выше.
При сохраняющейся высокой потребности в кислороде возможно применение стратегии рекруитмента (быстрого вовлечения в газообмен максимального количества альвеол). Пошаговое увеличение МАР на 1-2 см вод. ст. в течение 2-4 минут до появления возможности снижения процента кислорода на фоне улучшающейся оксигенации. Затем, после ухода с токсических концентраций, также пошаговое снижение давления до прежних значений.
При отмене ВЧО ИВЛ возможен перевод пациента на традиционную ИВЛ при достижении МАР 5-7 см вод. ст. При необходимости более ранней отмены ВЧО ИВЛ, среднее давление в дыхательных путях не должно превышать 11 см Н2О.
Возможна экстубация и перевод новорождённого с ВЧ ИВЛ на назальный СРАР непосредственно с осциллятора при условии, что МАР достигло 7 см вод. ст., а FiO2 не более 0,3-0,35.
Вентиляция:
При постоянной частоте осцилляций уровень PCO2 зависит от DР. Необходим контроль газового состава крови через 30 мин. после начала ВЧОВ.
PCO2< 35ммНg - снизить DР на 10% от имеющегося
PCO2< 25 мм Hg - снизить амплитуду на 20%
PCO2= 35 - 55 mmHg - не изменять
PCO2> 60 mmHg - увеличить DР на 10%
PCO2> 85 mmHg - увеличить DР на 20%
Особые указания:
Контролировать газовый состав крови необходимо каждые 30 мин, пока не нормализуется PCO2. (Оптимально - в процессе ВЧО ИВЛ проводить непрерывный транскутанный мониторинг уровня CO2).
Допускается уровень PCO2до 65 мм рт. ст. если pH > 7,2-7,25
1. Нарушения центральной и регионарной гемодинамики не являются противопоказанием к применению ВЧОВ
2. Контролировать газовый состав крови каждые 4-6 часов при стабильном состоянии пациента; через 30 минут после изменения параметров, пока не будут достигнуты удовлетворительные показатели PO2 и PCO2.
3. При возникновении выраженной гиперкапнии у стабильного до этого момента пациента, необходимо проверить положение эндотрахеальной трубки; не возникла ли полная или частичная обтурация эндотрахеальной трубки мокротой, и при необходимости - заменить эндотрахеальную трубку.
4. Аускультация пациента на ВЧОВ иногда может быть полезна для определения положениядотрахеальной трубки, а также для подбора оптимальной частоты вентиляции.
Удовлетворительная аускультативная картина - симметрично, справа и слева, с одинаковой интенсивностью выслушиваются осцилляторные колебания, а главное, шум постоянного потока газовой смеси. При нарушении положения трубки, (например, срез упёрся в стенку трахеи или низкое положение трубки) шум потока газовой смеси будет выслушиваться несимметрично - с одной стороны более глухо. Аускультация проводится не только по передней поверхности грудной клетки, но обязательно и в подмышечных областях. Аккуратно меняя положение трубки (или путём поворачивания головы пациента), добивайтесь симметричной аускультативной картины. При обтурации эндотрахеальной трубки шум газового потока и осцилляции будут симметрично приглушёнными. Посторонние аускультативные шумы могут указывать на необходимость проведения санации или на скопление в контуре конденсата (проверить!). Для подбора оптимальной частоты используется аускультация легких у больных на ВЧО ИВЛ. При совпадении частоты осцилляций с собственной резонансной частотой легких выслушивается максимальное звучание осцилляций. Подобная стратегия позволяет снизить избыточную работу дыхания пациента на ВЧО ИВЛ
5. При аускультации сердца осцилляции должны быть кратковременно отключены, но контур не отсоединяют от ЭТТ, чтобы сохранялось постоянное расправляющее давление.
Особенности ухода за ребёнком на ВЧОВ
! Следует избегать частого, даже кратковременного, разъединения контура. Крайне важно поддержание лёгочного объёма. С этой целью рекомендуется применять специальные закрытые системы для санации ТБД.
! Санацию дыхательных путей проводят только при наличии абсолютных показаний:
Снижение или отсутствие видимых колебаний грудной клетки
Значительное увеличение PCO2
Снижение оксигенации
Больным РДС в первые сутки, как правило, не требуется санация. При санации время отсоединения должно быть очень коротким (менее 30 секунд) и, при необходимости, процесс повторяют два или три раза. После процедуры может понадобиться восстановление адекватного объёма лёгких и следует временно увеличить PAW (на 2-3см Н2О в течение 1-2 минут).
Порядок изменения положения тела должен быть тщательно продуман до начала манипуляции.
При проведении высокочастотной вентиляции необходимо адекватное увлажнение. Из-за высокой скорости потока жидкость из увлажнительной камеры испаряется очень быстро. Рекомендуется постоянное капельное введение стерильной дистиллированной воды в камеру увлажнителя.
Нет необходимости вводить миорелаксанты всем детям, находящимся на ВЧОИВЛ. У большинства детей их собственная дыхательная активность не влияет на эффективность механической вентиляции, на практике она даже может сопровождаться улучшением оксигенации. Помните, что введение миорелаксантов может приводить к значимому микроателектазированию, а также увеличению вязкости мокроты.
Показания к назначению седативных препаратов включают выраженное возбуждение и очень явные, сильные дыхательные усилия. Появление активного самостоятельного дыхания может свидетельствовать о гиперкарбии или обтурации эндотрахеальной трубки.
Возможна обтурация интубационной трубки мокротой, при этом состояние больного может долгое время оставаться достаточно стабильным. Основными признаками обтурации будут снижение амплитуды видимых колебаний, увеличение парциального напряжения углекислого газа в артериальной крови. Поэтому, всегда надо быть готовым к проведению экстренной переинтубации пациента.
Особенности интерпретации данных мониторинга функции легких при ВЧО ИВЛ.
Пульсоксиметрия.
При ВЧО ИВЛ обычно поддерживают SаO2 в пределах 90-95%. Следует избегать SаO2 менее 85% (PCO2< 50 мм рт. ст.), т.к. повышается легочное сосудистое сопротивление и возможна тканевая гипоксия. В некоторых случаях, если не нарастает метаболический ацидоз и стабильны показатели гемодинамики, можно поддерживать более низкую оксигенацию (тяжёлая баротравма, определённые виды врождённых пороков сердца, бронхолегочная дисплазия и т.д.).
В последнее время существует тенденция в острый период заболевания легких считать приемлемыми более низкие величины рН (около 7,2) и более высокие величины PCO2 (более 50 - 60 мм рт. ст.), для того, чтобы избежать повреждение легких высоким давлением и/или дыхательным объёмом (метод допустимой гиперкапнии). Для профилактики ВЖК важнее избегать резких изменений PCO2, чем стремиться "нормализовать" его уровень.
Рентгенологический контроль.
Рентгеновский снимок грудной клетки производится до перевода на ВЧО ИВЛ и затем через 4 часа после начала ВЧО ИВЛ. Оптимальное положение правого купола диафрагмы измеренное по среднеключичной линии - между 8 и 9 ребрами (по задним дугам ребер). Положение правого купола диафрагмы на 10 ребре и ниже свидетельствует о прерастяжении легких, а выше 8 ребра - напротив, о недостаточном раздувании легких. Если пациент стабилен, и не требует увеличения параметров ВЧО ИВЛ, рентгеновские снимки повторяются каждые 12 - 24 часа, либо по показаниям. Ниже представлено оптимальное расписание проведения рентгенографического исследования:
1. Через 4 часа после начала вентиляции
2. Каждые 12 часов в последующие сутки
3. Каждые 24 часа в последующие 5 дней
4. Каждые 48 часов в следующие 8 дней
5. Каждую неделю в последующем
6. Всякий раз, когда подозревается перераздувание легких.
Графический пневмомониторинг при ВЧО ИВЛ позволяет оптимизировать дыхательную поддержку. Он осуществляется с помощью датчика потока, измеряющего инспираторный и экспираторный потоки, и давления в дыхательных путях. Датчик потока располагается между ЭТТ и дыхательным контуром. Динамика измерений давления, потока и объёма выводится на дисплей специально предназначенного монитора. На точность результатов будут влиять следующие факторы: диаметр и длина ЭТТ, величина утечки между ЭТТ и трахеей, наличие мокроты в трахеобронхиальном дереве, правильность калибровки прибора перед использованием.
Поддерживающая терапия.
Дети со среднетяжелым и тяжелым РДС не должны получать энтерального питания в первые сутки жизни. Вопрос о возможности и времени начала кормления детей с легким РДС решается индивидуально.
Обычно внутривенное введение 10 % раствора глюкозы из расчета 60-70 мл/кг/сут обеспечивает минимальную физиологическую (на уровне основного обмена) потребность в воде и калориях в первые 2-3 суток жизни. Вместе с тем у детей с массой тела более 1500 грамм, перенесших тяжелую асфиксию, в первые сутки жизни целесообразно ограничить объем вводимой жидкости до 40 мл/кг/сут. Недоношенным детям с массой от 1000 до 1500 грамм инфузиониую терапию начинают с введения 10 % раствора глюкозы в объеме на 10-20% меньшем, чем требуется для обеспечения минимальной физиологической потребности в жидкости. Детям с массой тела 800-1000 грамм инфузионную терапию целесообразней начинать с введения 7.5% раствора глюкозы, детям с массой тела 500-800 грамм - с введения 5% раствора глюкозы. В случае развития гипогликемии увеличивают концентрацию вводимой глюкозы. Основная цель проводимой терапии - поддержание биохимического гомеостаза. При проведении инфузионной терапии необходим контроль за основными биохимическими константами крови ребенка (концентрация глюкозы, мочевины, креатинина, общего белка, К, Na, Са и КОС).
При отсутствии лабораторного контроля, поддерживающая терапия должна быть направлена на обеспечение минимальных физиологических потребностей организма в жидкости, питательных веществах и электролитах. В этом случае неонатолог вынужден ориентироваться на средние значения физиологических потребностей новорожденного ребенка.
Физиологическая потребность новорожденного в жидкости зависит от массы тела, гестационного возраста (определенного на основании степени морфофункциональной зрелости организма ребенка) и постнатального возраста. Средние цифры физиологической потребности в жидкости, на которые можно ориентироваться, представлены в таблице №10.
Таблица №10
Ориентировочные потребности в жидкости детей на первой неделе жизни (в мл/кг/сут.)
| 1 сут. | 2 сут. | 3 сут. | 4 сут. | 5-7 сут. | |
| Доношенные (масса > 2500 гр.) | 50 | 60-70 | 70-90 | 90-120 | 120-150 |
| Недоношенные (масса > 1500 гр.) | 50-60 | 60-80 | 80-100 | 100-120 | 120-140 |
| Недоношенные (масса < 1500 гр.) | 60-80 | 80-100 | 100-110 | 110-130 | 120-140 |
(Диагностика и лечение РДС недоношенных // метод. Рекомендация, 2007)
При отсутствии контроля за электролитами крови парентеральное введение кальция проводят, начиная с конца первых суток жизни с целью профилактики ранней гипокальциемии. С этой целью используются 10% растворы глюконата или хлорида кальция (которые в 1 мл содержат 0.45 мэкв и 0.136 мэкв элементарного кальция, соответственно). Парентеральное введение натрия начинают с момента установления адекватного диуреза, введение калия - на 2-3 сутки жизни. Для обеспечения физиологической потребности в натрии может быть использовано добавление к 10% раствору глюкозы изотонического ("физиологического") раствора хлорида натрия (в 1 мл содержится 0.15 мэкв натрия). Для обеспечения физиологической потребности в калии используются 4, 7.5 или 10 % растворы хлорида калия (содержащие в 1 мл 0.6, 1.0 и 1.5 мэкв калия, соответственно). Использование с 3-4 суток панангина (в 1 мл - содержится 0.25 мэкв калия) позволяет одновременно обеспечить физиологическую потребность ребенка в магнии. В первые двое-трое суток жизни эта потребность обычно удовлетворяется путем парэнтерального введения 0.2 мл/кг 25 % раствора магния сульфата (при внутривенном пути введения этого препарата обязательным является растворение его в 10-20 мл 10% раствора глюкозы и медленная скорость введения).
Физиологическая потребность в натрии составляет 2-3 мэкв/кг/сут (у детей с массой тела менее 1000 грамм - до 4 мэкв/кг/сут)
Физиологическая потребность в калии - 1-2 мэкв/кг/сут (у детей с массой тела менее 1000 грамм - 2-3 мэкв/кг/сут)
Потребность в кальции составляет 0.45-0.9 мэкв/кг/сут.
По мере стабилизации состояния ребенка (обычно на 2-3-сутки жизни), после пробного введения стерильной воды и 5 % раствора глюкозы через зонд, начинают проведение энтерального питания. Более раннее начало питания может привести к развитию язвенно-некротического энтероколита (особенно у глубоконедоношенных детей), более позднее - к тяжелым дисбактериозам кишечника, вплоть до развития энтероколитов бактериальной этиологии. Наличие значительного количества застойного содержимого в желудке, упорные срыгивания или рвота с примесью желчи, вялая или усиленная перистальтика кишечника, кровь в стуле, симптомы раздражения брюшины служат противопоказанием для начала знтерального питания. В этих случаях ребенок нуждается в проведении парентерального питания. С этой целью в первые 5-7 дней жизни используются растворы аминокислот и глюкозы, а при необходимости длительного парентерального питания с 8-10 суток жизни подключаются жировые эмульсии.
Антибактериальная терапия.
Учитывая, что дети с РДС составляют группу высокого риска по развитию раннего неонатального сеписа, большинству новорожденных со среднетяжелым и тяжелым заболеванием показано проведение в родильном доме эмпирической антибактериальной терапии одной из двух комбинаций антибиотиков: полусинтетические пенициллины + аминогликозиды или цефалоспорины 2 поколения + аминогликозиды. Вопрос о длительности лечения и смене антибактериальной терапии должен решаться на основании микробиологических данных и результатах клинического и биохимических анализов крови.
Посиндромная терапия.
Борьба с сердечно-сосудистой недостаточностью, отеком мозга, судорогами, гипербилирубинемией, острой почечной недостаточностью осуществляется по общим принципам интенсивной терапии.
Диагностика, профилактика и лечение синдрома утечки воздуха.
Синдром утечки воздуха (СУВ) является одним из наиболее опасных осложнений РДС новорождённого при использовании ИВЛ и сурфактантов. Своевременное предупреждение, распознавание и лечение СУВ является необходимым условием для эффективного лечения РДС.
1. Пневмоторакс.
Пневмоторакс - вид СУВ, при котором воздух проникает в плевральную полость вследствие нарушения целостности висцеральной плевры. Чаще всего пневмоторакс является ургентным состоянием, сочетающимся с развитием внезапного плевропульмонального шока и гемодинамического коллапса.
По этиологии пневмоторакс подразделяют на спонтанный, осложняющий течение других легочных заболеваний (САМ, СПЛГ и т.д.) и ятрогенный (при санации ТБД, катетеризации подключичной вены и т.д.). Частота встречаемости зависит от вида респираторной терапии. Дети, получающие кислородотерапию, - до 4%, положительное давление конца выдоха - до 16%, пациенты, находящиеся на ИВЛ, - до 34%
Основные факторы риска развития пневмоторакса на ИВЛ представлены в таблице 11.
Диагностика пневмоторакса
Клинически - тахипное, цианоз, сниженное проведения дыхания на поражённой стороне, ассиметрия грудной клетки, выбухание на поражённой стороне, коробочный перкуторный звук, смещение органов средостения в здоровую сторону, вздутие живота, артериальная гипотензия, брадикардия. В газах крови гипоксемия, гиперкапния, смешанный ацидоз.
Таблица 11
Частота развития пневмоторакса при традиционной ИВЛ в зависимости отдельных параметров (Диагностика и лечение РДС недоношенных // метод. Рекомендация, 2007)
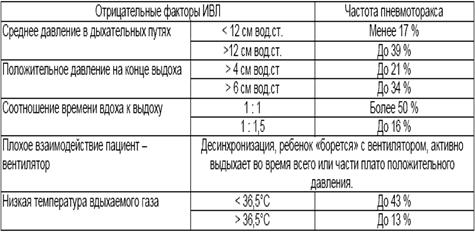
Трансиллюминация.
Метод трансиллюминации позволяет заподозрить пневмоторакс в ситуациях, когда рентгенологическое исследование недоступно или требует длительного времени. Необходимыми условиями для проведения трансиллюминации является относительно затемненная комната или возможность создать локальное затемнение (например, накрыть инкубатор и исследователя плотным покрывалом, не пропускающим свет) и наличие сильного источника холодного света (сильный фонарик, источник света от эндоскопа, источник света от системы BiliBlanket). Источник света прикладывают к грудной клетке ребёнка. Если в плевральной полости воздуха нет, то свет будет образовывать небольшое кольцо вокруг источника света (Рис.13), а в случае внелегочного скопления воздуха мы будем наблюдать широкое распространение света по грудной клетке (Рис.14).
Рентгенологические данные представляют наибольшую ценность в диагностике пневмоторакса (Рис.15). Воздух в плевральной полости, коллабированное лёгкое, смещение средостения в здоровую сторону - основные рентгенологические признаки пневмоторакса.
Асимптоматический пневмоторакс у новорождённых на самостоятельном дыхании требует только консервативного наблюдения и рентгенологического контроля каждые 12-24 часа. У доношенных новорождённых небольшой пристеночный пневмоторакс, имеющий клиническую симптоматику, можно также лечить консервативно. В этом случае резорбции экстраальвеолярного воздуха способствует повышение концентрации кислорода во вдыхаемой газовой смеси. Выявление пневмоторакса у пациента на ИВЛ - обязательное показание для дренирования плевральной полости.

Рисунок 13. Метод трансиллюминации. Источник света расположен на грудной клетке. Небольшое кольцо вокруг источника света. Пневмоторакса нет (Диагностика и лечение РДС недоношенных // метод. Рекомендация, 2007).

Рисунок 14. Метод трансиллюминации. Источник света расположен на грудной клетке. Кольцо вокруг источника света распространяется на всю половину грудной клетки. Пневмоторакс есть. (Диагностика и лечение РДС недоношенных // метод. Рекомендация, 2007)
Лечение пневмоторакса.
Поскольку пневмоторакс является опасным для жизни состоянием, в любом лечебном учреждении, лицензированном для оказания помощи новорождённому ребёнку должен быть всегда готов стерильный набор инструментов и расходных материалов для пункции и дренирования плевральной полости. В любой дежурной смене должен быть хоть один специалист, владеющий операцией торакоцентеза.
В набор для дренирования плевральной полости должны входить:
1. Набор для проведения местной анестезии
2. Скальпель
3. Троакар размером
4. Пуговчатый зонд
5. Дренажная трубка с двумя боковыми перфорациями
6. Изогнутые зажимы без зубчиков
7. Шовный материал
8. Набор шариков и салфеток
Пункция плевральной полости проводится как диагностическая процедура у пациентов, чьё состояние стремительно ухудшается и необходима незамедлительная диагностика.
Появление пузырьков воздуха свидетельствует о правильной пункции плевральной полости с поражённой стороны.
Инфицирование, ранение лёгкого, сосуда, грудного протока - возможные осложнения плевральной пункции, поэтому проведение процедуры требует большой осторожности.
Пункционная эвакуация воздуха из плевральной полости всегда недостаточна. Сразу же после диагностирования пневмоторакса производится дренирование.
Дренирование плевральной полости. Пневмоторакс должен быть дренирован у всех детей, имеющих клиническую симптоматику, находящихся на механической вентиляции (исключение только для пристеночных пневмотораксов без клинического ухудшения состояния пациента), а также во всех случаях напряжённого пневмоторакса.
Дренирование проводится в третьем межреберье по передней аксиллярной линии в стерильных условиях. Обязательны анальгезия, местная анестезия и седатация больного. Используют дренаж соответствующего размера (10 Fr для очень маленьких, 12-14 Fr для больших пациентов).
Во избежание ранения лёгкого непосредственно в момент постановки дренажа, рекомендуется на короткое время отсоединить новорождённого от вентилятора. С этой же целью троакар никогда не вводят более, чем на 1 сантиметр. Дренаж вводят на несколько сантиметров до достижения оптимального выхода воздуха. Все боковые отверстия дренажа должны находиться в плевральной полости. Затем подключают дренаж к системе активной аспирации с разрядкой 5-10 см вод. ст. Если больной находится на ИВЛ, подключение активной аспирации не обязательно т.к. во время активного аппаратного вдоха лёгкое активно расправляется и вытесняет воздух из плевральной полости. В этом случае свободный конец дренажа помещают в ёмкость с раствором антисептика так, чтобы свободный конец дренажа погружался в антисептик не более, чем на 3-4 см. При наложении активной аспирации важно, чтобы трубки системы активной аспирации не перегибались на протяжении. Следует также обращать внимание, чтобы давление аспирации не превышало указанные цифры т.к. высокое давление аспирации может усугублять сброс, препятствовать расправлению лёгкого и способствовать формированию бронхо-плевральной фистулы. Герметичность плевральной полости - необходимое условие терапии пневмоторакса, поэтому после закрепления дренажа лейкопластырем, если нужно, накладывают швы. Дренаж к грудной клетке крепится открытым способом, для постоянного наблюдения за состоянием и более удобной обработки кожи вокруг трубки.
Контролируют положение дренажа рентгенологически, если имеется остаточный воздух, либо изменяют положение дренажа, либо ставят второй. Рентгенологический контроль состояния легких и положения дренажа после стабилизации пациента осуществляют не реже, чем один раз в сутки. Возможные осложнения - те же, что и при пункции.
Продолжающаяся воздушная утечка проявляется отхождением пузырьков воздуха по системе активной аспирации. Пока это происходит, не следует изменять положение дренажной трубки. Средняя продолжительность стояния дренажа - около 5 дней. Через 12 часов после того, как воздух из плевральной полости прекратит отходить, пережимают дренаж. Если ещё через 12 часов на рентгенограмме лёгкое расправлено и воздуха в плевральной полости нет, дренаж удаляют.
Оптимальным режимом вентиляции является перевод ребёнка в режим ВЧО ИВЛ с использованием стратегии низкого легочного объёма. При отсутствии возможности использования ВЧО ИВЛ респираторная терапия направлена на уменьшение легочной баротравмы. Пиковое и среднее давление в дыхательных путях должно быть снижено до минимума, позволяющего поддерживать приемлемые значения газов крови PCO2 45-65 мм. рт. ст., PCO2 менее 65 мм. рт. ст., рН более 7.25.
2. Интерстициальная легочная эмфизема (ИЭЛ) (Рис.17) - вариант СУВ, при котором повреждённый альвеолярный эпителий пропускает воздух в интерстициальное пространство легких. Пузырьки газа распространяются перибронхиально и\или перивазально, значительно нарушая легочную механику. ИЭЛ может быть лобарной или односторонней, но наиболее часто поражаются оба легких. ИЭЛ встречается, главным образом, у недоношенных новорождённых с РДС, требующих респираторной поддержки. Частота развития ИЭЛ у недоношенных детей с экстремально низкой массой тела при рождении составляет до 42%, а с массой тела более 1000 грамм до 26%. Основным фактором развития ИЭЛ является баротравма, возникающая вследствие использования высокого пикового давления на вдохе при ИВЛ. Неправильное положение интубационной трубки в одном из главных бронхов приводит к развитию односторонней интерстициальной эмфиземы.
Клинически на фоне проведения ИВЛ у ребёнка развивается постепенное ухудшение состояния, лабораторно проявляющееся гиперкапнией, гипоксемией и ацидозом. Снижается экскурсия грудной клетки, нарастает зависимость от кислорода. На поражённой стороне аускультативно усиление дыхательных шумов. Скопление газа в интерстициальном пространстве, препятствуя легочному кровотоку, снижает легочную перфузию. Уменьшается комплайнс и страдает вентиляционно-перфузионное соотношение. Компрессия сосудов микроциркуляторного русла интерстициальным газом приводит к повышению давления в легочной артерии и формированию вторичной легочной гипертензии.
Диагностика опирается на клинико-лабораторные и рентгенологические данные. На рентгенограммах грудной клетки характерно диффузное поражение одного или обоих легких большим количеством маленьких пузырьков. По рентгенологическим признакам ИЭЛ делят на три степени:
1 - пузырьки газа на рентгенограмме диаметром > 1 мм.
2 - пузырьки газа на рентгенограмме диаметром > 2 мм.
3 - пузырьки газа на рентгенограмме диаметром > 2 мм или наряду с диффузным поражением имеется буллезная трансформация поражённых участков легких.
Трансиллюминация грудной клетки обнаруживает повышение светопроведения, такое же, как при пневмотораксе. Благодаря ежедневному рентгенологическому мониторингу новорождённых, находящихся на ИВЛ, порой неожиданно диагностируют ИЭЛ.
Респираторная терапия ИЭЛ направлена на предупреждение или уменьшение легочной баротравмы. Пиковое и среднее давление в дыхательных путях должно быть снижено до минимума, позволяющего поддерживать приемлемые значения газов крови PCO2 45-65 мм. рт. ст., PCO2 менее 65 мм. рт. ст., рН более 7.25.
Хорошие результаты при РДС даёт ранний перевод детей с ИЭЛ на ВЧО ИВЛ и использование стратегии низкого легочного объёма.
Пи одностороннем поражении - целесообразна "терапия положением" - эффект преимущественной вентиляции наименее пострадавшего лёгкого достигается за счёт выкладывания ребёнка на больную сторону.
3. Пневмомедиастинум (Рис.16) - одно из проявлений СУВ, характеризующееся накоплением воздуха в средостении. Чаще всего пневмомедиастинум сочетается с другими синдромами утечки воздуха, особенно с пневмотораксом. Существуют различные варианты клинического течения пневмомедиастинума от асимптомного до напряжённого с тяжёлой кардиоваскулярной и респираторной депрессией. Пневмомедиастинум, проявляющийся умеренным респираторным дистрессом, может быть заподозрен по приглушению сердечных тонов и коробочному оттенку звука при перкуссии грудины. При напряжённом пневмомедиастинуме происходит сдавление главных бронхов и магистральных сосудов, следствием чего становится нарастание степени дыхательной и сердечно-сосудистой недостаточности. В тяжёлых случаях может развиваться подкожная эмфизема.
Диагностика рентгенологическая.
На рентгенограмме пневмомедиастинум проявляется как полоски воздуха по сторонам от сердца. Боковая проекция позволяет обнаружить скопление ретростернального воздуха.
Изолированный пневмомедиастинум обычно не имеет симптоматики и не нуждается в лечении. Дренирование необходимо редко, в случаях напряжённого пневмомедиастинума с развитием явлений сердечно-сосудистой недостаточности.
4. Пневмоперикард - форма СУВ, при которой происходит скопление воздуха в полости околосердечной сумки. Воздух проникает в перикардиальную полость через дефект в области устья легочных вен из средостения или плеврального пространства. В большинстве случаев пневмоперикард развивается у недоношенных новорождённых, нуждающихся в ИВЛ с жёсткими параметрами.
Как правило, пневмоперикард проявляется тампонадой сердца, резкой артериальной гипотензией, брадикардией и цианозом. Диагностика основывается на данных клиники, ЭКГ, рентгенографии. Рентгенографически пневмоперикард выглядит как воздушный ореол вокруг сердца. В отличие от пневмомедиастинума появляется полоска воздуха вдоль нижней поверхности сердца над диафрагмой. По ЭКГ снижение вольтажа.
Все случаи пневмоперикарда нуждаются в немедленной пункции и дренировании сердечной сумки, дренирование проводится хирургом.
Дальнейшая тактика лечения такая же, как при ИЭЛ.
5. Пневмоперитонеум обычно является результатом перфорации полого органа брюшной полости, но может быть и вариантом СУВ из легких. В этом случае пневмоперитонеум развивается у вентилируемых новорождённых, уже имеющих пневмоторакс и пневмомедиастинум.
Пневмоперитонеум диагностируется по вздутию живота, тимпаниту при его перкуссии. На рентгенограмме в вертикальном положении или в положении на левом боку обнаруживается свободный газ в брюшной полости. Необходимо исключить энтероколит, и перфорацию полого органа. Консультация хирурга.
Дренирование брюшной полости производится с целью декомпрессии только в случаях напряжённого пневмоперитонеума.
6. Подкожная эмфизема. Развитие подкожной эмфиземы связано с проникновением воздуха в мягкие ткани шеи, верхнего плечевого пояса, передней брюшной стенки и т.д. Определяется при пальпации в виде подкожной крепитации. Встречается у новорождённых редко и сопровождает другие синдромы утечки воздуха. Специализированного лечения не требует.
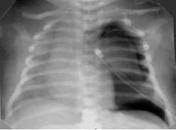
Рисунок 15. Напряжённый пневмоторакс слева. Рентгенограмма в прямой проекции, в горизонтальном положении. Легочные поля асимметрично коллабированы. Слева купол диафрагмы сглажен, в плевральной полости большое количество газа, коллабирующего лёгкое. Тень средостения смещена вправо - напряжённый пневмоторакс. Сосудисто-интерстициальный рисунок легких не дифференцируется на фоне однородного асимметричного интенсивного затемнения легочных полей.
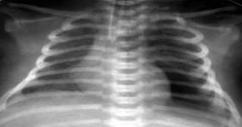
Рисунок 16. Пневмомедиастинум. Рентгенограмма в прямой проекции, в горизонтальном положении. Легочные поля симметрично слабоинтенсивно затемнены. Тень сердца смещена вправо, вокруг верхушки визуализируется зона просветления с чётким контуром - газ в средостении.
Рисунок 17. Интерстициальная легочная эмфизема (ИЭЛ). Рентгенограмма в прямой проекции, в горизонтальном положении. Легочные поля асимметрично вздуты: купол диафрагмы слева и справа выпрямлены, опущены до уровня передней пластинки 9 ребра справа и 8 ребра слева, париетальная плевра пролабирует в межреберные промежутки. Тень средостения проекционно смещена влево в соответствии с подворотом. Сосудисто-интерстициальный рисунок легких грубопетлистый, по ходу интерстиция в направлении от корней к плащевой зоне, больше слева, визуализируются извитые полоски просветления - интерстициальная эмфизема. Легочные поля неоднородно затемнены, по периферии правого лёгкого определяются множественные участки вздутия, легочные псевдокисты. В плевральной полости справа небольшое количество свободного газа.
Тестовый контроль.
1. При проведении дыхания под постоянным положительным давлением через лицевую маску возможно возникновение следующих осложнений:
а. отек лица
б. аспирация желудочного содержимого
в. обструкция дыхательных путей из-за неправильного положения головы и шеи
г. развитие внутрижелудочкового кровоизлияния
2. На уровень РаО2 оказывает влияние следующие параметры искусственной вентиляции легких:
а. концентрация кислорода
б. положительное давление в конце выдоха
в. время вдоха
г. частота дыхания
3. Метод спонтанного дыхания под постоянным положительным давлением неэффективен при:
а. болезни гиалиновых мембран
б. синдроме персистирующей легочной гипертензии
в. апноэ у недоношенных
г. транзиторном тахипноэ
д. отеке легких
4. Задержка жидкости в организме у детей с РДС связана с:
1. повышенной секрецией антидиуретического гормона
2. повышенной проницаемостью капилляров
3. наличием функционирующего артериального протока с большим сбросом крови слева направо
4. всеми перечисленными факторами
5. Для профилактика СДР новорожденного женщинам с угрозой преждевременных родов предпочтительнее вводить:
а. гидрокортизон
б. преднизолон
в. дексаметазон
г. тиреоидин
д. vit. E
6. Мероприятия по отношению к ребенку с болезнью гиалиновых мембран (БГМ) должны быть следующими:
а. введение сурфактанта
б. ИВЛ
в. положительное давление конца выдоха (СРАР)
г. ЗПК
д. поддержание адекватного теплового режима
7. Противопоказанием к применению метода дыхания с положительным давлением на выдохе в лечении дыхательной недостаточности у новорожденных детей:
а. синдром аспирации мекония
б. внутриутробная пневмония
в. пневмоторакс
г. респираторный дистресс-синдром 1-го типа
д. респираторный дистресс-синдром 2-го типа
8. Оптимальной концентрацией кислорода для лечения дыхательной недостаточности у новорожденных является:
а. 40 %
б. 60 %
в. 80 %
г. 100 %
д. индивидуальна для каждого ребенка
9. Искусственная вентиляция легких показана при РаСО2:
а. более 40 мм. рт. ст.
б. более 50 мм. рт. ст
в. более 60 мм. рт. ст.
г. более 70 мм. рт. ст.
10. При решении вопроса о необходимости проведения искусственной вентиляции легких наиболее важным показателем является:
а. РаО2
б. РаСО2
в. рН
г. BE
11. Интерстициальная эмфизема у новорожденного ребенка, находящегося на аппаратной ИВЛ, обычно развивается в течение:
а. 24 часов
б. 48 часов
в. 78 часов
г. 96 часов
д. 120 часов
Клинические задачи.
Задача 1.
А. У мальчика, родившегося в умеренной асфиксии с аспирацией мекония, на фоне оксигенотерапии методом СДППД через маску оценка по шкале Сильвермана 3 балла. Ра02 45 мм. рт. ст., РаС02 70 мм. рт. ст.
Какова дальнейшая тактика?
Б. На фоне ИВЛ состояние ребенка стабилизировалось только после ужесточения параметров. На 4-е сутки произошло внезапное ухудшение состояния, резко появился цианоз, не уменьшающийся при увеличении концентрации кислорода, грудная клетка несимметрично участвует в дыхании, тахикардия, глухость сердечных тонов, смещение средостения вправо, выбухание левой части грудной клетки, отсутствие дыхательных шумов слева. Какое осложнение имеет место?
Задача 2.
Ребенок от срочных родов, масса 3700 г, длина 51 см, во время родов произошла задержка разрыва плодных оболочек, при их разрыве отмечено наличие мекония в околоплодных водах. Состояние ребенка с рождения тяжелое, выражена дыхательная недостаточность (ригидность грудной клетки, усиленная функция вспомогательной дыхательной мускулатуры, обилие разнокалиберных влажных хрипов в легких).
На рентгеновском снимке: участки апновматоза (отсутствие пневмотизации) с мозаикой эмфизематозных участков (значительного просветления),
А) Диагноз?
Б) Какая летальность при этом синдроме?
В) Какие мероприятия мед. помощи наиболее всего влияют на успех помощи?
Г) Показания к этим мероприятиям помощи?
Д) Если второй вариант клинического течения этого синдрома?
Е) принципиальный алгоритм помощи таким детям?
Задача 3.
А. Новорожденный мальчик, первые сутки, от первых преждевременных родов в 28 недель, родился с массой 1200 г, длиной 35 см. Состояние с рождения тяжелое за счет выраженных дыхательных расстройств. Одышка 80 в мин, цианоз, втяжение межреберий, западение грудины, парадоксальное дыхание, экспираторные дистанционные шумы. В легких выслушиваются рассеянные крепитирующие хрипы, перкуторный звук мозаичный. На рентгенограмме легких - ячеистый рисунок.
Диагноз? Тактика?
Б. К концу первых состояние стабильно тяжелое, ребенок находится на ИВЛ. Тахикардия, АД 25/15 мм. рт. ст. Диурез 5мл за 10 часов.
Дальнейшая тактика?
В. На фоне проводимой терапии состояние ребенка стабильное. Кожа розовая, дыхание в легких симметрично, хрипов нет.
В каких пределах необходимо поддерживать показатели газов крови для новорожденного на ИВЛ?
Контрольные вопросы.
1. Что является основными причинными факторами развития РДС?
2. Что такое сурфактант? Его состав.
3. Основные функции сурфактанта
4. Назовите факторы снижающие синтез сурфактанта
5. Оценка тяжести РДС по шкале Сильвермана в баллах
6. Признаки шкалы Сильвермана
7. Основные рентгенологические признаки РДС
8. Что такое СРАР?
9. Виды проведения СРАР
10. Что такое СУВ?
Ответы.
Тесты:
1. а, б, в, г
2. а, б, в, г
3. а, б, в
4. г
5. в
6. а, б, в, д
7. в
8. б
9. в
10. б
11. г
Задача 1.
А. Показана ИВЛ. Стартовые параметры: Fi02 - 0,8, Rate 60 - 80, PIP - 20 см Н20, PEEP - 3 см Н20, Ti - 0,3.
Б. Синдром утечки воздуха. Пневмоторакс левосторонний
Задача 2.
а) Основной диагноз: РДС, вторичный, синдром аспирации мекония.
б) Летальность доношенных новорожденных при этом синдроме-10%.
в) Своевременностью и качеством санации трахеи и бронхов, отсасывание содержимого желудка сразу после рождения.
г) Независимо от того, есть ли клиника аспирации мекония, если околоплодные воды окрашены, положено проводить отсасывание из желудка и санацию дыхательных путей через интубационную трубку.
д) Да, есть второй вариант синдрома, проявляющийся светлым промежутком в состоянии, затем развитие СДР по взрослому типу, где шумная экспирация связана не со спазмом голосовой щели, а с бронхоспазмом и выраженной эмфиземой.
е) Оксигенотерапия, под контролем пульсоксиметрии.
Санация дыхательных путей.
Санация желудка.
Введение антибиотиков.
Восполнение ОЦК.
Нормализация реологических свойств крови.
Корреляция нарушенного метаболизма.
Симптоматическая терапия.
Организация правильного ухода и вскармливания
Задача 3.
A. РДС I типа, тяжелый.
Фон: недоношенность III степени.
Кувез t =34°С. Периодическая смена положения в кувезе.
ИВЛ. ИВЛ: Rate=40, PIP=15 см Н20, РЕЕР=3 см Н20,1: Е=1:
1. FiO2=0,6.
Инфузионная терапия 5 и 10% раствором глюкозы 70 мл и к концу 1-х суток натрия хлорид 0,9 % раствор 26 мл со скоростью 4 мл/час (80мл/кг/сут).
Введение экзосурфа с интервалом 8-12 часов эндотрахеально. общая дозировка 5 мл х 2 раза в сутки.
Б. в/в капельное введение дофамина (добутрекса) 2,5 мкг/кг/мин Д=6хМхдозу в мкг/кг/мин: скорость введения мл/час (0,1 мл 40 % -ного или 0,5 мл 8 % раствора развести в 100 мл 5 % глюкозы и вводить со скоростью 4 мл/час).
B. Sa 02 92 - 94%.
Ра02 50 - 80 мм рт. ст.
РаС02 35-45. мм рт. ст.
Вопросы:
а. дефицит образования и выброса сурфактанта;
II. Сурфактант (Surfactant (англ.) - Surface Active Agent) - поверхностно-активное вещество, синтезируемое альвеолоцитами II типа (покрывающими около 3% поверхности альвеол) и безволосковыми бронхиолярными клетками (клетки Клара). Он на 90% состоит из липидов и 10 % сухого веса сурфактанта - белки. Липиды на 90 % состоят из фосфолипидов: фосфатидилхолин (лецитин) - 70 % (4 5 - 5 0 % - окисленный, насыщенный и 20 - 25 % - ненасыщенный), фосфатидилглицерол - 6% и другие фосфолипиды - 6 %; 10% - нейтральные липиды. Белки: протеины А, В, С, D.
III. Сурфактант обладает следующими основными функциями:
· препятствует спадению альвеол на выдохе;
· защищает альвеолярный эпителий от повреждений и способствует мукоцилиарному клиренсу;
· обладает бактерицидной активностью против грамположительных микробов и стимулирует макрофагальную реакцию в легких;
· участвует в регуляции микроциркуляции в легких и проницаемости стенок альвеол, препятствует развитию отека легких.
IV. Факторы снижающие синтез сурфактанта:
а. холодовая травма, в том числе использование при ИВЛ не подогретой кислородно-воздушной смеси;
б. патологический ацидоз;
в. гиповолемия;
г. полицитемия;
д. гипоксемия;
е. гипероксия;
ж. баротравма и волюмотравма легких;
з. инфекции, как анте-, так интра-, постнатальные.
V. При суммарной оценке:
· 10 баллов - крайне тяжелый РДС
· 6-9 балов - тяжелый
· 5 баллов - средней тяжести
· ниже 5 - начинающийся РДС
VI. Признаки:
Участие верхней части грудной клетки и передней брюшной стенки в акте дыхания
Участие межреберий в акте дыхания
Участие мечевидного отростка в акте дыхания
Движение подбородка при дыхании
Экспираторные шумы
VII. Рентгенологические признаки РДС:
· Снижение пневматизации легких, воздушные бронхограммы, границы сердца на рентгенограмме ещё различимы
· Выраженное снижение пневматизации легких, воздушные бронхограммы, границы сердца практически не различимы, стёрты
· Резкое снижение пневматизации легких, воздушные бронхограммы, границы сердца не различимы, "белые лёгкие"
VIII. СРАР - continuous positive airway pressure - постоянное (т.е. непрерывно поддерживаемое) положительное давление в дыхательных путях. Препятствует спадению альвеол и развитию ателектазов. Может быть установлено в качестве положительного давления в конце выдоха при проведении ИВЛ или являться самостоятельным методом респираторной поддержки у новорождённых с сохранённым спонтанным дыханием.
IX. СРАР может проводиться через:
Интубационную трубку, установленную в трахеи (в настоящее время не рекомендуется)
Мононазальную канюлю (назофарингеальную трубку)
Назальную маску
Биназальные канюли
X. Синдром утечки воздуха (СУВ) является одним из наиболее опасных осложнений РДС новорождённого при использовании ИВЛ и сурфактантов. Своевременное предупреждение, распознавание и лечение СУВ является необходимым условием для эффективного лечения РДС.
Литература
1. "Дистресс-синдром респираторный" // М.Ф. Логачев, В.Н. Семенов.
2. Синдром дыхательных расстройств (СДР.) I типа у новорожденных детей // Евтюков Г.М., Иванов Д.О. // Санкт-Петербургская педиатрическая медицинская Академия
3. Neonatology // T.L. Gomella, Francis Scott
4. Неонатология // Шабалов Н.П. Диагностика и лечение респираторного дистресс-синдрома (РДС) недоношенных // Проект методических рекомендаций Российской ассоциации специалистов перинатальной медицины (РАСПМ): Байбарина Елена Николаевна, г. Москва; Верещинский Андрей Миронович, г. Нижневартовск, Горелик Константин Давидович, г. С-Петербург; Гребенников Владимир Алексеевич, г. Москва; Дегтярев Дмитрий Николаевич, г. Москва; Иванов Сергей Львович, г. С-Петербург; Ионов Олег Вадимович, г. Москва; Любименко Вячеслав Андреевич, г. С-Петербург; Мостовой Алексей Валерьевич, г. С-Петербург; Мухаметшин Фарид Галимович, г. Екатеринбург; Панкратов Леонид Геннадьевич, г. С-Петербург; Пруткин Марк Евгеньевич, г. Екатеринбург; Романенко Константин Владиславович, г. Челябинск; Фомичев Михаил Владимирович, г. Нижневартовск; Шведов Константин Станиславович, г. Нижневартовск. 2007
5. Neonatal-Perinatal Medicine // Ed. A.A. Fanaroff and R.J. Martin, 2002 de Mello D.E. et al., 1994; Nogee L. M., 1995; Chetcuti P.A.J., Ball R.J., 1995
6. Неотложные состояния в педиатрии // Ε. Η. Афанасьев, Η.В. Балыкина и др.
7. Неонатология // под редакцией В.В. Гаврюшина, К.А. Сотникова, Ленинград “МЕДИЦИНА”, 1985
8. Принципы ведения новорожденных с РДС // Методические рекомендации // А.Г. Антонов, Н.Н. Володин, В.А. Гребенников и др.
9. Принципы ведения новорожденных с РДС // Методические рекомендации // Д.Н. Дегтярёв, В.А. Любименко, О.Б. Миление, А.М. Аксёнов и др.
10. Острый респираторный дистресс-синдром. // Кассиль В.Л., Золотокрылина Е. С.
11. Адроге Г.Дж., Тобин М.Дж. Дыхательная недостаточность. Перевод Кассиля В. Л.
12. Acute Respiratory Distress Syndrome Network (2000). Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome // N Engl J Med. - 2000.
13. Pinhu L., Whitehead T., Evans T. et al. Ventilator-associated lung injury // Lancet. - 2003.
14. Lee D.L., Chiang H.T., Lin S.L. et al. Prone-position ventilation induces sustained improvement in oxygenation in patients with acute respiratory distress syndrome who have a large shunt // Crit Care Med. - 2002.
15. Johannigman J.A., Davis K.Jr., Miller S.L. et al. Prone positioning and inhaled nitric oxide: synergistic therapies for acute respiratory distress syndrome // J Trauma. - 2001.
16. Meduri C.U., Headley A.S., Golden E. et al. Effect of prolonged methylprednisolone therapy in unresolving acute respiratory distress syndrome // JAMA. - 1998 г.
17. Сушко Е.П., Новикова В.И. и др. // Неонатология // учебное пособие 1998 г.
18. Фомичев М.В. // Респираторная терапия у новорожденных // 2000 г.
19. Patrick Truffert et al. Neuromotor Outcome at 2 Years of Very Preterm Infants Who Were Treated With High-Frequency Oscillatory Ventilation or Conventional for Neonatal Respiratory Distress Syndrome, Pediatrics. April 2007.
20. Кассиль В.Л., Золотокрылина Е.С. // Острый респираторный дистресс-синдром. - М.: Медицина, 2003.
21. Марини Джон Дж., Уилер Артур П. Медицина критических состояний: пер. с англ. - М.: Медицина, 2002 г.
22. Болезни органов дыхания у детей, под ред. С.В. Рачинского и В.К. Таточенко, М., 1987.
23. Дифференциальная диагностика респираторного дистресс-синдрома // Эстрин В.В.; Ефанова Е.А.; Бичуль О. К. 1997г.
24. Решение проблем новорожденных // Руководство для эффективной практики - Департамент РЗ и исследований, Всемирная Организация Здравоохранения 2005г.
25. Greenough A., Robertson N.R.C., // Neonatal ventilation. - Early Hum. Dev., 1986
26. Stark A.R., Frantz I.D. // Respiratory distress syndrome // Pediatr. Clin. North. Am., 1986
27. Thibeault D.W., Gregory G.A. // Neonatal Pulmonary Care // Appleton-Century-Grofts, 1986
28. Philips J.R. // Management of the meconium-stained infant // Neonatal. Grand. Rounds., 1996
29. Alex C.G., Aronson R.M., Onal E., Lopata M. Effects of continuous positive airway pressure on upper airway and respiratory muscle activity. J Appl Physiol 1987;
30. Байбарина Е.Н., Антонов А.Г., Ионов О.В. Раннее применение назального СДППД с вариабельным потоком у недоношенных со сроком гестации 28-32 недели. // Интенсивная терапия 2006. № 2.
31. Bose C., Lawson E.E., Greene A., Mentz W., Friedman M. Measurement of cardiopulmonary function in ventilated neonates with respiratory distress syndrome using rebreathing methodology. Pediatric Res. 1986;
32. Colin Morley "Continuous distending pressure" Arch. Dis. Child. Fetal Neonatal Ed. 1999;
33. Cotton R.B., Lindstrom D.P., Kanarek K.S., Sundell H., Stahlman M.T. Effect of positive-end-expiratory-pressure on right ventricular output in lambs with hyaline membrane disease. Acta Paediatrica Scandinavica 1980.
34. Davis P.G., Henderson-Smart D.J. Prophylactic postextubation nasal CPAP in preterm infants. Neonatal module of the Cochrane database of systematic reviews 1997. The Cochrane Collaboration. Issue 1. Oxford: Update Software, 1998.
35. Engelke SC, Roloff DW, Kuhns LR. Postextubation nasal continuous positive airway pressure. Am. J Dis Child 1982.
36. Harris T.R., Wood B.R. Physiologic Principles. In: Goldsmith J. P., Karotkin E. H., eds. Assisted Ventilation.3rd edn. Philadelphia: WB Saunders, 1996.
37. Locker R., Greenspan J. S., Shaffer T. S., Rubenstein S. D., Wolfson M. R. Effect of nasal CPAP on thoracoabdominal motion in neonates with respiratory insufficiency. Pediatr Res 1994.
38. Miller M.J., Carlo W.A., Martin R.J. Continuous positive airway pressure selectively reduces obstructive apnea in preterm infants. J Pediatr 1985.
39. Prophylactic nasal continuous positive airways pressure in newborns of 28-31 weeks gestation: multicentre randomized controlled clinical trial F Sandri, G Ancora, A Lanzoni, P Tagliabue, M Colnaghi, M L Ventura, M Rinaldi, I Mondello, P Gancia, G P Salvioli, M Orzalesi and F Mosca Arch. Dis. Child. Fetal Neonatal Ed. 2004.
40. Saunders R.A., Milner A.D., Hopkin I.E. The effects of CPAP on lung mechanics and lung volumes in the neonate. Biol Neonate 1976.
41. So B-H, Tamura M, Mishina J, Watanabe T, Kamoshita S. Application of nasal continuous positive airway pressure to early extubation in very low birthweight infants. Arch Dis Child Fetal Neonatal Ed 1995.
42. Verder H., Robertson B., Griesen G., et al. The Danish-Swedish multicentre study group. Surfactant therapy and nasal continuous positive airway pressure for newborns with respiratory distress syndrome. N Engl J Med 1994; 331: 1051-5.
| Синдром острого повреждения легких | |
|
... Пензенский Государственный Университет Медицинский Институт Кафедра Хирургии Зав. кафедрой д.м.н., РЕФЕРАТ на тему: Синдром острого повреждения легких В 60-70-х годах разными авторами был описан синдром острой дыхательной недостаточности, возникающий на фоне интенсивной терапии у больных с острой кровопотерей, с тяжелой ... 1). Основная цель этой шкалы - объективизация оценки выраженности функциональных изменений при синдроме острого легочного повреждения, в том числе при проведении больному ... |
Раздел: Рефераты по медицине Тип: реферат |
| ЦНС | |
|
Этот файл взят из коллекции Medinfo http://www.doktor.ru/medinfo http://medinfo.home.ml.org E-mail: medinfo@mail.admiral.ru or medreferats@usa.net or ... При тяжелом состоянии с нарушением сознания проводится полный комплекс мероприятий интенсивной терапии, включая интубацию трахеи и перевод на ИВЛ при нарушениях дыхания. Инструктор , стоя сбоку от больного и расположив свои руки на его грудной клетке , вначале следует пассивно за дыхательными экскурсиями , как бы " подстраиваясь под ритм дыхания ... |
Раздел: Рефераты по медицине Тип: реферат |
| Стандарт сестринской помощи пациентам отделения реанимации | |
|
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БАШКОРТОСТАН ОКТЯБРЬСКИЙ ФИЛИАЛ БАШКИРСКОГО МЕДИЦИНСКОГО КОЛЛЕДЖА "Стандарт сестринской помощи пациентам ... ... психическое состояние больного, состояние его костно - мышечной системы и кожного покрова, состояние раны, параметры боли, способность пациента к передвижению, состояние его ... Пациенты с данными синдромами интенсивной терапии требуют специального наблюдения, более качественного ухода. |
Раздел: Рефераты по медицине Тип: реферат |
| Методики лазерной терапии | |
|
Методики лазерной терапии Более подробно с методиками лазерной терапии можно познакомиться в книгах серии "Основы лазерной терапии": Москвин С.В ... ... после 32 недель гестации позволяет добиться ремиссии вирусной инфекции, пролонгировать беременность, снизить процент инфекционных осложнений у новорожденных на 25% по сравнению с ... У них также отмечено достоверное уменьшение постгипоксических кардиопатий (в 7,1 раз), дыхательных расстройств (в 4,2 раза), различных синдромов перинатального поражения ЦНС (в 2,4 ... |
Раздел: Рефераты по медицине Тип: статья |
| Сборник тестовых заданий для итоговой государственной аттестации по ... |
|
Раздел: Рефераты по медицине Тип: реферат |