Курсовая работа: Нитрование n-нитроацетанилид
Нитрование n-нитроацетанилид
Москва 2009 г
Введение
Нитрования – один из важнейших процессов в химической промышленности. Продукты, получаемые за счёт нитрования, являются полуфабрикатами для производства многих товаров различных назначений от взрывчатых веществ до продукции фармацевтической промышленности. Чаще всего нитросоединения являются промежуточными продуктами производство азокрасителей и других веществ. В данной работе рассмотрены способы получения нитросоединений, химические свойства, таутометрия соединений, а также применение нитросоединений в народном хозяйстве.
Целью УИРС является синтез n-нитроацетанилида.
n-Нитроацетанилид - аморфное вещество бледно-желтого цвета, трудно растворимое в большинстве органических растворителей, т. пл. 206 ... 207 0С.
Литературный обзор
1. Нитрование и способы получения нитросоединений
Нитрование - введение нитрогруппы – NO2 в молекулы органических соединений. Может проходить по электрофильному, нуклеофильному и радикальному механизмам; активные частицы в этих реакциях - соответственно катион нитрония NO2, нитрит - ион NO2 и радикал NO2. нитрование может осуществляться по атомам С, N, О замещением атома водорода (прямое нитрование) или других функциональных групп (заместительное нитрование) либо в результате присоединения группы NO2; по кратной связи.
Нитрогруппу в молекулу ароматического углеводорода можно вводить различными путями; главным из них является нитрование углеводородов смесью азотной и серной кислот (нитрующая смесь) в жидкой фазе, последняя одновременно является катализатором процесса, водоотнимающим средством и веществом, способствующим более полному использованию азотной кислоты и препятствующим окислительным процессам. Но по механизму все способы нитрования ароматических углеводородов идут по электрофильному замещению.
Нитрования как процесс принято называть взаимодействие органического соединения с азотной кислотой или её производными, в результате которого атом водорода при одном или нескольких атомах углерода замещается нитрогруппой. В общем случае для процесса нитрования ароматических углеводородов (в ароматическое кольцо) можно написать уравнение:
ArH + NO2+ Ar-NO2 +H+
При нитровании только азотной кислотой реакция может быть выражена уравнением
ArH + HONO2 Ar-NO2 +H2O
Это уравнение даёт лишь общее представление о ходе реакции, но не характеризует всего сложного процесса нитрования, протекающего в несколько стадий; в действительности в реакцию с ароматическими углеводородами вступает не сама азотная кислота, а продукты её превращения.
Как видно из приведённого уравнения, при нитровании азотной кислотой введение каждой нитрогруппы в молекулу углеводорода сопровождается образованием молекулы воды. Это значительно уменьшает концентрацию азотной кислоты и понижает её нитрующую способность, а образующаяся слабая азотная кислота увеличивает степень окисления углеводородов. Поэтому нитрование углеводородов только азотной кислотой осуществляют крайне редко; в том случае необходим избыток азотной кислоты по сравнению с теоретически требуемым, а реакцию надо проводить при низких температурах, чтобы ослабить протекание нежелательных окислительных процессов.
Для связывания воды, выделяющейся в процессе нитрования, применяют водоотнимающие вещества – серную кислоту, полифосфорные кислоты, уксусных ангидрид, трёхфтористый бор. Серная кислота – наиболее доступное и дешёвое вещество для этих целей. Она эффективно связывает воду и переводит азотную кислот в активную нитрующую форму; это позволяет резко снизить расход азотной кислоты почти до теоретического.
Роль серной кислоты заключается не только в связывании реакционной воды. Ещё в 1889 г. В. В. Марковников установил, что наличие в реакционной среде серной кислоты ускоряет реакцию нитрования. Следовательно, серную кислоту можно рассматривать как катализатор этой реакции. Заводская практика подтвердила, что нитрование ароматических углеводородов смесью азотной и серной кислот протекает значительно быстрее, чем при действии безводной азотной кислоты, даже взято в большом избытке.
Для промышленных процессов нитрования (и сульфирования) в качестве водоотнимающего средства предложен трёхфтористый бор BF3 . при добавлении достаточного количества трёхфтористого бора реакции сульфирования и нитрования можно проводить стехиометрическими количествами соответствующих кислот (серной и азотной). Полагают, что реакции протекают по следующим схемам:
ArH + HNO3 + BF3 Ar-NO2 + BF3·H2O
ArH + H2SO4 + BF3 Ar-SO3H + BF3·H2O
По окончании реакции добавляют воду; при этом моногидрат фтористого бора превращается в дигидрат BF3·2H2O, который можно отогнать в вакууме. Далее его обрабатывают фтористым кальцием
2BF3·2H2O + CaF2 Ca(BF4)2 + 4H2O
и при нагревании регенерируют BF3:
Ca(BF4)2 2BF3 + CaF2
Особенности проведения нитрования зависят как от использующихся реагентов, так и от субстрата реакции.
Реагенты для проведения реакции нитрования
1. HNO3 (63-65%, d 1.35 г/мл, товарный продукт) + H2SO4 (96%). Наиболее распространенный.
2. HNO3 (98%, d 1.5 г/мл, также товарный продукт) + H2SO4 (96%-100 %). Для мало реакционноспособных соединений.
3. HNO3 (98%) + SO3 (4-63%), олеум. Для очень мало реакционноспособных соединений.
4. К(Na)NO3 или NH4NO3 + H2SO4 (96%). Распространенный реагент для получения полинитропроизводных.
5. HNO3 (98%, d 1.5 г/мл) + (CH3CO)2O (или СН3СООН). Для реакционноспособных соединений, селективный реагент. Реагент дорогой, поэтому необходимо обосновать экономическую целесообразность его использовании.
6. HNO3 (d 1,3 - 1,5). Для реакционноспособных соединений. Осложнение – побочная реакция окисления.
2. Химические свойства нитросоединений
Нитрогруппа отличается высокой стабильностью по отношению к электрофильным реагентам и разнообразным окислителям. Большинство нуклеофильных агентов за исключением литий- и магнийорганических соединений, а также литийалюминийгидрида не действуют на нитрогруппу. Нитрогруппа относится к числу превосходных нуклеофильных групп в процессах активированного ароматического нуклеофильного замещения ( SNAr). Так, например, нитрогруппа в 1,2,4- тринитробензоле легко замещается под действием гидроксид-, алкоксид-ионов или аминов.
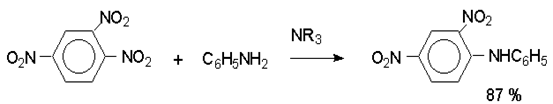
Наиболее важной реакцией ароматических нитросоединений является восстановление их до первичных аминов.
Эта реакция была открыта в 1842 году Н.Н.Зининым, который впервые восстановил нитробензол до анилина действием сульфида аммония. В настоящее время для восстановления нитрогруппы в аренах до аминогруппы в промышленных условиях применяется каталитическое гидрирование. В качестве катализатора используют медь на силикагеле в качестве носителя. Катализатор готовят нанесением карбоната меди из суспензии в растворе силиката натрия и последующим восстановлением водородом при нагревании. Выход анилина над этим катализатором составляет 98 %.

Иногда в промышленном гидрировании нитробензола до анилина в качестве катализатора используют никель в комбинации с оксидами ванадия и алюминия. Такой катализатор эффективен в интервале 250-300о и легко регенерируется при окислении воздухом. Выход анилина и других аминов составляет 97-98 %. Восстановление нитросоединений до аминов может сопровождаться гидрированием бензольного кольца. По этой причине для получения ароматических аминов избегают использовать в качестве катализаторов платину. палладий или никель Ренея.
Другим методом восстановления нитросоединений является восстановление металлом в кислой или щелочной среде.
Восстановление нитрогруппы до аминогруппы происходит в несколько стадий, последовательность которых сильно различается в кислой и щелочной среде. Рассмотрим последовательно процессы, протекающие при восстановлении нитросоединений в кислой и щелочной среде.
При восстановлении в кислой среде в качестве восстановителя применяют железо, олово, цинк и соляную кислоту. Эффективным восстановителем нитрогруппы является хлорид олова (II) в соляной кислоте. Этот реагент особенно эффективен в тех случаях, когда в ароматическом нитросоединении есть другие функциональные группы : CHO, COR, COOR и др., чувствительные к действию других восстановителей.
Восстановление нитросоединений до первичных аминов в кислой среде происходит ступенчто и включает три стадии с переносом двух электронов на каждой стадии.
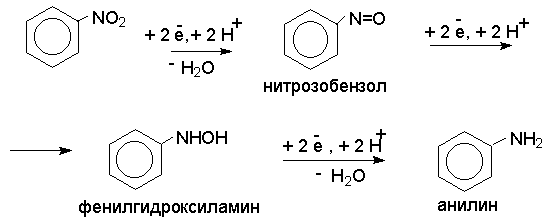
В кислой среде каждый из промежуточных продуктов быстро востанавливается до конечного продукта анилина и их не удается выделить в индивидуальном виде. Однако, в апротонных растворителях в нейтральной среде можно зафиксировать промежуточные продукты восстановления.
При восстановлении нитробензола натрием или калием в ТГФ сначала образуется анион-радикал нитробензола за счет переноса одного электрона от щелочного металла.
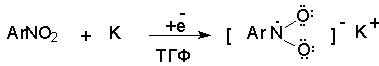
Катион щелочного металла связан в контактную ионную пару с атомом кислорода нитрогруппы анион-радикала. При дальнейшем восстановлении анион-радикал превращается в дианион, который после протонирования дает нитрозобензол.
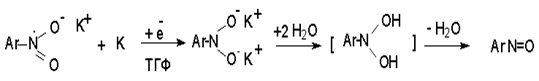
Нитрозобензол, также как и другие ароматические нитрозосоединения, обладает высоким окислительным потенциалом и очень быстро восстанавливается до N-фенилгидроксиламина. Поэтому нитрозобензол не удается выделить в качестве промежуточного продукта восстановления, хотя данные электрохимического восстановления однозначно указывают на его образование.
Дальнейшее восстановление нитрозосоединений до N-арилгидроксиламина включает две аналогичные стадии одноэлектронного восстановления до анион-радикала и далее до дианиона нитрозосоединения, который при протонировании превращается в N-арилгидроксиламин.
![]()
Последняя стадия восстановления арилгидроксиламина до первичного амина сопровождается гетеролитическим расщеплением связи азот-кислород после протонирования субстрата.
![]()
В нейтральном водном растворе можно получить фенилгидроксиламин в качестве продукта восстановления нитробензола. Фенилгидроксиламин получается при восстановлении нитробензола цинком в водном растворе хлорида аммония.
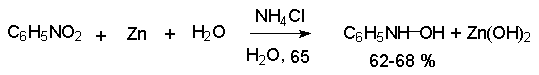
Арилгидроксиламины легко восстанавливаются в амины при обработке железом или цинком и соляной кислотой.
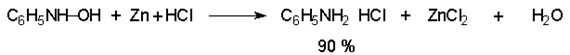
Поскольку фенилгидроксиламин является промежуточным продуктом восстановления, его можно не только восстановить до анилина, но и окислить до нитрозобензола.
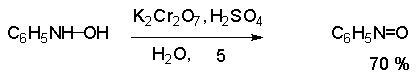
Это, вероятно, один из лучших методов получения ароматических нитрозосоединений, которые не удается иным способом выделить в качестве промежуточного продукта восстановления нитросоединений.
Ароматические нитрозосоединения легко димеризуются в твердом состоянии, причем их димеры бесцветны. В жидком и газообразном состоянии они мономерны и окрашены в зеленый цвет.
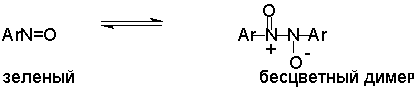
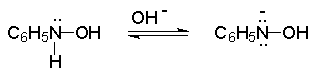
Восстановление нитросоединений металлами в щелочной среде отличается от восстановления в кислой среде. В щелочной среде нитрозобензол быстро взаимодействует со вторым промежуточным продуктом восстановления фенилгидроксиламином с образованием азоксибензола. Эта реакция по существу подобна присоединению азотистых оснований к карбонильной группе альдегидов и кетонов.
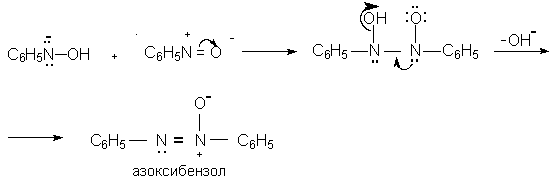
В лабораторных условиях азоксибензол с хорошим выходом получается при восстановлении нитросоединений боргидридом натрия в ДМСО, метилатом натрия в метиловом спирте или старым способом при использовании в качестве восстановителя As2O3 или глюкозы.
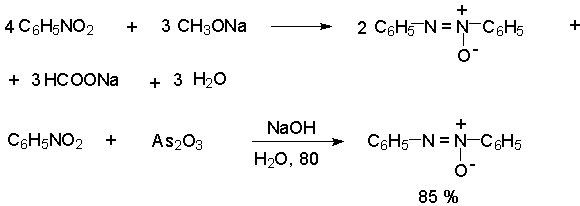
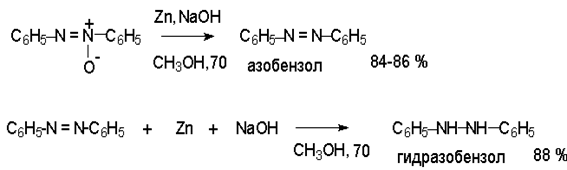
Азоксибензол при действии цинка в спиртовом растворе щелочи восстанавливается сначала до азобензола, а при действии избытка цинка далее до гидразобензола.
В синтетической практике производные азоксибензола могут быть восстановлены до азобензола под действием триалкилфосфита в качестве восстановителя. С другой стороны, азобензол легко окисляется до азоксибензола перкислотами.
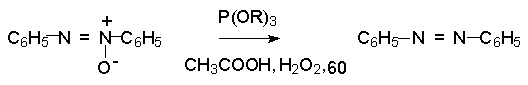
Азобензол существует в виде цис- и транс- изомеров. При восстановлении азоксибензола получается более стабильный транс-изомер, который при облучении УФ-светом превращается в цис-изомер.
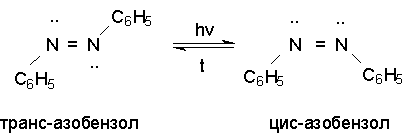
Несимметричные производные азобензола получаются при конденсации нитрозосоединений и первичных ароматических аминов.
![]()
При восстановлении ароматических нитросоединений алюмогидридом лития в эфире также образуются азосоединения с выходом, близким к количественному.
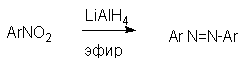
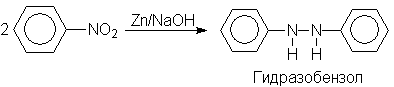
Азобензол восстанавливается цинковой пылью и спиртовой щелочью до гидразобензола. Гидразобензол является, таким образом, конечным продуктом восстановления нитробензола металлом в щелочной среде. На воздухе бесцветный гидразобензол легко окисляется до окрашенного в оранжево-красный цвет азобензола. Вместе с тем гидразобензол, также как и азобензол и азоксибензол, восстанавливается до анилина под действием дитионита натрия в воде или хлорида олова (II) в соляной кислоте.
![]()
Суммарный процесс восстановления ароматических нитросоединений металлами в кислой и щелочной среде может быть представлен в виде следующей последовательности превращений.
В кислой среде
![]()
В щелочной среде
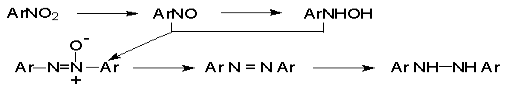
В промышленности анилин получают каталитическим восстановлением нитробензола на медном или никелевом катализаторе, который вытеснил старинный способ восстановления нитробензола чугунными стружками в водном растворе хлорного железа и соляной кислоты.
![]()
Восстановление нитрогруппы до аминогруппы сульфидом и гидросульфидом натрия в настоящее время имеет значение только для частичного восстановления одной из двух нитрогрупп, например, в м-динитробензоле или 2,4-динитроанилине.
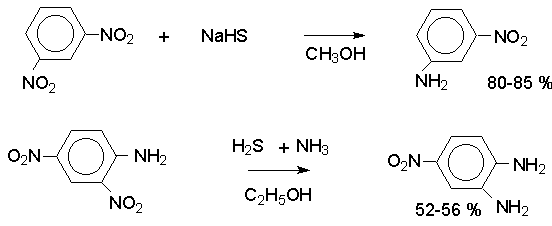
При ступенчатом восстановлении полинитросоединений с помощью сульфида натрия этот неорганический реагент превращается в тетрасульфид натрия, что сопровождается образованием щелочи.
![]()
Высокая щелочность среды приводит к образованию азокси- и азосоединений в качестве побочных продуктов. Для того чтобы избежать этого в качестве восстановителя следует использовать гиросульфид натрия, где щелочь не образуется.
3. Реакции нитросоединений
3.1 Таутомерия алифатических нитросоединений
Вследствие сильных электроноакцепторных свойств нитрогруппы, a-атомы водорода обладают повышенной подвижностью и поэтому первичные и вторичные нитросоединения являются С-Н-кислотами. Так, нитрометан является довольно сильной кислотой (pKa 10,2) и в щелочной среде легко превращается в резонансностабилизированный анион:
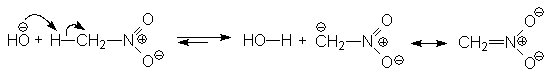
Нитрометан pKa 10,2 Резонансностабилизированный анион
3.2 Конденсация алифатических нитросоединений с альдегидами и кетонами
Нитрогруппа может быть введена в алифатические соединения альдольной реакцией между анионом нитроалкана и альдегидом или кетоном. В нитроалканах a-атомы водорода даже более подвижны, чем в альдегидах и кетонах и поэтому они могут вступать с альдегидами и кетонами в реакции присоединения и конденсации предоставляя свои a-атомы водорода. С алифатическими альдегидами обычно проходят реакции присоединения, а с ароматическими – исключительно конденсации.
Так, нитрометан присоедняется к циклогексанону
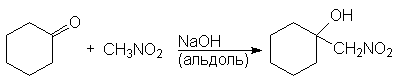
1-Нитрометилциклогексанол но конденсируется с бензальдегидом
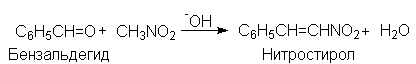
В реакции присоединения с формальдегидом участвуют все три атома водорода нитрометана и образуется 2-гидроксиметил-2-нитро-1,3-динитропропан или триметилолнитрометан.
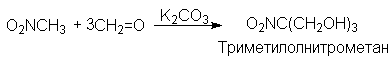
Конденсацией нитрометана с гексаметилентетрамином мы получили 7 нитро-1,3,5-триазаадамантан
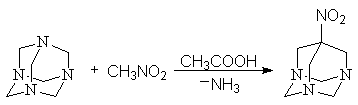
3.3 Восстановление нитросоединений
Нитрогруппу восстанавливают в аминогруппу различными восстановителями (11.3.3). Гидрированием нитробензола под давлением в присутствии никеля Ренея в промышленных условиях получают анилин
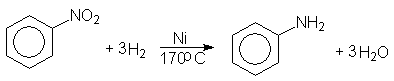
Анилин
В лабораторных условиях вместо водорода можно использовать гидразин, разлагающийся в присутствии никеля Ренея с выделением водорода.
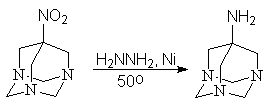
7-нитро-1,3,5-триазаадамантан 7-амино-1,3,5-триазаадамантан
Нитросоединения восстанавливают металлами в кислой среде с последующим подщелачиванием
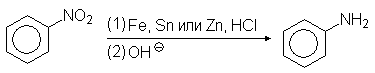
В зависимости от рН среды и используемого восстановителя могут быть получены различные продукты. В нейтральной и щелочной среде активность обычных восстанавливающих агентов по отношению к нитросоединениям меньше, чем в кислой среде. Характерным примером может служить восстановление нитробензола цинком. В избытке соляной кислоты цинк восстанавливает нитробензол в анилин, в то время как в буферном растворе аммонийхлорида - в фенилгидроксиламин/
таутометрия нитросоединение лаборатория
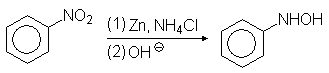
В кислой среде арилгидроксиламины подвергаются перегруппировке:
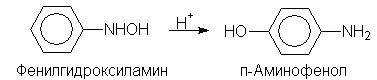
п-Аминофенол используется в качестве проявителя в фотографии. Фенилгидроксиламин далее может быть окислен до нитрозобензола:
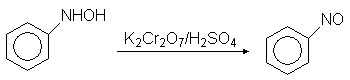
Нитрозобензол
Восстановлением нитробензола хлоридом олова (II) получают азобензол, а цинком в щелочной среде – гидразобензол.
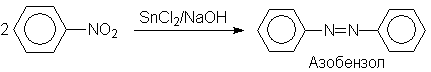
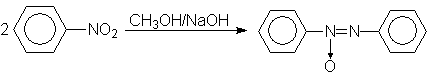
Обработкой нитробензола раствором щелочи в метаноле получают азоксибензол, при этом метанол окисляется в муравьиную кислоту.
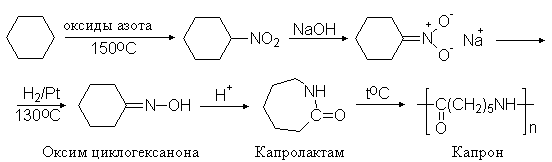
Известны методы неполного восстановления и нитроалканов. На этом основан один из промышленных методов получения капрона. Нитрованием циклогексана получают нитроциклогексан, который восстановлением переводят в оксим циклогексанона и далее с помощью перегруппировки Бекмана - в капролактам и полиамид - исходное вещество для приготовления волокна – капрона
Восстановление нитрогруппы продуктов альдольного присоединения (7) является удобным способом получения b-аминоспиртов.
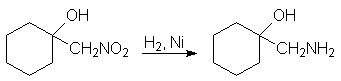
1-Нитрометилциклогексанол 1-Аминометилциклогексанол
Использование в качестве восстановителя сероводорода позволяет восстанавливать одну из нитрогрупп в динитроаренах
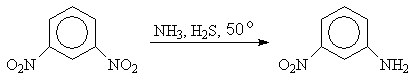
м-Динитробензол м-Нитроанилин
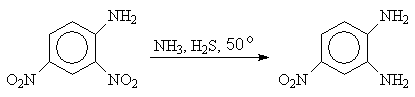
2,4-Динитроанилин 4-Нитро-1,2-диаминобензол
4. Применение нитросоединений в народном хозяйстве
Нитросоединения широко применяются в нефтеперерабатывающей и фармацевтической промышленности, в производстве полимерных материалов, взрывчатых веществ и порохов, а также в ряде других отраслей промышленности и сельского хозяйства.
Опыт. Синтез. n-нитроацетанилид
Пара-нитроацетанилид


![]()
 NHCOCH3 NHCOCH3
NHCOCH3 NHCOCH3![]()

![]()
![]() + HONO2
+ HONO2
- H2O O2N
Реактивы: ацетанилид – 3,5 г;
азотная кислота (ρ = 1,36) – 3 мл;
серная кислота (ρ = 1,84) – 9,5 мл;
этанол
Аппаратура: химический стакан на 200мл; баня со льдом; колба Бунзена; воронка Бюхнера.
Ход работы
Опыт №1.
В фарфоровый стакан емкостью 200 мл всыпают 3,5 г тонко измельченного сухого ацетанилида, приливают 7,5 мл концентрированной серной кислоты и размешивают стеклянной палочкой до образования прозрачного раствора. Температура смеси при этом не должна подниматься выше 25˚С во избежание частичного омыления ацетанилида. Раствор охлаждают до +2˚С в бане со снегом и постепенно при помешивании приливают нитрующую смесь, содержащую 3 мл азотной кислоты и 2 мл концентрированной серной кислоты. Во время реакции нитрования температура реакционной массы не должна превышать 15˚С с целью снижения содержания нитроацетанилида.
После прибавления всей нитрирующей смесираствор продолжают перемешивать еще в течении получаса. Затем реакционную смесь выливают в стакан с холодной водой (10 мл) и снегом (10г) и хорошо перемешивают. Образующийся осадок и нитроацетанилида отделяют фильтрованием на воронке Бюхнера и промывают на фильтре несколько раз холодной водой и сушат.
Опыт №2.
В работе также был проделан еще раз вышеописанный опыт, но с измененными условиями: объем азотной кислоты был увеличен с 3 мл до 7 мл.
Результаты проделанных опытов сводим в таблицу.
| Исходные вещества | Количество получаемого вещества | Потери, % | |||||||
| Названия формула вещества |
Mr |
tпл |
tкип |
ρ г/м3 |
сод. % |
по теории, вещества, г | Теоретический выход, г | Практический выход, г | |
| Ацетанилид | 135,17 | 144 | 305 | 1,082 | 100 | 3,5 | |||
|
Азотная кислота |
63,01 | -42 | 83,8 | 1,36 | 57,6 | 4,89 | |||
| Паранитро ацетанилид | 180,16 | 215 | - | - | - | 10,49 | 3,4 | 67,8 | |
| Опыт №2 | 6,0 | 42,8 |
Результаты опыта №1
![]()
Результаты опыта №2
![]()
Вывод
В результате увеличения объема азотной кислоты во втором опыте количество полученного вещества увеличилось почти в 2 раза по сравнению с полученным веществом в первом опыте. Это приблизило значение практического выхода продукта к значению теоретического выхода, уменьшились потери.
Правила работы в лаборатории в органической химии
При работе в лаборатории органической химии всегда нужно помнить, что органические соединения в той или иной мере ядовиты, и многие из них огнеопасны и взрывоопасны. Поэтому в процессе работы необходимо соблюдать чистоту, аккуратность, быть внимательным, стремиться к тому, чтобы вещества не попадали на кожу, не трогать руками лицо и глаза, не принимать пищу во время работы, после работы и перед едой тщательно мыть руки.
Существует ряд общих правил, выполнение которых строго обязательно.
1. Приступать к работе можно только с разрешения преподавателя, после прохождения соответствующего инструктажа по технике безопасности и правилам работы в лаборатории.
2. Работать только на закрепленном за каждым студентом рабочем месте, соблюдая чистоту и порядок.
3. Проводить лабораторную работу следует в рабочем халате, быть аккуратным и внимательным.
4. Перед выполнением каждой операции следует проверять правильность сборки прибора, а также соответствие взятых в реакцию веществ, указанных в описании работы.
5. Категорически запрещается оставлять действующие приборы без наблюдения.
6. На всех банках, склянках и на другой посуде, в которой хранятся вещества.
7. Нельзя проводить какие бы то ни было опыты в загрязненной посуде. Посуду следует мыть после окончания опыта.
8. Запрещается втягивать ртом в пипетки любые растворы.
9. Нюхать вещества можно лишь осторожно, не вдыхая полной грудью, не наклоняясь над сосудом, а направляя к себе пары или газ движением руки.
10. Нельзя наклоняться над сосудом, в котором что-либо кипит или в который наливается какая-нибудь жидкость, так как брызги могут попасть в глаза. При нагревании жидкости в пробирке не направлять отверстие на себя или в сторону стоящего рядом
11. Категорически запрещается пробовать химические вещества на вкус.
12. Включая воду в стеклянные холодильники с водяным охлаждением необходимо установить небольшую скорость пропускания воды во избежание срыва шлангов подачи воды, следить за тем, чтобы резиновый шланг, по которому вытекает вода, не выходил из раковины.
13. В сливные воронки и раковины разрешается сливать лишь чистую воду и прозрачные растворы минеральных веществ. Категорически запрещается сливать концентрированные кислоты и щелочи, жидкие органические вещества, выбрасывать осадки с фильтров и другие твердые вещества.
14. При работе с газовыми горелками не допускается утечки газа, следить за тем, чтобы пламя не было коптящим или не отрывалось от горелки, после окончания работы закрыть газовый кран.
15. Если при проведении опыта разбился термометр, ртуть следует быстро собрать кисточкой из белой жести. Поверхность стола или пола тщательно обработать 20%-ным раствором хлорного железа.
16. При работах, производимых с использованием вакуума или повышенного давления, при переливании кислот или растворов щелочей, при щелочном плавлении, при реакциях сопровождающихся бурным вскипанием или взрывом, необходимо надевать предохранительные очки из толстого стекла или использовать защитный щиток из органического стекла. Однако лучше всего такие операции проводить в вытяжном шкафу, закрыв дверцы шкафа так, чтобы лицо было защищено от всевозможных брызг или осколков в случае взрыва. При работе с вакуум-эксикатором или колбой Бунзена необходимо поместить их в специальные защитные мешочки или обернуть плотной тканью во избежание попадания осколков стекла в глаза в случае взрыва.
17. Работа с баллонами со сжатым или сжиженным газом разрешается после получения специального инструктажа.
18. При перегонке органических веществ, при отгонке растворителя и других работах, связанных с нагреванием или атмосферным давлением, не допускается работы в герметически закрытых сосудах. Внутренне пространство любого прибора, не предназначенного для работы под давлением, должно иметь связь с атмосферой.
19. Работая с металлическим натрием (или калием), необходимо соблюдать осторожность: следить, чтобы на столе не оказалось даже незначительно количества воды, чтобы вблизи не было брызгающих шлангов от холодильников, брать металлический натрий только пинцетом, резать на сухой фильтровальной бумаге непосредственно перед употреблением, оставшиеся обрезки натрия и фильтровальную бумагу не бросать в раковины или ведра для мусора и не оставлять лежать открытыми. По окончании работы необходимо тщательно собрать все остатки непрореагировавшего натрия в банку с керосином и сдать лаборанту. Мелкие остатки непрореагировавшего натрия в реакционных сосудах уничтожить, растворяя их в этаноле.
20. Измельчение твердых щелочей и фенола проводятся в защитных очках и резиновых перчатках.
21. При разбавлении концентрированной серной кислоты вливают постепенно кислоту в воду. С дымящими кислотами работать только в вытяжном шкафу.
22. Особую осторожность нужно проявлять при работе с бромом, так как это очень ядовитое вещество, сильно действующее на слизистые оболочки и дающее трудно заживающие ожоги. Поэтому все работы с ним проводятся только в вытяжном шкафу, а очках и специальных резиновых перчатках.
23. При работе с легковоспламеняющимися веществами (эфир, петролейный эфир, бензол, ацетон и т.д.) не должно быть по соседству огня и включенных плиток. Нагревание следует проводить в колбах с обратным холодильником, перегонять досуха нельзя во избежание взрыва.
24. Определяя температуру плавления в приборе, заполненном Сеной кислотой, обязательно надевать защитную маску из органического стекла.
25. При нагревании жидкости в пробирке не направлять отверстие на себя или в сторону стоящего рядом, не заглядывать в пробирку сверху, так как возможен выброс.
26. По окончании работы необходимо выключить газовые горелки, закрыть воду, привести свое рабочее место в порядок.
Заключение
В результате работы была проработана литература по нитрованию углеводородов, рассмотрены способы получения нитросоединений, химические свойства, реакции нитросоединений, а также их применение в народном хозяйстве.
Также была найдена методика получения n-нитроацетанилида, по которой проведён синтез.
Список используемой литературы
1. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. М.: Химия, 1969. 670 с.
2. Адельсон С.В. и др. Технология нефтехимического синтеза. М.: Химия, 1985. 607 с.
3. Горелик М.В., Эффос Л.С. Основы химии и технологии ароматических соединений. М: Химия, 1992. 640 с.
4. Чичибабин А.Е. Основные начала органической химии. М.: Государственное научно-техническое изд-во химической литературы, 1963. т.1 545 с.
5. Грейш А.А., Демыгин С.С., Кустов Л.М. Нанесенные вольфрам-циркониевые и цеолитные катализаторы // Катализ в промышленности, 2002, № 4 с. 17
6. Чичибабин А.Е. Основные начала органической химии. М.: Государственное научно-техническое изд-во химической литературы, 1957. т.2 614 с.
7. Агрономов А.Е., Шабаров Ю.С. Лабораторные работы в органическом практикуме. Изд. 2-е, пер. и доп. М., "Химия", 1974 г.
| Синтез и свойства амилнитрита | |
|
Федеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования Самарский государственный ... Реактивы: амиловый спирт 77 г, нитрит натрия 38 г, серная кислота концентрированная 25 г, бикарбонат натрия 1 г, сульфат натрий, безводный 1 г, хлористый натрий. Восстановление ароматических нитросоединений в сочетании с нитрованием аренов является главным способом получения аминов. |
Раздел: Рефераты по химии Тип: курсовая работа |
| Разработка технологии концентрирования серной кислоты | |
|
СЛАБАЯ АЗОТНАЯ КИСЛОТА, КОНЦЕНТРИРОВАННАЯ СЕРНАЯ КИСЛОТА, РЕКУПЕРИРОВАННЫЕ И УЛОВЛЕННЫЕ КИСЛОТЫ, ОТРАБОТАННАЯ СЕРНАЯ КИСЛОТА, ТЕХНОЛОГИЯ ... СЛАБАЯ АЗОТНАЯ КИСЛОТА, КОНЦЕНТРИРОВАННАЯ СЕРНАЯ КИСЛОТА, РЕКУПЕРИРОВАННЫЕ И УЛОВЛЕННЫЕ КИСЛОТЫ, ОТРАБОТАННАЯ СЕРНАЯ КИСЛОТА, ТЕХНОЛОГИЯ, ПРОЕКТИРОВАНИЕ, КОНЦЕНТРАЦИОННАЯ КОЛОННА ... После стадии денитрации разбавленная серная кислота отправляется на стадию концентрирования /3/. В процессе концентрирования разбавленной серной кислоты, имеющиеся в ней примеси, в ... |
Раздел: Промышленность, производство Тип: дипломная работа |
| Регенерация азотной и серной кислоты | |
|
Перечень условных сокращений, обозначений, применяемых в проекте. 3 1. Аналитическая часть 5 1.1. Технико-экономическое обоснование выбранного метода ... 54)(57) Способ очистки концентрированной серной кислоты от оксидов азота обработкой восстановителем при повышенной температуре, отличающийся тем, что с целью снижения расхода ... 54)(57) Способ снижения содержания оксидов азота в хвостовых газах производства слабой азотной кислоты, включающий абсорбцию нитрозных газов водным раствором азотной кислоты с ... |
Раздел: Рефераты по химии Тип: реферат |
| Нанесение и получение металлических покрытий химическим способом | |
|
Кафедра xxx Аттестационная работа по теме: "НАНЕСЕНИЕ МЕТАЛЛИЧЕСКИХ ПОКРЫТИЙ ХИМИЧЕСКИМ СПОСОБОМ" на соискание степени бакалавра по направлению xxx ... Для удаления шлака осуществляют травление при комнатной температуре в равнообъемной смеси серной и соляной кислот либо в растворе, содержащем серную кислоту (30-40 г/л), хромовый ... Для снятия травильного шлама с поверхности нержавеющих сталей используются нагретые до 20-30 °С растворы следующих составов, г/л серная кислота 15-30, хромовый ангидрид 70-120 ... |
Раздел: Промышленность, производство Тип: дипломная работа |
| Качественный анализ (кислотно-основная классификация) | |
|
Качественный анализ (кислотно-основная классификация) Содержание Аналитические реакции катионов I группы: Lі+, Na+, К+, NH-. 4 Аналитические реакции ... Катионы Fe3+ при реакции с ферроном (7-иод-8-оксихинолин-5- еульфоновой кислотой) в кислой среде (р№=2,6) образуют комплексы зеленого цвета; при реакции с тайроном (1,2-диокси-3,5 ... Осадок HgO растворяется в азотной кислоте, в растворах хлоридов и иодидов щелочных металлов с образованием соответственно Hg(NO3)2. HgCl2 и комплекса [Hgl4f: |
Раздел: Рефераты по химии Тип: дипломная работа |