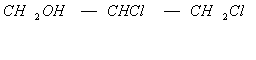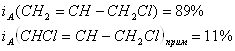Дипломная работа: Получение аллилового спирта гидролизом хлористого аллила
Введение
1. Литературный обзор
1.1 Методы получения целевого продукта
1.2 Обоснование выбора реакции
1.3 Анализ основной реакции
2. Термодинамический анализ основной реакции
2.1 Подготовка исходной информации
2.2 Расчет термодинамических функций
3. Кинетика и механизм реакции получения изобутилена
3.1 Механизм реакции и его обоснование
3.2 Анализ факторов, влияющих на основную реакцию
3.3 Кинетическая модель реакции
4. Выбор типа реактора
5. Расчет реактора
5.1 Материальный баланс
5.2 Определение тепловой нагрузки на реактор
6. Операторная модель химико-технологической системы
Выводы
Список литературы
Введение
Непредельные спирты - это производные непредельных углеводородов, в молекулах которых водородный атом замещен на гидроксильную группу. Непредельные спирты сильно отличаются по свойствам от углеводородов. [1]
Отличие в физических свойствах между спиртами и многими другими классами органических соединений объясняется наличием в молекулах спиртов очень полярной гидроксильной группы. Входящий в нее атом кислорода, проявляя электроакцепторные свойства, «стягивает на себя» электронную плотность от связанного с ним атома водорода, и у последнего образуется дефицит электронной плотности. В результате этого между атомом водорода гидроксильной группы одной молекулы спирта и свободной электронной парой кислорода OH- - группы другой молекулы спирта возникает водородная связь, за счёт которой происходит ассоциация молекул спиртов. Спирты - бесцветные вещества с плотностью меньше единицы. Химические свойства спиртов проявляются в основном за счет гидроксильной группы.
Аллиловый спирт получают гидролизом аллилхлорида (хлористого аллила) - продукта хлорирования пропилена 5% раствором щелочи. Пропеновый спирт является побочным продуктом производства глицерина, синтетических смол и пластических материалов. [2]
Он широко используется в химическом синтезе, а также в производстве фармацевтических препаратов, но самое большое применение аллиловый спирт нашел в производстве различных сложных эфиров аллила, из которых наиболее важными являются диаллил-фталат и диаллил-изофталат , которые служат в качестве мономеров и реполимеров . Кроме того, пропеновый спирт является полупродуктом в производстве глицерина, синтетических смол и пластических материалов. [2]
Целью данной работы является формирование химической концепции процесса гидролиза хлористого аллила, как метода получения аллилового спирта.
Для реализации вышеуказанной цели необходимо решить следующие задачи:
1. Изучить инженерные и технологические основы получения аллилового спирта.
2. Выполнить теоретический анализ предложенного метода, рассмотреть особенности химической реакции.
3. Рассмотреть особенности механизма реакции синтеза аллилового спирта.
4. Провести термодинамический анализ основной реакции.
5. Рассчитать материальный и тепловой баланс синтеза аллилового спирта.
6. Сделать выбор типа реактора, осуществить расчеты объема реактора и поверхности теплообмена.
7. Предложить операторную схему получения аллилового спирта.
1. ЛИТЕРАТУРНЫЙ ОБЗОР
1.1 Получение непредельных спиртов
Замещение атома галогена на гидроксил в хлористом аллиле (промышленный метод получения) [1, 20]
Непредельные спирты можно получать, вводя гидроксильную группу в соединение, имеющее кратную связь.
Аллил хлорид омыляют разбавленным раствором щелочи при 150—160°С и 15 атм.:
![]() .
.
Выход аллилового спирта, считая на хлористый аллил, составляет 88%; побочно образуется до 9% диаллилового эфира (побочная реакция):
2CH2=CH—CH2Cl+H2O ![]() ⇄ (CH2=CH—CH2)2O+2HCl.
⇄ (CH2=CH—CH2)2O+2HCl.
Гидролиз хлористого аллила в аллиловый спирт можно проводить также в кислом растворе в присутствии хлористого метилена СН2Сl2; в этом случае выход аллилового спирта составляет 85—90%.
Реакция протекает в две стадии; сначала образуется хлористый аллил, а затем аллиловый спирт.
Или:
Н2С = СН — СН3 + Cl2 ![]() Н2С = СН — СН2Сl + НСl,
Н2С = СН — СН2Сl + НСl,
пропилен хлористый аллил
Н2С = СН — СН2С1 + NaOH ![]() Н2С = СН — CН2OН + NaCI.
Н2С = СН — CН2OН + NaCI.
аллиловьй спирт
Восстановление карбоновых кислот [2]
Получают спирты гидрированием соответствующих карбоновых
кислот или их производных (амидов, эфиров, галогенангидридов), или
их производных (амидов, эфиров, галогенангидридов), или восстановлением LiAlH4, NaBH4 и др.:
R – COOH ![]() R - CH2OH,
R - CH2OH,
H2C=CH-COOH ![]() H2C=CH-CH2OH.
H2C=CH-CH2OH.
акриловая кислота аллиловый спирт
Селективное восстановление акролеина по Меервейену - Понндорфу – Верлею [27]
Схема реакции представлении ниже:
СH2=CH—CHO+
RCH2—CH2OH ![]() CH2=CH—CH2OH+
RCH2—CHO
CH2=CH—CH2OH+
RCH2—CHO
Реакцию проводят кипячением раствора альдегида в этиловом или изопропиловом спирте в присутствии этилата (или соответственно изопропилата) алюминия. Для того, чтобы реакция закончилась, необходимо непрерывно отводить образующиеся продукты реакции.
Гидрирование пропаргилового спирта
Эта реакция проводится в присутствии катализатора на основе железа [25]:
![]() .
.
Получение аллилового спирта из глицерина []:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() +
+ ![]() .
.
![]()
![]()
глицерин аллиловый спирт
Реакция глицерина с безводной щавелевой кислотой
При нагревании глицерина с безводной щавелевой кислотой до 150 ˚С в результате распада промежуточного образовавшегося щавелевокислого эфира глицерина получается аллиловый спирт [34]:
 |
|||
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() +
+![]()
![]()
![]()
![]()
![]() .
.
![]()
![]()
![]()
щавелевокислый эфир аллиловый
глицерина спирт
Для этого нагревают в реторте 4 части глицерина с 1 частью кристаллической щавелевой кислоты до 195 °С, причем отгоняется муравьиная кислота при постоянном выделении углекислого газа. При достижении температуры равной 195 °С меняют приемник и продолжают осторожно нагревать далее, пока еще заметно выделение углекислоты и пока, наконец, температура не поднимется до 260 °С. Нечистый спирт, входящий в состав дистиллята, нагревают продолжительное время с едким кали, отгоняют, обезвоживают прокаленным поташом и вновь перегоняют. Такую обработку повторяют несколько раз до тех пор, пока не будут удалены поташом последние следы воды.
Реакция между муравьиной кислотой и глицерином (лабораторный синтез) [5]
Данный синтез проходит очень гладко и без тенденции к вспениванию:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() +
+![]()
![]()
![]()
![]()
![]() .
.
![]()
![]()
![]()
В колбу помещают глицерин и техническую 85% муравьиную кислоту. Колбы дистиллирования и бутылка с крепким раствором едкого натра соединены трубкой. И, чтобы растворить и разложить любой акролеин, который может быть образован в ходе синтеза, реакционную смесь быстро нагревают. Первые порции должны прибыть в пределах пятнадцати минут, и температура 195 °С должна быть достигнута после 30 - 45 мин. Медленное нагревание приводит к обугливанию и формированию большого количества акролеина и дает очень низкий выход аллил алкоголя. Нагревание продолжается, пока температура не достигает 260 °С - главная реакция происходит между 225 °С и 235 °С. Для проведения полной реакции требуется приблизительно четыре часа.
Реакция глицерина с муравьиной кислотой [55]
Известен способ получения аллилового спирта нагреванием глицерина с тремя последовательно вносимыми порциями муравьиной кислоты при 225 - 260 ˚С с одновременной отгонкой продуктов реакции. Отгон представляет собой азеотропную смесь аллилового спирта с водой, содержащую 68 - 70% целевого спирта. Для дальнейшей очистки продукт высаливают из отгона поташом при нагревании и перегоняют.
Чистота аллилового спирта 98 - 99%. Выход 45 - 47% от теоретического.
Недостатками известного способа являются низкий выход целевого продукта и получение водного аллилового спирта в ходе отгонки продуктов реакции, что приводит к необходимости дополнительной довольно трудоемкой стадии очистки целевого продукта, требующей специального оборудования и энергетических затрат.
Способ синтеза, описанный в А.С. [55], позволяет увеличить выход целевого продукта и упрощает процесс.
Поставленная цель достигается предлагаемым способом получения аллилового спирта из глицерина при нагревании с одновременным удалением из сферы реакции ее продуктов и выделением целевого продукта, по которому глицерин обрабатывают этиловым эфиром ортомуравьиной кислоты при мольном соотношении 1:1 в присутствии каталитических количеств бензойной кислоты при 150 - 230 ˚С:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() +
+![]()
![]()
![]()
![]()
![]() .
.
![]()
![]()
![]()
Предлагаемый способ осуществляют нагреванием исходных реагентов при температуре бани 150 - 155 ˚С с одновременной отгонкой этилового спирта до выделения около половины от теоретического количества, после чего температуру банки повышают до 180 - 230 ˚С и отгоняют смесь безводного аллилового спирта и этанола, которую перегоняют с образованием целевого продукта 99,9% -ной чистоты (по данным ГЖХ) и выходом 62,2 - 92,7%.
Способ исключает образование воды в ходе реакции, в связи с чем уже после дистилляции отгона получается хроматографически чистый аллиловый спирт, что упрощает и удешевляет выделение и очистку целевого продукта. Способ обеспечивает более высокий выход при более низкой температуре.
Селективное гидрирование акролеина или пропаргилового спирта над палладием
Аллиловый спирт образуется при действии на акролеин водорода в
момент выделения [32]:
![]() .
.
Или:
![]() .
.
реакция глицерин кислота гидрирование
Каталитическое восстановление акролеина [56]
Аллиловый спирт можно получить путем восстановления чистого акролеина при температуре 400 °С в присутствии катализатора, например окиси магния, с помощью алкоголя при избытке последнего 5—10 моль на
1 моль чистого акролеина. Однако, способ требует специальной дорогостоящей подготовки акролеина, включающий его концентрирование с 2,5—6 до 80% с последующей ректификацией и экстрактивной перегонкой, что сопровождается большими потерями акролеина, обусловленными его низкой стабильностью. Кроме того, наблюдается короткий срок действия катализатора, вследствие образования полимеров на его поверхности и большой избыток алкоголя как восстанавливающего агента.
По предложенному в А. С. [56] способу получения аллилового спирта пропилен и кислород в смеси с азотом и водяным паром пропускают при нагревании через зону каталитического окисления и полученную при этом реакционную массу, содержащую акролеин, непосредственно направляют в зону каталитического восстановления:
![]() .
.
В зоне каталитического окисления в присутствии катализаторов окисления, например молибдена, висмута, олова, сурьмы, меди в виде окисидов на носителе, происходит окисление пропилена в акролеин при 400 - 500 ˚С. Последний без предварительного выделения в смеси с газами подают в зону восстановления, где в присутствии катализаторов восстановления, например, окисида магния, его восстанавливают в аллиловый спирт 97%-ным этанолом, поступающим в зону восстановления под давлением при температуре 400 °С. Далее аллиловый спирт выделяют с возвращением в цикл не прореагировавших исходных и побочных продуктов реакции. За счет исключения потерь акролеина при его концентрировании и перегонке выход аллилового спирта повышается на 20% по сравнению с известным восстановлением акролеина в момент его взаимодействия с водородом. Разбавление реагирующих компонентов азотом и водяным паром снижает качество 97%-ного этанола, как восстанавливающего агента, и повышает конверсию акролеина до 80%, по сравнению с известным, где она составляет 50%, а также продлевает срок годности катализатора окисида магния до 100 час, который в известном способе составляет 12 - 18 час.
Изомеризация окиси пропилена (промышленный метод) [36 ]:
|
Реакция протекает в паровой фазе при 250 °С; в качестве катализатора используют фосфат лития. При этом выход спирта достаточно высок.
Изомеризация пропиленоксида [52]
Известен способ получения аллилового спирта путем изомеризации пропиленоксида при температуре 300 — 500°С на стационарном катализаторе — фосфате лития. При этом катализатор осмоляется. Необходимо отработанный катализатор периодически обрабатывать воздушно-азотной смесью или инертной жидкостью. В результате проведение процесса по непрерывной схеме затруднено.
С целью упрощения и обеспечения непрерывности процесса в работе [52] предложен способ, заключающийся в том, что пропилен окисляют кислородсодержащим газом в присутствии уксусной кислоты и воды в газовой фазе на палладиевом катализаторе при 50 — 250 °С, затем полученную реакционную массу омыляют водой в присутствии кислого катализатора при давлении 1 — 10 атм. и температуре 50 — 150 °С. После отделения катализатора реакционную массу подвергают дистилляции. Сначала отбирают фракцию, содержащую аллилацетат, аллиловый спирт и воду, которую возвращают на стадию омыления, а кубовый остаток направляют на вторичную дистилляцию с отбором азеотропной смеси аллиловый спирт - вода и кубового остатка, который возвращают частично или полностью в начало процесса или на стадию омыления:
|
На стадии окисления палладиевый катализатор может быть в виде металла или его соединений — солей карбоновых кислот, например, пропионата палладия.
Катализатор желательно применить с добавками, увеличивающими активность и селективность процесса, в качестве которых пригодны ацетаты щелочного металла. Палладиевый катализатор лучше применять на носителях, в качестве которых используют кремниевую кислоту, активированный уголь, оксид алюминия. На стадии омыления в качестве кислого катализатора используют минеральные кислоты и катиониты.
Процесс можно вести как периодически, так и непрерывно.
Синтез Вогна [52]
Вогн получал смесь аллилового спирта, пропионового альдегида, аллилацетата и других изомеров пиролизом моноацетата пропиленгликоля при 425-525°.
Синтез проводили в пустых и заполненных насадкой трубках. Конденсированные пары фракционировали и для получения аллилового спирта гидролизовали фракцию, кипящую ниже 110 °С.
Синтез Баллара [38]
Баллар и его сотрудники получали аллиловый спирт из этилового спирта и пропенальдегида.
Пары этилового спирта и пропенальдегида в отношении 2,3: 1 пропускали над смесью некальцинированных окисида магния и окисида цинка со скоростью 0,099 моль на 100 мл катализатора в минуту; выход аллилового спирта при 391- 401° составлял 77,5%.
Электролиз пропенальдегида
На предприятиях фирмы British Celanese, Ltd. аллиловый спирт получают пропусканием постоянного тока через электролизер с амальгамированным свинцовым катодом. Электролит содержал 25 частей пропенальдегида, 825 частей 5%-ной серной кислоты и по 2 части сульфата двухвалентного железа, ацетата цинка и гидрохинона. При плотности тока на катоде 0,0128 а/см2 и температуре 25° из анодного пространства спустя 5 час отгоняли 50% аллилового спирта.
Окисление пропилена в водном растворе уксусной кислоты [54]
Данный способ получения аллилового спирта основан на окислении
пропилена в водном растворе уксусной кислоты в присутствии катализатора при температуре 50 - 250 °С, водном гидролизе полученного аллилацетата в жидкой фазе в присутствии кислого катализатора при температуре 50 - 150 °С и давлении 1 - 10 атм с последующим выделением целевого продукта известными приемами. Выход целевого продукта до 90%.
С целью упрощения процесса в А. С. [54] предлагается проводить водный гидролиз аллилацетата в жидкой фазе при температуре 150—350 °С, предпочтительно при 170 – 250 °С, при давлении не ниже 5 атм. и молярном соотношении между аллилацетатом и водой, равном 1:1 — 1:10, желательно 1 : 2—1 : 5 [54].
Предлагаемый способ более прост, чем известный способ изомеризации окиси пропилена, так как не требует применения катализатора, исключает стадию нейтрализации реакционной смеси и регенерацию катализатора. Кроме того, процесс сопровождается образованием незначительного количества побочных продуктов, поскольку уксусная кислота и аллилацетат не полимеризуются в данном случае.
1.2 Обоснование выбора реакции
В 1941 году были опубликованы работы американского учёного Вильямса, разработавшего очень интересный метод получения глицерина из пропилена через хлористый аллил и аллиловый спирт. Этот метод основан на открытой в 1936 году реакции взаимодействия пропилена с хлором при высоких температурах [39].
В настоящее время это наиболее дешевый и простой способ получения аллилового спирта. Для реакции характерны не очень высокие температуры, по сравнению с методом получения изомеризацией окиси пропилена (250 ˚С), и большой выход продукта.
Хлористый аллил омыляют разбавленным раствором щелочи при 150—160 °С и 15 атм.:
![]() .
.
Выход аллилового спирта, считая на хлористый аллил, составляет 88%; побочно образуется до 9% диаллилового эфира:
2CH2=CH—CH2Cl+H2O ![]() (CH2=CH—CH2)2O+2HCl.
(CH2=CH—CH2)2O+2HCl.
Гидролиз хлористого аллила в аллиловый спирт можно проводить также в кислом растворе в присутствии хлористого метилена СН2Сl2; в этом случае выход аллилового спирта составляет 85 - 90%. Но эта реакция не выгодна из экономических соображений.
Промышленным методом получения аллилового спирта является синтез из хлористого аллила, по сравнению с изомеризацией оксида пропилена, протекающей по схеме:
|
так как он не требует столь высокой температуры – 250 °С, хотя при таком синтезе выход спирта достаточно высок. При этом катализатор осмоляется. Необходимо отработанный катализатор периодически обрабатывать воздушно - азотной смесью или инертной жидкостью. В результате проведение процесса по непрерывной схеме затруднено.
Также, широко используемым является селективное гидрирование акролеина или пропаргилового спирта над палладием. Аллиловый спирт образуется при действии на акролеин водорода в момент выделения:
![]()
Однако такой синтез сопровождается большими потерями акролеина, обусловленными его низкой стабильностью, коротким сроком действия катализатора, вследствие образования полимеров на его поверхности и большим избытком алкоголя как восстанавливающего агента.
Также такой синтез сопровождается большими потерями акролеина, обусловленными его низкой стабильностью, коротким срок действия катализатора, вследствие образования полимеров на его поверхности и большим избытком алкоголя как восстанавливающего агента.
Таким образом, для дальнейших расчетов выбран метод замещение атома галогена на гидроксил – гидролиз хлористого аллила.
1.3 Анализ основной реакции
Реакция протекает по схеме:
![]()
1.3.1 Физические свойства реагентов и продуктов реакции
Физические свойства реагентов и продуктов реакции взяты из справочников [6,7,8,9] и представлены в табл. 1.
Таблица 1
Физические свойства реагентов
| Вещество | Молеку-лярная масса, г/моль |
Фазовое состояние |
Плотность, d, г/см3 |
Ткип, 0С |
Тпл, 0С |
Растворимость | |
| В воде | В других средах | ||||||
| Хлористый аллил | 76,5 |
бесцветная жидкость, обладающая слезоточи-вым действием |
0,938 | 44,6 | -136,4 | раств. | сп, этил. эфир, бензол |
| Вода | 18 | жидкость без цвета и запаха |
1 (при 4˚С) |
100 | 0 | - | Этил. спирт, метил. Спирт, глиц, ацетон |
| Аллиловый спирт | 61 | Бесцв. жид. с резким запахом | 0,852 | 96,9 | -129 | хорошо раств. | хорошо раств. |
| Соляная кислота | 36,5 | бесцветная жидкость | 1,64 | -84 | -112 | хорошо раств. | Этил. спирт, этил. эфир, бензол |
1.3.2 Электронная структура реагентов и продуктов реакции
Химическое поведение, реакционная способность молекулы зависит от природы составляющих ее атомов и от их взаимного расположения. Образуя молекулы, атомы изменяют свое состояние, влияют друг на друга. Наиболее сильно взаимодействуют между собой атомы, образующие химические связи.
Реагенты и продукты изучаемой реакции имеют неполярные (С - С, С = С) и полярные (С - Н, С - О, О - Н) ковалентные связи, возникающие в результате обобщения не спаренных валентных электронов с противоположными спинами. Зная число электронов во внешней оболочке атомов для любого органического и неорганического соединения легко написать октетные формулы. В них учитываются только внешние электроны атомов, как образующих так и не образующих химические связи.
Электронное строение аллилового спирта
Атом кислорода гидроксильной группы имеет sp3 гибридизацию. Средние длины связей 0,143 нм (С - О) и 0,091 нм (О - Н). Обе связи полярны. Однако некоторые ученые считают их в значительной мере поляризованными электроотрицательным атомом кислорода [12, 24, 26, 31].
Относительно высокие значения температуры кипения и диэлектрической проницаемости аллилового спирта объясняют полярностью группы ОН- и ее способностью образовывать водородные связи. Кислород является более электроотрицательным элементом, по сравнению с углеродом, и поэтому электронная плотность смещена в сторону кислорода. Дипольный момент ОН- группы равен 5,5·1028 Кл·м [4].
Функциональная группа спиртов содержит электроотрицательный атом кислорода с двумя неподеленными парами электронов. Его конфигурация близка к тетраэдрической и показана на рис. 1[4, 33].
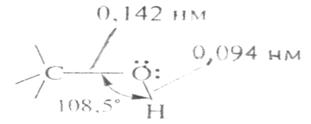
Рис. 1. Конфигурация функциональной группы спиртов
В молекуле спиртов можно выделить следующие реакционные центры, показанные ниже на рис. 2 [4, 12, 13, 33]:
• ОН - кислотный центр, обусловливающий возможность
отщепления
протона вследствие высокой полярности связи О - Н;
• нуклеофильный и n-основный центр — атом кислорода, имеющий не -поделенные пары электронов;
• электрофильный центр — α-атом углерода, на котором дефицит электронов вызван — I-эффектом соседней гидроксильной группы;
• β – СН - кислотный центр, в котором поляризация связи С - H также обусловлена электроноакцепторным влиянием гидроксильной группы.
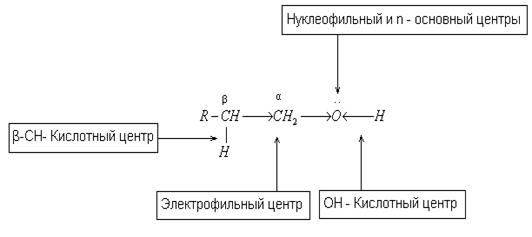
![]()
Рис. 2. Реакционные центры спиртов
Большинство реакций спиртов протекают с разрывом связей О - Н или
С - О.
Для спиртов также характерны реакции, в которых участвуют
α – Н - атом (окисление), β – Н - атом (дегидратация) или δ – Н – атом
(окислительная циклизация) [2].
Гидроксильная группа в молекуле аллилового спирта отдалена от двойной связи, поэтому в данном соединении не наблюдается сопряжения связи с заместителем и поляризующее влияние на его π - связь проявляется в значительно меньшей степени, чем в молекулах винильных соединений. Эти особенности химического строения аллилового спирта обуславливают его малую реакционную способность в процессах полимеризации. Еще менее активен его радикал [3].
Электронное строение воды
Молекула воды полярна. Угол НОН составляет 104,5˚. Связь О - Н является ковалентной полярной. Между молекулами воды возникает водородная связь, которая изображается точками [12].
![]() …Нσ+
…Нσ+![]() Оα-… Нσ+
Оα-… Нσ+ ![]() Оα-…
Оα-…
![]() Нσ+…
Нσ+…
Нσ+…
Связи О - Н в молекулах воды имеют заметный полярный характер с избытком отрицательного заряда σ- на атоме кислорода. Атом водорода, наоборот, приобретает небольшой положительный заряд σ+ и может взаимодействовать с неподеленными парами электронов атома кислорода соседней молекулы воды.
Взаимодействие между молекулами воды оказывается достаточно сильным, таким, что даже в парах воды присутствуют димеры и тримеры состава (Н2О)2, (Н2О)3 и т. д. В растворах же могут возникать длинные цепи ассоциатов, поскольку атом кислорода имеет две неподеленные пары электронов.
Дипольный момент воды равен 6,1·1028 Кл·м
1.3.3 Химические свойства реагентов и продуктов реакции
Рассмотрим наиболее типичные реакции, в которые могут вступать реагенты и продукты реакции.
1.3.3.1 Химические свойства аллилового спирта
Аллиловый спирт, имея в молекуле кратную связь и гидроксильную группу, проявляет свойства спиртов и непредельных соединений:
1. Взаимодействие с галогенами с образованием β - дигалоидгидринов глицерина
Совершенно иначе, чем этиловый спирт, относится аллиловый спирт к хлору и брому; тогда как обыкновенный спирт дает с ними продукты замещения и окисления (напр. хлораль), аллиловый спирт прямо присоединяет два атома хлора, брома или йода, образуя β-дигалоидгидрины глицерина C3H6Cl2O, C3H6Br2O и C3H6J2O [2]:
![]() ,
,
2,3-дибромпропанол-1
![]() .
.
2,3-дихлорпропанол-1
2. Реакция гидрирования [10]:
![]() .
.
пропанол-1
3. Реакция гидратации в присутствии кислорода с образованием глицерина [24]:
![]() .
.
глицерин
4. Окисление с образованием альдегида [24]
Окислителями переводится в альдегид - акролеин, дальнейшее окисление дает акриловую кислоту:
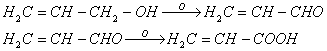 .
.
5. Взаимодействие со щелочными металлами с образованием алкоголятов [10]
Со щелочными металлами получаются алкоголяты, которые при действии хлористого аллила дают соответствующий этиловому эфиру аллиловый эфир (С3Н5)2О:
![]() ,
,
алкоголят
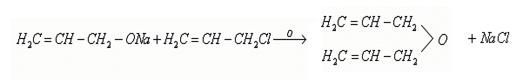
6. Межмолекулярная дегидратация спиртов с образование простых эфиров [27]:
![]() .
.
этилаллиловый эфир
7. Взаимодействие с минеральными и органическими кислотами с образованием сложных эфиров
Образование сложных эфиров происходит при взаимодействии с минеральными и органическими кислотами [26]:
![]() ,
,
аллилацетат
![]() .
.
8. Взаимодействие с магнийгалогеналкилами
Происходит замещение гидроксильного водорода на магнийгалоген и выделение углеводорода [10]:
![]() .
.
9. Взаимодействие с хлористым фосфором - PCl3 [31]
Треххлористый фосфор дает хлористый аллил C3H5Cl, изомерный с α- и β – хлорпропиленами:
![]() .
.
Аналогичным путем образуется йодистый аллил C3H5J:
![]() .
.
10. Гидратация под действием слабых минеральных кислот
При действии слабых минеральных кислот аллильный спирт способен присоединять элементы воды, причем превращается в пропиленгликоль который, вновь теряя воду, переходит уже в изомерный с аллиловым спиртом пропионовый альдегид или его продукты конденсации [24]:
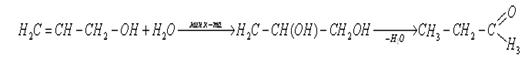
1.3.3.2 Химические свойства хлористого аллила [10]
Свойства обусловлены легкостью замещения атома галогена.
1. Омыление хлористого аллила раствором шелочи [24]:
![]() .
.
2. Взаимодействие с минеральными кислотами с образованием дихлоргидринов
Например, взаимодействие хлористого аллила с хлорноватистой
кислотой, которая присоединяется по двойной связи. При этом образуются два изомера [33]:
|
|
|
|
| α – дихлоргидрин | β – дихлоргидрин |
| (1,3 – дихлорпропанол – 2 ) | (1,3 – дихлорпропанол – 2) |
1.3.3.3 Химические свойства воды [12, 44, 46 - 50]
Вода взаимодействует со многими веществами при обычной температуре.
1. Взаимодействие с активными металлами
Со щелочными и щелочноземельными металлами, с их окислами вода образует гидроксиды металлов и водород:
2H2O + Ca = Ca(ОН)2 + H2![]() ,
,
2H2O + 2Na = 2NaOH + H2![]() .
.
Благородные металлы с водой не реагируют.
2. Взаимодействие с галогенами
Вода относится к химически активным соединениям, реагирует с фтором:
H2O + F2 = HF + O· (выделяется атомарный кислород),
O·+ F2 = ОF2 и др.
Хлор при нагревании или на свету разлагает воду с выделением атомарного кислорода:
H2O + Cl2 = HCl + HClO.
3. Взаимодействие с неметаллами
Вода вступает в реакцию и со многими неметаллами. Например, при взаимодействии с атомарным кислородом образуется пероксид водорода:
H2O + O = H2O2.
А при взаимодействии с фосфором образует фосфорную кислоту:
8H2O +2Р = 2Н3РО4+ 5 Н2![]() .
.
4. Взаимодействие с оксидами с образованием кислот и оснований
Многие оксиды реагируют с водой, образуя основания:
CaO + H2O = Ca(OH)2,
Na2O + H2O = 2 NaOH.
И кислоты:
CO2 + H2O = H2CO3,
3H2O +Р2О5= 2Н3РО4.
5. Взаимодействие с солями с образованием кристаллогидратов
При взаимодействии с некоторыми солями образуются кристаллогидраты. При нагревании они теряют кристаллизационную воду:
Na2CO3 + 10H2O = Na2CO3·10H2O,
Na2CO3·10H2O ![]() Na2CO3 + 10H2O,
Na2CO3 + 10H2O,
СuSO4 + 5H2O = CuSO4·5H2O
Белый голубой
CuSO4·5H2O![]() СuSO4 + 5H2O
СuSO4 + 5H2O
6. Разложение воды.
Происходит под действием электрического тока:
![]() .
.
При этом на катоде выделяется водород, а на аноде – кислород.
7. Гидролиз.
Вода также разлагает большинство солей:
AlCl3+ 3H2O=Al(OH)3 + 3HCl,
Al2S3+ H2O=Al(OH)3 + H2S.
Вода разлагает гидриды, фосфатиды, нитриды, силициды, бориды активных металлов.
NaH + H2O = NaOH + H2
8. Взаимодействие с органическими веществами
Присоединение по тройной связи:
![]() СН
СН![]() СН + НОН
СН + НОН ![]() СН3-С=О .
СН3-С=О .
Н
И двойной связи:
CH2=CH2 + H2O ![]() CH3-CH2OH.
CH3-CH2OH.
С галогензамещенными алканами:
Cl-CH2-CH3 + H2O ![]() CHOH-CH3 + HCl.
CHOH-CH3 + HCl.
1.3.3.4 Х имические свойства соляной кислоты [12, 44, 46 - 50]
1. Раствор HCl в воде - соляная кислота - сильная кислота, она полностью диссоциирует на ионы:
HCl = H+ + Cl- .
2. Взаимодействие с металлами, стоящими в ряду напряжений до водорода:
2Al + 6HCl = 2AlCl3 + 3H2.
3. Взаимодействие с оксидами металлов:
MgO + 2HCl = MgCl2 + H2O.
4. Взаимодействие с основаниями и аммиаком:
HCl + KOH = KCl + H2O.
3HCl + Al(OH)3 = AlCl3 + 3H2O,
HCl + NH3 = NH4Cl.
5. Взаимодействие с солями:
CaCO3 + 2HCl = CaCl2 + H2O + CO2.
HCl + AgNO3 = AgCl + HNO3.
6. Вытесняет галогены из солей:
KJ + HCl = KCl + HJ.
2. Термодинамический анализ основной реакции
2.1 Подготовка исходной информации
При проектировании технологических процессов важное место занимают термодинамические расчеты химических реакций. Цель термодинамического анализа заключается в определении принципиальной возможности проведения химической реакции в данных условиях, в расчете теплового эффекта реакции, константы равновесия при различных температурных режимах, а также в выборе условий проведения процесса с наибольшей эффективностью.
Для того чтобы более наглядно продемонстрировать характер изменения термодинамических величин, рассмотрим интервал температур от 80 0С
(353 K) до 180 0С (453 K).
Для исследуемой реакции:
![]() .
.
рассчитывается значение энтальпии (![]() Н0298), энтропии (
Н0298), энтропии (![]() S0298) и
температурных коэффициентов (а, в, с, d, с’) при температуре 298 К для всех
веществ участвующих в реакции. Все термодинамические данные взяты из
справочников [6, 40, 41, 51]. Эти данные представлены в табл. 2.
S0298) и
температурных коэффициентов (а, в, с, d, с’) при температуре 298 К для всех
веществ участвующих в реакции. Все термодинамические данные взяты из
справочников [6, 40, 41, 51]. Эти данные представлены в табл. 2.
Изменение энтальпии, энтропии и температурных коэффициентов рассчитывается по закону Гесса:
ΔН0298 = ΔН0298 (CH2 = CH - CH2OH) + ΔН0298 (HCl) – ΔН0298(H2O) -
-Н0298 (CH2 = CH - CH2Cl),
ΔS0298 = ΔS0298 (CH2 = CH - CH2OH) + ΔS0298 (HCl) – ΔS0298(H2O)
- S0298 (CH2 = CH - CH2Cl),
Δа = a (CH2 = CH - CH2OH) + a (HCl) – a(H2O) - a (CH2 = CH - CH2Cl),
Δb×103 = b (CH2 = CH - CH2OH) + b (HCl) – b(H2O) - b (CH2 = CH - CH2Cl),
Δc ×106 = c (CH2 = CH - CH2OH) - c (CH2 = CH - CH2Cl),
Δc’×10-5 = c’(HCl) - c’(H2О),
Δd ×109 = d (CH2 = CH - CH2OH) - d (CH2 = CH - CH2Cl).
Таблица 2
Исходные и расчетные данные термодинамики изучаемой реакции
|
DH0298 кДж/ моль |
S0298, Дж/ моль×К |
Ср = f(T), Дж/моль×К | |||||
| а | в×103 | с×106 | c’×10-5 | d×109 | |||
| Продукты реакции | |||||||
| CH2=CH--CH2OH | -131,879 | 204 | -1,104 | 31,413 | -2,029 | - | 0,531 |
| HCl | -92,311 | 186,677 | 26,501 | 4,598 | - | 1,087 | - |
| Исходные вещества | |||||||
| CH2=CH--CH2Cl | -8,95 | 14,8 | 2,525 | 3,042 | -2,275 | - | 0,449 |
| H2O | -241,825 | 188,723 | 30,096 | 11,286 | - | 0,33 | - |
| D | 26,585 | 187,154 | -7,224 | 21,683 | 0,246 | 0,757 | 0,082 |
2.2 Расчет термодинамических функций
Изменение энтальпии при указанной температуре определяется по уравнению Кирхгоффа:


Изменение энтропии реакции рассчитывают по формуле:


Изменение изобарно-изотермического потенциала рассчитывается по уравнению:
![]()
![]()
Константа равновесия реакции при заданных температурах определяется по уравнению нормального химического сродства:
![]()
![]()
![]()
Расчет всех термодинамических величин для температур от 353 до 463 К с шагом в 10 0С представлен в табл. 3.
Таблица 3
Термодинамические функции реакции
№ п/п |
Т, К |
ΔН0r,T, кДж/моль |
ΔS0 r,T, Дж/моль·К |
ΔG0r,T, кДж/моль | lnKp | Кр |
| 1 | 353 | 26,617 | 187,25 | -39,482 | 13,45 | 7,00·105 |
| 2 | 363 | 26,545 | 187,28 | -41,438 | 13,73 | 9,18·105 |
| 3 | 373 | 26,642 | 187,32 | -43,228 | 13,94 | 1,13·106 |
| 4 | 383 | 26,658 | 187,36 | -45,101 | 14,16 | 1,41·106 |
| 5 | 393 | 26,675 | 187,41 | -46,977 | 14,38 | 1,76·106 |
| 6 | 403 | 26,694 | 187,45 | -48,848 | 14,58 | 2,15·106 |
| 7 | 413 | 26,715 | 187,51 | -50,727 | 14,77 | 2,60·106 |
| 8 | 423 | 26,739 | 187,56 | -52,599 | 14,96 | 3,14·106 |
| 9 | 433 | 26,764 | 187,62 | -54,475 | 15,13 | 3,72·106 |
| 10 | 443 | 26,791 | 187,68 | -56,351 | 15,30 | 4,41·106 |
| 11 | 453 | 26,820 | 187,75 | -58,231 | 15,46 | 5,18·106 |
| 12 | 463 | 26,852 | 187,82 | -60,109 | 15,62 | 6,08·106 |
Графические зависимости энтальпии, энтропии, энергии Гиббса, константы равновесия от температуры представлены на рис. 3, 4, 5, 6.
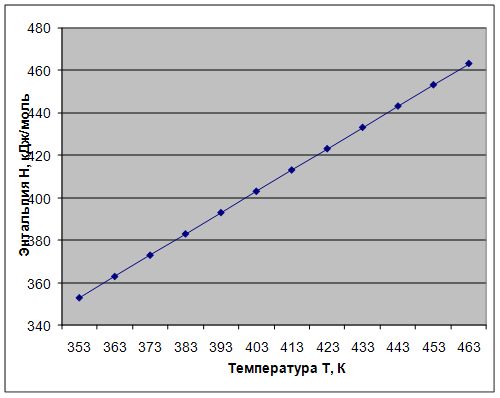
Рис. 3. Зависимость энтальпии ΔH от температуры T
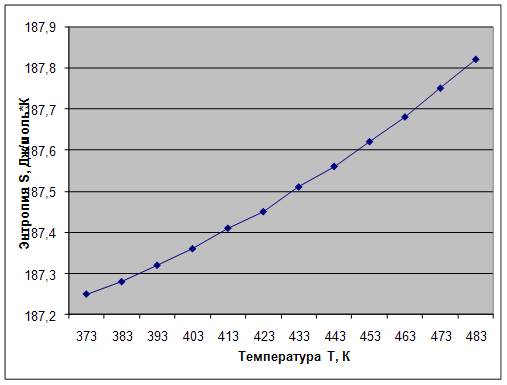
Рис. 4. Зависимость энтропии ΔS от температуры Т
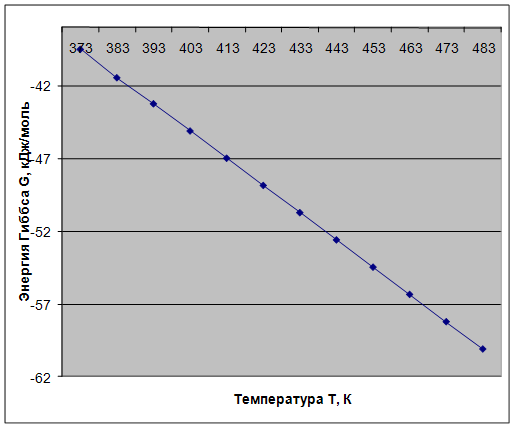
Рис. 5. Зависимость энергии Гиббса ΔG от температуры T
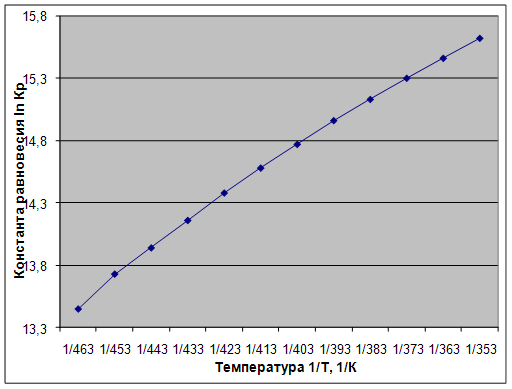
Рис. 6. Зависимость константы равновесия от обратной температуры
Выводы
1. Реакция является эндотермической (ΔH > 0), протекает с поглощением тепла.
2. Равновесие смещено в сторону образования хлористого аллила. Процесс характеризуется маленькими значениями Кр. С увеличением температуры константа равновесия увеличивается, а, следовательно, увеличивается выход продукта.
3. В указанных
условиях реакция протекает самопроизвольно, т.к. значения энергии Гиббса
отрицательны (![]() G < 0).
G < 0).
4. Процесс идет с поглощением тепла. Следовательно, с увеличением температуры, в соответствии с принципом Ле-Шателье равновесие смещается в сторону образования продуктов реакции.
3. Кинетика и механизм реакции получения целевого продукта
3.1 Механизм реакции и его обоснование
Температура необходимая для достижения высокой скорости окисления, обычно находится в пределах 140 - 1500С. Для поддержания реакционной массы в жидком состоянии при такой температуре требуется повышенное давление (15 атм), которое способствует и ускорению процесса за счет улучшения растворимости жидкостей [20].
Хлористый аллил омыляют разбавленным раствором щелочи при
140—150 °С и 15 атм.:
![]() .
.
Или проводят гидролиз водой:
![]() .
.
Реакция протекает по бимолекулярному механизму электрофильного замещения Sn2 [15, 59, 62]:
1) На 1 стадии происходит ориентации ориентация нуклеофила относительно «+» заряженного центра в молекуле галогенпроизводного в результате образуется переходный комплекс, в котором старые связи еще не полностью разорваны, а новые еще не полностью образовались:
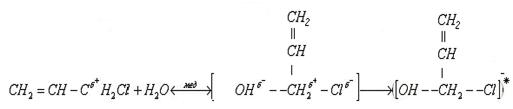
*- данный переходный комплекс обладает избыточной энергией (избыточной электронной плотностью)
2) На второй стадии происходит разрушение каталитического с выделением аллилового спирта и хлор – иона:
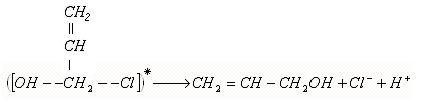 .
.
3) Взаимодействие хлор – иона с ионом водорода с образованием соляной кислоты:
![]() .
.
3.2 Анализ факторов, влияющих на протекание изучаемой реакции
3.2.1 Влияние строения субстрата
Атом кислорода гидроксильной группы имеет sp3 гибридизацию. Средние длины связей 0,143 нм (С - О) и 0,091 нм (О - Н). Обе связи полярны. Однако их считают в значительной мере поляризованными электроотрицательным атомом кислорода.
Полярностью группы ОН- и ее способностью образовывать водородные связи объясняют относительно высокие значения температур кипения и диэлектрической проницаемости. Кислород является более электроотрицательным элементом, чем углерод, и поэтому электронная плотность смещена в сторону кислорода.
Функциональная группа спиртов содержит электроотрицательный атом кислорода с двумя неподеленными парами электронов, конфигурация которого близка к тетраэдрической.
3.2.2 Влияние строения атакующей частицы [46]
В качестве атакующей частицы выступает вода. Она относится к химически активным соединениям. Молекула H2O представлена на рис. 7. Она нелинейна; угол между связями O - H равен 104,27°.

Рис. 7. Молекула воды
Связи эти ковалентные, но они полярны (атомы водорода несут на себе некоторый положительный заряд, атомы кислорода - отрицательный). Поэтому полярна и молекула воды в целом. Она легко диссоциирует на ионы:
H2O![]() H+ + OH-.
H+ + OH-.
3.3 Кинетическая модель реакции [63]
К реакциям первого порядка относится большинство мономолекулярных реакций, а также многие бимолекулярные реакции, называемые псевдомономолекулярными. Так как реакция протекает в большом избытке воды, значит, данная реакция является псевдомономолекулярной:
![]() .
.
По закону действия масс скорость этой реакции описывается уравнением:
![]() .
.
Концентрация воды в ходе реакции практически не изменяется:
![]() ,
,
тогда ![]() .
.
Объединив концентрацию воды с концентрацией скорости, получим кинетическое уравнение вида:
![]()
Это уравнение представляет скорость реакции как функцию
концентрации. Размерность константы скорости реакции 1 порядка обратна времени. Выражается она обычно в [с-1], [мин-1], [час-1].
4. Выбор типа реактора
Реакционными аппаратами называются закрытые сосуды, предназначенные для проведения различных физико-химических процессов. Реактор — аппарат, в котором протекает основной процесс химической технологии; он должен работать эффективно, т. е. обеспечивать определенную глубину и избирательность химического превращения веществ. Реактор должен удовлетворять следующим требованиям: иметь необходимый реакционный объем; обеспечивать заданную производительность и гидродинамический режим движения реагирующих веществ, создавать требуемую поверхность контакта фаз, поддерживать необходимый теплообмен, уровень активности катализатора и т. д. [6, 16, 19].
Конструкцию реакционного аппарата определяет ряд факторов: температура, давление, требуемая интенсивность теплообмена, консистенция обрабатываемых материалов, агрегатное состояние материалов, наличие или отсутствие катализаторов, заданная производительность аппарата, химический характер перерабатываемых материалов и другие специфические условия производства. Реакционные аппараты классифицируют [16, 19]:
1) по назначению — емкостные, тепловые, массообменные;
2) по конструктивному материалу — стальные, чугунные, медные, пластмассовые и др.;
3) по способу изготовления — сварные, литые, клепаные, паяные, кованые и др.;
4) по форме — цилиндрические, сферические, конические, торовые, комбинированные;
5) по схеме нагрузки — работающие под атмосферным давлением или вакуумом, нагруженные внутренним или внешним давлением;
6) по температуре стенок — не обогреваемые, обогреваемые;
7) по тепловому режиму — изотермические, адиабатические, политропические;
8) по условиям коррозионного воздействия — работающие в условиях интенсивного или умеренного разъедания;
9) по положению в пространстве — вертикальные, горизонтальные, наклонные;
10) по способу сборки — разъемные, неразъемные; по толщине стенки- — тонкостенные, толстостенные (с цельной стенкой, многослойной стенкой);
11) по гидродинамическому режиму — аппараты полного вытеснения, полного смешения, промежуточные;
12) по организации процесса — периодические, непрерывные, полунепрерывные.
Процесс гидролиза хлористого аллила в аллиловый спирт осуществляется при наличии двух жидких фаз. При этом большое значение имеет увеличение поверхности их контакта. Обычно это достигается смешением в насосе, на всасывающую линию которого подают оба реагента. Дальнейшее сохранение системы в эмульгированном состоянии обеспечивается турбулизацией потока за счет достаточно большой его линейной скорости [20].
Оптимальная температура процесса определяется желаемой скоростью и реакционной способностью хлорпроизводного; она равна 150 °С - 160 °С, она выбирается таким образом, чтобы время контакта составляло лишь несколько минут. Это определяет работу под давлением 10 - 15 кгс/см2 (от 1,0 - 1,5 МПа), необходимым для поддержания смеси в жидком состоянии [14, 20].
Реакция синтеза аллилового спирта является изотермической, поэтому ее следует проводить только в непрерывных реакторах, так как для поддержания постоянной температуры в реакторе периодического действия отвод тепла должен изменяться во времени, что в промышленных условиях осуществить трудно. В связи с этим, изотермические реакторы периодического действия на практике не применяются. Таким образом, целесообразно выбирать реактор непрерывного действия [16].
При протекании реакций, порядок которых выше n=0, тип реакторов имеет важное значение, так как для достижения одинаковой степени превращения в реакторе смешения нужно большее время, чем в реакторе вытеснения и, следовательно, интенсивность РИВ выше [18].
Если порядок основной реакции выше порядка побочной реакции, т.е. n1>n2, и, следовательно, n1 - n2=а, то при увеличении концентрации исходного вещества СА селективность возрастает. Следовательно, для достижения высокой селективности необходимо поддерживать концентрацию исходного реагента на максимально высоком уровне, т.е. выгодно применять РИВ или К-РИС, так как в этих реакторах средняя концентрация реагента СА выше, чем в РИС-Н [18, 19].
При проведении эндотермических реакций более эффективным является РИВ, так как средние значения СА, Т в нем выше, чем в РИС-Н [18].
Реакционная масса для синтеза аллилового спирта - гомогенная жидкофазная система. Ввиду последовательно - параллельного типа протекающих реакций для повышения селективности выгоден реактор, близкий к модели идеального вытеснения, при отсутствии циркуляции смеси. Вместе с высокой линейной скоростью потока это предопределяет выбор трубчатого реактора с большой длиной труб малого диаметра (змеевик, трубчатка). Первая его секция служит для подогрева смеси, что для высокотемпературных реакций осуществляют в трубчатой печи топочными газами, а для других — в пароподогревателях типа, например, «труба в трубе» [20].
Исходя из вышеизложенного, выбираем реактор идеального вытеснения непрерывного действия трубчатого типа. Это распространенный тип реактора для проведения реакций в жидкой среде, он представлен на рис. 8. Реакторы такой конструкции широко используют в промышленности органической и неорганической химии.
Реактор для получения аллилового спирта представляет собой вертикальную проточную колонну. Для регулирования температуры в зоне реакции, проходящей с поглощением тепла, средняя часть аппарата выполнена в виде трубчатки 2. В межтрубное пространство подаются топочные газы. Режимная температура поддерживается при помощи регуляторов, установленных на линиях обратных газов, выходящих из реактора. Через штуцер 1 реакционная смесь поступает в реактор [61].
Осмотр и чистку аппарата осуществляют через люки 6. С целью защиты от коррозии внутренняя поверхность отстойных секций покрыта медью; трубы и трубные решетки выполнены из меди [62].
Реактор описанного типа менее громоздок, чем аппараты с мешалками, требующие к тому же большого расхода электроэнергии. Такого рода противоточные реакторы, производительность которых (примерно в 2,5 раза) выше, чем производительность прямоточных аппаратов, отличаются минимальным перемешиванием вдоль оси движения материальных потоков и их применение целесообразно для быстро протекающих химических реакций.
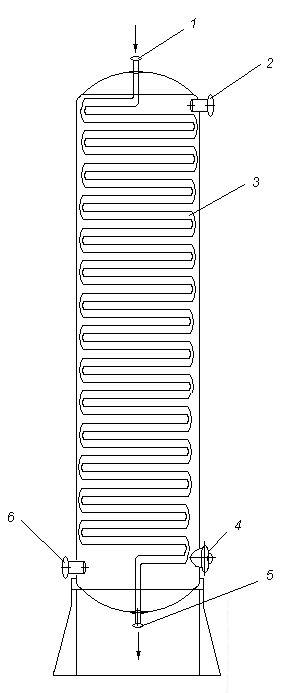
Рис.8. Трубчатый реактор с трубчаткой.
1 –штуцер для входа реагентов; 2 – штуцер для входа топочных газов; 3 – трубчатка; 4 – люк; 5 – штуцер для выхода продукта; 6 – штуцер для выхода топочных газов.
Реактор идеального вытеснения (РИВ) представляет собой трубчатый аппарат, в котором отношение длины трубы L к ее диаметру d достаточно велико. В реактор непрерывно подаются исходные реагенты, которые превращаются в продукты реакции по мере перемещения их по длине реактора.
Гидродинамический режим в РИВ характеризуется тем, что любая частица потока движется только в одном направлении по длине реактора, обратное (продольное) перемешивание отсутствует; отсутствует также перемешивание по сечению реактора. Предполагается, что распределение вещества по этому сечению равномерное, т. е. значения параметров реакционной смеси одинаковые.
Каждый элемент объема реакционной массы dVr движется по длине реактора, не смешиваясь с предыдущими и последующими элементами объема, и ведет себя как поршень в цилиндре, вытесняя все, что находится перед ним. Поэтому такой режим движения реагентов называется иногда поршневым или режимом полного вытеснения.
Состав каждого элемента объема последовательно изменяется по длине реактора вследствие протекания химической реакции. Так, например, концентрация исходного реагента А постепенно меняется по длине реактора от начального CA,0 до конечного значения Са.. Следствием такого режима движения реакционной смеси является то, что время пребывания каждой частицы в реакторе одно и то же [16].
Для составления математического описания РИВ [16, 19] исходят из дифференциального уравнения материального баланса (1), преобразуя его на основе указанных выше особенностей этого реактора:
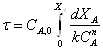 . (1)
. (1)
Поскольку в РИВ реакционная смесь движется только в одном направлении (по длине l), то для первой группы членов правой части уравнения (1) можно записать (выбрав за направление оси х направление движения потока реагентов в реакторе):
![]() ,
,
![]() , (2)
, (2)
![]() , (3)
, (3)
где w- линейная скорость движения реакционной смеси в реакторе; l- длина (длина пути, пройденного элементом объема реакционной смеси в реакторе).
Так как в идеальном реакторе каждый элемент объема реакционной смеси не смешивается ни с предыдущими, ни с последующими объемами, а также отсутствует радиальное перемешивание (нет ни продольной, ни радиальной диффузии, а молекулярная диффузия мала), то:
![]() . (4)
. (4)
С учетом вышесказанного уравнение для реактора идеального вытеснения принимает вид:
![]() . (5)
. (5)
Это уравнение материального баланса является математическим описанием потока реагента в реакторе идеального вытеснения при нестационарном режиме (когда параметры процесса не только меняются по длине реактора, но и непостоянны во времени). Подобный режим характерен для периодов пуска и остановки реактора. Член дСА/дτ характеризует изменение концентрации А во времени для данной точки реактора, т. е. накопление вещества А в этой точке.
Стационарный режим характеризуется тем, что параметры в каждой точке реакционного объема не меняются во времени (дСА/дτ = 0). В этом случае уравнение (5) принимает вид:
![]() . (6)
. (6)
Если объем реакционной смеси не меняется в процессе, справедливо уравнение:
![]() . (7)
. (7)
Но в любой момент времени τ имеем:
![]() , (8)
, (8)
Или ![]() .
(9)
.
(9)
Подставив полученное значение для dCA и dl в уравнение (6), находим:
![]() . (10)
. (10)
После интегрирования уравнения (10) в пределах изменения степени превращения от 0 до ХА получаем:
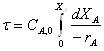 . (11)
. (11)
5. Расчет реактора
5.1 Материальный баланс
Материальный баланс рассчитывается с целью нахождения расходных коэффициентов по сырью и технико-экономических показателей объема реактора [17, 18]. В основе расчета материального баланса лежит закон сохранения массы вещества. В общем виде уравнение расчета материального баланса для любого элемента ХТС может быть записано:
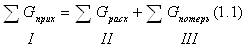
I – сумма всех входящих в элемент ХТС материальных потоков.
II – сумма всех выходящих из элемента ХТС материальных потоков.
III – сумма всех материальных потерь в элементе ХТС.
I определяет приход веществ в материальном балансе;
II и III – расход веществ в материальном балансе.
Существует теоретический и практический материальный баланс.
Теоретический материальный баланс рассчитывается на основе стехиометрии основной реакции и количества полученного продукта. Практический материальный баланс составляется на основе теоретического материального баланса с учетом степени превращения, селективности, выхода, соотношения исходных реагентов, степени чистоты сырья, количества примененного растворителя, инертного газа и т.д.
Отклонения практического материального баланса от теоретического обусловлены тремя основными факторами:
1) термодинамическим процессом (реакции не идут до конца вследствие их обратимости);
2) кинетическим фактором (реакции не идут до конца из-за снижения скорости реакции);
3) механизмом реакции (обуславливается протеканием побочных превращений).
Материальный баланс записывается в виде уравнения, таблицы или диаграммы.
Подготовка исходной информации
Реакции:
Основная:
![]() .
.
(А) (В) (С) (D)
Побочная:
![]() .
.
(А1) (В1) (С1) (D1)
Исходные данные для расчета материального баланса, взятые в источнике [20] сводим в табл. 4.
Таблица 4
Данные для расчета материального баланса
| Производительность реактора П, т/год | 5200 |
| Число дней работы реактора в году n | 320 |
|
Степень превращения |
86 |
|
Селективность основной реакции |
88 |
|
Технологический выход продукта |
92 |
| Молярное соотношение исходных реагентов А:В | 1:1 |
| Состав исходного реагента А, % масс. |
|
| Состав исходного реагента B, % масс. |
|
Расчет практического материального баланса
1) Переводим производительность реактора в мольную:
![]()
2) Рассчитываем производительность с учетом технологического выхода:
![]()
3) Рассчитываем количество хлористого аллила, необходимого для получения 0,211 кмоль/мин аллилового спирта с учетом селективности:
![]()
4) Рассчитываем количество хлористого аллила, необходимого для получения 0,211 кмоль/мин аллилового спирта с учетом степени превращения:
![]()
![]()
5) Рассчитываем количество хлористого аллила, вступившего в побочную реакцию:
![]()
![]()
6) Рассчитываем количество не прореагировавшего хлористого аллила:
![]()
![]()
8) Рассчитываем количество хлористого аллила на 100%:
![]()
![]()
9) Рассчитываем количество примеси вещества А- 1,3 дихлорпропилена:
![]()
![]()
10) Рассчитываем количество воды исходя из молярного соотношения реагентов:
![]()
![]()
11) Рассчитываем количество воды на 100%:
![]()
12) Рассчитываем количество воды, пошедшей на основную реакцию:
![]()
![]()
13) Рассчитываем количество воды, пошедшей на побочную реакцию:
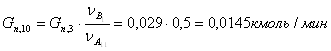
![]()
14) Рассчитываем количество не прореагировавшей воды:
![]()
![]()
15) Рассчитываем количество образовавшегося в основной реакции хлороводорода:
![]()
![]()
16) Рассчитываем количество образовавшегося целевого продукта- аллилового спирта:
![]()
![]()
17) Рассчитываем количество диаллилового эфира, образовавшегося в побочной реакции:
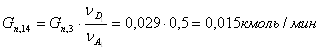
![]()
18) Рассчитываем количество хлороводорода, выделяемого в побочной реакции:
![]()
![]()
19) Рассчитываем суммарное количество хлороводорода:
![]()
![]()
Результаты вычислений записываем в таблицу материального баланса табл. 5.
Таблица 5
Материальный баланс синтеза аллилового спирта
| Приход | ||||||
| В-во |
|
|
|
|
|
|
|
|
0,279 | 47,94 | 21,35 | 73,55 | 22,80 | 76 |
|
|
0,279 | 47,94 | 5,04 | 17,36 | 5,00 | 16,67 |
|
|
0,024 | 4,12 | 2,64 | 9,09 | 2,20 | 7,33 |
| итого | 0,582 | 100,00 | 29,03 | 100,00 | 30,00 | 100,00 |
| Расход | ||||||
| В-во |
|
|
|
|
|
|
|
|
0,211 | 34,99 | 12,24 | 41,59 | 14,40 | 48,00 |
|
|
0,240 | 39,80 | 8,66 | 29,77 | 6,03 | 20,10 |
|
|
0,015 | 2,49 | 1,37 | 4,99 | 1,97 | 6,57 |
|
|
0,024 | 3,98 | 2,54 | 8,97 | 2,51 | 8,37 |
|
|
0,039 | 6,47 | 2,88 | 10,13 | 3,79 | 12,63 |
|
|
0,074 | 12,27 | 1,34 | 4,55 | 1,30 | 4,33 |
| итого | 0,603 | 100,00 | 29,03 | 100,00 | 30,00 | 100,00 |
Вывод: Расчет материального баланса показывает, что для получения 12,24 кг/мин аллилового спирта необходимо взять 21,35 кг/мин хлористого аллила и 5,04 кг/мин воды.
Анализ технико-экономических показателей свидетельствует о том, что реакция не является каталитической, однако технологический выход продукта достаточно высокий (f = 92%). Степень превращения ХА < 100%, что связано с потерями на стадиях синтеза целевого продукта.
Для повышения данного технико-экономического показателя можно повышать температуру в реакторе; потери могут быть связаны с дефектами оборудования, в этом случае его необходимо заменить.
Практический материальный баланс в отличие от теоретического считается с использованием расходных коэффициентов и также зависит от стехиометрических коэффициентов.
5.2 Определение тепловой нагрузки на реактор
Уравнение теплового баланса в общем случае имеет вид:
∑Qприх. = ∑Qрасх. + ∑Qпот.
Для изотермических процессов уравнение теплового баланса:
Qi(исх.) + Qr + Qф + QF = Qj(прод.) + Qi нагр. + Qпот.
Реакции:
Основная:
![]() .
.
(А) (В) (С) (D)
Побочная:
![]() .
.
(А1) (В1) (С1) (D1)
Исходные данные для теплового баланса:
Температура исходных реагентов — 50 0С (323 К);
Температура продуктов реакции — 140 0С (413 К);
Тепловые потери от прихода тепла — 2 %.
Таблица 6
Термодинамические свойства веществ, участвующих в реакции
| Вещество |
DH0298 кДж/ моль |
S0298, Дж/ моль×К |
Ср Дж/ моль |
Ср = f(т), Дж/моль×К | ||||
| а | в×103 | с×106 | d×109 | c'×10-5 | ||||
| CH2=CH-СН2Сl | -8,95 | 14,8 | 2,525 | 3,042 | -2,275 | 0,449 | - | |
| H2O | -241,825 | 188,723 | 30,96 | 11,286 | - | - | 0,33 | |
|
СH2=СН- -СН2ОH |
-131,87 | 204 | -1,104 | 31,413 | -2,029 | 0,531 | - | |
| НСl | -92,311 | 186,677 | 26,501 | 4,598 | - | - | 1,087 | |
| (C3H5)2O | -230,45 | 398,8 | 275,32 | - | - | - | - | - |
| C3H4Cl2 | 85,1 | 168,6 | 174,06 | - | - | - | - | - |
1.Определяем количество тепла, которое поступает с исходными реагентами:
![]()
Сpi = ![]() а +
а + ![]() в·T +
в·T + ![]() с·T2— для органических веществ
с·T2— для органических веществ
Сpi = ![]() а +
а + ![]() в·T +
в·T + ![]() с’·T-2 — для неорганических веществ
с’·T-2 — для неорганических веществ
1. 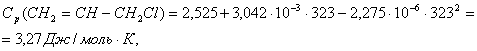
![]() .
.
2. ![]() ,
,
![]() .
.
3. ![]() ,
,
![]() ,
,
![]() .
.
2.Определяем количество тепла, которое выходит из реактора с продуктами реакции:
1. 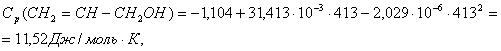
![]() .
.
2. ![]() ,
,
![]() .
.
3. ![]() ,
,
![]() .
.
4. ![]() ,
,
![]() .
.
5. ![]() ,
,
![]() .
.
6. ![]() ,
,
![]() ,
,
![]()
3.Определяем количества тепла, выделяющееся или поглощающееся в результате химической реакции:
Основная
реакция: СН3=СН-СН2Сl + H2O![]() СН3=СН-СН2OH + HCl
СН3=СН-СН2OH + HCl
![]() ,
,
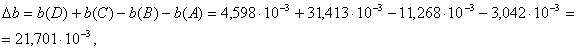
![]() ,
,
![]()
![]()
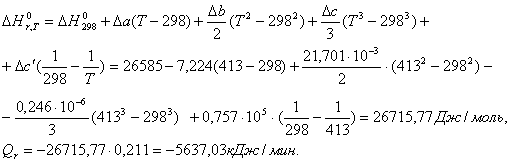
Побочная реакция: A1 B1 C1 D1
2 СН3=СН-СН2Сl + H2O![]() (СН2=СН-СН2)O + 2HCl
(СН2=СН-СН2)O + 2HCl
![]() ,
,
![]()
![]() ,
,
![]() ,
,
![]()
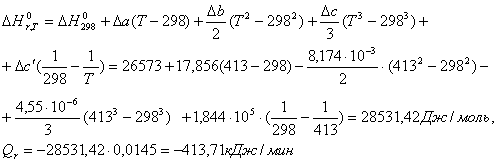
![]() .
.
4. Определяем количество тепла, которое необходимо для нагревания до
температуры химической реакции: ![]() ,
,
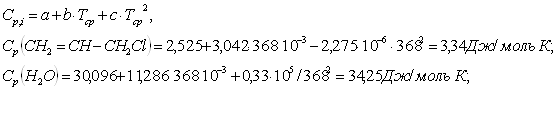

5.Определяем количество потерь тепла:
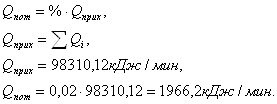
6. Определим тепловую нагрузку на реактор:
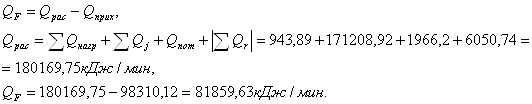
QF < 0 – для поддержания заданной температуры нужен теплоноситель;
Определим поверхность теплообмена реактора:
![]() .
.
Данные, полученные в результате расчета теплового баланса сводим в табл. 7.
Таблица 7
Тепловой баланс
| Приход | Расход | ||||
| Тепловой поток | кДж/мин | % тепл | Тепловой поток | кДж/мин | % тепл |
| Qi | 98310,12 | 54,57 | Qj | 171208,92 | 95,03 |
| QF | 81859,63 | 45,43 | Qнагр | 943,89 | 0,52 |
| Qпот | 1966,20 | 1,09 | |||
| Qr | 6050,74 | 3,36 | |||
| Итого | 180169,75 | 100,00 | Итого | 180169,75 | 100,00 |
Вывод: реакция эндотермическая, QF > 0, то есть для поддержания заданной температуры химической реакции необходимо подводить тепло в количестве 180169,75 кДж/мин.
5.3 Расчет объема реактора
Гидродинамический режим в РИВ характеризуется тем, что любая частица потока движется только в одном направлении по длине реактора; обратное (продольное) перемешивание и перемешивание по сечению аппарата отсутствуют.
В РИВ состав реакционной массы изменяется по длине реактора, поэтому материальный баланс по одному из компонентов необходимо составлять для элементарного объема аппарата dV [64].
Материальный баланс по одному из компонентов в общем виде выражают соотношением [18]:
∑Gприх = ∑Gрасх + ∑Gпотерь.
Gi = Gi + dGi + vrdV.
Учитывая, что dGi = d[Gi,0(1-xi)] = -Gi,0dxi, находим выражение по одному из компонентов для элементарного объема реактора dV:
Gi,0dxi = vrdV = GvCi,0dxi,
где Gv – объемный расход реакционной массы;
Gi,0 – массовый расход реакционной массы;
Ci,0 – концентрация реагента на входе в реактор.
Чтобы получить проектное уравнение для РИВ, необходимо в последнем уравнении разделить переменные и проинтегрировать его, учитывая, что скорость реакции зависит от концентрации веществ или степени превращения. После несложных операций получаем:
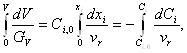
откуда время контакта реагентов в РИВ [61]:
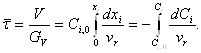
Так как нам известно время реакции, выражаем объем:
![]() .
.
Таким образом, объем реактор составит:
V = 3,5 мин ∙ 11,287 л/мин = 39,505 л = 0,034 м3.
6. Операторная модель химико-технологической системы
Операторная схема жидкофазного гидролиза хлористого аллила в аллиловый спирт представлена на рисунке 9.
Хлорпроизводное и водный раствор гидролизирующего агента подают на всасывающую линию компрессора 2, который эмульгирует смесь и сжимает её до давления 15 атм. Причем переключающее устройство гидравлического клапана пускает в действие поршневую ступень компрессора. При этом, в системе давление повышается до желаемого уровня.
В подогревателе 3 реакционная масса нагревается до температуры 1400С, и в изолированном от теплопотерь реакторе 4 процесс ведут до высокой степени конверсии хлорпроизводного (95% и более). После этого жидкость дросселируют в клапане редуктора 5 почти до атмосферного давления, причем часть ее в испарителе - сепараторе 6 испаряется и пары отделяются от жидкости. Органические продукты отгоняют с острым водяным паром; из нижней части испарителя 6 отводят раствор хлористого натрия и избыток щелочи.
В ректификационной колонне 7 аллиловый спирт отделяют, азеотропной перегонкой от диаллилового эфира. Из верхней части колонны при 77,8°С отбирают тройную азеотропную смесь аллилового спирта, диаллилового эфира и воды. Смесь поступает в сепаратор 8, где разделяется на два слоя: нижний (89,5% воды, 10% аллилового спирта и 0,5% диаллилового эфира), и верхний (90% диаллилового эфира; 8,6% аллилового спирта и 1,4% воды). Из сепаратора 8 верхний слой перетекает в аппарат 9, куда также подают воду для извлечения аллилового спирта в сепараторе 10. Из нижней части колонны 7 жидкость направляют в ректификационную колонну 11 для выделения аллилового спирта.
В процессе синтеза, с ректификационных колонн 7, 11, 13 аллиловый спирт поступает в сборник 14.
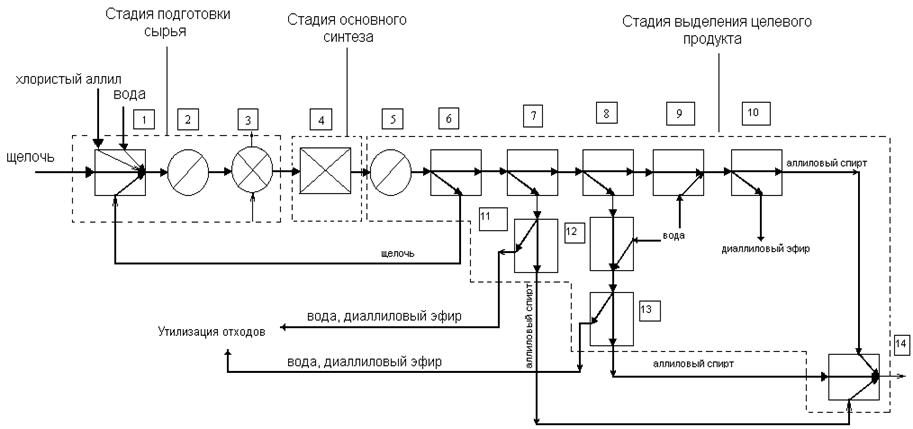
Рис. 9. Операторная схема получения аллилового спирта из хлористого аллила:
1 - смеситель; 2 - компрессор; 3 - подогреватель; 4 – реактор; 5 – редуктор; 6 – испаритель - сепаратор; 7, 11, 13 - ректификационная колонна; 8, 10 – сепаратор; 9, 12 – смеситель; 14- сборник
Щелочь из испарителя - сепаратора 6 вновь возвращается на стадию синтеза.
Побочные продукты от ректификационных колонн 11 и 13: вода и диаллиловый эфир, поступают на стадию утилизации сырья.
Выводы
Разработка и оптимизация методов получения аллилового спирта является актуальной в химической технологии.
Пропеновый спирт, полупродукт производства глицерина, синтетических смол и пластических материалов, и используется в производстве фармацевтических препаратов и в химическом синтезе вообще, но самое большое применение аллиловый спирт нашел в производстве различных сложных эфиров аллила, из которых наиболее важными являются диаллил - фталат и диаллил - изофталат , которые служат в качестве мономеров и реполимеров .
1. На основании анализа литературных данных выбран метод получения аллилового спирта гидролизом хлористого аллила.
Гидролиз проводят в жидкой фазе при 140 - 150 °С, давлении 10 - 15 атм.
Аллиловый спирт по этой реакции получается высокой чистоты с конечным выходом 92%.
2. Термодинамический расчет показал, что реакция
является эндотермической (ΔH > 0), протекает с небольшим поглощением
тепла. Процесс характеризуется маленькими значениями Кр. С увеличением
температуры константа равновесия увеличивается, а, следовательно, увеличивается
выход продукта. В указанных условиях реакция протекает самопроизвольно, т.к.
значения энергии Гиббса отрицательны (![]() G < 0). Процесс идет с поглощением тепла и с увеличением
температуры, значит, в соответствии с принципом Ле-Шателье равновесие смещается
в сторону образования продуктов реакции. Изменение концентрации реагирующих
веществ приведет к смещению равновесия в сторону образования продуктов реакции
(по принципу Ле-Шателье).
G < 0). Процесс идет с поглощением тепла и с увеличением
температуры, значит, в соответствии с принципом Ле-Шателье равновесие смещается
в сторону образования продуктов реакции. Изменение концентрации реагирующих
веществ приведет к смещению равновесия в сторону образования продуктов реакции
(по принципу Ле-Шателье).
3. Реакция протекает по механизму электрофильного замещения.
4. Для проведения процесса гидролиза хлористого аллила в соответствии с условиями протекания реакции выбран реактор с трубчатого типа. Смесь реакционных веществ предварительно сжимают до рабочего давления.
5. Материальный баланс процесса жидкофазного гидролиза хлористого аллила рассчитывается исходя из теоретических данных. Процесс осуществляется при температуре 140 оС; конечный выход аллилового спирта 92%, степень конверсии 86%. Селективность получаемого спирта составляет 88%. Расчет материального баланса показывает, что для получения 12,24 кг/мин аллилового спирта необходимо взять 21,35 кг/мин хлористого аллила и 5,04 кг/мин воды.
Из расчета материального баланса видно, что процесс подчиняется закону сохранения массы. Выход продукта невелик, т.к. имеются потери из-за неполного превращения исходных веществ. Определение тепловой нагрузки на реактор показало, что тепловой баланс подчиняется закону сохранения энергии. Реакция эндотермическая, QF > 0, то есть для поддержания заданной температуры химической реакции необходимо подводить тепло в количестве 180169,75 кДж/мин. С учетом тепловой нагрузки поверхность теплообмена равна 151,59 м2.
6. В работе предложена операторная схема процесса. Предусмотрено возвращение не прореагировавшей щелочи в реакцию. После химического превращения исходных реагентов в реакторе, они направляются на ректификацию, где происходит отделение аллилового спирта. Также в процессе используются компрессор и редуктор для создания необходимых технологических условий.
Список литературы
1. Краткая химическая энциклопедия, «Современная энергия» т.1, М: 1961
2. Химическая энциклопедия т.4, гл. ред. Зефиров Н.С., М: 1995, «Большая Российская энциклопедия»
3. Лосев И.И., Е.Б. Тростянская, химия синтетических полимеров, «Химия», М: 1964.
4. Общая органическая химия, под ред. Д.Бартона, В.Д. Опписса, т.2 Кислородсодержащие соединения, под ред. Дж. Ф. Стоддарта - пер. с англ.под ред. Н.Н. Кочеткова и А.И. Усова- М: Химия 1982.- 856с.
5. Синтезы органических препаратов, сб.1, М: 1949. - стр. 25-28
6. «Справочник химика» т. 2, Л.-М.: Химия, 1964. - стр. 412-413
7. Гурвич Я.А. «Справочник молодого аппаратчика- химика» М.: Химия, 1991.- стр. 229
8. Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977. - стр. 122
9. Гороновский И.Т., Назаренко Ю.П., Некряч Е.Ф. «Краткий справочник по химии» Киев: Наукова думка, 1965. - 837с.
10. Петров А.А., Бальян Х.В., Трощенко А.Т. «Органическая химия» М.: Высшая школа, 1969. - 973с.
11. Жиряков В.Г. «Органическая химия» М.: Химия, 1978. - 408с.
12. Кузьменко Н.Е. и др. Химия. Для школьников ст. кл. и поступающих в вузы: Учеб. Пособие Н.Е. Кузьменко, В.В.Еремин, В.А. Попков.- 4-е изд., стереотип.- М.: Дрофа, 2001. - 544с.
13. В. Л. Белобородов, С.Э. Зурабян, А.П. Лузин и др. «Органическая химия», уч. Для вузов в 2х книгах, М.: Дрофа, 2003 кн.1 Основной курс - - 640 с.
14. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза: Учебник для вузов. 4-е изд., перераб. и доп. – М.: Химия, 1988. – 592 с.
15. Сайкс П. Механизмы реакций в органической химии. Пер. с анг. под ред. Проф. Варшавского Я. М. Изд. 3-е, М., «Химия», 1977. – 320 с.
16. Х. Крамерс, К. Вестерп Химические реакторы расчет и управление ими М., издательство «Химия». 1967. - 265 стр.
17. И. П. Мухленов, Д. А. Кузнецов, А. Я. Авербух, А. Г. Амелин, Е. С. Тумаркина, И. Э. Фурмер Общая химическая технология . В 2х частях. Под ред. И. П. Мухленова. Учебник для вузов. Ч. 2 Важнейшие химические производства. Изд. 3-е перераб. И доп. М., «Высшая школа», 1977. - 288с.
18. Амелин А.Г., А.И. Малахов, Зубова И.Е., Зайцев В.Н. Общая химическая технология. Под ред. Амелина А.Г. М, , «Химия», 1977. - -400с.
19. Р. Михаил, К. Кырлогану Реакторы в химической промышленности, Изд. «Химия», ленинградское отделение, 1968. - 388 с.
20. Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза: Учебник для вузов. 2-е изд., перераб. – М.: Химия, 1975. – 736 с.
21. Кувшинский М. Н., Соболева А. П., Курсовое проектирование по предмету «Процессы и аппараты химической промышленности»: Учеб. Пособие для учащихся вузов.- 2-е изд., перераб. И доп.- М.: Высш. Школа, 1980. - 223с.
22. Рейхсфельд В. О., Шеин В. С., Ермаков В. И. Реакционная аппаратура и машины заводов основного органического синтеза и синтетического каучука: Учебное пособие для вузов.- 2-е изд., перераб.- Л.: Химия, 1985. - 264с.
23. Хардин А.П., Новаков И.А., Каргин Ю.Н. «Технология химических производств», учеб. Пособие., Волгоград, Волгоградский политехнический институт. 1984. - 140 с.
24. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия: Учеб. для вузов.-М.: Высшая школа, 1981. - 592с.
25. Моррисон Р., Бойд Р. Органическая химия: Учеб. пособие для студентов вузов. - М: Мир, 1974. - 1136с.
26. Общая органическая химия / Под. ред. Н.К. Кочеткова: В 2т. Т.2. - М.: Химия, 1982. - 856с.
27. Керн Ф., Сандберг Р. Углубленный курс органической химии: Учеб. пособие для студентов вузов. - М.: Химия, 1981. - 456с.
28. Березин Б.Д., Березин Д.Б.. Курс современной органической химии: Учеб. пособие для вузов. - М.: Высш. шк., 1999. - 768с.
29. Справочник химика / Под. ред. Б.П. Никольского. В 6т. Т.2. - Л.: Химия, 1971. - 1113с.
30. Физер Л., Физер М. Органическая химия. В 2т. Т.1: Пер. с англ. - М.: Химия, 1966. - 680с.
31. Артеменко А.И. Органическая химия: Учеб. для спец. вузов. - 3-е изд. - М.:Высш. шк., 1999. - 695с.
32. Гауптман 3., Грефе Ю., Ремане X. Органическая химия: Пер. с нем. - М.: Химия, 1979. - 832с.
33. Жиряков В.Г. Органическая химия: Учеб. для вузов. -М.: Химия, 1977. - 408с.
34. Шабаров Ю.С. Органическая химия: Учеб. пособие для студентов вузов. - 2-е изд. перераб. - М.: Химия, 1994. - 848с.
35. А.С. 960159 СССР, МКИ С07 СЗЗ/22. Селективное окисление бензилового спирта / Винц В.В., Грожан М.М., Гендолас Г.Д. и др. (СССР). - № 2875604; Заявлено 22.11.79; Опубл. 23.09.82, Бюл. № 35. - 2с.
36. Терней А. Современная органическая химия: Учеб. пособие для студентов вузов. -М.: Мир, 1981. - 680с.
37. Потапов В.М., Татаринчик С.Н. Органическая химия. - 2-е изд. - М.: Химия, 1976. - 546с.
38. Нейланд О.Я. Органическая химия: Учеб. для хим. Спец. вузов. - М.: Высш. шк., 1990. - 751с.
39. Репинская И.Б., Шваруберг М.С. Избранные методы синтеза органических веществ. Пер. с нем. - Новосибирск.: Новосибирский университет, 2000. - 284с.
40. Рид. Р., Шервуд Т. Свойства газов и жидкостей. - Л.: Химия, 1982. - -592с.
41. Краткий справочник физико - химических величин / Под. ред. А.А. Равделя. - С-Пб.: Химия, 1999. - 184с.
42. Лебедев Н.Н., Манаков М.Н., Швед В.Ф. Теория химических процессов основного органического и нефтехимического синтеза. - 2-е изд. перераб. - М: Химия, 1984. - 376с.
43. Юкельсон И.И. Технология основного органического синтеза. - 2-е изд. - М: Химия, 1968. - 848с.
44. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. Учебник для вузов. - 3-е изд., стер.- М: Химия, 1994. - 435с.
45. Лебедев Н.Н., Химия и технология основного органического и нефтехимического синтеза- 2-е изд. перераб. - изд. «Химия», М.: 1971. - 609с.
46. Николаев Л.А, Неорганическая химия: Учеб. Пособие для студентов пед. институтов по химии и биологии. Спец. - 2-е изд., перераб.- М.: Просвещение, 1982. - 374с.
47. Петров М.М., Михелев Л.А., Кукушкин Ю.Н. Неорганическая химия.: Учебное пособие для техникумов/ Под ред. Ю.Н. Кукушкина. -2-е изд., перераб.- Л.: Химия, 1981. - 281с.
48. Петров М.М., Михелев Л.А., Кукушкин Ю.Н. Неорганическая химия.: Учебное пособие для техникумов/ Под ред. Ю.Н. Кукушкина. -3-е изд., перераб.- Л.: Химия, 1981. - 283с.
49. Г. Реми. Курс неорганической химии. 1 том; издательство «Иностранная литература», 1963. - 76с.
50. Г. Реми. Курс неорганической химии. 2 том; издательство «Иностранная литература», 1963. - 77с.
51. Краткий справочник физико-химических величин/ Под ред. К.П. Мищенко и А.А. Ревделя. -4-е изд., перераб. и доп. - Л.: Химия, 1965.- -79с.
52. А.С. 439960 СССР, МКИ С07с СЗЗ/02. Способ получения аллилового спирта / Шарфе Г., Швердтель В., Шводенк В. и др. (ФРГ). - № 1455098; Заявлено 02.07.70; Опубл. 15.08.74, Бюл. № 30. - 3с.
53. А.С. 525655 СССР, МКИ С07с С21/04. Способ получения хлористого аллила / Шарифов Г.С., Джабиев Р.А., Свердлов Р.Ш. и др. . - № 2056133; Заявлено 28.08.74; Опубл. 25.08.76, Бюл. № 31. - 2с.
54. А.С. 345669 СССР, МКИ С07с С33/02. Способ получения аллилового спирта / Рошер Г., Шмитц Х. (ФРГ). - № 147965; Заявлено 25.09.70; Опубл. 14.07.72, Бюл. № 22. - 2с.
55. А.С. 706394 СССР, МКИ С07с С33/02. Способ получения аллилового спирта / Кибина И.Ю., Мусантаева Ш., Щелкунов А.В. - № 2600957; Заявлено 05.04.78; Опубл. 30.12.79, Бюл. № 48. - 2с.
56. А.С. 345119 СССР, МКИ С07с СЗЗ/02. Способ получения аллилового спирта / Бересь Я., Бекеж Я., Хетпер Я. и др. (Польская народная республика). - № 1172811; Заявлено 15.07.67; Опубл. 14.07.72, Бюл. № 22. - 3с.
57. А.С. 509575 СССР, МКИ С07с СЗЗ/02. Способ обезвоживания аллилового спирта / Полковникова А.Г., Гин Е.И., Верещагина Т.М.- - № 2024161; Заявлено 17.05.74; Опубл. 05.04.76, Бюл. № 13. - 3с.
58. Пузаков С.А., Попков В.А. Пособие по химии для поступающих в вузы. Учеб. пособие.- 2-е изд., перераб. И доп.- М.: Высшая школа 2001.-
-575с.
59. П. Сайкс. Механизмы реакций в органической химии − 4-е изд. Пер. с англ. / Под ред. В. Ф. Травеля. − М.: Химия, 1991. − 448 с.
60. Денисов Е. Т. Кинетика гомогенных химических реакций: Учеб. пособие для химических спец. университетов. − М.: Высшая школа, 1978. − 367 с.
61. Попов Ю. В., Но Б. И. Основы инженерной химии: Учебное пособие / ВолГТУ.− Волгоград: Политехник, 1999. − 180 с.
62. Рубанова Р. А, Бутов Г. М. и др. Механизмы реакций в органической химии: Учебное пособие / ВолГТУ − Волгоград: Политехник, 2005.− - 199 с.
63. Зорина Г. И., Гуреев Н. Г., Курунина Г. М. и др. Химическая кинетика. Лабораторный практикум по физической химии: Учеб. Пособие.- ВолгГТУ, Волгоград, 2004. - 64 с.
64. Смирнов Н.Н., Волжинский А. И. Химические реактора в примерах и задачах. − Л.: Химия, 1986. − 226 с.