Реферат: Электрический ток в жидкостях (электролитах)
Доклад на тему:
Электрический ток
в жидкостях
(электролитах)
Электролиз
Законы Фарадея
Элементарный электрический заряд
Ученицы 8го класса «Б»
Логиновой Марии Андреевны
Москва 2003
Школа № 91
Введение
С электропроводностью растворов солей в воде (электролитов) связано очень многое в нашей жизни. С первого удара сердца («живое» электричество в теле человека, на 80% состоящем из воды) до автомобилей на улице, плееров и мобильных телефонов (неотъемлимой частью этих устройств являются «батарейки» – электрохимические элменты питания и различные аккумуляторы – от свинцово-кислотных в автомобилях до литий-полимерных в самых дорогих мобильных телефонах). В огромных, дымящихся ядовитыми парами чанах из расплавленного при огромной температуре боксита электролизом получают алюминий – «крылатый» металл для самолётов и банок для «Фанты». Все вокруг – от хромированной решетки радиатора иномарки до посеребрённой серёжки в ухе когда-либо сталкивалось с раствором или расплавом солей, а следовательно и с электротоком в жидкостях. Не зря это явление изучает целая наука – электрохимия. Но нас сейчас больше интересуют физические основы этого явления.
Электроток в растворе. Электролиты
Из уроков физики в 8 классе нам известно, что заряд в проводниках (металлах) переносят отрицательно заряженные электроны.
Упорядоченное движение заряженных частиц называется электрическим током.
Но если мы соберем прибор (с электродами из графита):
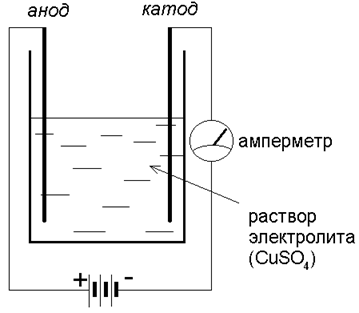
то убедимся, что стрелка амперметра отклоняется – через раствор идет ток! Какие же заряженные частицы есть в растворе?
Ещё в 1877 году шведский ученый Сванте Аррениус, изучая электропроводность растворов различных веществ, пришел к выводу, что её причиной являются ионы, которые образуются при растворении соли в воде. При растворении в воде молекула CuSO4 распадается (диссоциирует) на два разнозаряженных иона – Cu2+ и SO42- . Упрощенно происходящие процессы можно отразить следующей формулой:
CuSO4ÞCu2++SO42-
ü Проводят электрический ток растворы солей, щелочей, кислот.
ü Вещества, растворы которых проводят электрический ток, называются электролитами.
ü Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
ü Вещества, растворы которых не проводят электрический ток, называются неэлектролитами.
Электролитическая диссоциация
Процесс распада электролита на ионы называется электролитической диссоциацией.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него русские химики И. А. Каблуков и В. А. Кистяковский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворённого вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, то есть «одетые в шубку» из молекул воды. Следовательно, диссоциация молекул электролитов происходит в следующей последовательности:
а) ориентация молекул воды вокруг полюсов молекулы электролита
б) гидратация молекулы электролита
в) её ионизация
г) распад её на гидратированные ионы
По отношению к степени электролитической диссоциации электролиты делятся на сильные и слабые.
ü Сильные электролиты – такие, которые при растворении практически полностью диссоциируют.
У них значение степени диссоциации стремится к единице.
ü Слабые электролиты – такие, которые при растворении почти не диссоциируют. Их степень диссоциации стремится к нулю.
Из этого делаем вывод, что переносчиками электрического заряда (носителями электрического тока) в растворах электролитов являются не электроны, а положительно и отрицательно заряженные гидратированные ионы.
Температурная зависимость сопротивления электролита
При повышении температуры облегчается процесс диссоциации, повышается подвижность ионов и сопротивление электролита падает.
Катод и анод. Катионы и анионы
А что же происходит с ионами под воздействием электрического тока?
Вернёмся к нашему прибору:
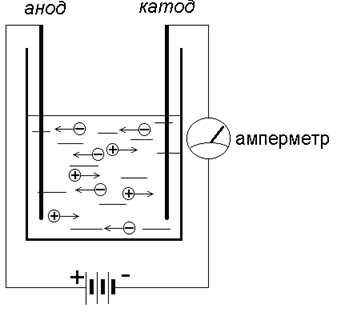
В растворе CuSO4 диссоциировал на ионы – Cu2+ и SO42-. Положительно заряженный ион Cu2+ (катион) притягивается к отрицательно заряженному электроду – катоду, где получает недостающие электроны и восстанавливается до металлической меди – простого вещества. Если извлечь катод из прибора после прохождения через раствор тока, то нетрудно заметить красно-рыжий налет – это металлическая медь.
Первый закон Фарадея
А можем ли мы узнать сколько меди выделилось? Взвешивая катод до и после опыта, можно точно определить массу осадившегося металла. Измерения показывают, что масса вещества, выделевшегося на электродах, зависит от силы тока и времени электролиза:
m=K´I´t
где K – коэффиент пропорциональности, называемый также электрохимическим эквивалентом.
Следовательно, масса выделевшегося вещества прямо пропорциональна силе тока и времени электролиза. Но ток за время (согласно формуле):
q=I´t
есть заряд.
Итак, масса вещества, выделевшегося на электроде, пропорциональна заряду, или количеству электричества, прошедшему через электролит.
M=K´q
Этот закон был эксперементально открыт в 1843 году английским ученым Майклом Фарадеем и называется первый закон Фарадея.
Второй закон Фарадея
А что такое и от чего зависит электрохимический эквивалент? На этот вопрос тоже дал ответ Майкл Фарадей.
На основании многочисленных опытов он пришёл к выводу, что эта величина является характерной для каждого вещества. Так, например при электролизе раствора ляписа (азотнокислого серебра AgNO3) 1 кулон выделяет 1,1180 мг серебра; точно такое же количество серебра выделяется при электролизе зарядом в 1 кулон любой серебряной соли. При электролизе соли другого металла 1 кулон выделяет другое количество данного металла. Таким образом, электрохимическим эквивалентом какого-либо вещества называется масса этого вещества, выделяемая при электролизе 1кулоном протекшего через раствор электричества. Приведем его значения для некоторых веществ:
|
Вещество |
K в мг/к |
|
| Ag (серебро) | 1,118 | |
| H (водород) | 0,01045 | |
| Cu (медь) | 0,3294 | |
| Zn (цинк) | 0,3388 | |
Из таблицы мы видим, что электрохимические эквиваленты различных веществ существенно отличны один от другого. От каких же свойств вещества зависит величина его электрохимического эквивалента? Ответ на этот вопрос даёт второй закон Фарадея:
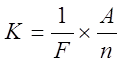
Электрохимические эквиваленты различных веществ пропорциональны их атомным весам и обратно пропорциональны числам, выражающим их химическую валентность.
Где:
n – валентность
A – атомный вес
![]() – называют химическим эквивалентом данного вещества
– называют химическим эквивалентом данного вещества
![]() – коэффициент пропорциональности, который
является уже универсальной постоянной, то есть имеет одинаковое значение для
всех веществ. Если измерить электрохимический эквивалент в г/к то найдем, что
он равен 1,037´10-5 г/к
.
– коэффициент пропорциональности, который
является уже универсальной постоянной, то есть имеет одинаковое значение для
всех веществ. Если измерить электрохимический эквивалент в г/к то найдем, что
он равен 1,037´10-5 г/к
.
Обьединяя первый и второй законы Фарадея получаем:
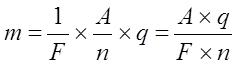
Эта формула имеет простой физический смысл: F численно равно заряду, котоый надо пропустить через любой электролит, чтобы выделить на электродах вещество в количестве, равном одному химическому эквиваленту. F называют числом Фарадея и оно равно 96400 к/г.
Моль и количество молекул в нем. Число Авогадро
Из курса химии за 8й класс мы знаем, что для измерения количеств веществ, участвующих в химических реакциях, была выбрана особая еденица – моль. Чтобы отмерять один моль вещества, нужно взять столько граммов его, какова относительная молекулярная масса его.
Например, 1моль воды (H2O) равен 18 граммам (1+1+16=18), моль кислорода (O2) – 32 грамма, а моль железа (Fe) – 56 грамм.Но что особенно для нас важно, установлено, что 1 моль любого вещества всегда содержит одинаковое число молекул.
Моль – это такое количество вещества, в котором содержится 6´1023 молекул этого вещества.
В честь итальянского ученого А. Авогадро это число (N) называется постоянной Авогадро или числом Авогадро.
Из формулы 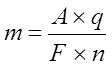 следует, что если q=F, то
следует, что если q=F, то 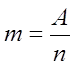 .
Это значит что при прхождении через электролит заряда равного 96400 кулонам,
выделится
.
Это значит что при прхождении через электролит заряда равного 96400 кулонам,
выделится ![]() граммов
любого вещества. Иначе говоря, для
выделения одного моля одновалентного вещества через электролит должен протечь
заряд q=F
кулонов. Но мы знаем, что в любом моле вещества
содержится одно и то же число его молекул – N=6x1023. Это позволяет нам вычислить заряд одного иона
одновалентного вещества – элементарный электрический заряд – заряд одного (!)
электрона:
граммов
любого вещества. Иначе говоря, для
выделения одного моля одновалентного вещества через электролит должен протечь
заряд q=F
кулонов. Но мы знаем, что в любом моле вещества
содержится одно и то же число его молекул – N=6x1023. Это позволяет нам вычислить заряд одного иона
одновалентного вещества – элементарный электрический заряд – заряд одного (!)
электрона:
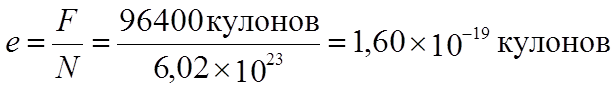
Применение электролиза
Электролитический метод получения чистых металлов (рафинирование, аффинаж). Электролиз, сопровождающийся растворением анода
Хорошим примером является электролитическое очищение (рафинирование) меди. Полученная непосредственно из руды медь отливается в виде пластин и помещается в качестве анода в раствор CuSO4. Подбирая напряжение на электродах ванны (0,20-0,25в), можно добиться, чтобы на катоде выделялась только металлическая медь. При этом посторонние примеси либо переходят в раствор (без выделения на катоде), либо выпадают на дно ванны в виде осадка («анодный шлам»). Катионы вещества анода соединяются с анионом SO42-, а на катоде при этом напряжении выделяется только металлическая медь. Анод как бы «растворяется». Такая очистка позволяет добится чистоты 99,99% («четыре девятки»). Аналогично (аффинаж) очищают и драгоценные металлы (золото Au, серебро Ag).
В настоящее время весь алюминий (Al) добывается электролитически (из расплава бокситов).
Гальванотехника
Гальванотехника – область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность как металлических, так и неметаллических изделий при прохождении постоянного электрического тока через растворы их солей. Гальванотехника пожразделяется на гальваностегию и гальванопластику.
Посредством электролиза можно покрыть металлические предметы слоем другого металла. Этот процесс называется гальваностегией. Особое техническое значение имеют покрытия трудноокисляемыми металлами, в частности никелирование и хромирование, а также серебрение и золочение, часто применяемые для защиты металлов от коррозии. Для получения нужных покрытий предмет тщательно очищяют, хорошо обезжиривают и помещают как катод в электролитическую ванну, содержащую соль того металла, которым желают покрыть предмет. Для более равномерного покрытия полезно применять две пластины в качестве анода, помещая предмет между ними.
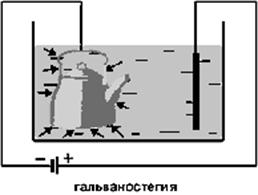
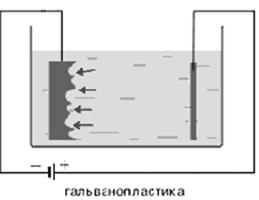
Также посредством электролиза можно не только покрыть предметы слоем того или иного металла, но и изготовить их рельефные металлические копии (например, монет, медалей). Этот процесс был изобретен русским физиком и электротехником, членом Российской Академии наук Борисом Семеновичем Якоби (1801-1874) в сороковых годах XIX века и называется гальванопластикой. Для изготовления рельефной копии предмета сначала делают слепок из какого-либо пластичного материала, например из воска. Этот слепок натирают графитом и погружают в электролитическую ванну в качестве катода, где на нём и осаждается слой металла. Это применяется в полиграфии при изготовлении печатных форм.
Кроме указанных выше, электролиз нашел применение и в других областях:
ü получение оксидных защитных пленок на металлах (анодирование);
ü электрохимическая обработка поверхности металлического изделия (полировка);
ü электрохимическое окрашивание металлов (например, меди, латуни, цинка, хрома и др.);
ü очистка воды – удаление из нее растворимых примесей. В результате получается так называемая мягкая вода (по своим свойствам приближающаяся к дистиллированной);
ü электрохимическая заточка режущих инструментов (например, хирургических ножей, бритв и т.д.).
Список использованной литературы:
1. Гуревич А. Е. «Физика. Электромагнитные явления. 8 класс» Москва, Издательский дом «Дрофа». 1999 год.
2. Габриэлян О. С. «Химия. 8 класс» Москва, Издательский дом «Дрофа». 1997 год.
3. «Элементарный учебник физики под редакцией академика Г. С. Ландсберга - Том II – электричество и магнетизм». Москва, «Наука» 1972 год.
4. Eric M. Rogers. «Physics for the Inquiring Mind (the methods, nature and phylosophy of physical science)». «Prinseton University press» 1966. Том III – электричество и магнетизм. Перевод Москва, «Мир» 1971 год.
5. А. Н. Ремизов «Курс физики, электроники и кибернетики для медицинских институтов». Москва, «Высшая школа» 1982 год.