Реферат: Материалы по химии (кислоты, оксиды, основания, водород)
H F-Фторная -F-фторная В –Не пробуют
HBr-Бромная -Br-бромная З – Нет.
Н2S-Cероводородная =S-сероводородная Растворимость в H2O – растворимая (Н2SiO3-нерасворимая)
НNO3-Азотная -NO3-азотная
НSO3-Cернистая =SO3-сернистая
Н2SO4-Cерная =SO4-серная
H2SiO3-Кремниевая =SiO3-кремниевая
Н3РО4-Фосфорная PO4-фосфорная
Н2СО3-Угольная -CO3-угольная
(Количество атомов водорода в кислоте определяется валентностью Кис.Ост.НХ)
(Кислотный остаток сохраняется постоянной хим. реакции). Кислоты НХКО
Классификация (О) Химические свойства
К ислородсодержащие
Бескислородные
1.Изменяют
цвет индикаторов
ислородсодержащие
Бескислородные
1.Изменяют
цвет индикаторов
HNO3;H2SO3;H2SO4;H2SiO3;H2CO3;H3PO4. HCl;HI;HF;HBr;H2S. ф\ф(безцветный) ф\ф(не изменяется)
 Кислоты
(Н)
Н м\о
(оранжевый)
м\о (красный)
Кислоты
(Н)
Н м\о
(оранжевый)
м\о (красный)
Одноосновные трехосновные лакмус (синий) лакмус (красный)
HCl;HI;HF;HBr;HNO3. двухосновные H3PO4 2.Реагирует с металлами (до Н)
H2S;H2SO3;H2SO4; НХКО+Ме=МеКО+Н2
H2SiO3;H2CO3. 2НСl+Zn=ZnCl2+H2
Получение. 3.HXKO+MeO=MeKO+H2O
неМеО+Н2О=НХКО Н2+неМЕ=НХКО НХКО+соль=НХКО+соль H2SO4+CuO=CuSO4+H2O
Н2+I2=2HI сильные кислоты бесцветная чёрный синяя бесцветная
(H2SO4;HCl;HNO3;H3PO4) 4.с Ме(ОН)Х
H2SO4+BaCl2=BaSO4+2HCl НХКО+Ме(ОН)Х=МеХКО+Н2О
НИЙТРОЛИЗАЦИЯ
К
 лассификация.
Физические
свойства.
лассификация.
Физические
свойства.





 Оксиды
Оксиды
Оксиды
Оксиды
С

 олиобразующие
Солинеобразующие
Жидкий Твёрдый
Газообразный
олиобразующие
Солинеобразующие
Жидкий Твёрдый
Газообразный
О
 сновные
Амфотерный
Кислотные
неМеО
CO;
NO;
N2O
H2O
BaO
SO3
сновные
Амфотерный
Кислотные
неМеО
CO;
NO;
N2O
H2O
BaO
SO3
МеО (двойной) CO2; SO2; SO3; H2O Ц - Различный
Na2O Al2O3 В – Нет, не пробуют
CaO B2O З – Нет, специфический, не пробуют.
BaO ZnO Растворимость в H2O - различна

О ксиды
ксиды
Получение. Химические свойства.
 Основные
(МеО)
Кислотные
(неМеО)
Основные
(МеО)
Кислотные
(неМеО)


 1.
С кислотами
1.
C
основаниями
1.
С кислотами
1.
C
основаниями

 Способы
получения
МеО+кислота=соль+H2O
неМеО+основания=соль+Н2О
Способы
получения
МеО+кислота=соль+H2O
неМеО+основания=соль+Н2О
Г





 орение
веществ
Разложение
веществ
CaO+H2SO4=CaSO4+H2O
СО+Са(ОН)2=СаСО3+Н2О
орение
веществ
Разложение
веществ
CaO+H2SO4=CaSO4+H2O
СО+Са(ОН)2=СаСО3+Н2О
2. С Н2О 2. С Н2О
П
 ростые
Сложные
Нерастворимые
Нестойкие
Соли МеО+Н2О=основание
неМеО+Н2О=кислота
ростые
Сложные
Нерастворимые
Нестойкие
Соли МеО+Н2О=основание
неМеО+Н2О=кислота
вещества вещества основания кислоты СaCO3tCO2+CaO СaO+H2O=Ca(OH)2 СО2+Н2О=Н2СО3
S +O2SO2
CH4+2O2=
CuOH2;
Zn
(OH)2;
H2CO3CO2H2O
CuO+H2O
(угольная
кислота)
+O2SO2
CH4+2O2=
CuOH2;
Zn
(OH)2;
H2CO3CO2H2O
CuO+H2O
(угольная
кислота)
 =CO2+2H2O
Al
(OH)3;
Fe(OH)2;
угольная
кислота
3.
неМеО+МеО=соль
=CO2+2H2O
Al
(OH)3;
Fe(OH)2;
угольная
кислота
3.
неМеО+МеО=соль
 Fe(OH)3.
СО2+СаО=СаСО3
Fe(OH)3.
СО2+СаО=СаСО3
Al(OH)3tAl2O3+3H2O

К
 лассификация.
Физические
свойства.
лассификация.
Физические
свойства.


 Основания
Твёрдые вещества
Основания
Твёрдые вещества
Растворимые в воде Нерастворимые в воде Ц - Различный
LiOH; NaOH; KOH; Сu(OH)2; Al(OH)3; В –Не пробуют
Ca(OH)2; Ba(OH)2; Mg(OH)2 Zn(OH)2; Fe(OH)2; З – Нет.
Щёлочи Fe(OH)3. Растворимость в H2O – различна
Г идроксид
Ме(вал)
идроксид
Ме(вал)
Основание
О снования
снования
Получение. Химические свойства.
1.Ме(актив)+H2O=Me(OH)X+H2 1.Основания изменяют цвет индикаторов
2 K+2H2O=2KOH+H2
ф/ф (безцветный)малиновый
K+2H2O=2KOH+H2
ф/ф (безцветный)малиновый
2.MeO(актив Ме)+Н2О=Ме(ОН)X КОН м/o (оранжевый)жёлтый
Щелочь лакмус (синий)синий
СаО+Н2О=Са(ОН)2 2.Ме(ОН)х+кислотысоль+Н2О
3.Соль+щёлочь=Ме(ОН)+соль Ca(OH)2+2HCl=2H2O+CaCl2
СuSO4+KOH=K2SO4+Cu(OH)2 3.Ме(ОН)х+соль1(Ме-неакт)=Ме(ОН)х+соль2
Голубого цвета 2КОН+СuSO4=Cu(OH)2+K2SO4
4.Me(OH)X+неМе=соль+Н2О
5.Нерастворимые основания разлагаются
Ме(ОН)Хt CМеО+Н2О
Cu(OH)2tCCuO+H2O
2Al(OH)3t CAl2O3+3H2O
О
 бщая
характеристика:
Физические
свойства:
бщая
характеристика:
Физические
свойства:


 Н
Н2О
1)
Земная
кора (1%)
Г
Ц - безцветный
Н
Н2О
1)
Земная
кора (1%)
Г
Ц - безцветный
Х.Э. Н2SO4 2) Живые организмы (6,5%) А В - (нет)
Ar (H)=1 3) Вселенная (92%) З З - (нет)
4) H2O
1)Легче воздуха
1761г. Открыт в Англии Генри Кавендиш 2) Малорастворим в Н2О
3) Горюч
Н2
Простое вещество водород Mr (H)=2
Получение: Химические свойства:
В промышленности:
I
Реагирует
с простыми
веществами
промышленности:
I
Реагирует
с простыми
веществами
CH4=t C C+2H2 а) с металлами
В лаборатории: Ca+H2=CaH2 (гидрид кальция)
b) c неметаллами
2Н2О=2Н2+О2 F2+H2=2HF (фтороводород)
Гидрид – соединение водорода с металлами
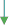 II
Реагирует
со сложными
веществами
II
Реагирует
со сложными
веществами
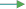 H2+CuO
Cu +H2O
H2+CuO
Cu +H2O
Восстановитель
Восстановитель-реакция восстановления-реакция замешения.
| Программа для поступающих в вузы (ответы) | |
|
Программа по химии для абитуриентов Предмет химии. Явления химические и физические. Атомно-молекулярное учение. Атомы. Молекулы. Молекулярное и ... водородотермия CuO + H2 = Cu + H2O Альдегид + [O] = Карбоновая кислота (Ag2O, Cu(OH)2, H2O2, KMnO4 +H2O); |
Раздел: Рефераты по химии Тип: реферат |
| Неорганическая химия | |
|
1. Химия металлов 1.1 Общие сведения и классификация Большинство химических элементов относятся к металлам. В атомах металлов внешние электроны ... CaO + H2O " Ca(OH)2 + 15,6 ккал/моль Известны две соли угольной кислоты: карбонат CaCO3 и гидрокарбонат Ca(HCO3)2. первая нерастворимая в воде и обладает сравнительно высокой термической устойчивостью, а гидрокарбонат ... |
Раздел: Рефераты по химии Тип: учебное пособие |
| Карбоновые кислоты, их производные | |
|
1. Карбоновые кислоты в природе, их использование, связи в карбоксильной группе; индуктивный эффект, гомологический ряд, изомерия, номенклатура ... СH3-C-OH + NaOH ° CH3-C-ONa + H2O Поэтому, подобно альдегидам муравьиная кислота является сильным восстановителем и окисляется до угольной кислоты, разлагающейся с образованием СО2 и Н2О. |
Раздел: Биология и химия Тип: статья |
| Химия и технология платиновых металлов | |
|
Буслаева Татьяна Максимовна Химия и технология платиновых металлов (Лекционный курс) Москва - 1999 г. Введение Платиновые металлы - это элементы VIII ... ... что гексахлороплатинат(IV) существует в растворах с СHCl > 3 М. При 0.1 < СHCl < 3 М, в 0,5 М растворе KCl, 0,2 и 3 М H2SO4 доминирующим является, наряду с [PtCl6]2-, комплекс [Pt( ... ... времени выдерживания растворов происходит образование катионных комплексов полимерного строения, возможно, вида {[(RuOH)2(H2O)4(OH)2]4+}. Если к таким растворам добавлять соляную ... |
Раздел: Рефераты по химии Тип: учебное пособие |
| Мир солей | |
|
Содержание Содержание. 2 Введение. 3 Графическое изображение формул солей. 6 Названия солей. 4 Классификация солей. 7 1. Кислые соли. 7 2. Средние ... Например, гидросульфат кальция Сa(HSO4)2 можно получить при нейтрализации серной кислоты H2SO4 гидроксидом кальция Ca(OH)2. От двухосновных кислот (H2 SO4, H2 CO3, H2 S и т.д.) производится только один тип кислых солей - однозамещенные (атом металла замещает только один атом водорода кислоты). |
Раздел: Рефераты по химии Тип: реферат |
