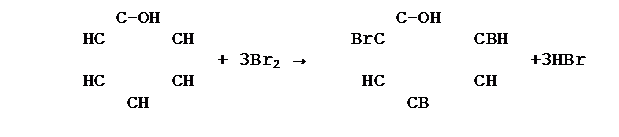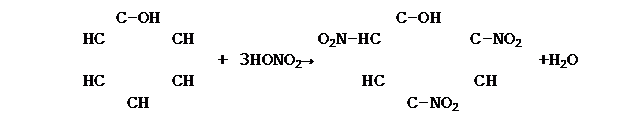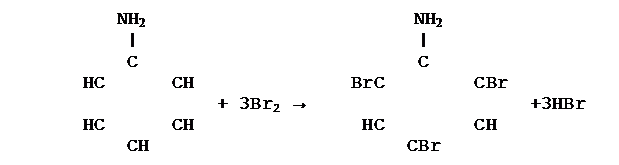Реферат: Теория Бутлерова
I. Строение молекулы метана.
Молекулярная формула метана CH4.
Так как атом углерода имеет большую электроотрицательность (2,5), чем водород (2,1), то в молекуле метана происходит незначительное смещение общих электронных пар в сторону атома углерода.
Однако такая формула не отражает пространственного строения молекулы. Чтобы это показать, необходимо вспомнить о формулах электронных облаков и размещении электронов по энергетическим уровням и подуровням. Например, строение атома углерода изображают следующей схемой:
| 2P | ||||||
| ) ) | 2S | ↑ | ↑ | |||
| С +6 2 4 | S | ↑↓ | ||||
| ) ) | ↑↓ |
1S2 2S2 2P2 |
Так как на втором энергетическом уровне р-подуровне имеется свободная орбиталь, то на нее может перейти один из 2S2 – электронов:
| ) ) | ||||||
| С +6 2 4 | ↓ | ↓ | ↓ | |||
| ) ) | ↓ | |||||
| S Sp | ↑↓ |
В результате все четыре наружных электрона второго энергетического уровня в атоме углерода окажутся неспаренными, и атом углерода в возбужденном состоянии становится четырехвалентным.
Чтобы понять, как происходит образование химических связей в молекуле метана перекрыванием электронных облаков и почему молекула метана имеет тетраэдрическое строение, нужно знать то, что эти облака после гибридизации распространяется в пространстве так, что их оси оказываются направленными к вершинам тетраэдры. При образовании молекул метана вершины этих гибридных облаков перекрываются с облаками электронов атомов водорода.
Так как в этом случае в гибридизации участвует один S-электрон и три p-электрона, то такой ее вид называется SP3- гибридизацией.
Химическая формула и строение молекул этилена.
Молекулярная формула этилена C2H4.
Если между двумя взаимно связанными атомами углерода разместить четыре атома водорода, то структурную формулу этилена следовало бы изобразить так:
H H
| |
H – C – C – H
| |
Однако свободных связей в молекуле не должно быть. Поэтому в структурной формуле этилена изображают двойную связь:
H H
| |
H – C = C – H
Следовательно, в отличие от предельных углеводородов, в молекулах которых между атомами углерода имеется ординарная связь, в молекулах углеводородов ряда этилена между атомами углерода имеется одна двойная связь.
В молекуле этилена подвергаются гибридизации одно S- и два p – электронных облака атомов углерода. Таким образом каждый атом углерода имеет по три (всего шесть) гибридных электронных облака и по одному (всего два) негибридному p – облаку. Два из гибридных электронных облаков атомов углерода взаимно перекрываются и образуют между атомами углерода δ (сигма) – связь. Остальные четыре гибридных электронных облака атомов углерода перекрываются в той же плоскости с четыремя S – электронными облаками атомов водорода и также образуют четыре δ – связи. Негибридные два p-облака атомов углерода взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости δ – связи, т.е. образуется одна П-связь. Следовательно, в молекуле этилена между атомами имеется одна δ и одна П – связь. В углеродных соединениях П – связь значительно слабее, чем δ – связь. Под воздействием респектов П – связь легко разрывается.
Легко понять, что в молекулах предельных углеводов атомы углерода могут свободно вращаться вокруг δ – связи. Если же между атомами углерода существует не только δ – связь, но и П – связь, то такое вращение без разрыва последней невозможно.
II.
1.Изомерия цепи атомов углерода в различных органических соединениях
Впервые с этим видом изомерии мы встретились при изучении предельных углеводородов. Например, молекулярной формуле C5H12 соответствуют три вещества:
CH3 – CH2 - CH2 - CH2 - CH3
Пентан
|
CH3 |
|
| | | |
|
CH3 – CH – CH2 – CH3 |
CH3 – C - CH3 |
| | | | |
|
CH3 |
CH3 |
| 2-метилбутан | 2,2 диметилпропан |
Этот вид изомерии встречается не только у предельных углеводородов, но и у других классов органических соединений. Так, например, в зависимости от строения углеродной цепи одной и той же молекулярной формуле С4Н90Н соответствуют два спирта:
|
CH3 |
|
| 4 3 2 1 | 3 2| 1 |
|
CH3 - CH2 - CH2 - CH2 - ОH |
CH3 - CH – CH2 - ОH |
| 1-бутанол | 2-метил-1-пропанол |
Другой пример. Одной и той же молекулярной формуле C4H9O2в зависимости от строения углеродной цепи соответствуют две аминокислоты:
| O |
CH3 O |
| 4 3 2 1// | 3 2| 1// |
|
CH3 – CH2 – CH – C |
CH3 – C – C |
| | | | \ |
|
NH2 |
NH2 OH |
| 2-аминобутановая кислота | 2-амино-2-метил-пропановая кислота |
2. Изомерия положения двойной или тройной связи в молекуле
С этим видом изомерии мы встретились при изучении непредельных углеводородов. Так, например, молекулярной формуле C4H6 в зависимости от места расположения тройной связи соответствуют два вещества:
CH3 – CH2 – C ≡ CH CH3 – C ≡ С - CH3
1- бутин 2-бутин
Другой пример. Одной и той же молекулярной формуле С4Н602 в зависимости от места двойной связи соответствуют две непредельные карбоновые кислоты:
| O | O |
| // | // |
|
CH2 = CH – CH2 - C |
CH3 - CH = CH - C |
| \ | \ |
| ОН | ОН |
| Винилуксусная кислота | Кротоновая кислота |
3. Изомерия положения функциональной группы или отдельных атомов в молекуле.
С этим видом изомерии мы ознакомились при изучении спиртов, аминокислот, а также галогенопроизводных углеводородов. Рассмотрим несколько примеров.
Молекулярной формуле С3Н7ОН в зависимости от положения гид роке ильной группы в молекуле соответствуют два вещества:
|
CH3 - CH – CH3 |
|
|
CH3 - CH2 - CH2 - ОH |
| |
| ОH | |
| 1-пропанол | 2-пропанол |
Молекулярной формуле С3Н7О2N в зависимости от положения аминогруппы —NH2 в молекуле соответствуют два вещества:
| O | O |
| 3 2 // | // |
|
NH2 - CH2 – CH2 - C |
CH3 - CH – C |
| \ | \ |
| ОН | ОН |
| 3-аминопропановая кислота | 2-аминопропановая кислота |
Молекулярной формуле С3Н7Сl в зависимости от положения атома хлора в молекуле тоже соответствуют два вещества:
CH3 – CH2 – CH2 - Cl CH3 – CНCl - CH3
1-хлорпропан 2-хлорпропан
4. Пространственная, или стереоизомерия. Этот вид изомерии встречается у непредельных углеводородов, в составе которых имеются разные атомы или группы атомов, способные занимать различные положения в пространстве. Например, олеиновая кислота С17Н33СООН существует в двух изомерных формах:
| Н Н |
CH3 – (CH2)7 Н |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| \ / | \ / | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| С = С | С = С | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| / \ | / \ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CH3 – (CH2)7 (CH2)7 - СООН |
Н (CH2)7 - СООН |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Цис-изомерЭтим же видом изометрии обусловлена стереорегулярность и стереонерегулярность различных полимеров. Характерным примером регулярного строения является дивиниловый каучук
А примером нерегулярного строения-бутадиеновый каучук
которые существенно отличаются по свойствам. 5. Изомерия, характерная для органических соединений, в молекулах которых имеется бензольное кольцо. Этот вид изомерии возможен при наличии двух заместителей в бензольном кольце. В зависимости от расположения заместителей в бензольном кольце различают орто-, мета- и пара-изомерию. Так, например, если в бензольном кольце имеется два заместителя — радикал метил и гидроксильная группа, то такое вещество называется крезолом. И в зависимости от расположения этих групп в бензольном кольце существует три различных вещества:
Следует учесть, что многие соединения, имеющие одну и ту же молекулярную формулу, могут отличаться между собой различными видами изомерии, например:
Эти изомерные вещества отличаются одновременно изометрией углеродной цепи и изометрией положения функциональной группы – NH2. III. Например, из молекулы этанола натрий вытесняет только один атом водорода. Следовательно, этот атом водорода более подвижен. Отсюда можно вывести структурную формулу этанола: H H | | H – C – C – H | | H H Наоборот, зная структурную формулу этанола, можно предвидеть, что натрий будет вытеснять только один атом водорода, который связан с атомом кислорода. Изучая свойства глюкозы, мы убедились, что в ее молекуле пять групп – он и одна альдегидная группа. Наоборот, зная структурную формулу глюкозы, можно предвидеть, что глюкоза будет проявлять свойства альдегидов и спиртов. IV. Химические свойства фенола обусловлены наличием в его молекуле гидроксильной группы и бензального ядра, которые взаимно влияют друг на друга. Наличие гидроксильной группы предопределяет сходство фенола со спиртами: 1. Сходство, сходное со свойствами спиртов: 2C6H5OH + 2 Na → 2C6H5ONa + H2 ↑ 2. Свойство, отличающееся от свойств спиртов: C6H5OH + NaOH → C6H5ONa + H2O 3.
Реакция бромирования 4. Реакция нитрования
Влияние бензольного ядра на гидроксильную группу обуславливает большую подвижность ее водородного атома. Поэтому фенол, в отличие от спиртов, реагирует со щелочами, т.е. обладает свойствами слабых кислот. Его иногда называют карболовой кислотой. Это объясняется тем, что бензольное ядро оттягивает к себе электроны кислородного атома гидроксильной группы. Чтобы компенсировать это, атом кислорода сильнее притягивает к себе электронную плотность от атома водорода. Вследствие этого кавалентная связь между атомами кислорода и водорода становится более полярной, а атом водорода – более подвижным. Гидроксильная группа в свою очередь придает атомам водорода большую подвижность в положении 2, 4, 6. Это один из многих примеров, подтверждающих тезис теории А.М. Бутлерова о взаимном влиянии атомов в молекулах. Химические свойства анилина обусловлены наличием в его молекуле аминогруппы - NH2 и бензольного ядра. Анилин более слабое основание. Чтобы ответить на этот вопрос, нужно вспомнить о взаимном влиянии атомов и атомных групп в молекулах. Как и в молекулах фенола (об этом говорилось раньше) бензольное ядро несколько оттягивает свободную электронную пару от атома азота аминогруппы. Вследствие этого электронная плотность на атоме азота в молекуле анилина уменьшается и он слабее притягивает к себе протоны, т.е. основные свойства анилина ослабляются. Важнейшие свойства анилина: 1. Реагирует с кислотами с образованием солей: C6H5 – NH2 + HCl → C6H5 NH3 Cl 2. Образовавшиеся соли реагируют со щелочами и снова выделяются анилин: C6H5 – NH3 Cl+ NaOH → C6H5 NH2 + Na Cl + H2O 3. Энергично участвует в реакциях замещения, например реагирует с бромной водой с образованием 2, 4, 6 – триброманилина:
Взаимное влияние атомов в молекулах галогенопроизводных углеводород. Самое характерное химическое свойство предельных углеводородов – реакции замещения. Примером такой реакции является взаимодействие предельных углеводородов с галогенами. Аналогично с галогенами реагируют и другие предельные углеводороды: CH3-CH3+Cl2 → CH3-CH2-Cl+HCl Галогенопроизводные углеводороды обладают некоторыми особенностями. Согласно теории А.М. Бутлерова, это объясняется взаимным влиянием атомов и атомных групп в химических соединениях. С точки зрения современных представлений об электронных облаках и их взаимном перекрывании, с учетом электроотрицательности химических элементов взаимное влияние атомов и атомных групп, например в метилхиориде, объясняется так. У атомов хлора электроотрицательность больше, чем у атомов углерода. Поэтому электронная плотность связи смещена от атома углерода в сторону атома хлора. Вследствие этого атом хлора приобретает частичный отрицательный заряд, а атом углерода – частичный положительный заряд. Приобретаемые частичные заряды обозначаются δ+ и δ- :
Влияние атома хлора распространяется не только на атом углерода, но и на атомы водорода. Из-за этого электронная плотность атомов водорода смещается в сторону атома углерода и химические связи между атомами водорода и углерода становится более полярными. В результате атомы водорода в молекуле метилхлорида оказываются менее прочно связанными с атомом углерода и легче замещаются на хлор, чем первый атом водорода в молекуле метана. Из-за смещения электронных плотностей от атома водорода к атому углерода значение положительного заряда последнего уменьшается. Поэтому ковалентная связь между атомами углерода и хлора становится менее полярной и более прочной. С точки зрения ионного механизма сущность правила В.В. Марковникова при взаимодействии пропилена с бромоводородом объясняется следующим образом: в молекуле пропилена в результате сдвига электронной плотности второй атом углерода, который связан с метилрадикалом заряжен более положительно, чем первый. Значение электроотрицательности у атомов углерода больше, чем у атомов водорода. Поэтому третий атом углерода метильной группы в результате сдвига электронной плотности от трех атомов водорода приобретает относительно больший отрицательный заряд, чем другие атомы углерода. Этот избыточный отрицательный заряд в свою очередь смещает подвижные П-электронные облака от второго к первому атому углерода. В результате такого сдвига первый атом углерода приобретает больший отрицательный заряд, а второй становится более положительным. В результате атом водорода (+) присоединяется к атому углерода (-), а галоген (-) – к атому углерода (+). Бензол очень стоек к окислению. В отличие от него ароматические углеводороды с боковыми цепями окисляются относительно легко. 1. При действии энергичных окислителей (K Mn O4) на гомолоне бензола окислению подвергаются только боковые цепи. Если, например, в пробирку налить 2-3 мл толуола, затем добавить к нему раствор перманганата калия и нагреть, то можно заметить, что фиолетовая окраска раствора постепенно обесцвечивается. Это происходит потому, что по действием перманганата калия метильная группа толуола окисляется и превращается в группу
Известно, что метан и другие предельные углеводороды весьма устойчивы к действию окислителей. Однако метильная группа в молекуле толуола окисляется сравнительно легко. Это объясняется влиянием бензольного кольца. Из приведенных примеров реакций замещения и окисления следует, что не только метильная группа влияет на бензольное кольцо, но и бензольное кольцо влияет на метильную группу, т.е. их влияние зависимо. |