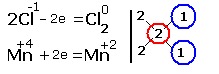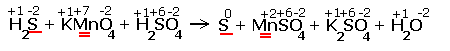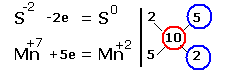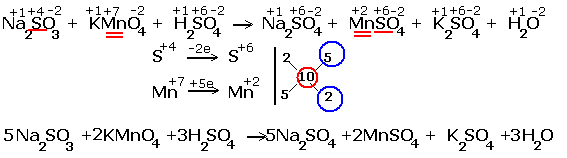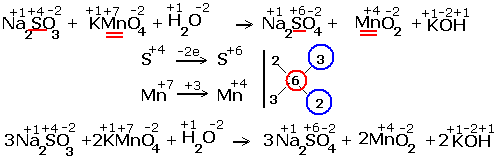Реферат: Составление уравнений окислительно-восстановительных реакций
Существуют два метода составления окислительно - восстановительных реакций - метод электронного баланса и метод полуреакций. Здесь мы рассмотрим метод электронного баланса.
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, приэтом руководствуемся правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем.
Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Рассмотрим этот метод на примере.
|
Расставить коэффициенты в реакции, схема которой: HCl +
MnO2 |
| Алгоритм расстановки коэффициентов |
|
1.Указываем степени окисления химических элементов.
Подчёркнуты химические элементы, в которых изменились степени окисления. |
|
2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов.
За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное ( взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2 тоже -1. Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно и перед HCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент - 2. В результате получится химическое уравнение:
|
| Рассмотрим более сложное уравнение: |
|
H2S + KMnO4 + H2SO4 |
|
Расставляем степени окисления химических элементов:
|
|
Электронные уравнения примут следующий вид
Перед серой со степенями окисления -2 и 0 ставим коэффициент 5, перед соединениями марганца -2, уравниваем число атомов других химических элементов и получаем окончательное уравнение реакции |
|
|
Список литературы
Для подготовки данной работы были использованы материалы с сайта http://www.alhimikov.net
ВЛИЯНИЕ СРЕДЫ НА ХАРАКТЕР РЕАКЦИЙ.
Реакции окисления - восстановления могут протекать в различных средах: в кислой, нейтральной и щелочной. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления. Рассмотрим пример влияния среды на восстановление перманганат-иона MnO4-:
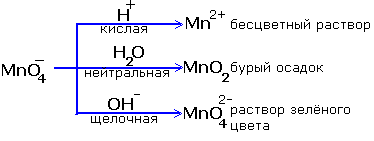
Обычно для создания в растворе кислой среды используют серную кислоту. Для создания щелочной среды применяются растворы гидроксидов калия или натрия.
Рассмотрим примеры протекания реакции между сульфитом натрия Na2SO4 (восстановитель) c перманганатом калия KMnO4(окислитель).
| Реакция в кислой среде |
|
|
| Реакция в нейтральной среде |
|
|
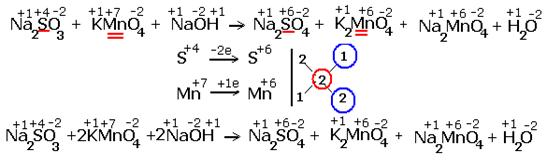
| Реакция в щелочной среде |
|
|