Статья: Денатурация белков
Березов Т.Т., Коровкин Б.Ф.
Природные белковые тела наделены определенной, строго заданной пространственной конфигурацией и обладают рядом характерных физико-химических и биологических свойств при физиологических значениях температуры и рН среды. Под влиянием различных физических и химических факторов белки подвергаются свертыванию и выпадают в осадок, теряя нативные свойства. Таким образом, под денатурацией следует понимать нарушение общего плана уникальной структуры нативной молекулы белка, преимущественно ее третичной структуры, приводящее к потере характерных для нее свойств (растворимость, электрофоретическая подвижность, биологическая активность и т.д.). Большинство белков денатурирует при нагревании их растворов выше 50–60°С.
Внешние проявления денатурации сводятся к потере растворимости, особенно в изоэлектрической точке, повышению вязкости белковых растворов, увеличению количества свободных функциональных SH-групп и изменению характера рассеивания рентгеновских лучей. Наиболее характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической, антигенной или гормональной). При денатурации белка, вызванной 8М мочевиной или другим агентом, разрушаются в основном нековалентные связи (в частности, гидрофобные взаимодействия и водородные связи). Дисульфидные связи в присутствии восстанавливающего агента меркаптоэтанола разрываются, в то время как пептидные связи самого остова полипептидной цепи не затрагиваются. В этих условиях развертываются глобулы нативных белковых молекул и образуются случайные и беспорядочные структуры (рис. 1.12).
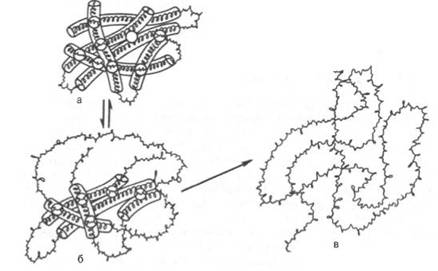
Рис. 1.12. Денатурация белковой молекулы (схема).
а - исходное состояние; б - начинающееся обратимое нарушение молекулярной структуры; в - необратимое развертывание полипептидной цепи.
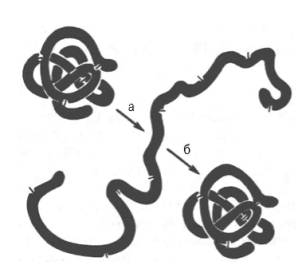
Рис. 1.13. Денатурация и ренатурация рибонуклеазы (по Анфинсену).
а - развертывание (мочевина + меркаптоэтанол); б - повторное свертывание.
При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурация белка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекулы (рис. 1.13), включая биологическую активность. Таким образом, при денатурации белковая молекула полностью теряет биологические свойства, демонстрируя тем самым тесную связь между структурой и функцией. Для практических целей иногда используют процесс денатурации в «мягких» условиях, например при получении ферментов или других биологически активных белковых препаратов в условиях низких температур в присутствии солей и при соответствующем значении рН . При лиофилизации белков (высушивание в вакууме путем возгонки влаги из замороженного состояния) для предотвращения денатурации часто пользуются химическими веществами (простые сахара, глицерин, органические анионы).
| Белок - основа жизни | |
|
Глава II Программа спецкурса "Белок - основа жизни". 2.1. Объяснительная записка. Предлагаемая программа спецкурса "Белок - основа жизни ... При изучении спецкурса в XI классе следует особое внимание уделять химическому строению, структурам белковых молекул, методам выделения и очистки белков, их биологическому действию ... Это связано как с дегидратацией белковых молекул, так и с денатурацией белка. |
Раздел: Рефераты по биологии Тип: реферат |
| Характеристика белков | |
|
План: Введение. Исследование белков. Классификация белков. Состав и строение пептидная связь элементарный состав молекулярная масса аминокислоты ... Денатурация белка - разрушение сил (связей), стабилизирующих четвертичную, третичную и вторичную структуры, приводящее к дезориентации конфигурации белковой молекулы и ... Необратимое осаждение связано с глубокими внутримолекулярными изменениями структуры белка, что приводит в потере ими нативных свойств - денатурации , которая влечет потерю ... |
Раздел: Рефераты по химии Тип: реферат |
| Белковый баланс организма | |
|
Реферат по дисциплине валеология Красноярский государственный технический университет Усть-Илимск 2004 Введение В своем реферате я рассмотрю белки, их ... Поэтому и относительная молекулярная масса белков колеблется в очень широких пределах - от 10 тысяч до многих миллионов На основе определения относительной молекулярной массы и ... Разрушение исходной (нативной) структуры белка, называемое денатурацией, происходит в присутствии кислот и оснований, при нагревании, изменении ионной силы и других воздействиях. |
Раздел: Биология и химия Тип: реферат |
| Белки молока, строение и функции | |
|
Калининградский Государственный Технический Университет", ФГОУ ВПО "КГТУ" Кафедра химии Курсовая работа по биохимии Белки молока, строение и функции ... Они максимально расщепляются пищеварительными протеиназами в нативном состоянии, в то время как обычно глобулярные белки приобретают эту способность только после денатурации. Такой выпавший альбумин вновь в воде не растворяется, так как при нагревании происходит изменение в строении белковой молекулы альбумина - денатурация его. |
Раздел: Рефераты по химии Тип: курсовая работа |
| Выделение мембранных белков | |
|
Содержание Введение. 2 1. Структура мембранных белков. 3 2. Выделение мембранных белков. 6 2.1 Солюбилизация мембранных белков. 7 2.1.1 Периферические ... 3.2 Определение молекулярной массы нативного белка с помощью гидродинамических методов. Анализируя спектр КД белков, его обычно представляют как сумму компонентов, отвечающих поглощению разных участков белковой молекулы: ѭ-спиралей, ѭ-слоев и случайных клубков. |
Раздел: Рефераты по биологии Тип: курсовая работа |