Реферат: Реакции спиртов. Кислотно-основные свойства спиртов. Реакции с участием нуклеофильного центра
Спирты представляют собой соединения общей формулы ROH, в которых гидроксильная группа присоединена к насыщенному атому углерода. По номенклатуре ИЮПАК насыщенные спирты называют алканолами, нумерация в которых определяется гидроксильной группой. Гидроксильная группа при наличии двойной и тройной связей является старшей.
![]()
![]()
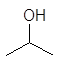
![]()
![]()
этанол 1-пропанол 2-пропанол 2-пропен-1-ол 2-пропин-1-ол
этиловый пропиловый изопропиловый аллиловый пропаргиловый спирты
![]()
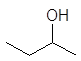
![]()
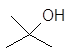

1-бутанол 2-бутанол 2-метил-1-пропанол 2-метил-2-пропанол
н-бутиловый втор-бутиловый изобутиловый трет-бутиловый спирты
При нумерации атомов главной цепи спиртов гидроксильная группа имеет преимущество перед алкильными группами, атомами галогенов и кратной связью.
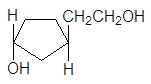
транс-3-(2’-гидроксиэтил)-1-циклопентанол
Часто спирты называют по углеводородной группе (этиловый спирт). В этой номенклатуре положение заместителя в алкильной группе спирта обозначается буквами греческого алфавита:
![]()
![]()
g-бромпропиловый спирт b-метоксиэтиловый спирт
В зависимости от того, является ли атом углерода, к которому присоединена гидроксильная группа, первичным 1о, вторичным 2о или третичным 3о спирты бывают 1о (RCH2OH), 2о (R2CHOH) или 3о (R3COH). Например, из четырех возмож-ных бутиловых спиртов два – бутиловый и изобутиловый являются первичными 1о, втор-бутиловый - вторичным 2о и трет-бутиловый – третичным 3о.
Число гидроксильных групп в молекуле определяет так называемую атомность спирта. По числу гидроксильных групп в молекуле спирты подразделяются на одноатомные, двухатомные, трехатомные и т.д. Например, этанол является одноатомным спиртом, этиленгликоль _ двухатомным, а глицерин _ трехатомным.
![]()
![]()
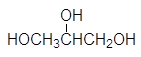
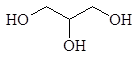
этиленгликоль глицерин
1. Реакции спиртов
Функциональная группа спиртов содержит электроотрицательный атом кислорода с двумя неподеленными парами электронов. В молекуле спиртов можно выделить следующие реакционные центры:
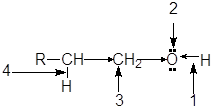
1. ОН-кислотный центр, обусловливающий возможность отщепленя протона вследствие высокой полярности связи О-Н;
2. нуклеофильный и n-основный центр - атом кислорода, имеющий неподеленные пары электронов;
3. электрофилный центр - a-атом углерода, на котором дефицит электронов вызван -I-эффектом соседней гидроксильной группы;
4. b-С-кислотный центр, в котором поляризация связи С-Н также обусловлена электроноакцепторным влиянием гидроксильной группы.
1.1. Кислотно-основные свойства спиртов
Спирты являются слабыми ОН-кислотами Бренстеда и жесткими кислотами по Пирсону. По кислотности спирты близки к воде. Кислотные свойства спиртов определяются способностью к протонизации атома водорода гидроксильной группы. Последняя обусловливается не только разницей в электроотрицательностях между атомами кислорода (3,5) и водорода (2,1), но и природой радикала. Метанол (pKa = 15,5), несколько более сильная кислота, чем вода (pKa = 15,7), но большинство спиртов являются более слабыми кислотами, чем вода. Причиной этого являются стерические препятствия, мешающие в разветвленных спиртах сольватации образующегося алкоксид-аниона. Сольватация стабилизирует алкоксид-анион и следовательно усиливает кислотные свойства.
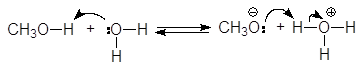 (26)
(26)
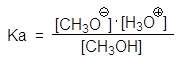
pKa = 15.5
Образование межмолекулярной водородной связи в жидкой фазе определяет различие в кислотности первичных, вторичных и третичных спиртов. В водном растворе кислотность спиртов уменьшается в ряду:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
pKa (в воде) 5.0 15,5 15,7 15,9 17,0 18,0
тогда как в газовой фазе наблюдается прямо противоположная последователь-ность
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 30 20 10
10
30 20 10
10
В жидкой фазе определяющим фактором стабилизации алкоксид-анионов является эффект сольватации, который тем больше, чем меньше стерические препятствия для сольватации, т.е. чем меньше в молекуле углеводородных радикалов и меньше их размер. Разветвленность алкильной группы снижает кислотность спиртов, а введение в их молекулы атомов галогена, наоборот повышает ее.
Кислотные свойства спиртов проявляются во многих реакциях, например:
![]() (27)
(27)
метоксид натрия
(MeO‾Na+)
![]() (28)
(28)
этоксид натрия
(EtO‾Na+)
![]() (29)
(29)
трет-бутоксид калия
(t-BuO‾K+)
1.2. Реакции с участием нуклеофильного центра
Высокая электроотрицательность атома кислорода (3,5 по шкале Полинга), являющегося основным центром, позволяет рассматривать спирты как слабые n-основания Бренстеда и жесткие основания по Пирсону. Неудивительно, что спирты способны образовывать соли оксония только с сильными протонными кислотами и жесткими кислотами по Пирсону (фторид бора, хлорид цинка и др.).
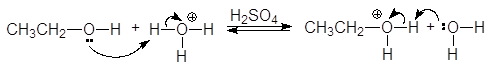 (30)
(30)
гидроний этилоксоний
Таким образом, спирты обладают слабыми кислотными и слабыми основными свойствами, т.е. являются амфипротонными соединениями.
При достаточно высокой температуре и в отсутствие хорошего нуклеофила протонированные спирты способны к реакции Е1, т.е. к реакции дегидратации.
Будучи жесткими основаниями, вследствие низкой поляризуемости и высокой электроотрицательности, атома кислорода спирты являются слабыми нуклеофилами. Кислоты Бренстеда протонируют атом кислорода гидроксигруппы.
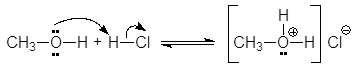 (31)
(31)
метилгидроксоний хлорид
Кислоты Люиса образуют со спиртами доноро-акцепторные комплексы, в которых атом кислорода является донором неподеленной электронной пары.
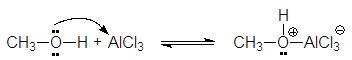 (32)
(32)
В общем, спирты являются сравнительно слабыми основаниями: значения pKa их сопряженных кислот ROH2+ составляют около -2. Разветвление алкильной группы в молекуле спирта увеличивает его основность.
К реакциям, протекающим с участием нуклеофильного центра, можно отнести реакции О-ацилирования и О-алкилирования спиртов.
А. О-Ацилирование
Спирты реагируют с карбоновыми кислотами с образованием сложных эфиров (эстеров) по реакции конденсации получившей название этерификация.
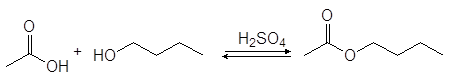 (33)
(33)
уксусная кислота 1-бутанол бутилацетат
Реакция этерификации катализируется кислотами. Без добавления кислоты равновесие достигается очень медленно, но если же смесь спирта и кислоты нагревать в присутствии небольшого количества концентрированной серной кислоты или хлороводорода равновесие устанавливается достаточно быстро.
В качестве ацилирующих реагентов могут использоваться как неорганические, так и органические кислоты, и их функциональные производные. С неорганически-ми кислотами без осложнений реагируют только первичные спирты, в результате чего образуются сложные эфиры (кислые или средние):
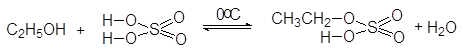 (34)
(34)
этилгидросульфат
Эта реакция имеет промышленное значение, т.к. с ее помощью из высших спиртов получают синтетические моющие средства:
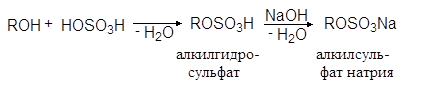 (35)
(35)
При использовании избытка спирта можно получать диалкилсульфаты. Так при нагревании метанола с олеумом получают диметилсульфат.
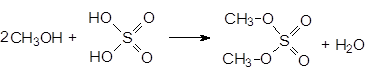 (36)
(36)
Диметилсульфат - это нервный яд, он хорошо адсорбируется кожей. Его используют для получения метилиодида.
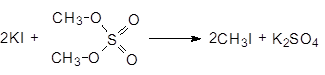 (37)
(37)
Вторичные и третичные спирты при нагревании с серной кислотой подвергаются дегидратации.
При действии на спирты азотной кислоты образуются нитраты. Тринитрат глицерина, неправильно называемый тринитроглицерином, является взрывчатым веществом, однако он очень чувствителен к удару, поэтому его применяют в виде динамита, представляющего собой опилки, пропитанные тринитроглицерином. Взрывчатыми веществами являются нитраты и других полиолов.
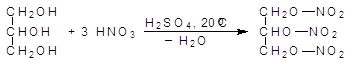 (38)
(38)
глицерин тринитрат глицерина
Спирты реагируют с фосфорной кислотой, давая алкилфосфаты:
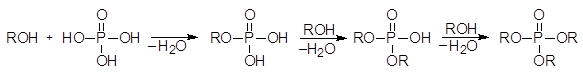 (39)
(39)
фосфорная к-та алкилдигидро- диалкилгидро- триалкилфосфат
Фосфат фосфат
При нагревании фосфорной кислоты она превращается в ангидриды, называемые дифосфорной и трифосфорной кислотой. Ди- и трифосфорная кислоты также реагируют со спиртами давая эфиры. Эфиры фосфорной кислоты играют очень важную роль в биохимических реакциях. Особенно большое значение имеют эфиры трифосфорной кислоты. В воде они способны медленно гидролизоваться с выделением тепла. В организме эти реакции катализируются энзимами.
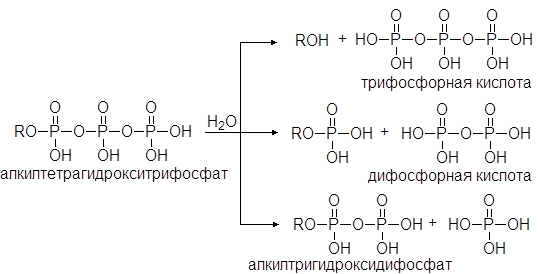 (40)
(40)
Б. О-Алкилирование
В качестве алкилирующих агентов используются галогенопроизводные, диалкилсульфаты и алкилсульфонаты. Для увеличения нуклеофильности спиртов их превращают в алкоксиды щелочных металлов.
![]() (41)
(41)
этоксид натрия пропилбромид пропилэтиловый эфир
Активность спиртов как нуклеофильных реагентов может быть увеличена, если использовать в качестве среды полярные апротонные растворители, например диметилсульфоксид. Растворители этого типа в меньшей степени сольватируют спирты, т.к. не образуют с ними водородных связей. Отсутствие сольватации повышает нуклеофильность спиртового атома кислорода. В этом случае можно использовать спирт и щелочь вместо алкоголята:
 (42)
(42)
бутилпропиловый эфир
Эта реакция, называемая синтезом Вильямсона, протекает по механизму SN2.
Использование в синтезе Вильямсона вторичных и третичных галогеноалканов приводит к получению простых эфиров с более низким выходом, поскольку нуклеофильное замещение сопровождается конкурентной реакцией дегидрогалогенирования с образованием алкенов. Также ограничено применение в синтезе Вильямсона алкоголятов вторичных и третичных спиртов, основность которых сопоставима с их нуклеофильностью, что способствует конкурентному протеканию реакции дегидрогалогенирования. Синтетические возможности реакции Вильямсона расширяются при использовании диалкилсульфатов и алкилсульфонатов вместо галогеноалканов. Этот вариант применется главным образом для метилирования и этилирования спиртов:
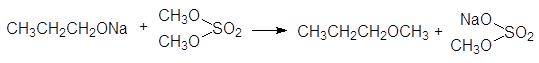 (43)
(43)
пропоксид натрия диметилсульфат метилпропиловый эфир
| Программа для поступающих в вузы (ответы) | |
|
Программа по химии для абитуриентов Предмет химии. Явления химические и физические. Атомно-молекулярное учение. Атомы. Молекулы. Молекулярное и ... По положению гидроксила в молекуле, в зависимости от того, с каким атомом углерода связан (с первичным, вторичным или третичным) различают первичные, вторичные и третичные спирты. Скорость реакции этерификации зависит от природы спирта и кислоты, а именно - с каким атомом углерода связана гидроксильная группа (первичным, вторичным или третичным) и каково ... |
Раздел: Рефераты по химии Тип: реферат |
| Оксисоединения | |
|
Под ми понимают органические соединения содержащие в составе своей структурной формулы одну или несколько гидроксильных групп (OH). Таковыми являются ... Под ми понимают органические соединения содержащие в составе своей структурной формулы одну или несколько гидроксильных групп (OH). Спирты классифицируют на первичные, вторичные и третичные в зависимости оттого, с каким атомом углерода (связана гидроксильная группа). В результате между атомом водорода гидроксильной группы и свободной электронной парой кислорода OH группы другой молекулы спирта возникает водородная связь, за счёт которой ... |
Раздел: Рефераты по химии Тип: реферат |
| Спирты | |
|
Содержание Введение 2 ОН ОН 2 ОН ОН ОН 2 Алициклические 3 Ароматические 3 ОН 3 Алифатические 3 Бутанол - 1 4 Бутанол - 2 4 Глава I. Свойства спиртов ... По положению гидроксильной группы спирты делятся на : первичные - с гидроксильной группой у конечного звена цепи углеродных атомов, у которого, кроме того, имеются два водородных ... Простейшие спирты (метиловый, этиловый, пропиловый, бутиловый) в больших количествах расходуются как таковые , а также в форме эфиров уксусной кислоты, как растворители в ... |
Раздел: Рефераты по химии Тип: реферат |
| Синтез этилового эфира 4-бромбенозойной кислоты | |
|
Федеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования "САМАРСКИЙ ГОСУДАРСТВЕННЫЙ ... При пропускании паров первичного или вторичного, но не третичного спирта над металлической медью при повышенной температуре происходит выделение двух атомов водорода и первичный ... Скорость этерификации зависит от силы кислоты и природы спирта: с увеличением силы кислоты она возрастает, первичные спирты реагируют быстрее вторичных, вторичные спирты - быстрее ... |
Раздел: Рефераты по химии Тип: курсовая работа |
| Спирты (алкоголи) | |
|
Спиртами или алкоголями называют производные углеводородов, в молекулах которых один или несколько водородных атомов замещены на соответствующее число ... Спиртами или алкоголями называют производные углеводородов, в молекулах которых один или несколько водородных атомов замещены на соответствующее число гидроксильных групп (-ОН). В зависимости от характера углеродного атома (первичный, вторичный или третичный), с которым связана гидроксильная группа, различают спирты первичные, вторичные и третичные: |
Раздел: Биология и химия Тип: реферат |