Реферат: Клеточная биотехнология
Содержание
Введение
Общее представление о росте и развитии
Дифференцировка.
Тотипотентность.
Культура каллусных тканей и их морфогенетические особенности.
Суспензионная культура.
Культуры отдельных клеток.
Применение культур растительной ткани. Фундаментальные и практические аспекты.
Вспомогательное использование методов in vitro в селекции растений.
Преодоление постгамной несовместимости.
Клональное микроразмножение отдаленных гибридов.
Гибридизация соматических клеток.
Слияние изолированных протопластов.
Заключение.
Приложения.
Литература.
Введение
Клеточная биотехнология базируется на использовании культуры клеток, тканей и протопластов. Для того чтобы манипулировать клетками, нужно выделить их из растения и создать такие условия, при которых они могли бы жить и размножаться вне растительного организма. Метод культивирования изолированных клеток и тканей на искусственных питательных средах в стерильных условиях (in vitro) получил название культуры изолированных тканей и приобрёл особое значение в связи с возможностью его использования в биотехнологии.
Культура клеток высших растений может рассматриваться с трёх точек зрения – как уникальная биологическая система, как модель в физиологии растений и как инструмент для разнообразных исследований и биотехнологий. Изолированные растительные клетки способны продуцировать ценные для медицины, парфюмерии и других отраслей промышленности вещества вторичного синтеза (вещества не участвующие в основном обмене веществ): алкалоиды, стероиды, гликозиды, гормоны, эфирные масла и т.д. Продуктивность культивируемых клеток в результате клеточной селекции может значительно превышать продуктивность целых растений. Использование изолированных культур клеток в селекции, дают возможность получать быстрорастущие растения, устойчивые к различным неблагоприятным факторам среды. Вместе с тем, это направление предусматривает создание новых растений путём слияния изолированных протопластов и получение соматических гибридов. Перенос в изолированные протопласты чужеродных генов с помощью методов генной инженерии позволяет получать в дальнейшем растения с новыми наследуемыми свойствами. Культура клеток как экспериментально созданная биологическая система интересна сама по себе и является объектом исследования узкого круга специалистов. Как модель, клетки in vitro представляют интерес для многих физиологов и биохимиков растений. Очевидно, что адекватно использовать культуру клеток как модель можно тогда, когда чётко представляешь её свойства, как биологической системы. И, наконец, как инструмент фундаментальных и прикладных исследований. Статус экспериментально созданной биологической системы обусловлен свойственной культурам клеток изменчивостью, наследуемостью возникших изменений, адаптивным отбором и эволюцией. В некотором роде её можно считать микропопуляцией, основное отличие которой от природных популяций - это отсутствие полового размножения особей, т.е. клеток. Можно выделить две принципиальные особенности культуры клеток растений как биологической системы: во-первых, отсутствие организменного контроля развития, и во-вторых - избыточный генетический материал. Культивируемые клетки и ткани могут служить адекватными моделями для исследований различных направленностей, например метаболизма и его регуляции в клетках и тканях целого растения. И для более глубокого понимания данных процессов и явлений часто используются методы создания биохимических мутантов, гибридных и трансформированных клеток в пределах исследуемой культуры. Простота клеточных моделей, возможность быстро получать достаточную массу в асептических, контролируемых по многим параметрам условиях являются преимуществами такого моделирования. В отношении синтеза вторичных метаболитов культуры клеток также обладают рядом достоинств, а именно возможность использования для этой цели растения, не произрастающие в наших природных условиях, и получать продукцию круглый год. Тем не менее, проблемы клеточных и молекулярных основ морфогенеза, не говоря уже о механизмах морфогенеза, остаются малоизученными. Прежде всего, это концепция тотипотентности растительной клетки и её влияние на стратегию исследовательской работы с культурой тканей и клеток растений. Постулат этой концепции о первичности внешнего сигнала в морфогенетическом ответе растительной клетки во многом определил экстенсивный характер исследований в области культуры клеток растений. Второй причиной является сложность морфогенетических процессов, которые позволяют моделировать и изучать культуры клеток и тканей. Известно, что в культуре in vitro может осуществляться реализация нескольких морфогенетических программ, а именно зародышевого развития и некоторого органогенеза. Возможность моделирования в культуре in vitro более простых процессов, например гистогенеза и цитодифференцировок представляется затруднительнее. Однако, в рамках исследования эти проблемы вполне преодолимы, при индивидуальной разработке методики и постановки эксперимента.
Общее представление о росте и развитии
О росте растений, казалось бы, можно судить по увеличению общей биомассы. Однако этот показатель весьма неоднозначен, поскольку сырая биомасса может не только увеличиваться, но и уменьшаться. Ещё один показатель роста – это увеличение числа клеток. Если число клеток растёт, можно уверенно говорить о росте, но постоянное число клеток ещё не говорит об отсутствии роста: в зоне растяжения увеличение числа клеток незначительно, тем не менее, рост идёт. О росте можно судить по увеличению линейных размеров – высоты растения, длины корня, ширины листа и т.д.
Таким образом, ростом можно называть необратимое увеличение растения хотя бы по одному из параметров: число клеток, линейные размеры, сырая/сухая биомасса.
Упрощённой моделью изменения параметров роста от времени является «кривая роста». Более подробно я буду говорить о ней ниже. Следует только отметить, что характер этой кривой способен резко меняться, в связи с действием на растение массы внешних факторов. Общая кривая роста, часто оказывается составленной разномасштабными S – образными участками. Таким образом, кривая роста целого растения обычно имеет более сложную форму.
Дифференцировка
Термин дифференцировка был введён для обозначения процесса приобретения различий между клетками (тканями, органами, системами органов и т.д.). Предполагается, что есть начальное недифференцированное состояние, когда наблюдатель не может установить различий между клетками, затем появляются видимые различия клеток и они становятся дифференцированными. Традиционно недифференцированными считают: делящиеся клетки эмбриона; меристематические клетки апексов корня и стебля, камбия, феллогена, интеркалярных меристем; клетки,_неорганизованно делящиеся в экспериментальных условиях (суспензионная и каллусная культура in vitro).
Клетки, покинувшие зону деления, приступают к дифференцировке. Результат этого процесса можно увидеть, например, при образовании проводящей системы: возникает прокамбий, который дифференцируется на флоэму, ксилему и камбий. Во флоэме дифференцируются ситовидные элементы и клетки-спутницы, в ксилеме — паренхимные клетки и трахеиды, проводящий пучок может быть усилен дифференцирующимися механическими тканями и т.д. В данном примере клетки поэтапно приобретают анатомические различия в связи с выполняемыми функциями, многообразие клеток растет.
Анатомической дифференцировке предшествует биохимическая дифференцировка, когда видимых различий между клетками мало, но они, не одинаковы по содержанию тех или иных веществ. Удобнее следить за дифференциальной эспрессией генов: появлением новых или снижением уровня старых мРНК и белков. Эти данные позволяют зарегистрировать различия между клетками раньше, чем они станут видимыми на анатомическом уровне. Таким образом, дифференцировка начинается с изменения активности генома, экспрессии одних генов и подавления активности других.
При таком подходе делящиеся клетки меристемы придется считать дифференцированными, так как для прохождения клеточного цикла нужна определённая активность генома, которая и будет отличать эти клетки от других. Анатомы давно обратили внимание на неоднородность клеток меристемы. Можно сказать, что апикальная меристема корня дифференцирована на каллиптроген (инициали чехлика), дерматоген (инициали эпидермальной ткани), инициали коры, покоящийся центр и инициали осевого цилиндра. Для каждой из групп делящихся клеток характерны определенная локализация, направление веретена делений и тип производных клеток. Исследование меристемы методами молекулярной генетики показывает, что обнаруженная анатомами дифференцировка меристемы на зоны совпадает с зонами дифференциальной экспрессией определенных генов. Более того, саму меристему в целом можно достаточно четко выделить по зонам дифференциальной экспрессии. Таким образом, меристема является биохимически дифференцированной тканью.
Дифференциальная экспрессия генов — фундаментальное проявляение дифференцировки, и, как это ни парадоксально, недифференцированных клеток вообще не существует. Понятие «недифференцированный» хорошо работает только там, где в соответствии с задачами исследования исходные различия между клетками не учитывают (или нет методов их обнаружить).
Генетический анализ процесса развития предполагает его разложение на ряд промежуточных этапов, каждый из которых контролируется определённой генетической системой. Развитие есть результат совместной, возможно сменяющей друг друга активности двух генетических систем – первичной и вторичной. Под первичной системой понимается генетический контроль, жёстко регламентирующий переход развивающейся системы из одного состояния в другое, а под вторичной генетической регуляцией – способность системы достигать некоторого конечного состояния автоматически или авторегуляторно.
Геноконтролируемые этапы являются критическими периодами в развитии биологической системы, поскольку именно здесь происходят коренные изменения, связанные с формированием морфофункциональной структуры и определение принципов регулирования. В эти периоды создаются предпосылки негеноконтролируемых переходов системы, в которых она сохраняет свои качественные характеристики и свойства, а также демонстрирует низкую чувствительность к внешним и внутренним изменениям условий развития.
Итак, дифференцировкой можно назвать процесс изменения профиля генной активности, приводящий к дальнейшему изменению функции клеток.
Тотипотентность
В эмбриологии животных процесс дифференцировки изображают как сложный «ландшафт», по которому катится «шар». Шар — это символ клетки, дающей начало новому организму. В развилках шар «совершает выбор» и скатывается по одной из нескольких возможных траекторий. Так и клетки, возникшие при делении зиготы, направляются по одному из возможных путей дифференцировки. При этом клетки теряют «морфогенетический потенциал». Все «траектории» заканчиваются в «море», символизирующем смерть организма.
Если в начале пути у «шара» - клетки много потенциальных возможностей, то по мере приближения к «морю» их становится все меньше.
По имени ученого, предложившего такую аналогию, ее называют морфогенетическим ландшафтом Уоддингтона.
Процесс дифференцировки равносилен потере морфогенетического потенциала.
В отличие от клеток животных большинство клеток растений после анатомической дифференцировки легко переходят к делению. Такой процесс называют дедифференцировкой (потерей специализации). При механическом повреждении растения, а также в условиях эксперимента дедифференцировка приводит к образованию каллуса.
Из большинства клеток можно получить новый организм (для клеток животных это невозможно). Практически любая клетка многоклеточного организма содержит полный набор генов, необходимый для формирования организма, однако не каждая клетка может дать начало целому организму. Свойство клетки реализовать имеющуюся генетическую информацию и дать начало целому организму называют тотипотентностью. Тотипотентность клеток растения сравнительно легко реализовать, тогда, как большинство животных клеток не могут образовать новый организм. Таким образом, понятие дифференцировки как снижения морфогенетического потенциала, заимствованное из эмбриологии животных, не применимо к тотипотентным растительным клеткам, так как их морфогенетический потенциал долго остается высоким.
Идея о тотипотентности растительной клетки была выдвинута Г. Хаберландтом еще в 1902 г., хотя и не получила тогда экспериментального подтверждения. Согласно определению Хаберландта, любая клетка растения может дать начало новому организму, и если этого не наблюдается, то только потому, что растительный организм подавляет потенции клетки к развитию. Изоляция клеток от растений способствует проявлению этих потенций.
Культура каллусных тканей и их морфогенетические особенности
Культура изолированных тканей обычно бывает представлена каллусными или опухолевыми тканями. Каллусная культура – это неорганизованная пролиферирующая ткань, состоящая из недифференцированных клеток. В дальнейшем они специализируются как каллусные. Каллус может образовываться как на изолированных участках ткани (эксплантах) in vitro, так и на растении при повреждении.
Каллусная ткань in vitro в основном бывает белого или желтоватого, реже светло-зелёного цвета (полная или зональная пигментация антоцианами). Тёмно-коричневая окраска возникает при старении каллусных клеток и вызвана накоплением в них фенолов. Каллусная ткань аморфна и не имеет конкретной анатомической структуры, но в зависимости от происхождения и условий выращивания она может быть различной консистенции:
1. Рыхлая, состоящая из сильно оводнённых клеток, легко распадающиеся на отдельные агрегаты.
2. Средней плотности, с хорошо выраженными меристематическими очагами.
3. Плотная, в которой дифференцируются элементы камбия и проводящей системы.
Обязательным условием дифференцировки растительной клетки и превращение её в каллусную является присутствие в питательной среде двух групп антагонистических гормонов: ауксинов и цитокининов. Ауксины вызывают процессы дифференцировки клетки, запуская механизмы активизации вторичных мессенджеров, способствующих растяжению клеточных стенок и дальнейшую пролиферацию, а цитокинины вызывают деление уже дифференцированных клеток. Для того чтобы дифференцированные клетки вновь приобрели способность к делению, необходим «возврат» к меристематическому состоянию (дедифференцировка). Размножение дифференцированных клеток приводит к анархическому, неорганизованному росту, в результате чего образуется каллусная ткань. Таким образом, превращение специализированной клетки в каллусную связано с индукцией митозов, способность к которому была потеряна в процессе дифференцировки.
Эффект, вызываемый действием одних и тех же фитогормонов, может быть различным в зависимости от физиологической характеристики ткани-мишени. Её компетентность определяется степенью дифференцировки клеток.
Переход клетки in vitro из дифференцированного состояния к дедифференцировке и активным клеточным делениям обусловлен изменением активности генов (эпигеномной изменчивостью). Активирование одних генов и репрессирование других приводит к изменению в белковом составе клеток. В каллусных клетках появляются специфические белки и одновременно исчезают или уменьшаются в количестве белки, характерные для фотосинтезирующих клеток листа. У двудольных растений процесс репрессии и дерепрессии генов, лежащий в основе дедифференцировки, происходит легче, чем у однодольных. При переходе дедифференцированной клетки к неорганизованному анархическому размножению, приводящему к образованию каллусной ткани, в клетках происходят биохимические и цитологические изменения. Дедифференцировка начинается с использования запасных веществ и разрушения специализированных клеточных органелл. Через 6—12 ч после индукции дедифференцировки клеточная оболочка разрыхляется и разбухает, увеличивается число свободных рибосом, возрастает число элементов аппарата Гольджи, увеличиваются размеры и число ядрышек. Все эти изменения предшествуют началу делений, которые начинаются через 48-72 часа.
Каллусная клетка имеет свой цикл развития и повторяет развитие любой клетки, включая деление, растяжение и дифференцировку, после чего наступает старение и отмирание клетки. Каллусную дифференцировку можно назвать вторичной, но её не следует путать с вторичной дифференцировкой клетки, лежащей в основе морфогенеза. Для того чтобы не произошло старения, утраты способности к делению и отмирание каллусных клеток, первичный каллус, возникший на эксплантах, через 4-6 недель переносят на свежую питательную среду – пассируют. При регулярном пассировании способность к делению может поддерживаться в течение нескольких лет.
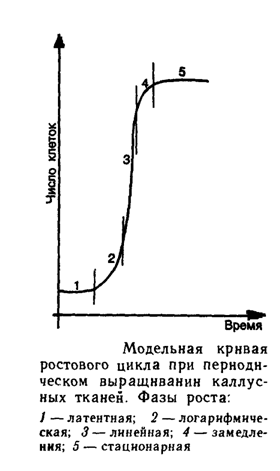
Ростовая кривая каллусных клеток имеет S-образную форму (рис.1). Данный график включает пять фаз. Во время первой – латентной фазы увеличения числа и массы клеток не происходит. Клетки в этот период подготавливаются к делению. Вторая фаза - период экспоненциального роста, характеризующаяся наибольшей митотической активностью и увеличением массы каллусной культуры. Кроме того, рост здесь происходит с ускорением. Третья фаза – линейная, где скорость роста клеток относительно постоянна. Далее наступает фаза замедленного роста, при которой митотическая активность клеток резко снижается. И пятая фаза – стационарная или период деградации. Скорость нарастания клеточной массы здесь равна нулю.
На электронно-микроскопических фотографиях показана тонкая структура молодой, растущей и стареющей клетки каллусной ткани:

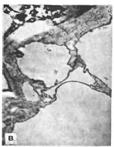
а – молодая
б - растущая
в - стареющая
Успех в применении культуры клеток и тканей в первую очередь зависит от оптимизации физиологических процессов, обеспечивающих нормальную пролиферацию, их дифференцировку и регенерацию из них взрослых особей. Наиболее сложной является регенерация растений из отдельных клеток. В первую очередь это касается злаковых растений. Поэтому важнейшее значение имеет выяснение механизма морфогенеза in vitro, регенерация и лежащих в их основы процессов.
Каллусные клетки in vitro сохраняют многие физиолого-биохимические черты, свойственные нормальным клеткам, входящим в состав растительного организма. Каллусные клетки сохраняют способность к синтезу вторичных метаболитов. Морозостойкость и способность к закаливанию присущи каллусным клеткам, полученным от морозостойких растений. Этим свойством не обладают каллусные ткани, полученные от тропических и субтропических культур. Таким образом, устойчивость к низким температурам сохраняется при переходе клетки к каллусному росту. Каллусным тканям свойственна и фотопериодическая реакция, что связано с сохранением активности фитохромов. Общим у каллусные и нормальных клеток растения является и еще ряд признаков, в частности, устойчивость к действию высоких температур, осмотически активных веществ, засолению.
Вместе с тем каллусные клетки обладают отдельными свойствами, отличающими их от нормальных. В них появляются специфические белки, и уменьшается количество белков, характерных для фотосинтезирующих клеток листа, или они совсем исчезают. Каллусные клетки отличаются большой генетической гетерогенностью и физиологической асинхронностью.
В результате выхода из-под контроля организма рост каллусных клеток происходит неорганизованно, асинхронно, и является неограниченным.
Клеточный цикл у каллусных клеток более длительный, чем у растений, произрастающих в открытом грунте. Особенностью каллусных клеток является гетерогенность по возрасту. В каллусной ткани одновременно присутствуют клетки молодые в G1-фазе, старые в G2- и S-фазах цикла клеточных делений.
Значительные отличия наблюдаются в энергетическом обмене каллусных клеток. Они потребляют меньше кислорода по сравнению с нормальными.
Митохондрии в каллусных клетках так же, как и в меристематических, являются слабо развитыми, в них мало крист, что не может не оказывать влияния на активность аэробного дыхания.
Наряду с изменением характера дыхания в каллусных клетках в направлении усиления бескислородного расщепления углеводов происходит также сдвиг в сторону пентозофосфатного пути, который является источником пентоз, необходимых для делящихся клеток.
Длительное время считали, что каллусные клетки генетически строго однородны. Однако клетки каллусной ткани обладают выраженной генетической гетерогенностью. Генетическая неоднородность каллусных клеток выражается, прежде всего, в различной плоидности, т.е. каллусные клетки отличаются по числу хромосом. Генетически стабильными in vitro являются меристематические ткани. В каллусных и суспензионных культурах встречаются клетки, имеющие диплоидный набор хромосом, свойственный исходному растению, полиплоидные клетки, содержащие 3, 4, 5 и более хромосомных наборов. Наряду с полиплоидией в культуре каллусных тканей можно нередко наблюдать анеуплоидию (возрастание или уменьшение хромосомного набора на несколько хромосом). Чем длительнее культивировать каллусные клетки, тем больше они различаются по плоидности. В каллусных клетках табака через четыре года культивирования совсем не остается диплоидных клеток: все клетки становятся полиплоидными или анеуплоидными. Этот факт указывает на то, что изменение плоидности происходит под влиянием условий культивирования и, прежде всего входящих в состав питательной среды веществ. Однако можно интерпретировать его и иначе. Полиплоидные клетки имеют меньшую лаг-фазу и поэтому быстрее переходят к делениям, чем диплоидные. Вследствие этого они и получают преимущество в дальнейших пассажах. Скорее всего, влияние оказывают обе причины.
Кроме изменения плоидности, культивирование клеток и тканей растений in vitro вызывает появление в клетках хромосомных аббераций. Последние сказываются на биологических особенностях культивируемых тканей, изменяя их внешний вид, обмен веществ, скорость роста. Наряду с видимыми под микроскопом хромосомными мутациями в культивируемых клетках могут возникать изменения, не выявляемые микроскопически. Эти изменения могут затрагивать как незначительные участки хромосом, так и структуру генов. Генные мутации выявляются по изменению морфологии и физиолого-биохимических свойств клеток.
Каковы же причины генетической нестабильности культивируемых клеток? Таких причин несколько. Прежде всего – это генетическая неоднородность исходного материала (гетерогенность экспланта). У многих растений дифференцированные ткани характеризуются наличием клеток разной плоидности и лишь активно пролиферирующие в течение онтогенеза ткани, такие, как верхушечные меристемы, камбий и другие, остаются всегда диплоидными. Другой причиной может быть длительное пассирование тканевых и клеточных культур, приводящее к накоплению в них генетических изменений, в том числе к неравномерному изменению плоидности. Нарушение коррелятивных связей при изолировании участков тканей растений и помещении их на питательную среду также приводит к генетической нестабильности клеток. Подобные результаты могут быть связаны и с влиянием на генетический аппарат клетки входящих в состав питательных сред фитогормонов. В качестве гормонов в питательные среды для каллусообразования обязательно входят ауксины и цитокинины. О мутагенном действии этих веществ известно из целого ряда работ. Наиболее активным мутагенным препаратом является 2,4-Д (2,4-Дихлорфеноксиуксусная кислота – синтетический аналог индолилуксусной кислоты), входящий в состав большинства питательных сред. Цитокинины, в частности кинетин, способствуют полиплоидизации клеток. Не исключено, что возникновение генетических аббераций вызвано накоплением вторичных метаболитов, и в частности полифенолов.
Существует несколько путей, по которым может идти развитие клетки после ее дедифференцировки.
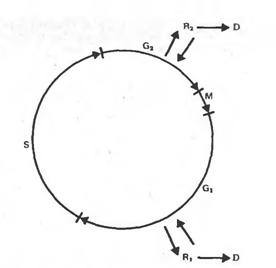
Первый путь – это вторичная регенерация целого растения, возможна дифференцировка на уровне клеток, тканей, органов.
Второй путь - это утрата клеткой способности к вторичной дифференцировке и регенерации растения, стойкая дедифференцировка, приобретение способности расти на среде без гормонов, т.е. превращение в опухолевую. Такими свойствами часто характеризуются клетки старых пересадочных культур. На рисунке изображены фазы клеточного цикла, и показано, в каких из них клетки могут выйти из митотического цикла, и перейти в дифференцированное состояние и соответственно вернуться в цикл при дедифференцировке и индукции их к делению. Обычно клетки переходят к специализации из фазы G1.
Третий путь - это нормальный цикл развития каллусной клетки, заканчивающийся ее старением и отмиранием. В этом случае клетка претерпевает вторичную дифференцировку и прекращает делиться (стационарная фаза роста). Однако такая дифференцировка не ведет к морфогенезу, а закрепляет за ней свойства старой каллусной клетки. В культуре каллусных тканей морфогенезом называют возникновение организованных структур из неорганизованной массы клеток.
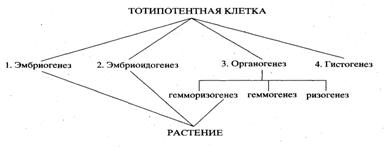
Существует два основных типа морфогенеза. В культуре тканей он может проявляться в виде органогенеза (образования монополярной структуры, т.е. отдельных органов); корневого, стеблевого, реже флорального (цветочного) или листового, в виде соматического эмбриогенеза (образования биполярных зародышеподобных структур из соматических клеток).
В случае органогенеза сначала регенерируют отдельные органы, а затем уже из них - целые растения, исключение составляет корневой органогенез. В результате соматического эмбриогенеза в отличие от органогенеза сразу образуется зародыш, имеющий как меристему корня, так и меристему верхушечной почки, из которого в дальнейшем развивается целое растение.
Согласно концепции тотипотентности, если мы получаем каллус из клеток лепестка цветка, или из клеток сердцевинной паренхимы стебля, или из клеток любой ткани, то в принципе каждая такая клетка может регенерировать целое растение. Однако свойство тотипотентности не всегда реализуется, так как потенциальные возможности клеток разных типов проявляются неодинаково. В некоторых из них гены в сильной степени репрессированы, в связи с чем проявление тотипотентности становится ограниченным.
Клеточную основу морфогенеза составляет цитодифференцировка. Регенерация растения начинается с вторичной дифференцировки клеток. При этом дедифференцированные клетки вновь приобретают структуру и функции специализированных. Вторичная дифференцировка каллусных клеток не всегда заканчивается морфогенезом и регенерацией растения. Иногда она приводит только к образованию тканей (гистодифференцировка). Таким путем каллусная клетка может превращаться во флоэмные или ксилемные элементы. Другим примером вторичной дифференцировки может служить превращение дедифференцированной активно пролиферирующей клетки в старую неделящуюся каллусную клетку (стационарная фаза роста).
Из всех видов вторичной дифференцировки наибольший интерес представляет морфогенез, так как он позволяет получать целое растение из каллусной клетки. Как отмечалось выше, в основе дифференцировки и морфогенеза лежит последовательное включение различных генов, т.е. дифференцировка клеток определяется дифференциальной активностью генов. Изменение активности структурных генов может быть связано с их дерепрессией, репрессией или амплификацией. Большую роль в этом процессе играют фитогормоны.
Морфогенезом в культуре каллусных тканей можно управлять. На способность изолированных растительных клеток к морфогенезу оказывают влияние как внутренние, так и внешние факторы. К внутренним факторам относятся: видовая принадлежность исходного растения, орган, из которого взят эксплант, возраст экспланта, и даже его массы. В этом случае можно говорить об «эффекте минимальной массы», который сводится к тому, что способность уже детерминированных клеток к дальнейшей дифференцировки зависит от наличия некоторой минимальной массы, необходимой для морфогенеза.
Любопытны работы по выявлению зависимости регенерации растений от скорости их развития. Раннеспелые сорта характеризуются более низким уровнем регенерации по-сравнению с позднеспелыми культурами. Возможно, что выделенные для культивирования in vitro из более быстро развивающихся растений органы и ткани могут иметь жолее короткий период существования инициальных меристематических клеток, обеспечивающих морфологическую компетентность у потенциальных эксплантов.
К внешним факторам, прежде всего, относятся: состав питательной среды, температура, свет (интенсивность и длина фотопериода). Наиболее мощным индуктором морфогенеза, который принято называть стимулом или сигналом морфогенеза, является изменение соотношения между цитокининами и ауксинами, входящими в состав питательных сред.
Присутствие в среде одного ауксина определяет переход специализированной клетки из фазы G0 митоза в S-фазу. Однако для завершения фазы синтеза ядерной ДНК, синтеза белков, стимулирующих переход клеток к митозу и цитокенезу, необходимо добавление к среде кинетина.
При преобладании цитокининов над ауксинами часто начинается стеблевой органогенез, а в случае преобладания ауксинов – корневой. Это легко объяснить антагонистичностью двух гормонов, их совместным аттрагирующим эффектом и процессом индукции/репрессии апикального доминирования.
Таким образом, различия в балансе экзогенных гормонов ауксинового и цитокининового рядов определяет, с одной стороны, возможность перехода клетки в культуре к дифференцировки и неорганизованной пролиферации, а с другой стороны - индукцию вторичной дифференцировки того или иного типа морфогенеза.
Если органогенез можно индуцировать с помощью ауксинов или цитокининов, то соматический эмбриогенез фактически независим от экзогенных фитогормонов. Обычно эмбриогенные зоны возникают в каллусной ткани на той же питательной среде, которая использовалась для каллусообразования. Развитие соматических зародышей в каллусной ткани начинается тогда, когда устраняется дедифференцирующий фактор из питательной среды (2,4-Д или другие ауксины). Развивающийся зародыш не нуждается в экзогенных гормонах, так как сам обеспечивает себя ими.
Независимость соматического эмбриогенеза от гормонов является аргументом в пользу точки зрения, высказанной Хаберландтом, а позднее Стэвардом, что сам процесс изолирования клетки стимулирует реализацию ее тотипотентности, т.е. переход к морфогенезу. Таким образом, основными стимулами морфогенеза являются изменения соотношения гормонов в питательной среде, а также сам процесс изоляции растительной клетки от организма.
Дополнительными стимулами морфогенеза в культуре каллусных тканей является присутствие в питательной среде нитрата серебра, нитрата аммония, некоторых аминокислот (пролин, тирозин, иногда серии), полиаминов (путресцин и спермидин). В ряде случаев стимулируют процесс морфогенеза маннит и сорбит. Ионы N03, оказывают влияние на развитие возникших в каллусной ткани организованных структур, а их индукцию стимулируют ионы NН4. Гиббереллиновая кислота стимулирует рост зачатков стебля, а абсцизовая ускоряет дифференцировку органов соматических зародышей. Интересно отметить, что некоторые из перечисленных веществ, например, нитрат серебра, продлевают регенерационную способность в старых пересадочных культурах. Под влиянием того или иного стимула морфогенеза каллусная клетка должна стать детерминированной, однако не все клетки, а лишь одна из 400—1000 становится на путь регенерации. Следовательно, для перехода к морфогенезу недостаточно индуктора (стимула), а необходимо, чтобы клетка была готова к ответу на него. Способность воспринимать стимулы морфогенеза называют компетентностью клетки. Исследователи пришли к выводу, что компетентность клеток - событие случайное и поэтому столь редкое. В связи с этим напрашивается вопрос о судьбе тех каллусных клеток, которые в силу некомпетентности не способны воспринять стимулы морфогенеза и детерминироваться. В пересадочной культуре эти клетки продолжают делиться и, скорее всего, становятся на путь перехода к гормононезависимости. Однако не все каллусные ткани со временем завершают развитие возникновением гормононезависимости.
Многие из них в силу генетических особенностей продолжают использовать экзогенные гормоны, но полностью утрачивают способность к регенерации. Такие ткани занимают промежуточное положение между «привыкшими» и свежими каллусными тканями. Морфогенез в каллусной ткани начинается с того, что под влиянием соответствующих условий детерминированная клетка обособляется от окружающих ее каллусных клеток, образуя утолщенную клеточную стенку. Клетка - инициаль при соматическом эмбриогенезе дает начало зиготе, а при органогенезе - меристематическому очагу. От недетерминированных каллусных клеток инициальная отличается более крупным ядром и меньшими размерами вакуолей. Ядро обычно занимает центральное положение. В инициальных клетках содержатся большие количества запасных веществ: крахмала, иногда — липидов. Некоторое время инициальные клетки находятся в лаг-фазе, что необходимо для их перестройки и подготовки к последующим быстрым делениям. Затем эти клетки делятся по типу дробления, образуя сферическую массу мелких изодиаметрических клеток. В случае органогенеза эту массу клеток называют меристематическим очагом, а в случае соматического эмбриогенеза - глобулярным проэмбрио. В дальнейшем в меристематическом очаге дифференцируются зачатки стебля, корня, листа или цветочной почки и соответственно происходит стеблевой, корневой, листовой или флоральный органогенез. В глобулярном проэмбрио развивается биполярная эмбриоидная структура. Можно выделить несколько последовательных стадий формирования соматических эмбриоидов из каллусной клетки: глобулярную, сердечка, торпедовидную, соматического зародыша. Меристематические очаги или проэмбрио могут возникать на периферии каллусной ткани или быть погруженными в нее. Обычно не наблюдается определенной закономерности в их локализации.
Сравнительный анализ половых и соматических зародышей позволяет говорить о параллелизме их развития, который проявляется в основных закономерностях морфогенеза (полярности, симметрии, клеточной и тканевой дифференциации, способности к пролиферации). И половые и соматические зародыши характеризуются полиморфизмом, переходными формами и аномалиями. Генезис и структура соматического зародыша таксоноспецифицны. Возможно, они определяются местом формирования инициальной клетки. С помощью сопоставления характеров формирования половых и соматических зародышей, была выделена новая категория вегентативного размножения растений – эмбриоидогения.
При переходе каллусных клеток к морфогенезу происходит существенное изменение их метаболизма. Морфогенезу предшествует появление в клетках белков-антигенов. В работах Р.Г. Бутенко, Н.И. Володарского и Н.А.Моисеевой показано, что морфогенез в культуре каллусных тканей табака характеризуется включением и выключением синтеза определенных белков-маркеров. В меристемах обнаружено два белка-антигена, которые являются маркерами этих клеток. Одновременно показано, что индуцированная детерминация клеток каллусной ткани сопряжена с появлением в ней антигена-маркера клеток меристемы стебля.
Белок, выделенный из эмбриогенных культур, можно рассматривать как конденционирующий фактор. При частых пересадках на свежую питательную среду, где гликопротеид накапливаться не может, эмбриогенез не идет. Если белок, появляющийся в клетках при переходе к соматическому эмбриогенезу, выделить и ввести в длинные (неэмбриогенные) каллусные клетки, у которых гены морфогенеза не работают или потеряны, то в них индуцируется переход к морфогенезу. Работы по поиску новых маркеров морфогенеза продолжаются. Клетки меристематических очагов и клетки, дающие начало эмбриоидным структурам, отличаются от каллусных интенсивным синтезом РНК и ДНК, что связано с особенностями их белкового обмена. Изменения в белковом обмене сходны с теми, которые протекают при дедифференцировке клетки, но итоги у них различны. Специфика реакции определяется не общим усилением синтеза макромолекул, что необходимо для усиленной пролиферации, а теми уникальными синтезами, которые идут на этом общем фоне и обусловливают появление белков регуляторного типа. Переход к морфогенезу в культуре каллусных тканей сопровождается значительными изменениями дыхательного метаболизма. В целом дыхание (по СО2) усиливается, но изменяется его характер в направлении интенсификации пентозофосфатного пути. Возрастает активность дыхательных ферментов. Вслед за биохимической наступает структурная реорганизация клетки. Биохимическая дифференцировка клетки всегда предшествует структурной. В клетках, вступивших на путь морфогенеза, возрастает число рибосом, митохондрий, меняется их внутренняя структура. Процессы морфогенеза в каллусных клетках протекают асинхронно и продолжительно. Одновременно в каллусной ткани могут иметься как полностью сформированные структуры, так и клетки, только что вступившие на этот путь. Повышенная синтетическая активность клеток меристематического очага и глобулярного проэмбрио делает их аттрагирующим центром, в который устремляются питательные вещества. Окружающие каллусные клетки при этом часто разрушаются и образующиеся эмбриоиды легко выпадают из массы каллусных клеток. Каллусные клетки не связаны между собой плазмодесмами или последние сильно редуцированы. При появлении зародышеподобных структур или меристематических очагов между клетками снова восстанавливается связь с помощью плазмодесм. Все изменения, происходящие при морфогенезе и заканчивающиеся регенерацией из каллусой клетки растения, управляются (контролируются) специальными генами. В настоящее время одни ученые считают, что признак морфогенеза полигенен и контролируется несколькими хромосомами, другие пришли к заключению, что этот признак определяется двумя ядерными генами. Тот факт, что морфогенетическая активность каллусных клеток имеет генетическую природу, объясняет, почему не удается в ряде случаев получить регенерацию из каллусной ткани тех или иных генотипов. Регенерационную способность может увеличить скрещивание генотипов, морфогенетически активных in vitro.
В работах М.И.Соболевой и И.В.Логинова была сделана попытка определить зависимость морфогенной способности каллусов от различных факторов. По их мнению, тотипотентность и пролиферация тесно связаны единым молекулярным механизмом, выключение или нарушение которого приводит в культуре in vitro к формированию неморфогенного каллуса. Исследование комплексного показателя «размер-прирост биомассы» каллусов позволил заключить, что морфогенные каллусы увеличивают свою биомассу за счёт активной пролиферации, чем за счёт активного накопления сухого вещества. Увеличение биомассы и размера за счёт оводнения клеток в сочетание с их растяжением также маловероятно, так как в этом случае морфогенный каллус приобретал бы рыхлую оводнённую консистенцию, а он имел плотную глобулярную структуру. Прирост биомассы неморфогенного каллуса, по их мнению, в большей степени зависит от роста растяжением в сочетание с оводнением клеток. В ряде работ были выявлены морфологические различия клеток морфогенных и неморфогенных каллусов. Например, поверхность проэмбриональных клеточных комплексов морфогенного каллуса покрыта сетью экстраклеточного матрикса (ЭКМ), тогда как на поверхности клеток неморфогенного каллуса ЭКМ не наблюдается. Поверхностная сеть экстраклеточного матрикса представляет собой фибриллярную белковую структуру. ЭКМ – это структурный маркер характерный для проэмбриональных клеточных комплексов морфогенных культур и проэмбрио. Таким образом, наличие ЭКМ коррелирует с морфогенной способностью каллусов.
Суспензионная культура
Помимо культур каллусных клеток в научной практике довольно часто применяются культуры клеточных суспензий и культуры единичных (одиночных) клеток. Для начала рассмотрим суспензионную культуру.
Суспензию клеток можно получить из каллуса, поместив его в жидкую питательную среду с автоматическим перемешиванием. Суспензионную культуру получают непосредственно из ткани экспланта. Культура состоит из отдельных клеток и агрегатов, отделившихся от первично образованной каллусной ткани. Необходимым условием культивирования клеточных суспензий является постоянное перемешивание на качалке (90 – 120 об/мин), роллеров различного типа, или встряхивание среды. Если клеточная суспензия находится в неподвижном состоянии, то пролиферация суспензионных клеток приводит к образованию каллусной ткани. Также необходимыми условиями поддержания культуры является аэрация, оптимальные температуры (20-30оС), а также определенный объём и физиологическое состояние инокулюма (часть клеточной суспензии, используемая для переноса на свежую среду). Минимальный объём инокулюма, необходимый для роста культуры, зависит от вида объекта, фазы роста и состава культуральной среды. При слишком больших объёмах рост клеток в суспензии может ингибироваться из-за накопления токсичных продуктов метаболизма, либо из-за недостатка питательного субстрата.
Начальный момент получения суспензионной клеточной культуры является рандомическим событием. Это означает, что только клетки, которые по ряду причин способны к перестройке метаболизма и размножению с высоким коэффициентом в данных конкретных условиях суспензионного культивирования, образуют «хорошие» линии. Важными характеристиками иаких линий является высокая степень дезинтеграции (5-10 клеток в группе), морфологическая выравненность клеток. На рисунке показаны микрофотографии суспензионных клеток отвечающих этим критериям.
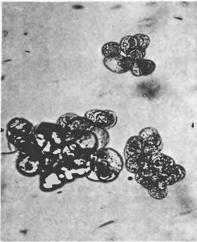
Морфологическая вариабельность клеток суспензионных культур не слишком высока: встречаются одиночные растянувшиеся клетки, содержащие огромную вакуоль и пристеночный слой цитоплазмы с крупным ядром; клетки меньшего размер, округлые или овальные, в той или иной степени вакуолизированные, с более плотной цитоплазмой, одиночные или образующие агрегаты.
Суспензии лучше образуются из рыхлого каллуса, получаемого на средах с 2,4-Д. Исключение из питательной среды ионов кальция облегчает суспензирование. Ещё больше облегчает этот процесс добавление в среду пектидазы, способной гидролизировать пектиновые связи в клеточной стенке.
Кривая роста клеток в суспензии, как и клетки каллусной культуры, имеет S--образную форму.
Выращивание клеточных суспензий в жидкой питательной среде имеет ряд преимуществ перед выращиванием каллусных тканей поверхностным способом. Здесь легче и более воспроизводимо влиять на метаболизм и рост клеточных популяций экзогенными факторами. Они удобнее для биохимических и молекулярно-биологических экспериментов – изучения индукции ферментов и связи их с событиями клеточного цикла, экспрессии и репрессии определённых генов, изолирования и характеристик мутантов.
Работы по культивированию и субкультивированию проводят в асептических условиях.
Первичную суспензию перед субкультивированием фильтруют через 1 — 2 слоя марли, нейлоновые или металлические сита, чтобы избавиться от крупных, плотных кусков каллусной ткани, остатков экспланта и очень крупных агрегатов. Фильтрование рекомендуется и в нескольких последующих субкультивированиях до приобретения клеточной суспензией желательных характеристик. Однако агрегированность суспензии зависит не только от характеристик начальной линии, но и от условий культивирования.
Способы выращивания, разработанные в микробиологии, применяются для глубинного культивирования растительных клеток. Используются закрытые или открытые системы в периодическом или проточном режимах. В закрытой системе при периодическом режиме выращивания клеточная масса (инокулюм) помещается в определенный объем среды. До конца выращивания система остается закрытой по всем параметрам, кроме газов. В закрытой культуре в систему периодически подается свежая питательная среда, а старая удаляется в том же объеме. Клетки при этом остаются в системе в течение всего цикла выращивания.
В открытые проточные культуры периодически (или непрерывно) поступает свежая питательная среда, однако отбирается не только старая среда, но и часть урожая клеточной массы. Регуляция этого процесса может осуществляться по принципу турбидостата или хемостата. В турбидостате подача свежей среды, и отбор суспензии происходят после достижения клеточной популяцией определенной заданной плотности. Сигнал на включение протока поступает от реле, связанного с оптической системой, определяющей плотность клеток. В хемостате скорость протока задается экспериментатором и от нее зависит скорость роста клеточной массы. Для этого питательная среда лимитируется по одному из наиболее важных для роста факторов, чаще всего по фосфору, азоту или сахару. Режим хемостата позволяет с помощью фиксированной скорости разбавления поддерживать константную скорость деления и плотность клеток в популяции.
Клеточные суспензии в биотехнологии используются для получения вторичных метаболитов, многие из которых являются ценными лекарственными препаратами, для промышленного выращивания клеточной биомассы и для клеточной селекции. Наряду с этим, суспензии клеток можно применять в качестве исходного материала для получения изолированных протопластов. Для промышленного получения продуктов вторичного синтеза из больших клеточных масс используют ферментеры большой емкости (от 20000 и более литров), в которых проводят непрерывное культивирование клеток. Суспензионные культуры могут быть не только источником ценных вторичных метаболитов, но в них выявлены также другте соединения, например, камптотецин, харрингтонин и другие антиканцерогены, пептиды (ингибитор протеаз, ингибитор фитовирусов) и др. Следует отметить, что деление клеток, приводящее к увеличению клеточной биомассы, и синтез вторичных метаболитов разобщены во времени. Синтез вторичных метаболитов достигает максимума в стационарной фазе роста.
Культуры отдельных клеток
Для генетических и физиологических исследований, а также для практического использования в клеточной селекции очень ценном является культивирование отдельных клеток.
Получение клона-потомства одиночной клетки помогает разобраться в причинах генетической неоднородности каллусных клеток, так как наблюдения в данном случае проводятся на ткани, полученной не из гетерогенного экспланта, а из одной клетки. Одиночная гибридная клетка, выделенная из культуры изолированных протопластов, при дальнейшем ее делении позволяет получить клон, состоящий из гибридных клеток. Это намного облегчает работу исследователя, так как устраняет необходимость отбора потомства в культуре изолированных протопластов от негибридных, что представляет значительные трудности. Кроме того, сам процесс соматической гибридизации лучше наблюдать, если работа ведется с одиночными протопластами. Выделяют одиночные клетки из клеточных суспензий, из тканей растений, например, из мезофилла листа после его мацерации ферментами, из культуры изолированных протопластов после восстановления клеточной стенки. Для получения одноклеточной фракции суспензионной культуры иногда достаточно простого отстаивания в колбе в течение 15—30 мин. При этом крупные агрегаты оседают на дно колбы, а надосадочная фракция содержит только одиночные клетки или мелкие агрегаты. В том случае, когда при отстаивании не удается получить одноклеточную фракцию, применяют мацерирующие ферменты, центрифугирование или фильтрование через сита (найлоновые или металлические).
Трудности культивирования одиночных клеток связаны с тем, что отдельная клетка не делится в тех условиях, в которых хорошо растет каллусная ткань. Для того чтобы заставить одиночные клетки делиться, разработаны специальные методы. Существует так называемый метод «няньки», при котором функцию «няньки», стимулирующей деление одиночной клетки, выполняют кусочки каллусной ткани, отделенные от нее фильтровальной бумагой. В присутствии «няньки» одиночная клетка делится и дает индивидуальную колонию клеток — клон. Другой метод основан на использовании очень малых объемов богатой питательной среды и представляет собой культивирование одиночных клеток в микрокапле в чашке Купрака объемом 20 мкл. Для индукции клеточных делений у одиночной клетки можно использовать также «кормящий слой» (активно делящиеся клетки суспензионной культуры того же вида растений, что и одиночная клетка):
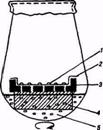
1 - колонии клеток
2 - фильтровальная бумага
3 - алюминиевая сетка
4 - пенополиуретан
5 - суспензия клеток
Применение культур растительной ткани. Фундаментальные и практические аспекты
В последнее время культура растительной ткани приобрела большое значение для сельскохозяйственной промышленности. Произошло это, когда было показано, что из одной клетки, отделенной от каллуса, может быть выращено индивидуальное растение моркови, т. е. тысячи идентичных растений моркови могут быть получены из одного кусочка каллусной ткани. Следовательно, при получении растения с повышенной продуктивностью нет необходимости ждать несколько лет для его воспроизводства и накопления достаточного количества посевного материала. Вместо этого в течение нескольких месяцев можно получить много идентичных клонированных растений. Все эти растения будут одинаковы по внешнему виду, цвету и размеру с редкими случаями неконтролируемых вариаций.
Одно из направлений клеточных технологий — это использование их в селекции, которое облегчает и ускоряет традиционный селекционный процесс в создании новых форм и сортов растений. Существующие методы культивирования изолированных клеток и тканей in vitro условно можно разделить на две группы.
Первая группа—это вспомогательные технологии, которые не подменяют обычную селекцию, а служат ей. К ним можно отнести: оплодотворение in vitro (преодоление прогамной несовместимости), культивирование семяпочек и незрелых гибридных зародышей (преодоление постгамной несовместимости), получение гаплоидов путем культивирования пыльников и микроспор, криосохранение изолированных клеток, тканей и органов, клональное микроразмножение отдаленных гибридов.
Вторая группа методов ведет к самостоятельному, независимому от традиционных методов селекции, получению новых форм и сортов растений: клеточная селекция с использованием каллусной ткани, соматическая гибридизация (слияние изолированных протопластов и получение неполовых гибридов), применение методов генной инженерии.
Вспомогательное использование методов in vitro в селекции растений
В отдаленной гибридизации находят применение такие методы культуры изолированных тканей, как оплодотворение in vitro, эмбриокультура (выращивание изолированных зародышей на искусственных питательных средах), клональное микроразмножение ценных гибридов, а также получение гаплоидов in vitro и криосохранение.
Оплодотворение in vitro (преодоление прогамной несовместимости) проводится в том случае, когда невозможно осуществить оплодотворение между выбранными парами в естественных условиях. Это вызвано несколькими причинами:
I) физиологические (несоответствие во времени созревания пыльцы и т. д.); 2) морфологические (короткая пыльцевая трубка или блокирование роста ее на разных этапах развития и т. д.). Оплодотворение in vitro можно осуществить двумя способами:
а) культивирование на искусственной агаризованной питательной среде завязи с нанесенной на нее готовой пыльцой;
б) завязь вскрывается и на питательную среду переносятся кусочки плаценты с семяпочками, вблизи которых или непосредственно на ткани плаценты культивируется готовая пыльца. Визуально определить, прошло оплодотворение in vitro или нет, можно по быстро увеличивающимся
в размерах семяпочкам. Сформировавшийся зародыш, как правило, не переходит в состояние покоя, а сразу прорастает и дает начало гибридному поколению.
Преодоление постгамной несовместимости
Постгамная несовместимость при отдаленной гибридизации возникает после оплодотворения. Часто при этом образуются невсхожие семена. Причиной может быть расхождение во времени развития зародыша и эндосперма. Из-за слабого развития эндосперма зародыш часто неспособен к нормальному прорастанию. В таких случаях из зрелой зерновки изолируют зародыш и выращивают его в питательной среде.
Выращивание зародышей в искусственной питательной среде называется эмбриокультурой.
Применение эмбриокультуры в селекции приобретает в последнее время большое значение для получения отдаленных гибридов зерновых, злаковых и других сельскохозяйственных культур. Метод эмбриокультуры находит все более широкое применение в межвидовой гибридизации овощных растений.
Культура изолированных зародышей как вспомогательный метод при отдаленной гибридизации применяется не только для преодоления постгамной несовместимости, но также с целью микроразмножения ценных гибридов. В этом случае микроразмножение идет путем каллусогенеза, индукции морфогенеза и получения растений - регенерантов из каллусной ткани.
Техника клонирования незрелых зародышей позволяет размножать ценные генотипы растений на ранних стадиях жизненного цикла. Еще одна возможность применения культуры зародышей — использование ее в клеточной селекции.
Клональное микроразмножение отдаленных гибридов
Эмбриокультура дает возможность вырастить гибридные растения из неполноценных зародышей.
Размножают гибриды путем активации развития меристемы пазушных почек (черенкованием стерильных побегов), адвентивными почками или регенерацией растений из каллусной ткани, в частности полученной при культивировании зародышей.
Метод культуры изолированных клеток, тканей и органов растений in vitro, широко используемый для решения многих фундаментальных вопросов клеточной биологии, физиологии и генетики растений, в настоящее время находит все большее применение и при создании новых биотехнологий. Начиная с первых работ по культивированию растительных клеток, тканей и органов особый интерес у исследователей вызвал вопрос о том, какие клеточные изменения могут происходить в изолированных клетках, растущих на искусственных питательных средах, и причины, их вызывающие. С разработкой техники получения растений - регенерантов из каллусной ткани появилась возможность получать новые формы растений, отличающиеся как по фенотипическим, так и по генетическим признакам от исходных растений. Сомаклональные варианты имеют, несомненно, практическое применение в сельскохозяйственной практике, в силу появления форм, отличающихся от родительских по различным биохимическим, качественным и количественным признакам, а также цитогенетическим характеристикам. Например, получены сомаклоны картофеля, отличающиеся высокой урожайностью, повышенной устойчивостью к заболеваниям, более высоким содержанием в клубнях протеина и крахмала. Причем наследование важных признаков при размножении клубнями сохранялось в течение трех лет полевых испытаний. Для растений табака через каллусную культуру получены сомаклоны, устойчивые к вирусу табачной мозаики, а для сахарного тростника получен новый сорт, характеризующийся высокой урожайностью и повышенной устойчивостью к заболеваниям (данные 1998 года).
Селекция растений на клеточном уровне. Значительный интерес представляет вопрос об использовании клеточной селекции в комплексе с получением сомаклонов. Одна из наиболее сильных сторон культуры in vitro в создании технологий для сельского хозяйства — возможность на основе сомаклональных вариаций или индуцированных мутаций отбирать в жестких селективных условиях клетки, характеризующиеся искомыми признаками.
Для проведения работ по клеточной селекции растений в условиях in vitro в качестве объекта исследования могут быть использованы каллусные, суспензионные культуры или изолированные протопласты. Выбор объекта зависит от наличия разработанных технологий применительно к различным видам растений, а также от конечных целей исследования. Наряду с перечисленными выше объектами (каллусная, суспензионная культура, изолированные протопласты), в качестве исходного материала для селекции могут быть использованы культуры соматических или андрогенных эмбриоидов, такие органогенные экспланты, как сегменты листьев или различные меристематические и стеблевые части растений, а также культура изолированных зародышей.
Гибридизация соматических клеток
Следующий метод клеточной селекции — создание неполовых гибридов путем слияния изолированных протопластов, полученных из соматических клеток. Этот метод позволяет скрещивать филогенетически отдаленные виды растений, которые невозможно скрестить обычным половым путем, вызывать слияние трех и более родительских клеток, получать асимметричные гибриды, несущие весь генный набор одного из родителей наряду с несколькими хромосомами или генами, или только органеллами и цитоплазмой другого. Гибридизация соматических клеток дает возможность не только соединить в одном ядре гены далеких видов растений, но и сочетать в гибридной клетке цитоплазматические гены партнеров.
Слияние изолированных протопластов
Использование данного метода в селекции растений не ограничивается возможностью их индуцированного слияния и получения соматических гибридов. Изолированные протопласты способны поглощать из окружающей среды макромолекулы и органеллы, следовательно, в них можно вводить
чужеродную информацию, не пересаживая ДНК или органеллы других клеток. Уже проведена успешная трансплантация изолированных ядер в протопласты петунии и табака. Вместе с тем поглощение протопластами чужеродных ядер не всегда ведет к образованию гибридов. Кроме ядер в изолированные протопласты удалось трансплантировать чужеродные хлоропласты. В целом использование изолированных протопластов в генетической реконструкции клетки открывает богатые перспективы перед клеточной селекцией.
Разработки клеточных систем с высоким регенерационным потенциалом и методов оптимальной инициации каллусной ткани и растений - регенерантов для получения большого количества однородного материала за небольшое время.
Помимо этого, культура каллусных тканей является одним из наиболее удобных и наглядных объектов фундаментальных исследований. Она используется в различных по своей направленности экспериментах. Это и выявление общих закономерностей развития изолированных биологических систем, и на основе этих данных получение представлений о морфофизиологических и биохимических механизмах в природе.
Заключение
Использование культур клеток и тканей во многих работах позволяет проводить параллели между процессами in vitro и in vivo, моделировать и изучать метаболические процессы вне организменного контроля. Эти системы могут быть использованы как альтернатива природным источникам получения практически ценных соединений, в частности как модель биосинтеза и биогенетических связей в ряду вторичных метаболитов. Много работ проводилось в сфере изучения влияния различных факторов и химических агентов на биохимические и морфологические процессы в культуре тканей и клеток, с последующим переносом этих знаний на природные объекты. С помощью моделей in vitro возможно исследование геномных и хромосомных аббераций, изучение роли экзо- и эндофитогормонов (эксперименты по изменению и подбору питательных сред) на характеристики роста и развития растений.
Таким образом, культура клеток растений имеет огромное как практическое, так и фундаметально-научное значение. Безусловно, данный метод будет использоваться и модифицироваться, как удобный инструмент биотехнологической, биохимической и других категорий исследовательской деятельности.
Приложения
Техника культивирования растительного материала на искусственных питательных средах
Организация биотехнологической лаборатории
Для организации биотехнологической лаборатории необходимы просторные изолированные помещения, а также современное оборудование и высококачественные реактивы.
Для удобства проведения дезинфекции полы и стены в помещениях должны иметь кафельное покрытие, а потолок должен быть побелен.
Оборудование моечной комнаты: мойки с горячей и холодной водой; дистиллированная вода; дистилляторы и бидистилляторы; сушильные шкафы с режимом работы для сушки посуды – до 100-130оС, для инструментов – до 170оС; шкафы для хранения чистой посуды и инструментов, емкости для хранения моющих средств, вытяжные шкафы с эксикаторами. Оборудование комнаты для приготовления питательных сред: лабораторные столы; холодильники для хранения маточных растворов солей, гормонов и витаминов; аналитические и торсионные весы; иономер; магнитные мешалки; плитки, газовые горелки; набор посуды (колбы, стаканы, мерные цилиндры, мензурки, пробирки и др.), необходимый набор химических реактивов надлежащей степени чистоты (ХЧ, Ч, ЧДА).
Оборудование помещения для стерилизации: автоклавы с режимом работы – давление 1-2 атмосферы и температура 120оС; стеллажи для штативов с питательными средами; шкафы для хранения стерильных материалов. Данное помещение должно быть оборудовано приточно-вытяжной вентиляцией и иметь канализационный слив для отвода конденсата из автоклава.
Оборудование комнаты для инокуляции (перенесение) растительных эксплантов на питательные среды: ламинар-боксы, лабораторные столы, стеллажи, бактерицидные лампы, шкафы для материалов и оборудования.
Оборудование культуральных комнат: световое отделение – источники освещения со спектром близким к спектру дневного света (от 3 до 10 kLx), кондиционер для регуляции температуры (25+ - 2оС) и влажности воздуха (70 %), стеллажи для штативов с культивируемым материалом; темновое отделение – с тем же оборудованием, исключая источники освещения. Для культивирования эксплантов на питательной среде желательно использовать термостаты или хладотермостаты, способные с высокой точностью поддерживать задаваемые режимы температуры и влажности воздуха.
Необходимый набор посуды, инструментов и материалов в биотехнологической лаборатории: мерные колбы, колбы Эрленмейера, химические стаканы, мерные цилиндры, чашки Петри, пробирки, бутылки, пипетки, стеклянные палочки, стеклянные и мембранные фильтры, ланцеты (в том числе глазные, хирургические, анатомические), ножницы, пинцеты, ножи, бритвенные лезвия, препарировальные иглы, шпатели, бумага (оберточная, пергаментная, фильтровальная), фольга алюминиевая, вата, марля, шпагат.
Приготовление питательных сред для культивирования клеток и тканей in vitro .
Компоненты среды для выращивания растительных клеток и тканей можно разделить на 6 основных групп, что обычно отражает порядок приготовления концентрированных маточных растворов: макроэлементы, микроэлементы, источники железа, витамины, источники углерода, фитогормоны.
Основой для всех питательных сред для культивирования растительных эксплантов является смесь минеральных солей. Это соединения азота в виде нитратов, нитритов, солей аммония; фосфора – в виде фосфатов; серы – в виде сульфатов; а также растворимых солей К+, Na+, Са2+, Мg2+. Железо используется в виде хелатов [FeО4 или Fe2O4 + ЭДТА (этилендиаминтетрауксусная кислота) или её натриевая соль Na ЭДТА (трилон Б)] – наиболее доступной форме для усвоения растительными тканями.
Азот, фосфор, сера входят в состав органических соединений: белков, жиров, нуклеиновых кислот. Железо, цинк, марганец, молибден, кобальт в сочетании с порфиринами образуют макромолекулы пигментов фотосинтеза (хлорофилла), окислительно-восстановительных ферментов (каталазы, пероксидазы, полифенолоксидазы). Следовательно, все эти соединения выполняют в клетках и тканях структурную функцию. В то же время ионы К+, Na+, Са2+, Cl –, Н + необходимы для регуляции pH среды и поддержания физиологических градиентов клеток (тургора, осмотического давления, полярности).
В качестве источника углерода для биологических макромолекул, а также при культивировании гетеротрофных тканей (каллусов и суспензий) в питательные среды добавляют углеводы в концентрации 20-60 г/л. Обычно это дисахариды (сахароза), моносахариды (гексозы: глюкоза и фруктоза, пентозы: ксилоза и другие). Полисахариды в питательных средах практически не используются. Только некоторые типы тканей (опухолевые), содержащие гидролитические ферменты, выращивают на средах с крахмалом, раффинозой (природный трисахарид), целлобиозой.
Для стимуляции биохимических реакций в клетке используют биологические катализаторы – витамины группы В: В1, В6, В12; С (аскорбиновую кислоту), РР (никотиновую кислоту), мезоинозит (витаминоподобное соединение).
Тиамин (В1) входит в состав пируватдекарбоксилазы, участвует в превращениях углеводов. Тиаминпирофосфат входит в состав ферментов окислительного декарбоксилирования кетокислот (пировиноградной и кетоглутаровой), является коферментом транскетолазы (фермент пентозомонофосфатного пути).
Пиридоксин (В6) в виде фосфорнокислого эфира входит в состав ферментов декарбоксилирования и переаминирования аминокислот.
Никотиновая кислота (РР) в виде амида входит в состав дегидрогеназ НАД и НАДФ, катализирующих донорно-акцепторную электротранспортную цепь Н+ (отнятие Н+ от молекул органических веществ).
Для управления процессами формообразования в культуре тканей необходимы биологические регуляторы роста и развития – фитогормоны. Эти вещества влияют на дифференциацию и дедифференциацию клеток и тканей, инициируют гистогенез, индуцируют деление и растяжение клеток, участвуют в процессах старения и созревания, либо стимулируют, либо ингибируют рост и развитие клеточных культур, обуславливают формирование пола. В биотехнологических исследованиях чаще используют гормоны, стимулирующие рост и развитие: ауксины, цитокинины, гиббереллины.
Ауксины: ИУК – b-индолил-3-уксусная кислота, ИМК – индолил-3-мас-ляная кислота, НУК – a-нафтилуксусная кислота, 2,4-Д – 2,4-дихлорфеноксиуксусная кислота.
Цитокинины: кинетин – 6-фурфуриламинопурин, зеатин, NN-дифенил-мочевина, 6-БАП – 6-бензиламинопурин.
Гиббереллины: гиберрелловая кислота.
В качестве биологических добавок для индукции первичного каллуса можно использовать растительные экстракты (10-15 % от общего объёма среды): кокосовое молоко (жидкий эндосперм кокосового ореха), вытяжки из незрелых зерновок кукурузы (лучше в период молочной спелости), которые содержат цитокинины – кинетин и зеатин (6-ти замещенные аминопурины) и NN-дифенилмочевину.
В культуре in vitro применяют жидкие и агаризованные (твердые) среды. Жидкие среды используются для культивирования суспензий, каллусов, изолированных органов и тканей, растений - регенерантов. При этом для поддержания эксплантов в пробирки со средой помещают специальные мостики - поддержки из фильтровальной бумаги или синтетических пористых материалов.
Агаризованные среды готовят на основе агар-агара – полисахарида, входящего в состав морских водорослей, который образует с водой гель при pH 5,6-6,0. иногда в качестве уплотнителя и заменителя агар-агара используют полиакриламидные гели (биогели) P10 и P200.
Для искусственных питательных сред растворы макро- и микросолей готовят заранее и используют многократно. Это маточные (концентрированные) растворы. Их хранят в специальных условиях: макро- и микросоли в холодильнике в сосудах с притертыми пробками при 0…+4оС; витамины, фитогормоны, ферменты, растительные экстракты – при -20оС в небольших по 5-10 мл сосудах с пробками (пеницилловые флаконы).
Маточные растворы макросолей обычно превосходят рабочие по концентрации в 10-40 раз, микросолей – в 100-1000 раз, витаминов – в 1000 раз.
Растворы фитогормонов желательно готовить непосредственно перед работой со средами.
Для приготовления маточного раствора макро- и микросолей каждую соль растворяют в отдельном стаканчике при нагревании, затем сливают и доводят до нужного объема. В охлажденную смесь микросолей последним добавляют раствор солей молибдена, а в макросоли – раствор солей магния (для предотвращения выпадения осадка).
Маточные растворы хлористого кальция и хелата железа (сернокислое железо + ЭДТА, либо Na ЭДТА – трилон Б) готовят и хранят отдельно от других солей.
Концентрированные растворы витаминов готовят следующим образом: 10-кратные навески растворяют в 10 мл дистиллированной воды каждый отдельно.
Фитогормоны – это вещества, которые плохо растворяются в воде. Поэтому предварительно 100 мг вещества растворяют в небольших количествах (0,5-2,0 мл) спирта (ауксины, гиббереллины), 0,5-1н HCl или КОН (цитокинины), затем подогревают до полного растворения (кроме абсцизовой кислоты и кинетина) и доводят до 100 мл объема (1 мл содержит 1 мг вещества).
В таблице представлен состав наиболее часто используемых питательных сред. Как правило, начиная работать с новым объектом, исследователи модифицируют состав стандартных сред, особенно часто варьируя концентрации и набор органических компонентов.
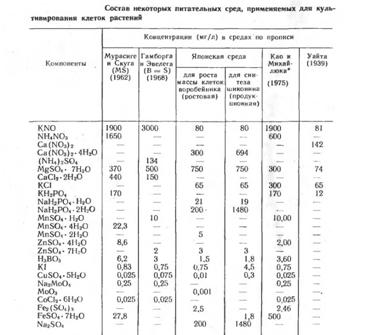
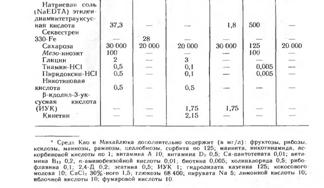
Частные примеры питательных сред.
Приготовление маточных растворов для среды Мурасиге-Скуга.
| № п.п. | Компонент среды | Количество вещества |
| Маточный раствор макросолей (г на 1 л маточного раствора) | ||
|
1. 2. 3. 4. |
KNO3 NH4NО3 KH2PO4 MgSO4 . 7H2O или MgSO4 безводный |
38 33 3,4 7,4 3,6 |
| 5. |
CaCl2 . 2H2O или CaCl2 безводный |
8,8 6,65 |
| Маточный раствор микросолей (мг на 100 мл маточного раствора) | ||
|
6. 7. 8. 9. 10. 11. 12. |
Na2MoO4 . 2H2O CuSO4 . 5H2O H3BO3 MnSO4 . 5H2O или MnSO4 . 4H2O ZnSO4 . 7H2O KJ CoCl2 . 6H2O |
25 2,5 620 2410 2230 860 83 2,5 |
| 13. |
FeSO4 Na2 ЭДТА |
557 745 |
Среда Мурасиге-Скуга (М-С) для клеточных и тканевых культур
| Компоненты питательной среды | |
|
Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaCl2 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Мезоинозит Глицин Сахароза |
50 мл/л 1 мл/л 5 мл/л 50 мл/л 0,1 мг/л 0,5 мг/л 0,5 мг/л 100 мг/л 2 мг/л 30 г/л |
| рН 5,6-5,8 |
Модифицированная питательная среда Мурасиге-Скуга для культивирования апикальных меристем картофеля
| Компоненты питательной среды | |
|
Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaCl2 Тиамин-HCl Пиридоксин-HCl Витамин В12 Никотиновая кислота Фолиевая кислота Мезоинозит Гидролизат казеина Аденин Пантотенат Са Рибофлавин Биотин Активированный уголь ГК Кинетин Сахароза Глюкоза Агар-агар |
50 мл/л 1 мл/л 5 мл/л 50 мл/л 1 мг/л 1 мг/л 0,015 мг/л 2 мг/л 0,5 мг/л 100 мг/л 1 г/л 40 мг/л 10 мг/л 0,5 мг/л 1 мг/л 10 г/л 2 мг/л 0,5 мг/л 20 г/л 20 г/л 7 г/л |
| рН 5,7-5,8 |
Модифицированная питательная среда Мурасиге-Скуга для микроразмножения картофеля черенкованием побегов
| Компоненты питательной среды | |
|
Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaCl2 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Аденин Кинетин Гибберелловая кислота Пантотенат Са |
50 мл/л 1 мл/л 5 мл/л 50 мл/л 1 мг/л 1 мг/л 2 мг/л 40 мг/л 0,5 мг/л 2 мг/л 10 мг/л |
|
Активированный уголь Сахароза Агар-агар |
10 г/л 30 г/л 7 г/л |
| рН 5,8 |
Приготовление маточных растворов для среды Гамборга-Эвелега.
| № п.п. | Компонент среды | Количество вещества |
| Маточный раствор макросолей (г на 1 л маточного раствора) | ||
|
1. 2. 3. 4. |
KNO3 (NH4)2SO4 MgSO4 . 7H2O NaH2PO4 . H2O |
60 2,68 10,0 3,0 |
| 5. |
CaCl2 . 2H2O |
3,0 |
| Маточный раствор микросолей (мг на 100 мл маточного раствора) | ||
|
6. 7. 8. 9. 10. 11. |
Na2MoO4 . 2H2O CuSO4 . 5H2O H3BO3 MnSO4 . H2O ZnSO4 . 7H2O CoCl2 . 6H2O |
25 7,5 300 1000 200 2,5 |
| 12. |
FeSO4 Na2 ЭДТА |
557 745 |
Среда Гамборга-Эвелега
| Компоненты питательной среды | |
|
Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaCl2 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Мезоинозит 2,4-Д Сахароза |
50 мл/л 1 мл/л 5 мл/л 50 мл/л 10 мг/л 1 мг/л 1 мг/л 100 мг/л 2 мг/л 20 г/л |
| рН 5,8 |
Модифицированная питательная среда Мурасиге-Скуга для клубнеобразования у картофеля.
| Компоненты питательной среды | |
|
Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaCl2 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Аскорбиновая кислота Кинетин Сахароза Агар-агар |
50 мл/л 1 мл/л 5 мл/л 50 мл/л 1 мг/л 0,5 мг/л 0,5 мг/л 1 мг/л 0,5 мг/л 50 г/л 7 г/л |
| рН 5,8-6,0 |
Приготовление маточных растворов для среды Блейдза.
| № п.п. | Компонент среды | Количество вещества |
| Маточный раствор макросолей (г на 1 л маточного раствора) | ||
|
1. 2. 3. 4. 5. |
KNO3 KCl KH2PO4 NH4NO3 MgSO4 . 7H2O или MgSO4 безводный |
20 1,3 6 20 1,44 0,7 |
| 6. |
Ca(NO3)2 . 4H2O |
10,28 |
| Маточный раствор микросолей (мг на 100 мл маточного раствора) | ||
|
7. 8. 9. 10. |
H3BO3 MnSO4 . H2O или MnSO4 . 5H2O ZnSO4 . 7H2O KJ |
160 440 627 150 80 |
| 11. |
FeSO4 Na2 ЭДТА |
557 745 |
Среда Блейдза для каллусогенеза.
| Компоненты питательной среды | |
|
Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaNO3 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Аскорбиновая кислота Мезоинозит 2,4-Д Сахароза Агар-агар |
50 мл/л 1 мл/л 5 мл/л 50 мл/л 0,5 мг/л 0,5 мг/л 1 мг/л 1 мг/л 0,1 г/л 2 мг/л 20 г/л 7 г/л |
| рН 6,0 |
Среда Блейдза для соматического эбриогенеза.
| Компоненты питательной среды | |
|
Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaNO3 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Аскорбиновая кислота Мезоинозит ИУК Кинетин АБК Сахароза Агар-агар |
50 мл/л 1 мл/л 2,5 мл/л 50 мл/л 0,5 мг/л 0,5 мг/л 1 мг/л 1 мг/л 0,1 г/л 0,2 мг/л 0,2 мг/л 0,05 мг/л 20 г/л 7 г/л |
| рН 6,0 |
Способы стерилизации в биотехнологии
Все работы с культурой клеток и тканей in vitro проводят в стерильных (асептических) условиях в стерильном боксе или ламинар-боксе, стерильными инструментами, в стерильной посуде, на стерильных питательных средах. В случае нарушения стерильности на средах хорошо развиваются микроорганизмы (грибы, бактерии), нарушающие состав среды и подавляющие рост растительных эксплантов.
Чаще всего для стерилизации помещений (боксов для пересадки тканей, культуральных комнат) используют ультрафиолетовое облучение в течение 0,5-2 часов (в зависимости от площади помещения). Работы в облученном помещении начинают через 15-20 минут после отключения бактерицидных ламп, так как под действием ультрафиолетового излучения двухатомный кислород воздуха становится трехатомным озоном – газом, токсичным для человека. Для достижения максимальной стерильности перед обработкой УФ все поверхности тщательно отмываются моющими средствами, водой и растворами хлорсодержащих веществ, поверхности ламинар-бокса обрабатывают 96 % спиртом.
Посуду, халаты, вату, бумагу, дистиллированную воду, питательные среды стерилизуют в автоклавах под давлением пара 1-2 атмосферы и температурой 120оС в течении 20-60 мин, в зависимости от объёма стерилизуемого материала.
Колбы, штативы со средой, вату, бумагу, халаты перед автоклавированием заворачивают в целлофановую бумагу, либо помещают в бюксы.
Металлические инструменты автоклавировать нельзя, так как под действием пара образуется ржавчина. Поэтому их стерилизуют сухим жаром в термостатах с температурой 170-250оС в течении 1-2 часов или на окрытом пламени горелки, что также не иене эффективно.
С пособы стерилизации растительных эксплантов
С целью получения эксплантов для каллусной и опухолевой культур, микроклонального размножения, изучения гормональной регуляции используют стерильные проростки. Семена для проращивания высевают либо на воду, либо на питательную среду.
Растительные объекты перед стерилизацией тщательно отмывают проточной водой, иногда с моющими средствами, очищают от излишних тканей. С корнеплодов и корней снимают кожуру, с побегов – кору, с почек – кроющие чешуи.
Растительные экспланты стерилизуют растворами веществ, содержащими активный хлор (хлорамином, гипохлоритом Са и Nа, сулемой), бром (бромной водой), перекисью водорода, спиртом, нитратом серебра, диацидом, антибиотиками.
Этиловый спирт часто применяют для предварительной стерилизации, протирая им поверхность материала или погружая материал на несколько секунд в абсолютный спирт. Иногда такой стерилизации достаточно, ее используют при работе с плодами, семенами, побегами, завязями.
Гипохлорит кальция (хлорная известь) используется в виде 5-7 % раствора для обработки почек, завязей, цветков, семян, побегов в течение 5-8 минут.
Гипохлорит натрия используется в виде 0,5-5 % раствора для обработки любых эксплантов в течение 1-20 минут. Это вещество является клеточным ядом, поэтому время стерилизации и концентрацию подбирают экспериментально. Например: для изолированных зародышей используют 2-3 % раствор в течение 10-15 минут, а для сухих семян 3-5 % раствор в течение 1 часа. Остатки гипохлорита натрия сначала удаляют 0,01 н HCl, а затем 8 раз промывают автоклавированной дистиллированной водой.
Хлорамин применяют в концентрации 1-6 %. Пыльники и молодые зародыши обрабатывают в течение 1-3 минут, сухие семена – 30-60 минут, затем промывают стерильной дистиллированной водой 2-3 раза.
Сулема – токсичное вещество и требует особой тщательности, как при хранении, так и при подборе концентрации для отдельных объектов. Для стерилизации зародышей используют 0,1 % раствор в течение 1-3 минут, для корне- и клубнеплодов – до 10-20 минут.
Растворы, содержащие активный хлор используются 1 раз и готовят их непосредственно перед работой.
Диацид используется в 0,2 % растворе для стерилизации корнеплодов, семян, кусочков, тканей, верхушечных меристем, изолированных зародышей, пыльников. Диацид готовят, растворяя отдельно 330 мг этанолмеркурхлорида и 660 мг цетилпиридиния хлорида в горячей воде (330 мл), затем их смешивают и доводят объем жидкости до 1 л, добавляют несколько капель детергента твин-80; хранят в плотно закрытой колбе в темноте.
Также применяются 5%-й раствор формалина или фенола. Антибиотики применяют для стерилизации растительного материала, инфицированного бактериями (ткани корончатогалловых опухолей). Часто применяют стрептомицин и тетрамицин 10-80 мг/л, ампициллин 200-400 мг/л, левомицитин, каномицин и другие. Семена могут быть обработаны газами (оксид пропилена).
Стерилизацию можно разделить на три этапа:
- предварительная стерилизация исходного растительного материала. Условия обработки варьируют в зависимости от объекта. Хранящиеся органы промывают водопроводной водой, фрагменты стебля, корня или листа также промывают проточной водопроводной водой и помещают в спирт. Предварительная стерилизация семян – более длительная процедура, зависящая от степени их загрязнённости.
- собственно стерилизация. Предварительно простерилизованные ткани и органы помещают в стерилизующий раствор. Необходимое условие процесса стерилизации – это обеспечение достаточной степени чистоты объекта, и сохранность его жизнеспособности.
- Постстерилизация. Отмывание объекта от стерилизующего раствора порциями дистиллята.
Литература
1. Алёхина Н.Д., Балконин Ю.В., Гавриленко В.Ф. Физиология растений М.: Академия, 2005. С. 416-498, 588-593.
2. Комов В.П., Шведова В.Н. Биохимия М.: Дрофа, 2004. С 494-507.
3. Андреев В.П., Марков А.Г. Биология. Толковый словарь с английскими эквивалентами Санкт – Петербург: Лань, 1999.
4. Бутенко Р.Г. Биология культивируемых клеток и биотехнология растений М.: Наука, 1991. С. 166 – 183.
5. Гупало П.И., Скрипчинский В.В. Физиология индивидуального развития растений М.: Колос, 1971. С. 3 – 164.
6. Сорокина И.К., Старичкова Н.И., Решетникова Т.Б., Гринь Н.А. Основы биотехнологии растений. Культура растительных клеток и тканей. Учебное пособие М.: УМК биологического факультета СГУ им. Н.Г.Чернышевского, 2002. 45 с.
7. Шевелуха В.С., Калашникова Е.А., Дегтярев С.В. Сельскохозяйственная биотехнология М.: Высшая школа, 1998. С. 7 – 66.
8. Адамс Р. Методы культуры клеток для биохимиков М.: Мир, 1983. С. 16.
9. Бутенко Р.Г., Гусев М.В., Киркин А.Ф. Клеточная инженерия М.: Высшая школа, 1987. С. 7 – 49.
10. Егоров Н.С., Олескин А.В., Самуилов В.Д. Биотехнология. Проблемы и перспективы М.: Высшая школа, 1987. 150 с.
11. Носов А.М. Культура клеток высших растений – уникальная система, модель, инструмент //Физиология растений. 1999. Т. 46. №6. С. 837 – 844.
12. Соболева М.И., Логинов И.В. Статистические характеристики, маркирующие морфогенез в каллусных культурах яровой мягкой пшеницы //Физиология растений. 2004. Т. 51. № 2. С. 287 – 296.
13. Батыгина Т.Б. Эмбриогенез и морфогенез половых и соматических зародышей //Физиология растений. 1999. Т. 46. № 6. С. 884 – 898.
14. Копертех Л.Г., Стрибная Л.А. Регенерация растений из листовых эксплантов пшеницы //Физиология растений. 2003. Т. 50. № 3. С. 410 – 414.
15. Филиппова В.Н., Володина С.О., Смоленская И.Н. Экдистероиды в культурах клеток Serrtula Coronata и Ajuga Reptans //Химия растительного сырья. 2002. № 1. С. 57 – 62.
16. Мухитов А.Р. Влияние колхицина на генетическую стабильность и морфогенную активность каллусов Fagopyrum Tataricum (L.) Gaertn.: Автореферат дис… канд. биол. наук. Казань, 2000. 23 с.
17. Ветчинникова Л.В. Изучение роста и развития растений Карельской берёзы, полученных в культуре in vitro. Годичное собрание общества физиологов растений России и Международная научная конференция «Проблемы растений Севера». Петрозаводск, 2004. С. 40.
18. Медведев С.С. Полярный транспорт ИУК, как основа пространственно-временной организации процессов роста и морфогенеза растений. Годичное собрание общества физиологов растений России и Международная научная конференция «Проблемы растений Севера». Петрозаводск, 2004. С. 125.
19. Карначук Р.А., Тищенко С. Ю., Головацкая И.Ф. Эндогенные фитогормоны и регуляция морфогенеза синим светом //Физиология растений. 2001. Т. 48. №2. С. 262 – 267.
20. Дунаева С.Е., Лукьянова М.В., Ковалёва О.Н. Способность незрелых зародышей к образованию растений – регенерантов в культуре in vitro у ранее- и позднеспелых сортов ячменя. Регенерация растений в первичном каллусе, полученном от незрелых зародышей //Физиология растений. 2000. Т. 47. № 1. С. 53 – 57.
21. Власова Т.А., Гавриленко В.Ф., Ермаков И.П., Жигалова Т.В. Малый практикум по физиологии растений М.: Московский Университет, 1994. С.35 – 50.
| Педиатрия | |
|
1. История отечественной педиатрии Начало становления отечественной педиатрии относится к 18 веку. Ломоносов в письме к Шувалову указывает на ... ... имплантации бластоцитов в оболочку матки; б) имплантация- длится 2 дня; в) фаза эмбрионального развития- высркая степень дифференцировки тканей, закладкавнутренних органов, питание ... Постепенная дифференцировка и миелинизация нервных клеток VII слоя коры и их аксонов, составляющих пирамидные пути, обусловливают последовательность развития статических и моторных ... |
Раздел: Рефераты по медицине Тип: шпаргалка |
| Влияние регуляторов роста растений на физиолого-биохимические ... | |
|
Министерство сельского хозяйства РФ Федеральное государственное образовательное учреждение высшего профессионального образования Кубанский ... Ауксины - обуславливают быстрое деление клеток растений, но при завышенных нормах могут привести растение к гибели; При всех физиологических проявлениях ауксины усиливают поступление и перераспределение воды и питательных веществ в растение. |
Раздел: Рефераты по ботанике и сельскому хозяйству Тип: дипломная работа |
| ... и навыков у учащихся второго класса при изучении комнатных растений | |
|
Дипломная работа Московский Государственный Педагогический Университет Кафедра естественных дисциплин и методики их преподавания в начальной школе ... Всем растениям для нормального роста и развития нужен свет, т.к. только на свету происходит процесс фотосинтеза, в ходе которого растение вырабатывает необходимые ему питательные ... В набухших семенах активизируются ферменты, а запасные питательные вещества переходят в форму, доступную для питания зародыша. |
Раздел: психология, педагогика Тип: дипломная работа |
| Акушерство и гинекология | |
|
акушерство и гинекология (лекции) ОГЛАВЛЕНИЕ I АКУШЕРСТВО 1. Общие понятия в акушерстве 2. Физиология беременности 3. Гестозы 4. Родовой акт 5 ... Токсины повреждают эндотелий сосудов (клеточные мембраны)°тромбопластин переходит на плазматическую поверхность или в более поверхностный слой сосудистой стенки, концентрация его в ... Отличительными признаками микоплазм и уреаплазм являются отсутствие клеточной стенки и способность паразитировать (персистировать) на мембране клеток хозяина. |
Раздел: Рефераты по медицине Тип: учебное пособие |
| Строение растительной клетки. Ткани растений | |
|
СТРОЕНИЕ РАСТИТЕЛЬНОЙ КЛЕТКИ Растительная клетка состоит из более или менее жесткой клеточной оболочки и протопласта. Клеточная оболочка - это ... Клеточная стенка имеет специфические функции, которые важны не только для клетки и ткани, в которой клетка находится, но и для всего растения. Если у животных процесс выделения шлаков связан с выведением их из организма, растения могут этого и не делать, изолируя ненужные вещества в живом протопласте (выведение в вакуоль ... |
Раздел: Рефераты по биологии Тип: учебное пособие |