Курсовая работа: Эффективность применения тотальной гипотермии у новорожденных с гипоксически-ишемической энцефалопатией
Министерство здравоохранения Украины
Днепропетровская государственная медицинская академия
Кафедра анестезиологии, интенсивной терапии и медицины неотложных состояний ФПО
Курсовая работа
на тему:
« Эффективность применения тотальной гипотермии у новорожденных с гипоксически-ишемической энцефалопатией»
Выполнил:
Врач-интерн Тебердеев А.А.
Научный руководитель:
Ассистент кафедры Скляр В.В.
Днепропетровск 2011
Актуальность темы
Энцефалопатия новорожденных из-за ишемии-гипоксии встречается в развитых странах в 1 - 6 случаях на 1000 живорожденных доношенных детей. Приблизительно 15-20 % асфиктичных новорожденных умирает в послеродовой период, ещё 25% являются инвалидами детства. Патологические находки при неврологическом осмотре через несколько дней после рождения - единственный и самый полезный показатель того, что повреждение мозга развилось в перинатальном периоде. У новорождённых с лёгкой энцефалопатией нет увеличенного риска моторных или познавательных нарушений. У выживших детей, перенесших тяжелую энцефалопатию, есть увеличенный риск смерти и увеличенный риск церебрального паралича и интеллектуальной инвалидности. У новорождённых со среднетяжёлой энцефалопатией есть значительные моторные дефициты, ухудшение памяти, визуальная моторная или умственная дисфункция; увеличенная гиперактивность и отсроченная школьная готовность. (1) (2)
Основные критерии, предложенные как предпосылки для диагноза гипоксически-ишемического повреждения, заканчивающегося среднетяжёлой или тяжелой энцефалопатией у доношенных новорожденных, включают: метаболический ацидоз из крови пуповины меньше чем 7 или дефицит оснований, по крайней мере, 12 ммоль/л; раннее начало энцефалопатии; полиорганная недостаточность; и исключение других причин, таких как травма, нарушения коагуляции, метаболические нарушения, и генетические причины. (3)
Патофизиология гипоксически-ишемического повреждения головного мозга новорожденных
Патофизиология повреждения головного мозга из-за ишемии-гипоксии была хорошо изучена. Ишемия-гипоксии связана с двумя фазами патологических событий, которые достигают высшей точки в травме головного мозга. Эти фазы первичной и вторичной энергетической недостаточности основаны на особенностях состояния энергетики мозга, используемых для описания временной последовательности у новорожденных животных. (4) Первичная энергетическая недостаточность характеризуется снижением мозгового кровотока и доставки кислорода/субстратов. (4) (5) Концентрации высокоэнергетических фосфорилированных соединений, таких как аденозина трифосфат (АТФ) и фосфокреатинина уменьшены, выражен тканевой ацидоз. Эта фаза - существенная предпосылка для всех последующих патологических изменений. Первичная энергетическая недостаточность связана с острыми внутриклеточными расстройствами, такими как потеря мембранного ионного гомеостаза, осуществление/блокировка повторного захвата возбуждающих нейромедиаторов, нарушение осморегуляции и торможение синтеза белка. (6) Чрезмерное возбуждение рецепторов нейромедиаторов и потеря ионного гомеостаза приводят к увеличению внутриклеточного кальция и осмотической дисрегуляции. Повышение внутриклеточной концентрации кальция запускает многочисленные механизмы деструкции, активизируя липазы, протеазы и эндонуклеазы. (7) Разрешение ишемии-гипоксии в пределах определенного временного интервала полностью устраняет дефицит высокоэнергетических фосфорилированных метаболитов, внутриклеточного рН и способствует рециркуляции нейромедиаторов. Продолжительность времени, требуемого для ликвидации ишемии-гипоксии и активизации восстановления, находится под влиянием предварительно обусловивших событий, наличия субстрата, температуры тела, и одновременного течения других патологических состояний.
Хотя состояние энергетики мозга может улучшиться после первичной энергетической недостаточности, второй эпизод энергетической недостаточности может развиться на определённом отдалении от первоначального случая. Вторичная энергетическая недостаточность отличается от первичной тем, что снижение фосфокреатинина и АТФ не сопровождается ацидозом мозга. (4) Наличие и серьезность вторичной энергетической недостаточности зависит от степени выраженности первичной энергетической недостаточности. Патогенез вторичной энергетической недостаточности так же как и первичной, до конца не выяснен, но, вероятно, заключается в развитии многочисленных патофизиологических процессов, включая накопление возбуждающих нейромедиаторов, окислительное повреждение, апоптоз, воспаление, видоизменение факторов роста и синтеза белка. (8 (9) (10) (11) (12)
Интервал между первичной и вторичной энергетической недостаточностью представляет скрытую фазу, которая соответствует терапевтическому окну. Инициирование методов лечения во время скрытой фазы у перинатальных животных эффективно уменьшало повреждение головного мозга, что доказывает наличие терапевтического окна. Продолжительность терапевтического окна составляет приблизительно 6 часов у почти доношенных плодов овец, подвергнутых нейропротекции с помощью охлаждения мозга, начатым в различных временных интервалах после мозговой ишемии. (13) (14) (15)
Современные методы лечения неонатальной гипоксически-ишемической энцефалопатии
Лечение гипоксически-ишемической энцефалопатии (ГИЭ), было ограничено поддерживающей интенсивной терапией. Такие меры включают коррекцию кровообращения и легочных нарушений (гипотензия, метаболический ацидоз, и гиповентиляция), коррекцию расстройств обмена веществ (глюкоза, кальций, магний и другие электролиты), лечение судорог и дисфункции других органов и систем. Этот подход в лечении не учитывает последовательных патофизиологических механизмов, приводящих к гипоксически-ишемическому повреждению головного мозга, и направлен на предотвращение повреждений от вторичных событий, связанных с ишемией-гипоксией.
Диагноз энцефалопатии у доношенных детей
Должен быть получен детальный анамнез относительно беременности и интранатального периода как первый шаг в диагностировании энцефалопатии. Должен быть исследован любой случай, который мог поставить под угрозу доставку крови или кислорода к плоду. Эти события включают особенности плацентарного отделения, разрыв матки, эмболию амниотической жидкостью, ущемление пуповины головкой плода, пролапс и разрыв пуповины, материнское кровотечение, травма или сердечно-легочная остановка, тяжелую и длительную брадикардию плода и длительные роды. У большинства младенцев с энцефалопатией нет очевидной причины её развития. В настоящее время нет ни одного чёткого диагностического теста на энцефалопатию вследствие ишемии-гипоксии. Является опасным повышение материнской температуры в анамнезе, потому что умеренное повышение температуры у матери увеличивает риск неонатальной энцефалопатии. Эмбриональная и материнская тахикардия в анамнезе может указывать на хориоамнионит. Для выявления плацентарной инфекции должно быть выполнено гистологическое исследование плаценты. В постановке диагноза могут помочь повышенные уровни биомаркеров (увеличенные цитокины). Все новорождённые должны быть тщательно осмотрены неврологом, чтобы выявить наличие лёгкой, среднетяжёлой или тяжелой энцефалопатии. (16)
Гипотермия как защита мозга
Нейропротекция специфичными для мозга методами лечения была хорошо изучена в преклинических условиях за последние 20 лет, с целью блокирования или подавления каскада событий, вызванных гипоксией и ишемией. Гипотермия мозга - многообещающая терапия нейрозащиты в отношении энцефалопатии как следствия гипоксической ишемии.
Преклинические исследования
Доказано на моделях плодов и новорожденных животных различных видов, что охлаждение глубиной 4.0°C - 6.0°C по сравнению с контрольными группами обладало нейропротективным действием и хорошо переносилось. (13) (14) (19) - (31) Продолжительность охлаждения в этих исследованиях варьировала от 3 до 72 часов, и в каждом исследовании в соответствии с глубиной охлаждения была контрольная группа. Глубина охлаждения, достигнутого в каждом из этих исследований, определялась ректальной температурой в диапазоне от 28.0°C до 33.0°C. (19) (21) (23) (27) Диапазон температуры скальпа, обеспечивающий в преклинических исследованиях нейропротекцию, был зарегистрирован от 21.3°C до 23.9°C. (29) В исследованиях Gunn сообщается об экстрадуральных мозговых температурах вплоть до 30.0°C. (14)(15) Исследования, измеряющие мозговые температуры, оценили эффекты охлаждения к 30.0°C к 32.2°C, (28) 31.1°C, (30) и 32.0°C. (22) Ни одно из этих исследований, сравнивающих определенную глубину гипотермии к контрольным группам, не сообщило о каких бы то ни было отрицательных воздействиях, кроме одного сообщения о поросенке, дрожавшем во время охлаждения. (30)
Механизм защиты был зарегистрирован многими методиками, включая уменьшение использования энергии мозгом, измеренное спектроскопией магнитного резонанса, (32) сокращение размера инфаркта, (33) уменьшение потерь нейронов, (14) сохранение чувствительности моторной функции, (19) сохранение гиппокампальных структур, (21) (22) и восстановление электроэнцефалографической активности. (14) Нейропротекция с помощью гипотермии является температурзависимым процессом, с прогрессивным увеличением защиты по мере увеличения глубины температуры. Covey и Oorschot (34) отметили, что гипотермия на 5.0°C ниже нормальной То, применяемая после повреждения в течение 6 часов показала лучшую нейропротекцию для стриальных нейронов чем глубина на 2.0°C ниже нормальной. Iwata и коллеги (35) продемонстрировали, что охлаждение в двух различных режимах (ректальные температуры 35.0°C и 33.0°C по сравнению с нормотермией от 38.5°C до 39.0°C) в течение 48 часов заканчивалось прогрессивным увеличением выживаемости нейронов в сером веществе при 33.0°C по сравнению с 35.0°C. Laptook и коллеги (32) отметили линейные отношения между нормой использования энергии мозгом и мозговой температурой в диапазоне температур между 27.6°C и 41°C, причём уменьшение мозговой температуры на 1°C приводило к сокращению использования энергии мозгом на 5.3 %. Тэйлор и сотрудники (33) оцененивали размер инфаркта при охлаждении до 33.0°C и 30.0°C в сравнении с нормотермией и нашли уменьшение инфаркта при обеих глубинах гипотермии по сравнению с нормотермией. Williams и партнеры (36) оценили мозговой энергетический метаболизм во время ишемии-гипоксии и продемонстрировали, что при сравнении с контрольными группами, метаболиты магнитно-ядерного резонанса сохранялись при 31.0°C и 34.0°C. Ни в одном из этих исследований, сравнивающих различные глубины гипотермии к контрольным группам на тех же самых моделях, не было зарегистрировано отрицательных воздействий гипотермии. Кроме того, изменение мозговых температур от 28.0°C до 41.0°C не изменяла никакие переменные величины на модели поросенка, за исключением частоты сердечных сокращений, которая непосредственно коррелировала с мозговой температурой. (32)
Клинические исследования
До настоящего времени, два рандомизированных, контролируемых исследования и одно большое предварительное исследование были опубликованы, оценивая гипотермию как нейропротектор для доношенных и почти доношенных младенцев с ГИЭ. Многоцентровое исследование Cool Cap вовлекло 243 младенцев, которые имели среднетяжёлую или тяжелую энцефалопатию и патологические aEEG амплитуды и были или охлаждены до температуры 34.0°C - 35.0°C в течение 72 часов, или отнесены к группе нормотермии с обычным лечением. (37) Главным оцениваемым исходом исследования была смерть или инвалидность в 18 месяцев. Охлаждение было обеспечено изолированным охлаждением головы, и умеренным системным охлаждением. Смерть или тяжелая инвалидность встречались у 66 % младенцев, рандомизированных по обычному лечению и 55 %, рандомизированных по группе охлаждения (отношение разногласий [OR] 0.61, 95%-ый доверительный интервал [CI] 0.34 к 1.09, P=0.10). Эффект охлаждения головы у младенцев с самыми тяжелыми изменениями aEEG не был защитным, но эффект охлаждения головы у младенцев с менее тяжелыми изменениями aEEG (n=172) был защитным (OR 0.42, 95%-ый CI 0.22 к 0.80, P=0.009).
Большое рандомизированное контролируемое управляемое исследование, выполненное в семи центрах с вовлечением 65 младенцев, изучало умеренную системную гипотермию всего тела на уровне 33.0°C в течение 48 часов по сравнению с нормотермией, поддерживаемой на уровне 37.0°C. (38) В сообщении о безопасности этого управляемого исследования зарегистрировано, что у младенцев в группе гипотермии были более значительная брадикардия, более продолжительная зависимость от вазопрессорных веществ, более высокое протромбиновое время, больше судорог, и большая потребность в переливаниях плазмы и тромбоцитов. В 12 месячном возрасте смерть или тяжелые моторные показатели были зарегистрированы у 52 % группы гипотермии по сравнению с 84 % группы нормотермии (P=0.02). В анализируемой подгруппы, младенцы, рождённые вне госпиталя, имели большую вероятность умереть, чем младенцы рождённые дома (OR 10.7, 95%-ый CI 1.3 к 90.0).
В проведенном Национальным Институтом Здоровья ребенка и Развития человека (NICHD) исследовании Гипотермии Всего Организма у младенцев со среднетяжёлой и тяжелой энцефалопатией рандомизировано 102 младенца в группе гипотермии до 33.5°C в течение 72 часов и 106 младенцев контрольной группы с обычным лечением. (39) Главным оцениваемым исходом была смерть или умеренная/тяжелая инвалидность в 18-ти месячном возрасте. У младенцев в группе гипотермии была значительно более низкая частота сердечных сокращений, чем у младенцев в контрольной группе на протяжении всего 72-часового периода вмешательства. Не было никакого значительного различия между группами в систолическом или диастолическом артериальном давлении. Частота неблагоприятных событий во время исследования вмешательства была низка: у одного младенца в каждой группе была аритмия, у двух младенцев в группе гипотермии был ацидоз, у трех младенцев в группе гипотермии и двух младенцев контрольной группы было кровотечение, и у четырёх охлажденных младенцев отмечено нарушение целостности кожи. Смерть или тяжёлая инвалидность были отмечены у 44 % младенцев в группе гипотермии по сравнению с 62 % младенцев в контрольной группе, с отношением риска 0.72 (0.54 к 0.95). Показано положительное воздействие охлаждения у младенцев в группах со среднетяжёлой и тяжелой энцефалопатией.
Исследование Cool Cap и Гипотермия Всего Организма NICHD использовали различные критерии отбора, которые отличаются, прежде всего, применением aEEG в Cool Cap. Способ охлаждения в каждом испытании был различен, и не известно, превосходит ли один режим охлаждения другой. Главные исходы не обрабатывались по одной и той же методике в этих двух испытаниях. Хотя оценка среднетяжёлой или тяжелой энцефалопатии отдельно не была предусмотрена, уменьшение летальности и среднетяжёлой/тяжёлой инвалидности были отмечены в исследовании Гипотермии Всего Тела в объединённой группе среднетяжёлой и тяжелой энцефалопатии. Главным оцениваемым исходом каждого испытания был объединенный конечный исход в виде смерти или инвалидности; Гипотермия не оказывала ощутимого эффекта у младенцев, которые имели настолько тяжелые расстройства, что умерли бы в отсутствии вмешательства. Развитие церебрального паралича было уменьшено с 31 % в контрольной группе до 18 % в исследовании Cool Cap и с 30 % в контроле до 19 % в испытании Гипотермия Всего Организма сетью NICHD.
Повышенные температуры у младенцев с ГИЭ
Испытание NICHD Гипотермия Всего Тела продемонстрировало возникновение повышенной базальной температуры тела у младенцах контрольной группы, когда температуры были измерены последовательно за 76 часов вмешательства исследования и фазы нагревания. (39) Из 102 младенцев рандомизированных в обычной группе лечения, 28 имели в среднем пищеводную температуру по крайней мере 38.0°C. Более высокие внутренние температуры были связаны со значительным увеличением риска смерти или ухудшения в контрольной группе. (40) Во вторичном анализе Cool Cap, исследователи также отметили связь между повышенной температурой у детей в контрольной группе и увеличением риска смерти или инвалидности. (41) Гипертермия после поражения головного мозга повышает риск более тяжелого неврологического повреждения, и исследования у взрослых, подтверждают связь между более высокими внутренними температурами и худшим результатом. (42) На моделях животных судороги связывают с гипоксически-ишемическим повреждением в результате некроза нейронов, специфично в пределах гиппокампа. (43) Повреждение гиппокампа отмечается при спонтанной гипертермии на 1.5°C выше нормотермии; крысята, у которых гипертермия была предотвращена во время судорог, показали значительное сокращение повреждений головного мозга по сравнению с контрольными группами. В другом исследовании у новорожденных крыс, подвергнутых гипоксически-ишемическому повреждению, проводили избирательное и длительное изучение ухудшения памяти во время поведенческих задач, и гипотермия к 27.0°C значительно уменьшала дефицит внимания в поведенческих задачах, тогда как гипертермия ухудшила поведенческий дефицит и повреждение головного мозга. (44)
Четыре вторичных анализа были опубликованы по данным рандомизированного NICHD, контролируемого исследования. На первой стадии исследования в отношении повышенной температуры после ГИЭ, 22 % пищеводных внутренних температур, измеренных у младенцев контрольной группы, были более высокими, чем 37,5°C. (40) Вероятность смерти или инвалидности увеличивалась в 3.6 - 4 раза на каждый градус увеличения температуры в контрольной группе. Вторичное исследование, вовлекающее образцы мочи, собранные у 58 участниках исследования, показало, что высокое отношение в моче лактата к креатинину было связано со смертью/инвалидностью. (46) Наконец, подробный анализ данных рандомизированного контролируемого исследования показал безопасность гипотермии во время периода исследования вмешательства, всего стационарного курса, и продолжения к 18 - 22 месяцам. (47)
Цель исследования. Изучить эффективность тотальной гипотермии у новорожденных с гипоксически-ишемической энцефалопатией.
Задачи.
1. Оценить летальность у детей с ГИЭ и влияние на этот фактор гипотермии
2. Оценить влияние гипотермии у детей с ГИЭ на длительность ИВЛ
3. Оценить влияние гипотермии у детей с ГИЭ на длительность судорожного синдрома.
4. Оценить влияние гипотермии у детей с ГИЭ на длительность пребывания в ОИТН.
Материалы и методы исследования:
В исследование было включено 10 новорожденных с установленным диагнозом: Гипоксически-ишемическая энцефалопатия, которые соответствовали критериям включения в группу подлежащей гипотермии.
КРИТЕРИИ ВКЛЮЧЕНИЯ
1. Гестационный возраст 35 и более недель
2. <6 часов от рождения
3. Проявления асфиксии, определяемые по наличию, по крайней мере, двух из следующих четырех критериев:
a) Apgar <6 на 10 минуте или сохраняющаяся потребность в ИВЛ с положительным давлением, возможно в сочетании с наружным массажем сердца на 10 минуте жизни.
b) Любые острые перинатальные проблемы, которые могут привести к ГИЭ (то есть отслойка плаценты, выпадение петель пуповины, тяжелые расстройства сердечного ритма плода и т.д).
c) рН из крови пуповины <7.0 или дефицит оснований 12 или больше.
d) Если рН пуповинной крови не определялся, рН артериальной крови <7.0 или ВЕ> 12 ммоль/л в пределах 60 минут после рождения (если есть возможность определить эти показатели).
4. Проявления среднетяжёлой или тяжелой ГИЭ на основании модифицированной Классификации Sarnat
| Категория | Среднетяжёлая ГИЭ | Тяжелая ГИЭ |
| Уровень сознания | Летаргия | Ступор/кома |
| Спонтанная активность | Сниженная активность | Отсутствие активности |
| Положение тела | Дистальная флексия, разогнутые конечности | Децеребрация |
| Тонус мышц | Гипотония | Отсутствие |
| Примитивные рефлексы | Слабый сосательный, неполный Moрo | Отсутствующий сосательный, отсутствующий Moрo |
|
Автономная система: Зрачки ЧСС Дыхание |
Суженные Брадикардия Периодическое дыхание |
расширенные/без фотореакции Переменная ЧСС Апноэ |
В исследование были включены новорожденные, которым проводилась гипотермия (n=5) и новорожденные, которым гипотермия не проводилась (n=5) (дети находящиеся в ОИТН до введения гипотермии, но которые согласно ретроспективному анализу подходили по нынешним критериям включения в программу гипотермии). Проводилась оценка летальности, динамики судорожного синдрома, длительности нахождения на ИВЛ, длительности нахождения в ОИТН, индекса резистентности передней мозговой артерии при доплерографическом исследовании головного мозга новорожденных.
Гипотермия проводилась следующим образом:
1. Решение охлаждать новорожденного с ГИЭ принимается дежурным врачом.
2. Чтобы быть эффективным, охлаждение должно начаться как можно скорее, то есть, в пределах 6 часов от рождения.
3. Цель состоит в том, чтобы достигнуть заданной температуры в течение 1 часа.
4. Полный период охлаждения и согревания составляет 84 часа, и состоит из 2 фаз:
· Активное охлаждение – в течение 72 часов от начала охлаждения.
новорожденный гипоксический энцефалопатия лечение гипотермия
· Согревание - 12 часов активного постепенного согревания после завершения 72 часов охлаждения.
Результаты исследования
Установлено, что летальность в первой группе составила 1 (20%), во второй группе летальность составила 2 человек (40%).
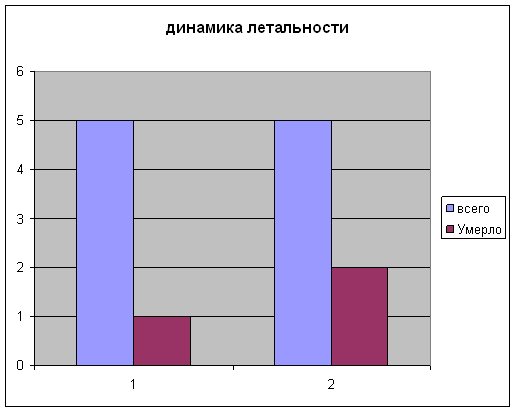
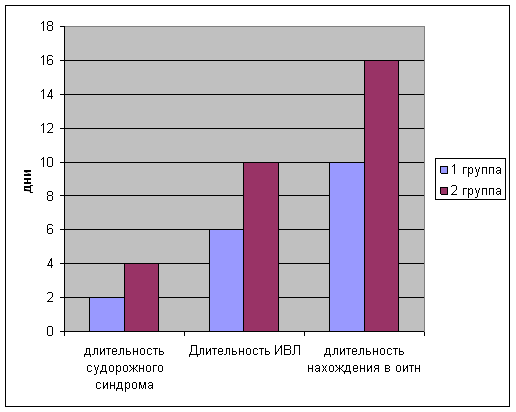
Длительность судорожного синдрома определялась ретроспективно по записям в врачебных дневниках и в первой группе составила в среднем 2-е суток, тогда как во второй группе судорожный синдром присутствовал в среднем 4 дня.
При оценке длительности нахождения на ИВЛ, выяснилось, что у детей первой группы средняя продолжительность ИВЛ составила 6 дней, тогда как у детей 2 группы эта цифра составила 10 дней. Также определено снижение общего пребывания в ОИТН детей первой группы ( в среднем 10 суток) по сравнению со второй группой (16 суток)
При проведении нейросонографии с доплерографией у детей обеих групп исследовался индекс резистентности в передней мозговой артерии на 3-и сутки жизни.
| Ri 1 | Ri 2 | Ri 3 | Ri 4 | Ri 5 | |
| 1 группа | 0.55 | 0.5 | 0.6 | 0.45 | 0.4 |
| 2 группа | 0.42 | 0.4 | 0.35 | 0.32 | 0.4 |
Среднее значение Ri в первой группе составило 0,5, а во второй- 0,38 , что свидетельствует о более неблагоприятном прогнозе у детей 2 группы.
Выводы
Выявленные нами различия у детей двух исследуемых групп с гипоксически-ишемической энцефалопатией, позволяют судить о том, что применение тотальной гипотермии у новорожденных с гипоксически-ишемической энцефалопатией:
- Снижает летальность
- Снижает длительность нахождения на ИВЛ
- Снижает длительность пребывания ребёнка в отделении реанимации
- Улучшает гемодинамику в сосудах головного мозга и соответственно увеличивает шанс на благоприятный исход данного заболевания
- Укорачивает длительность судорожного синдрома
Список литературы
1. Roberston CMT, Finer NN, Grace MGA. School performance of survivors of neonatal encephalopathy associated with birth asphyxia at term. J Pediatr. 1989;114:753–760
2. Shankaran S, Woldt E, Koepke T, Bedard MP, Nandyal R. Acute neonatal morbidity and long-term central nervous system sequelae of perinatal asphyxia in term infants. Early Hum Dev. 1991;25:135–148
3. American College of Obstetricians and Gynecologist and American Academy of Pediatrics.Neonatal Encephalopathy and Cerebral Palsy. Defining the Pathogenesis and Pathophysiology. Washington, DC: 2003
4. Lorek A, Takei Y, Cady EB, et al Delayed ("secondary") cerebral energy failure after acute hypoxia-ischemia in the newborn piglet: continuous 48-hour studies by phosphorus magnetic resonance spectroscopy. Pediatr Res. 1994;36:699–706
5. Laptook AR, Corbett RJ, Arencibia-Mireles O, Ruley J. Glucose-associated alterations in ischemic brain metabolism of neonatal piglets. Stroke. 1992;23:1504–1511
6. Johnston MV, Trescher WH, Ishida A, Nakajima W. Neurobiology of hypoxic-ischemic injury in the developing brain. Pediatr Res. 2001;49:735–741
7. Siesjo BK, Bengtsson F. Calcium fluxes, calcium antagonists, and calcium-related pathology in brain ischemia, hypoglycemia, and spreading depression: a unifying hypothesis. J Cereb Blood Flow Metab. 1989;9:127–140
8. Fellman V, Raivio KO. Reperfusion injury as the mechanism of brain damage after perinatal asphyxia. Pediatr Res. 1997;41:599–606
9. Liu XH, Kwon D, Schielke GP, Yang GY, Silverstein FS, Barks JD. Mice deficient in interleukin-1 converting enzyme are resistant to neonatal hypoxic-ischemic brain damage. J Cereb Blood Flow Metab. 1999;19:1099–1108
10. Mehmet H, Yue X, Squier MV, et al Increased apoptosis in the cingulate sulcus of newborn piglets following transient hypoxia-ischaemia is related to the degree of high energy phosphate depletion during the insult. Neurosci Lett. 1994;181:121–125
11. Tan WK, Williams CE, During MJ, et al Accumulation of cytotoxins during the development of seizures and edema after hypoxic-ischemic injury in late gestation fetal sheep. Pediatr Res. 1996;39:791–797
12. Gluckman PD, Guan J, Williams C, et al Asphyxial brain injury—the role of the IGF system. Mol Cell Endocrinol. 1998;140:95–99
13. Gunn AJ, Gunn TR, de Haan HH, Williams CE, Gluckman PD. Dramatic neuronal rescue with prolonged selective head cooling after ischemia in fetal lambs. J Clin Invest. 1997;99:248–256
14. Gunn AJ, Gunn TR, Gunning MI, Williams CE, Gluckman PD. Neuroprotection with prolonged head cooling started before postischemic seizures in fetal sheep. Pediatrics. 1998;102:1098–1106
15. Gunn AJ, Bennet L, Gunning MI, Gluckman PD, Gunn TR. Cerebral hypothermia is not neuroprotective when started after postischemic seizures in fetal sheep. Pediatr Res. 1999;46:274–280
16. Sarnat HB, Sarnat MS. Neonatal encephalopathy following fetal distress. A clinical and electroencephalographic study. Arch Neurol. 1976;33:696–705
17. Spitzmiller RE, Phillips T, Meinzen-Derr J, Hoath SB. Amplitude-integrated EEG is useful in predicting neurodevelopment outcome in full term infants with hypoxic-ischemic encephalopathy: a meta-analysis. J Child Neurol. 2007;22:9:1069–1078
18. Freeman JM. The use of amplitude-integrated electroencephalography: beware of its unintended consequences. Pediatrics. 2007;119:615–617
19. Bona E, Hagberg H, Løberg EM, Bågenholm R, Thoresen M. Protective effect of moderate hypothermia after neonatal hypoxia-ischemia: short and long term outcome. Pediatr Res. 1998;43:738–745
20. Busto R, Dietrich WD, Globus MYT, Valdes I, Scheinberg P, Ginsberg MD. Small differences in intraischemic brain temperature critically determine the extent of ischemic neuronal injury. J Cereb Blood Flow Metab. 1987;7:729–738
21. Carroll M, Beek O. Protection against hippocampal CA cell loss by post-ischemic hypothermia is dependent of delay of initiation and duration. Metab Brain Dis. 1992;7:45–50
22. Colbourne F, Corbett D. Delayed and prolonged post-ischemic hypothermia is neuroprotective in the gerbil. Brain Res. 1994;656:265–272
23. O'Brien FE, Iwata O, Thornton JS, et al Delayed whole body cooling to 33 to 35C and the development of impaired energy generation consequential to transient cerebral hypoxia-ischemia in the newborn piglet. Pediatrics. 2006;117:1549–1558
24. Sirimanne ES, Blumberg RM, Bossano D, et al The effect of prolonged modification of cerebral temperature on outcome after hypoxia-ischemic brain injury in the infant rat. Pediatr Res. 1996;39:591–597
25. Thoresen M, Penrice J, Lorek A, et al Mild hypothermia following severe transient hypoxia-ischemic ameliorates delayed cerebral energy failure in the newborn piglet. Pediatr Res. 1995;5:667–670
26. Thoresen M, Bågenholm R, Løberg EM, Apricena F, Kjellmer I. Posthypoxic cooling of neonatal rats provides protection against brain injury. Arch Dis Child. 1996;74:F3–F9
27. Thoresen M, Simmonds M, Satas S, Tooley J, Silver IA. Effective selective head cooling during posthypoxic hypothermia in newborn piglets. Pediatr Res. 2001;49:594–599
28. Tooley J, Satas S, Eagle R, Silver IA, Thoresen M. Significant selective head cooling can be maintained long-term after global hypoxia ischemia in newborn piglets. Pediatrics. 2002;109:643–649
29. Tooley J, Satas S, Porter H, Silver IA, Thoresen M. Head cooling with mild systemic hypothermia in anesthetized piglets in neuroprotection. Ann Neurol. 2003;53:65–72
30. Tooley JR, Eagle RC, Satas S, Thoresen M. Significant head cooling can be achieved while maintaining normothermia in the newborn piglet. Arch Dis Child Fetal Neonatal Ed. 2005;90:F262–F266
31. Yager JY, Asselin J. Effects of mild hypothermia on cerebral energy metabolism during the evolution of hypoxic-ischemic brain damage in the immature rat. Stroke. 1996;27:919–926
32. Laptook AR, Corbett RJ, Sterett R, Garcia D, Tollefsbol G. Quantitative relationship between brain temperature and energy utilization rate measured in vivo using P and H magnetic resonance spectroscopy. Pediatr Res. 1995;38:919
33. Taylor DL, Mehmet H, Cady EB, Edwards AD. Improved neuroprotection with hypothermia delayed by 6 hours following cerebral hypoxia-ischemia in the 14-day-old rat. Pediatr Res. 2002;51:13–19
34. Covey MV, Oorschot DE. Effect of hypothermic post-treatment on hypoxic-ischemic striatal injury, and normal striatal development, in neonatal rats: a stereological study. Pediatr Res. 2007;62:646–651
35. Iwata O, Thornton JS, Sellwood MW, et al Depth of delayed cooling alters neuroprotection pattern after hypoxia-ischemia. Ann Neurol. 2005;58:75–87
36. Williams G, Dardzinski BJ, Buckalew AR, Smith MB. Modest hypothermia preserves cerebral energy metabolism during hypoxia-ischemia and correlates with brain damage: a P nuclear magnet resonance study in unanesthetized neonatal rats. Pediatr Res. 1997;42:700–708
37. Gluckman PD, Wyatt J, Azzopardi DV, et alon the behalf of the Cool Cap Study Group. Selective head cooling with mild systemic hypothermia after neonatal encephalopathy: multicenter randomized trial. Lancet. 2005;365:663–670
38. Eicher DJ, Wagner CL, Katikaneni LP, et al Moderate hypothermia in neonatal encephalopathy: efficacy outcomes. J Pediatr Neurol. 2005;32:11–17
39. Shankaran S, Laptook AR, Ehrenkranz RA, et aland the NICHD and Human Development Neonatal Research Network. Whole-body hypothermia for neonates with hypoxic-ischemic encephalopathy. N Engl J Med. 2005;353:1574–1584
40. Laptook A, Tyson J, Shankaran S, et al Elevated temperature after hypoxic-ischemic encephalopathy: a risk factor for adverse outcome. Pediatrics. 2008;122:491–499
41. Wyatt JS, Gluckman PD, Liu PY, et alfor the Cool Cap Study Group. Determinants of outcomes after head cooling for neonatal encephalopathy. Pediatrics. 2007;119:912–921
42. Bramlett HM, Dietrich WD. Progressive damage after brain and spinal cord injury; pathomechanisms and treatment strategies. Prog Brain Res. 2007;161:125–141
43. Yager JY, Armstrong EA, Jaharus C, Saucier DM, Wirrell EC. Preventing hypothermia decreases brain damage following neonatal hypoxic-ischemic seizures. Brain Res. 2004;1011:48–57
44. Mishima K, Ikeda T, Yoshikawa T, et al Effects of hypothermia and hyperthermia on attention and spatial learning deficits following neonatal hypoxia-ischemic insult in rats. Behav Brain Res. 2004;151:209–217
45. Ambalavanan N, Carlo WA, Shankaran S, et alNational Institute of Child Health and Human Development Neonatal Research Network. Predicting outcomes of neonates diagnosed with hypoxemic-ischemic encephalopathy. Pediatrics. 2006;118:2084–2093
46. Oh W, Perritt R, Shankaran S, et al Association between urinary lactate to creatinine ratio and neurodevelopmental outcome in term infants with hypoxic-ischemic encephalopathy. J Pediatr. 2008;153:375–378
47. Shankaran S, Pappas A, Laptook AR, et alfor the NICHD Neonatal Research Network. Outcomes of safety and effectiveness in a multicenter randomized controlled trial of whole-body hypothermia for neonatal hypoxic-ischemic encephalopathy. Pediatrics. 2008;122:e791–e798
48. Shah PS, Ohlsson A, Perlman A. Hypothermia to treat neonatal hypoxic ischemic encephalopathy. Arch Pediatr Adolesc Med. 2007;161:951–958
49. Schulzke SM, Rao S, Patole SK. A systematic review of cooling for neuroprotection with hypoxic ischemic encephalopathy—are we there yet? BMC Pediatrics. 2007;7:1–30
50. Jacobs S, Hunt R, Tarnow-Mordi W, Inder T, Davis P. Cooling for newborns with hypoxic ischemic encephalopathy. Cochrane Database Syst Rev. 2007;4:1–46
| Респираторный дистресс-синдром у новорожденных | |
|
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ УЗБЕКИСТАН ТАШКЕНТСКИЙ ПЕДИАТРИЧЕСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ У НОВОРОЖДЕННЫХ ... Первый путь синтеза сурфактанта легко истощается под влиянием гипоксии, ацидоза, гипотермии. 16. Meduri C.U., Headley A.S., Golden E. et al. |
Раздел: Рефераты по медицине Тип: учебное пособие |
| Активность основных карбоксипептидаз в тканях мышей при введении ... | |
|
ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ ПЕДАГОГИЧЕСКИЙ УНИВЕРСИТЕТ ИМЕНИ В.Г. БЕЛИНСКОГО На правах рукописи Салдаев Дамир Абесович АКТИВНОСТЬ ОСНОВНЫХ ... 66. Birch N.P., Rodriguez C., Dixon J.E., Mezey E. Distribution of carboxypeptidase H messenger RNA in rat brain using in situ hybridization histochemistry: implications for ... 84. Cool D.R., Normant E., Shen F.S., Chen H.C., Pannell L., Zhang Y., Loh Y.P. Carboxypeptidase E is a regulated secretory pathway sorting receptor: genetic obliteration leads to ... |
Раздел: Рефераты по биологии Тип: дипломная работа |
| Изучение влияния селенсодержащих соединений на системную гемодинамику ... | |
|
СОДЕРЖАНИЕ ВВЕДЕНИЕ ГЛАВА 1 ОБЗОР ЛИТЕРАТУРЫ 1.1 Современные представления о механизмах регуляции мозгового кровотока 1.2 Роль селена в организме 1.3 ... 75. Dopaminergic action on brain vessels. / Z. Edvinsson [et al.] // Intern. 167. Clayton C.C. Diet and azo dye tumors: effect of diet during a period when the drug is not fed / C.C. Clayton, C.A. Baumann // Cancer Res. |
Раздел: Рефераты по медицине Тип: дипломная работа |
| Прогрессирующие мышечные дистрофии | |
|
ГОУ ВПО Волгоградский государственный медицинский университет Росздрава Кафедра детских болезней педиатрического факультета Прогрессирующие мышечные ... К ним относят спинальные (протекающие с преимущественным поражением двигательных клеток спинного мозга) и невральные (с поражением периферических нервов) амиотрофии [McNally E ... 77. Held M., Schneider C., Fleischer K., Jany B. A patient with muscle pain after a journey to the tropics. |
Раздел: Рефераты по медицине Тип: курсовая работа |
| Педиатрия | |
|
1. История отечественной педиатрии Начало становления отечественной педиатрии относится к 18 веку. Ломоносов в письме к Шувалову указывает на ... Осуществляется между женской консультацией, роддомом и детской поликлиникой в виде дородового патронажа посещения новорожденного в течение 3 дней после выписки из роддома ... При гипоксической энцефалопатии легкой степени применяют седативные (фенобарбитал, натрия бромид, дроперидол), антигистаминные, сосудистые (хлорид кальция, витамин С) препараты, а ... |
Раздел: Рефераты по медицине Тип: шпаргалка |