Курсовая работа: Технология получения полисахарида хитозана из хитина, выделяемого из панцирей ракообразных
Федеральное агентство по образованию
государственного технического университета
технологический институт
Кафедра химической технологии
Курсовой проект по дисциплине
«Технология переработки полимеров»
на тему: «Технология получения полисахарида хитозана из хитина, выделяемого из панцирей ракообразных»
2008г.
Содержание
Введение. 3
Основная часть. 5
1. Технологический раздел.. 5
1.1. Информационный анализ. 5
Хитин и хитозан. Строение и свойства.. 5
Способы получения хитозана.. 10
Деацетилирование хитина. Получение хитозана.. 11
Сушка хитозана. Измельчение и хранение. 16
Применение хитина и хитозана.. 17
1.2. Характеристика исходного сырья, вспомогательных материалов и готовой продукции.. 23
Характеристика сырья.. 23
Характеристика готового продукта.. 25
1.3. Методы исследования.. 26
Исследование процесса деминерализации и депротеинирования 26
1.4. Описание технологического процесса.. 27
1.5. Основные параметры технологического процесса.. 31
1.6. Техническая характеристика основного технологического оборудования.. 31
1.7. Технологические расчёты.. 32
Заключение. 34
Список используемой литературы.. 35
Введение
В настоящее время природный полисахарид хитозан (ХТЗ) благодаря широкому спектру своих полезных свойств находит всё более широкое применение в самых различных областях, таких как: текстильная промышленность – при шлихтовке и противоусадочной или водоотталкивающей обработке тканей; бумажная и фотографическая промышленность – для производства высококачественных и специальных сортов бумаги, а также для улучшения свойств фотоматериалов; атомная промышленность – для локализации радиоактивности и концентрации радиоактивных отходов; медицина – в качестве шовных материалов, рано- и ожогозаживляющих повязок, в составе мазей и различных лечебных препаратов, как энтеросорбент; сельское хозяйство – для производства удобрений, защиты семенного материала и сельскохозяйственных культур; в пищевой промышленности выполняет роль консерванта, осветлителя соков и вин, диетического волокна, эмульгатора; в качестве пищевой добавки показывает уникальные результаты как энтеросорбент; в парфюмерии и косметике входит в состав увлажняющих кремов, лосьонов, гелей, лаков для волос, шампуней; при очистке воды служит как сорбент и флокулянт.
К неоспоримым достоинствам хитозана относится его совершенная безопасность для человека и окружающей среды: экологически чист и полностью распадается в природных условиях.
Набор полезных свойств ХТЗ обширен благодаря присутствию в его структуре большого числа функциональных групп:

Известно, что основным масштабным сырьевым источником при промышленном получении ХТЗ служат панцири камчатских крабов. Учитывая ценность и уникальность этого продукта, а также огромную сферу практического использования, представляется актуальным изыскание иных доступных сырьевых ресурсов для производства ХТЗ, способных обеспечить его тоннажное производство и находить новые области его применения.
Поэтому решение проблемы создания эффективной технологии получения хитозана из панцирей камчатских крабов и исследование комплекса его физико-химических характеристик является актуальной задачей.
Основная часть. 1. Технологический раздел 1.1. Информационный анализ
Хитин и хитозан. Строение и свойства
Биополимеры хитин и хитозан обратили на себя внимание учёных почти 200 лет назад. Хитин был открыт в 1811 г. (H. Braconnot, A. Odier), а хитозан в 1859 году (C. Rouget), хотя своё нынешнее название получил в 1894 г. (F. Hoppe-Seyler). В первой половине ХХ века к хитину и его производным был проявлен заслуженный интерес, в частности, к нему имели непосредственное отношение три Нобелевских лауреата: F. Fischer (1903) синтезировал глюкозамин, P. Karrer (1929) провёл деградацию хитина с помощью хитиназ, а W. H. Haworth (1939) установил абсолютную конфигурацию глюкозамина.
Хитин – линейный аминополисахарид, состоящий из N-ацетил-2-амино-2-дезокиси-D-гликопиранозных звеньев.

хитин
По химической структуре он близок к целлюлозе и только ей уступает по распространенности в природе. Хитин нерастворим в воде, разбавленных кислотах, щелочах, спиртах и других органических растворителях. Он растворим в концентрированных растворах соляной, серной и муравьиной кислот, а также в некоторых солевых растворах при нагревании, но при растворении он заметно деполимеризуется. В смеси диметилацетамида, N-метил-2-пирролидона и хлористого лития хитин растворяется без разрушения полимерной структуры.
Большая длина и ограниченная гибкость макромолекул являются предпосылками для образования биополимерами сложных надмолекулярных структур в тканях живых организмов. Для хитина основным элементом такой структуры являются фибриллы - высокоориентированные агрегаты макромолекул диаметром 25-50 нм, в свою очередь состоящие из микрофибрилл диаметром 2,5-2,8 нм. Такая структура обеспечивает выполнение важной биологической функции армирования (повышения механической прочности) содержащих хитин тканей.
Благодаря регулярности строения полимерной цепи хитина формируется высокоупорядоченная структура, обладающая признаками, характерными для кристаллического фазового состояния полимеров. При этом кристаллические области структуры хитина могут существовать в трех кристаллографических (структурных) модификациях, отличающихся расположением молекулярных цепей в элементарной ячейке кристаллита (явление, известное под названием полиморфизма). Так, посредством рентгеноструктурного анализа показано, что молекулярные звенья хитина имеют конформацию 4С1.
В зависимости от расположения полимерных молекул различают три формы структуры хитина - a, b и g. a-хитин представляет собой плотно упакованный, наиболее кристаллический полимер, в котором цепочки располагаются антипараллельно, он характеризуется самым стабильным состоянием. В b-хитине цепочки располагаются параллельно относительно друг друга, а в g-хитине две цепочки полимера направлены “вверх” относительно одной, направленной “вниз”. b и g-хитины могут превращаться в a-хитин [1].
Специфика полимерного состояния хитина, как и других высокомолекулярных соединений, обусловливает невозможность существования этого полимера как однофазной системы (полная кристалличность). Однако содержание кристаллических областей в хитине достаточно велико и составляет в зависимости от происхождения и способа выделения 60-85%. При этом фиксация взаимного расположения макромолекул хитина обеспечивается системой внутри - и межмолекулярных водородных связей: ОН-группа у С3 элементарного звена включена в водородную связь с атомом кислорода в цикле соседнего элементарного звена; ОН-группа у С6 может быть связана водородными связями как внутримолекулярно - с атомом кислорода гликозидной связи и (или) атомом азота ацетамидной группы, так и межмолекулярно - с ОН-группой у С6 соседней макромолекулы. При этом последняя может образовывать водородные связи с молекулами кристаллизационной воды.
Панцирь краба и кутикула насекомых играют роль внешнего скелета и выполняют защитные функции. Хитин, входящий в состав панциря ракообразных, образует волокнистую структуру, он связан с белками посредством пептидной связи деацетилированной аминогруппы с диаминомонокарбоновыми аминокислотами неароматического строения, имея вид хитин-белкового комплекса (ХБК).
Особым образом изменяется хитин под действием ферментов в организме морских крабов. В процессе линьки хитин панциря подвергается значительному разрушению и последующему восстановления. Участие в этом процессе специфических ферментов способствует протеканию синтеза и деградации хитина с исключительно большой скоростью. Хитинолитические ферменты имеют неодинаковый уровень активности в зависимости от физиологического состояния ракообразных. У крабов, например, хитиназа синтезируется постоянно, а синтез хитобиазы усиливается перед линькой и немедленно уменьшается после её окончания. У морских крабов сразу после линьки панцирь мягкий, эластичный, состоящий только из ХБК, но с течением времени происходит его упрочнение за счёт минерализации структуры ХБК в основном карбонатом кальция. Эта минерализация происходит в большей или меньшей степени в зависимости от вида животного.
Таким образом, панцирь краба построен из трёх основных элементов – хитина, играющего роль каркаса, минеральной части, придающей панцирю необходимую прочность и белков, делающих его живой тканью. В состав панциря входят также липиды, меланины и другие пигменты. Пигменты панциря ракообразных представлены, в частности, каротиноидами типа астаксантина, астацина и криптоксантина. В кутикуле взрослых насекомых хитин также ковалентно связан с белками типа артраподина и склеротина, а также большим количеством меланиновых соединений, которые могут составлять до 40% массы кутикулы. Кутикула насекомых отличается большой прочностью и в то же время гибкостью благодаря хитину, содержание которого от 30% до 50%. В клеточной стенке некоторых фикомицетов, например в итридиевых, хитин обнаруживается вместе с целлюлозой. Хитин у грибов, как правило, ассоциируется с другими полисахаридами, например b-1-3-глюканом, у членистоногих он связан с белками типа склеротина и меланинами.
Структурный компонент хитина N-ацетил-D-глюкозамин у бактерий, наряду с N-ацетилмурамовой кислотой, является компонентом клеточной стенки. В животном мире N-ацетилглюкозамин входит в состав мукополисахаридов (гликозаминогликаны) соединительной ткани (гиалуроновой кислоты, хондроитинсульфатов, гепарина), групповых веществ крови и других гликопротеинов. Остаток N-ацетил-D-глюкозамина обычно находится на восстановленном конце углеводных цепей животных гликопротеинов, образуя связь углевод – белок. Этим объясняется совместимость хитина и хитозана с живыми тканями. Наиболее распространённым типом связи в животных гликопротеинах является N-гликозидная связь, образуемая остатком N-ацетилглюкозамина и b-амидной группой аспаргина.
Хитозан является b-(1-4) - 2-амино-2дезокси-D-гликополисахаридом, т.е. аминополисахаридом, полученным при удалении ацетильной группы из положения С2 в хитине в результате обработки его в жестких условиях раствором щелочи, что позволяет заместить ацетильные группы хитина аминогруппами:
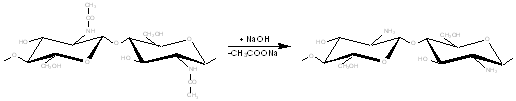
В зависимости от источника сырья и метода получения молекулярная масса хитозана колеблется в пределах 3·105-6·105.
Как и хитин, хитозан представляет собой аморфно-кристаллический полимер, для которого также характерно явление полиморфизма, причем количество структурных модификаций при переходе от хитина к хитозану увеличивается до 6. Сохранение при этом размеров элементарной ячейки кристаллита вдоль оси макромолекулы на уровне соответствующей характеристики для хитина (103 нм) свидетельствует о том, что конформация макромолекул при переходе от хитина к хитозану существенно не изменяется. В то же время в процессе деацетилирования хитина заметно уменьшается общая упорядоченность структуры (степень кристалличности снижается до 40-50%). Снижение степени кристалличности может быть обусловлено как аморфизацией структуры вследствие внутрикристаллитного набухания при деацетилировании, так и нарушением регулярности строения полимерной цепи в случае неполного отщепления N-ацетильных групп.
В отличие от хитина, получаемый при его деацетилировании хитозан растворяется даже в разбавленных органических кислотах, например в водном растворе уксусной кислоты. При этом для растворов хитозана, как и других полимеров, характерна существенная зависимость вязкости от концентрации (при увеличении концентрации раствора хитозана в 1-2% -ном растворе уксусной кислоты с 2 до 4% вязкость раствора увеличивается примерно в 30 раз). Появление в каждом элементарном звене макромолекулы свободной аминогруппы придает хитозану свойства полиэлектролита, одним из которых является характерный для растворов полиэлектролитов эффект полиэлектролитного набухания - аномального повышения вязкости разбавленных растворов (с концентрацией ниже 1 г/л) при уменьшении концентрации полимера. Этот эффект является следствием увеличения эффективного объема и асимметрии макромолекул в растворе в результате отталкивания одноименных зарядов, возникающих при протонировании аминогрупп [2,3].
Хитозан является биополимером относительно слабой основности (рКа~ 6,5). Он не растворяется в щелочных средах, однако его катионная полиэлектролитная природа в кислой среде обеспечивает взаимодействие с отрицательно заряженными синтетическими или природными полимерами. Этот катионный полиамин имеет высокий молекулярный вес линейного полиэлектролита, а также обладает вязкостью от высокой до низкой. Проявляет хелатные свойства, связывает переходные металлы, обладает высокой способностью к химической модификации благодаря наличию реактивных амино - и гидроксильных групп. Кроме того, хитозан является природным биополимером, который биологически совместим с тканями организма, биодеградирует до обычных компонентов организма (глюкозамин, N-ацетилглюкозамин), нетоксичен, в медицине проявляет себя как гемостатик, бактериостатик, фунгистатик, иммуномодулятор, оказывает антиопухолевый эффект и снижает уровень холестерина [4].
Способы получения хитозана
Как говорилось ранее, хитозан является аминополисахаридом, полученным при удалении ацетильной группы в хитине в результате обработки его в жестких условиях раствором щелочи, что позволяет заместить ацетильные группы хитина аминогруппами. Таким образом, стадии деацетилирования хитина всегда предшествует процесс его выделения из хитинсодержащего сырья. Хитин как нерастворимый полимер не поддается выделению из панциря напрямую. Для его получения необходимо последовательно отделить белковую и минеральную составляющие панциря, т.е. перевести их в растворимое состояние и удалить. Для получения хитина и его модификаций с воспроизводимыми характеристиками необходимо исчерпывающее удаление белковой и минеральной составляющих панциря. Все известные способы извлечения хитина из ПСС можно разделить на три основные группы:
- химическая обработка кислотами, щелочами, комплексонами и др.;
- методы биотехнологии, применение ферментных препаратов и протеолитических бактерий;
- электрохимический способ.
Деацетилирование хитина. Получение хитозана
В основе получения хитозана лежит реакция отщепления от структурной единицы хитина-N-ацетил-D-глюкозамина ацетильной группировки или реакция деацетилирования.
Транс-расположение в элементарном звене макромолекулы хитина заместителей (ацетамидной и гидроксильной групп) у С2 и С3 обусловливает значительную гидролитическую устойчивость ацетамидных групп, в том числе и в условиях щелочного гидролиза. Поэтому отщепление ацетамидных групп удается осуществить лишь в сравнительно жестких условиях - при обработке 40-49% -ным водным раствором NaOH при температуре 110-1400С в течение 4-6 часов. Однако и в этих условиях степень деацетилирования (доля отщепившихся ацетамидных групп в расчете на одно элементарное звено) не достигает единицы, то есть не обеспечивается количественное удаление этих групп, составляя обычно 0,8-0,9 [3].
Реакция ДА сопровождается одновременным разрывом гликозидных связей полимера, т.е. уменьшением молекулярной массы, изменением надмолекулярной структуры, степени кристалличности и т.д. Таким образом, хитозан представляет собой полидисперсный по молекулярной массе полимер D-глюкозамина, содержащий 5-15% ацетамидных групп, а также до 1% групп, соединенных с аминокислотами и пептидами [5].
Процесс ДА проводят обычно с помощью концентрированных щелочей при повышенных температурах. Первым опытом получения хитозана, было сплавление хитина с твердой щелочью при 1800С. Этим способом получали продукт со степенью деацетилирования (СД) 95%, но значительно деструктированный (до 20 единиц).
Наиболее распространено ДА растворами щелочей 30-50% -ной концентраций, поскольку оно является более мягким. ДА в водных растворах щелочей может обеспечить 100% -ную степень деацетилирования при использовании ступенчатого процесса и значительно менее деструктурирует хитозан. При получении хитозана в указанных условиях одновременно с реакцией ДА идет деструкция хитина, т.е. разрыв его цепей по гликозидным связям, что приводит к уменьшению молекулярной массы хитозана и снижению его вязкости [1,6,7]. Высокая устойчивость хитина к ДА объясняется наличием водородной связи между карбонильной группой и азотом амидной группы смежных цепочек хитина в мицелярной структуре. Для разрушения этой, весьма прочной связи, процесс ведут при высокой температуре (100-1600С). С увеличением температуры даже при невысокой концентрации щелочи (30%) степень ДА достигает почти предельного значения (98%), однако при этом снижается молекулярная масса, а, следовательно, и вязкость растворов полученного хитозана. Для сохранения молекулярной массы полимера предпочтительно снижать температуру обработки хитина [6].
Как уже отмечалось, структура хитина представляет собой кристаллическую решетку, в связи, с чем степени растворимости и набухания хитина в различных средах довольно низки. Степень измельчения хитина перед ДА важна для получения однородного продукта. Измельчение хитина облегчает доступ деацетилирующего агента внутрь структуры, благодаря чему достигается равномерное протекание процесса ДА и сопровождающей его деструкции. При использовании слишком крупных частиц хитина процесс ДА проходит не в полной мере, поверхностные слои таких частиц деацетилированы в большей степени, чем внутренние. При растворении в уксусной кислоте эти поверхностные слои образуют раствор, а внутренние слои частиц не полностью деацетилированные, только набухают. Такой неоднородный по СД хитозан может иметь ограниченное применение. В случае достаточно тонкого измельчения хитина все слои частиц деацетилируются в одинаковой степени, что приводит к получению более однородного продукта.
Важную роль в снижении степени деструкции хитина играет среда, в которой проводят реакцию ДА, т.е. присутствие в ней кислорода. Разработан ряд способов удаления кислорода из сферы реакции. Самый простой из них - плотная укладка и подпрессовка смоченного щелочью хитина с последующим вытеснением из тары остатков воздуха азотом и ее герметизацией. Применяется также барботирование реакционной смеси азотом, пропускание азота над поверхностью суспензии и др. Во всех случаях при ДА хитина в инертной среде отмечается повышение молекулярной массы и вязкости хитозана без снижения СД в противовес данным, полученным при деацетилировании хитина на воздухе.
Важным фактором при ДА хитозана является перемешивание реакционной массы. Известны способы получения хитозана и в реакторах с перемешиванием и в емкостях из различных материалов (включая полимерные) без перемешивания. В случае применения перемешивания необходимо учитывать консистенцию реакционной массы, которая определяется соотношением жидкой и твердой фаз. Оптимальным можно считать массовое соотношение хитин: раствор щелочи 1: 5-1: 12 в зависимости от качества хитина, взятого для обработки. Такая суспензия хорошо перемешивается в реакторе и не требует лишнего объема щелочи. [8]
Известен способ получения хитозана путём обработки хитина 50% -ным раствором едкого натра при температуре 105 – 110оС в течение 40 – 60 мин. Однако жёсткие условия являются недостатком данного способа деацетилирования. [9]
Известен способ получения хитозана из панциря морского краба, включаящий активацию сухого или влажного хитина путём измельчения в коллоидной мельнице, деацетилирование, помывку готового продукта и частичное обезвоживание с последующей сушкой, измельчение и таблетирование. Данный способ требует дорогостоящего оборудования и сложен в обслуживании. [10]
Существует способ получения хитозана из ракообразных путём деацетилирования, включаящий приготовление 50% -ного раствора едкого натра, охлаждение его до температуры 18 – 22оС, внесение сухого хитина в соотношении хитин: раствор щёлочи 1: 10 – 1: 15 до образования однородной суспензии и выдерживание последней при комнатной температуре в течение 5-20 суток. Однако данный способ предусматривает использование щёлочи высокой концентрации, что приводит к значительному расходу щёлочи и частичной деструкции целевого продукта. [11]
Известен также способ получения хитозана из хитинсодержащего сырья, в частности панциря краба, заключающийся в измельчении исходного сырья до фракции 49 – 2000 мкм, обесцвечивании его с помощью 0,1 N раствора гипохлорита натрия, двукратной деминерализации 6-7% -ной соляной кислотой при температуре 15-35оС в течение 1 часа при перемешивании. Модуль ванны составляет 7-8. при этом добавляют небольшое количество бутанола в качестве антивспенивателя. По окончании процесса деминерализации кислоту сливают через ложное днище аппарата. Далее проводится две стадии депротеинирования, после каждой из них также производят сцеживание маточного раствора. При этом первая стадия осуществляется 15-20%-ным раствором гидроксида натрия при температуре 85-95 о С, а вторая 5-6%-ным раствором гидроксида натрия с целью снижения деструкции добавляют боргидрид натрия. Деацетилирование проводят 43-45% -ным раствором гидроксида натрия при первоначальной температуре 113-115оС, которая через 15-30 мин снижается до 105-108оС. После каждого процесса (ДМ, ДП, ДА) осуществляют промывку сырья водой до рН 6,5. недостатком данного способа является большое количество стадий, использование дополнительных реагентов, таких как гипохлорит и боргидрид натрия и бутанол, которые являются токсичными и дорогостоящими веществами. Кроме того, хитозан, полученный таким способом, обладает недостаточно высокой степенью деацетилирования, которая составляет 82%. [12]
Задачей предложенного способа получения хитозана являлось устранение недостатков описанных способов, упрощение технологии, снижение себестоимости конечного продукта и повышение его качества.
Это достигается тем, что в способе получения хитозана, включающем измельчение природного хитинсодержащего сырья, загрузку его в реактор, деминерализацию 6-7% раствором соляной кислоты, депротеинирование гидроксидом натрия при температуре 85-95оС, деацетилирование раствором гидроксида натрия при нагреве, обесцвечивание и промывку водой после каждой сади до рН 6,5, проводят загрузку хитинсодержащего сырья, измельчённого до получения фракции размером 0,5 – 6 мм, одновременно в несколько реакторов. Деминерализацию проводят потоком раствора соляной кислоты при 85-95оС в течение 1,5 ч с рН контролем на выходе каждого реактора до выравнивания концентрации кислоты на выходе каждого реактора с концентрацией исходной кислоты путём непрерывной её подачи, депротеинирование проводят потоком 6-7% гидроксида натрия в течение 1,5 ч, далее осуществляют выгрузку обработанного сырья в автоклав, где проводят деацетилирование одновременно с обесцвечиванием 50% раствором гидроксида натрия при 130-140 о С в атмосфере инертного газа азота и в присутствии 5% -ного раствора пероксида водорода в количестве 3-5% от общего объёма смеси.
Деацетилирование происходит под действием 50% -ного раствора гидроксида натрия в течение 1 - 2 ч. при температуре 130 – 140оС в атмосфере инертного газа азота, что делает возможным получение хитозана с высокой степенью деацетилирования и молекулярной массой благодаря предотвращению термоокислительной деструкции цепи полимера. Полученный хитозан промывают водой до рН 6,5 и сушат при температуре 60 – 70оС.
Таким образом, предлагаемый способ отличается меньшей стадийностью. Также способ отличается более высокой эффективностью процессов, меньшими трудо - и энергозатратами. Способ позволяет повысить степень деацетилирования до 87-91%, а также предусматривает использование более доступного и дешёвого, в регионах, удалённых от моря.
Сушка хитозана. Измельчение и хранениеПосле ДА и отмывки до нейтрального значения рН хитозан представляет собой сильно гидратированный, набухший продукт с содержанием воды более 70%. Для предотвращения ороговения хитозан сушат при 50-550С. При сушке в условиях более высоких температур хитозан уплотняется, темнеет и теряет растворимость, что снижает возможность его использования. Наилучшим образом показывает себя сушка хитозана в псевдокипящем слое при 500С. Низкомолекулярный водорастворимый хитозан и олигосахариды сушат на распылительных и лиофильных сушилках. Воздушно-сухой хитозан содержит 8-10% воды.
Для использования хитозана, например, в фармации и парафармации в качестве субстрата для таблетирования и капсулирования необходимо измельчить его до размера частиц 100 - 200 мкм. Хитозан, сохраняя кристаллическую структуру хитина, плохо поддается измельчению, и поэтому для получения порошкообразного продукта его измельчают последовательно резанием, истиранием и ударно-сдвиговой деформацией, применяя для этого соответственно дезинтеграторы, мельницы и шаровые мельницы. Наибольшую трудность при измельчении представляет плохо высушенный или ороговевший хитозан, так как в этом случае он обладает пластичностью и плохо поддается измельчению [5].
В ряде случаев преимущества перед порошкообразной формой имеет гранулированная форма полимера. Переработка хитозана в гранулы может быть осуществлена различным способами: распылительным высушиванием низковязких растворов полимера; гранулированием под давлением порошкообразного полимера, содержащего пластификатор; осаждением полимера в виде капель из высоковязкого раствора; формированием сферических микрокапель из раствора полимера путем его эмульгирования в подходящей дисперсионной среде [30]. Два последних способа наиболее актуальны, поскольку они обеспечивают наибольшую аморфизацию полимера и получение композитных гранул при условии введения в формовочный раствор модифицирующих добавок.
В процессе хранения хитозана на свету наблюдается его потемнение до коричневого цвета, снижение растворимости. Особенно это относится к тонко измельченному, а также распылительно высушенному хитозану. Хитозан представляет собой гигроскопичный материал, порошковый хитозан может слеживаться при хранении в помещениях с повышенной влажностью или при перепадах температур. Поэтому хитозан хранят герметично укупоренным в светонепроницаемой упаковке (банки, пакеты, мешки) в сухих закрытых помещениях при комнатной температуре [5].
Применение хитина и хитозана
Как уже указывалось, хитин и хитозан по своему строению близки к целлюлозе - одному из основных волокнообразующих природных полимеров. Естественно поэтому, что, как и целлюлоза, эти полимеры и их производные обладают волокно - и пленкообразующими [13-15] свойствами. Благодаря биосовместимости с тканями человека, низкой токсичности, способности усиливать регенеративные процессы при заживлении ран, биодеградируемости такие материалы представляют особый интерес для медицины.
При лечении гнойных и ожоговых ран широкое применение приобрели ферменты, эффективность использования которых может быть повышена за счет их включения в структуру волокон и губок. Такие полимеры, как хитин, хитозан, карбоксиметилхитин, благодаря широкому набору функциональных групп обеспечивают возможность образования между полимером-носителем и ферментом связей различной прочности, что создает предпосылки для регулирования активности и стабильности фермента, скорости его диффузии в рану [16,17,18].
В медицине для лечения и профилактики тромбозов используется природный антикоагулянт крови - гепарин, по химическому строению являющийся смешанным полисахаридом. Наиболее близкий его структурный аналог - сульфат хитозана также обладает антикоагулянтной активностью, возрастающей при увеличении степени сульфатирования [19]. Возможность реализации синергического эффекта (усиления активности гепарина при введении добавок сульфата хитозана) делает это соединение перспективным для создания лекарственных препаратов антикоагулянтного и антисклеротического действия.
N - и О-сульфатированные производные частично деацетилированного карбоксиметилхитина не только препятствуют свертыванию крови благодаря селективной адсорбции антитромбина, но и резко уменьшают интенсивность деления раковых клеток.
Еще одна возможность использования хитина, хитозана и их производных (карбоксиметилхитина, карбоксиметилхитозана, сукцинилхитозана) - создание биодеградируемых носителей фармацевтических препаратов (антибиотиков, антивирусных, противоопухолевых и антиаллергенных препаратов) в виде пленок (мембран). Применение таких пленок создает условия для выделения лекарственных средств, обеспечивая эффект пролонгирования их действия [20-26].
Одной из уникальных биологических активностей хитозана является его способность индуцировать устойчивость к вирусным заболеваниям у растений, ингибировать вирусные инфекции у животных и предотвращать развитие фаговых инфекций в зараженной культуре микроорганизмов [27,28].
Образование комплексов полимерными лигандами с различными металлами находит все более широкое применение в аналитической химии, хроматографии, биотехнологических процессах. Полимерные комплексообразователи, в том числе хитин, хитозан и их производные, например карбоксиметиловые эфиры, могут рассматриваться как реальная альтернатива традиционным методам очистки сточных вод промышленных предприятий от соединений металлов, используемых для нанесения защитных покрытий (никель, хром, цинк), а также от таких металлов, как ртуть и кадмий, способных аккумулироваться живыми организмами. Наличие электронодонорных амино - и гидроксильных групп, широкие возможности введения различных ионогенных групп кислотного и основного характера делают производные хитина и хитозана весьма перспективными для использования в хроматографии при разделении и очистке биологически активных соединений (нуклеиновых кислот и продуктов их гидролиза, стероидов, аминокислот) [29-31].
В фотографических процессах, связанных с быстрым проявлением изображения, используют такие важные характеристики хитозана, как его пленкообразующие свойства, поведение в системах, содержащих желатин и комплексы серебра, обеспечивающее отсутствие поперечной (в слоях пленки) диффузии красителя, оптические характеристики полимера.
Весьма перспективно использование хитозана в бумажной промышленности: благодаря большей прочности при водных обработках ионных связей, образующихся при нанесении хитозана на целлюлозное волокно при формировании бумаги, по сравнению с существующими в обычной бумаге водородными связями заметно возрастает прочность бумажного листа, особенно в мокром состоянии. При этом одновременно улучшаются и другие важные свойства (сопротивление продавливанию, излому, стабильность изображения) [32].
В последнее время все большее внимание уделяется исследованиям процессов образования, изучению свойств и возможностей практического применения особого класса продуктов химических превращений полимеров - интерполимерных комплексов. Эти соединения, образующиеся при взаимодействии макромолекул противоположно заряженных полиэлектролитов, характеризуются высокой гидрофильностью, что позволяет использовать их в качестве эффективных флокулянтов, структурообразователей, а в виде пленок в качестве полупроницаемых мембран и покрытий, в том числе в медицине [33,34].
Использование в качестве компонента интерполимерного комплекса сравнительно жесткоцепного хитозана, способного благодаря наличию ионогенных групп к образованию межмолекулярных ион - ионных и ион - дипольных связей, обеспечивает возможность улучшения физико-механических свойств получаемых пленок. Одним из направлений успешного использования таких пленок могут быть первапорационные процессы разделения водно-органических смесей. Так, пленка на основе интерполимерного комплекса хитозан - полиакриловая кислота в процессе разделения методом первапорации водно - изопропанольной смеси не уступает по транспортным характеристикам пленкам из традиционных материалов (ацетат целлюлозы, поливиниловый спирт), заметно превосходя их по селективности [35].
Благодаря своим уникальным свойствам хитозан нашел применение в пищевой промышленности. Способность хитозана осветлять технологические жидкости используется в производстве соков, пива, вин, молочной сыворотке, промывных вод фаршевого производства, подпрессовых бульонов и других низкоконцентрированных жидкостей, содержащих мелкодисперсные частицы органических соединений различной природы. Проявление свойств сорбента и частично эмульгатора обусловливает липофильный эффект хитозана.
В технологии формованных изделий хитозан используется как структурообразующий агент, повышающий значения реологических характеристик пищевых масс. Хитозан обладает редким свойством соединять в упорядоченную структуру фрагменты материалов различного влагосодержания: сухих, с промежуточной влажностью и высоковлажных.
Бактерицидное действие хитозана позволяет использовать его при хранении различных видов пищевой продукции. Наиболее широко показано защитное действие пленок из хитозана, нанесенных на поверхность плодов и овощей - яблок, апельсинов, земляники, томатов, перца. Поскольку плоды и овощи остаются живым организмом, будучи отделенными от материнского растения, они обладают определенным иммунитетом и в них проходят обменные процессы.
Однородные, гибкие, не дающие трещин хитозановые пленки, обладают избирательной проницаемостью, подобно другим полимерным покрытиям, на поверхности плодов и овощей играют роль микробного фильтра и/или регулируют состав газов у поверхности и в толще тканей, влияя тем самым на активность и тип дыхания, что в целом способствует продлению сроков хранения растительного сырья. Помимо этого покрытие из хитозана вызывает некоторые морфологические изменения в возбудителях порчи томатов и перца. Пленка хитозана, способствующая продлению срока хранения мороженого тунца, вероятнее всего, играет роль барьера, регулирующего проникновение кислорода воздуха и испарение воды.
Хитозан, присутствуя в составе пищевых продуктов, положительно влияет на их биологическую ценность. Кроме того, хитозан относится к диетическим волокнам, которые не усваиваются организмом человека, а в кислой среде желудка образует раствор высокой вязкости. Как компонент пищи или как лечебно профилактический препарат хитозан проявляет свойства энтеросорбента, иммуномодулятора, антисклеротического и антиартрозного фактора, регулятора кислотности желудочного сока, ингибитора пепсина и др. [36].
Хитозан отличается от большинства природных и химически синтезированных гелеобразователей, применяемых в косметике, тем, что при биологических значениях рН они имеют положительный заряд, т.е. является поликатионом (если рН < б). В этом заключается их преимущество перед полианионными гелеобразователями, отрицательно заряженными при биологических значениях рН.
Положительно заряженный хитозан взаимодействуют с отрицательно заряженной кожей и волосами. На этой их биоадизивной способности основано их применение в составе косметических средств.
Кроме того, биосовместимость хитозана с растительными экстрактами и другими компонентами, используемыми в качестве полезных добавок и биологически активных ингредиентов, открывает перспективы их использования для разработки новых средств для введения активных компонентов в косметические рецептуры. Примером может служить технология создания гранул, внутри которых содержатся биологически активные субстанции, нестабильные в обычных условиях косметических производств и при хранении готовых изделий.
Применение хитозана в средствах для волос, основано на их способности образовывать пленки при взаимодействии с кератинами волос. Пленки хитозана более стабильны при повышенной влажности, чем пленки, образованные синтетическими полимерами, поэтому в составе средств для укладки волос имеют значительные преимущества перед традиционными фиксаторами. Хитозан улучшает и другие потребительские качества средств для ухода за волосами, улучшает расчесываемость, уменьшают статический заряд, увеличивают блеск волос. Они уже давно используются в качестве кондиционирующих добавок в шампунях и кондиционерах.
При разработке средств ухода за кожей используются такие свойства хитозана, как способность образовывать прозрачную защитную пленку, предохраняющую кожу от потери влаги.
Другое интересное свойство хитозана - способность служить матрицей для активных ингредиентов.
Потенциал использования хитозана в средствах ухода за кожей определяется его уникальной химической структурой, сходной с целлюлозой.
Фракция молекул, содержащих оставшиеся N-ацетил группы (5-24%) определяет способность хитозана к гидрофобным взаимодействиям. Гидрофильность и гидрофобность хитозана позволяет использовать его в качестве стабилизаторов эмульсий. Благодаря высокомолекулярной массе и линейной структуре молекулы, хитозан является отличным средством повышения вязкости эмульсий при низких значениях рН.
Хитозан, как и другие гидроколлоиды, способен удерживать воду и служить увлажняющим компонентом косметических средств [37].
1.2. Характеристика исходного сырья, вспомогательных материалов и готовой продукции Характеристика сырьяДля проведения испытаний по получению хитозана был использован панцирь королевского камчатского краба. Панцирь построен из трех основных элементов – хитина, играющего роль каркаса, минеральной части, придающей панцирю необходимую прочность, и белков, делающих его живой тканью (табл.1).
Таблица 1. Характеристика химического состава панциря в%.
|
Содержание влаги, |
Белок | Липиды |
Минеральные вещества |
Хитин |
| 7-8 | 21-27 | 0,2-0,4 | 34-39 | 26-32 |
Таблица 2. Перечень нормативных документов используемых материалов
| Используемые материалы | ГОСТ, ТУ | Внешний вид | Применение |
| NaOH | ГОСТ 4328-77 | Бесцветные кристаллы (технический продукт – белая непрозрачная масса) | Применяют в химической, текстильной, мыловаренной и многих других отраслях промышленности. |
| H2O2 | ТУ2611-003-00207787-00 | Бесцветная вязкая жидкость | Применяют как окислитель, инициатор полимеризации, для отбеливания волос, меха, шелка, в медицине как антисептическое, кровоостанавливающее и дезодорирующее средство. |
| Ca(OH) 2 | ГОСТ 9262-77 | Бесцветные кристаллы (технический продукт называется гашёная известь) | Применяют как вяжущий материал в строительстве, в сахарной промышленности, в производстве стекла, для раскисления почв, умягчения воды. |
| HCl | ГОСТ 3118-77 | Бесцветная, «дымящая» на воздухе жидкость (техническая соляная кислота желтоватая из-за примесей Fe, Cl2 и др.) | применяют в гидрометаллургии и гальванопластике, для очистки поверхности металлов при паянии и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. |
| N2 | ГОСТ 9293-74 | Инертный газ без цвета и запаха | В промышленности газ азот используют главным образом для получения аммиака. Как химически инертный газ азот применяют для обеспечения инертной среды в различных химических и металлургических процессах, при перекачке горючих жидкостей. |
Для определения свойств полученного хитозана были проведены физико-химические, радиологические и микробиологические испытания. Для оценки уровня свойств полученного хитозана были использованы показатели, заложенные в технические условия на пищевой хитозан (ТУ 9289-067-00472124-03). В приложении представлены соответствующие акты испытаний, а общие результаты представлены ниже в таблицах
Органолептические показатели
Внешний вид: чешуйки размером 1-3 мм.
Цвет: кремовый с желтоватым оттенком.
Вкус: свойственный данному продукту, без постороннего привкуса.
Запах: свойственный данному продукту, без постороннего запаха.
Таблица 3. Физико-химические свойства хитозана
| Наименование показателя | Ед. изм. | Норма по ТУ | Результаты испытаний |
| Молекулярная масса | кДа | - | 120 |
| Степень деацетилирования | % | - | 87 |
| Массовая доля влаги | % | Не более 10,0 | 9.4 |
| Массовая доля минеральных веществ | % | Не более 0,7 | 0,33 |
|
рН 1% раствора хитозана в 2% уксусной кислоте |
Ед. рН | Не более 7,5 | 3,85 |
| Массовая доля нерастворимых веществ в 3% р-ре уксусной кислоты | % | Не более 0,2 | 0,18 |
| Токсичные элементы | |||
| Ртуть | мг/кг | Не более 0,03 | 0,005 |
| Мышьяк | мг/кг | Не более 0,2 | 0,007 |
| Свинец | мг/кг | Не более 1,0 | 0,31 |
| Кадмий | мг/кг | Не более 0,1 | 0,012 |
| Пестициды | |||
| ГХЦГ (α,β,γ,-изомеры) | мг/кг | Не более 0,5 |
Не обнаружено |
| ДДТ и его метаболиты | мг/кг | Не более 0,02 | Не обнаружено |
| Гептахлор | мг/кг | Не допускается | Не обнаружено |
| Алдрин | мг/кг | Не допускается | Не обнаружено |
| Радиологические испытания | |||
| Цезий 137 | Бк/кг | 200 | 28,0 |
| Стронций 90 | Бк/кг | 100 | 8,0 |
| Микробиологические показатели | |||
| Количество мезофильных аэробных и факультативно анаэробных микроорганизмов, КОЕ/г | Не более 5*104 КОЕ/г | 0 | |
| БГКП (колиформы) | не допускаются в 0,1 г | Не выделены | |
| E. coli | не допускаются в 1,0 г | Не выделены | |
|
Патогенные, в том числе сальмонеллы |
не допускаются в 25 г | Не выделены | |
| Дрожжи, плесени | Не более 100 КОЕ/г | Не выделены |
Таким образом, полученные результаты свидетельствуют о достаточно высоком качестве полученного хитозана. Большинство приведенных показателей существенно отличаются от допустимых значений в лучшую сторону, что обуславливает широкую сферу его дальнейшего практического применения, в том числе и в пищевой промышленности.
1.3. Методы исследованияИсследование процесса деминерализации и депротеинирования
Взвешивали несколько проб измельчённого панциря морского краба одинаковой массы. Для определения параметров деминерализации заливали пробы растворами соляной кислоты квалификации ХЧ концентрацией 1%, 2%, 3%, 4%, 5%, 6%, 7%, и выдерживали по 2 часа при t=250С и t=850C.
Для определения параметров депротеинирования готовили несколько проб деминерализованного сырья одинаковой массы и заливали раствором NaOH квалификации ХЧ концентрацией 1%, 2%, 3%, 4%, 5%, 6%, 7%, после чего смесь выдерживали в течение 2 часов при t=250С и t=850C.
Обработанный панцирь рака подвергали деацетилированию путём взаимодействия сырья с 50% -м раствором NaOH при температуре t=130-1400С в течение 1,5 часа в присутствии 3-5% -го раствора пероксида водорода в количестве 3-5% от общего объема смеси.
Степень деминерализации (депротеинирования) считали по формуле:
Х= 100 ∙ (М1 – М2) /М1, (г)
Где Х – степень деминерализации (депротеинирования),%;
М1 - масса панциря до деминерализации (депротеинирования), г;
М2 - масса панциря после деминерализации (депротеинирования), г.
Определение молекулярной массы хитозана
Молекулярную массу хитозана определяли вискозиметрически по стандартной методике. Растворы концентрации 0,05 и 0,5 г/дл готовили растворением навески порошка полимера в ацетатном буфере (0,33 М СН3СООН + 0,2 М СН3СOONa) в течение одних суток. Использовали ледяную уксусную кислоту и уксуснокислый натрий квалификации ХЧ. Измерения проводили при 250С в капиллярном вискозиметре Уббелоде, диаметр которого равен 0,54 мм. Расчёт ММ проводили по уравнению Марка-Куна-Хаувинка с константами К и α из работы ([h] =К ∙ Мα):
![]() ,
,
где [h] -характеристическая вязкость раствора, дл/г,
М – молекулярная масса.
1.4. Описание технологического процессаТехнологический процесс получения хитозана состоит из следующих стадий.
Деминерализация морского краба соляной кислотой, в результате чего происходит растворение с последующим вымыванием минеральных соединений, содержащихся в панцире.
Депротеинирование, целью которого является удаление из панциря белков и липидов. Для этого панцирь обрабатывается гидроксидом натрия. Вследствие этого процесса получается хитин, который имеет структурную формулу:
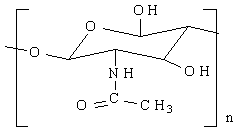
хитин
Деацетилирование хитина в присутствии горячей щёлочи с превращением в хитозан:
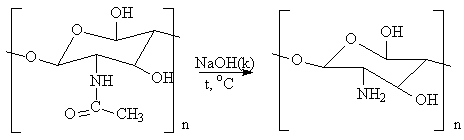
хитин хитозан
Деацетилирование позволяет получить растворимый полимер D-глюкозамина, хитозан, важнейшей характеристикой которого является степень деацетилирования (СДА), определяемая как отношение количества звеньев D-глюкозамина к N-ацетил-D-глюкозамина. СДА характеризует растворимость хитозана в растворе кислоты, а растворяться хитозан начинает при СДА 70%. Деацетилирование проводили в 50% растворе NaOH при 130оС, варьируя продолжительность процесса (рис.1). Реакция деацетилирования сопровождается одновременным разрывом гликозидных связей полимера. Таким образом, хитозан представляет собой полидисперсные по молекулярной массе полимер D-глюкозамина, содержащий 5-15% ацетамидных групп, а также до 1% групп, соединённых с аминокислотами и пептидами.
С увеличением температуры снижается молекулярная масса хитозана, для сохранения которой предпочтительно снижать температуру обработки хитина. Наибольшая скорость реакции деацетилирования наблюдается в течение первого получаса щелочной обработки. За это время хитин деацетилируется примерно на 80% при условии обработки его 50% щелочью при 130оС. Далее скорость реакции значительно замедляется и к 45 минутам степень деацетилирования достигает 86%. Таким образом, длительная обработка не приводит к резкому повышению степени деацетилирования, в то время как процесс деструкции происходит на всём протяжении процесса.
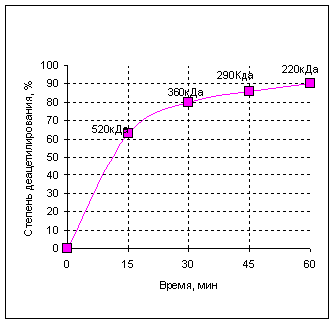
Рис 1. Зависимость степени деацетилирования от продолжительности щелочной обработки хитина.
Примечание: над точками приведены значения молекулярной массы хитозана в зависимости от продолжительности процесса деацетилирования.
Панцирь морского краба подаётся в измельчитель 1, после которого в измельчённом виде, ссыпается в загрузочный бункер 2, который снабжён ворошителем 3 для предотвращения слёживания исходного продукта. Секторным дозатором 4 материал подаётся на ленточный транспортёр 5, который, двигаясь по горизонтали, распределяет сырьё по диффузорам 7-1, 7-2, 7-3. Диффузоры снабжены откидным днищем, над которым находится решётка. Твёрдый материал распределяется над решёткой. Выгрузка материала происходит через ложное днище. Из бункера-хранилища, с помощью насоса 12 прокачивается через диффузоры соляная кислота 7%, которая подогревается в бункере хранилище через обогревающую рубашку, в которой циркулирует водяной пар с температурой 120-130 0С, что обеспечивает нагрев соляной кислоты до 85-95 0С.
После обработки соляной кислотой выключается насос 12 и включается насос 13, который прокачивает воду через диффузоры и обеспечивает промывку сырья до рН=6-6,5. После окончания промывки выключается насос 13, включается насос 14 и из бункера хранилища, снабжённого обогревающей рубашкой, через которую циркулирует водяной пар и нагревает содержимое бункера до 85-95 0С (содержимым является раствор NaOH 7%) в диффузоры прокачивается раствор NaOH, в результате чего происходит депротеинирование деминерализованного сырья. После этого также проводится промывка водой через насос 13. Работать насосы 8-2, 8-2, 8-3 и вентили 12, 13 и 14 могут только по одному.
Хитин выгружается на ленточный транспортёр 9, на котором осуществляется измерение массы продукта, который после этого поступает в реактор. Он также имеет решётку, откидное днище и тихоходную мешалку якорного типа. Из бункера хранилища 10, снабжённого обогревающей рубашкой, в которой циркулирует горячий водяной пар, в реактор нагнетается концентрированный раствор NaOH (65-75%) предварительно нагретый до 85-95 0С. Из бункеров 8-1, 8-2 и 8-3 в реактор подаётся соответственно азот - для предотвращения термоокислительной деструкции, перекись водорода - для получения светлоокрашенного хитозана.
Таким образом, предлагаемый способ отличается меньшей стадийностью, поскольку предусматривает однократное проведение стадий деминерализации и депротеинирования. Также способ отличается высокой эффективностью процессов, низкими трудо- и энергозатратами (процесс может быть легко автоматизирован). Он обеспечивает достаточно высокое качество конечного продукта. Доступность реагентов, грамотное аппаратурное оформление и организация нейтрализации кислотно– щелочных стоков с последующей регенерацией и рециклом отходов, может повлиять на себестоимость продукта, существенно снижая её. Особенно актуален такой подход при организации крупнотоннажных производств. Способ позволяет получать хитозан со степенью деацетилирования до 87 – 91%, молекулярной массой - от 250 кДа до 400 кДа и влажностью – 8-10%.
1.5. Основные параметры технологического процессаКонцентрация NaOH составляет 50%
Температура – 130оС
Концентрация Н2О2 составляет 1% от общей массы смеси
Концентрация Ca(OH) 2 составляет 1% от общего объёма смеси
Продолжительность процесса – 1 час.
1.6. Техническая характеристика основного технологического оборудования| Поз. | Обозначение | Наименование | Кол. |
Наименова- ние и марка материала |
Приме- чание |
| 1 | Реактор | 1 | |||
| 2 | Сушильная | 1 | |||
| установка | |||||
| 3 | Диффузор | 1 | |||
| 4 | Измельчитель | 1 | |||
| 5 | Загрузочный | 1 | |||
| бункер | |||||
| 6 | Дозатор секторный | 1 | |||
| 7 | Ленточный | 1 | |||
| транспортер | |||||
| 8 | Бункер- | 2 | |||
| хранилище | |||||
| 9 | Насос | 5 | |||
| 10 | Шнековый | 1 | |||
| питатель |
| Изм | Лист | № докум. | Подп. | Дата | Технология получения полисахарида хитозана из хитина, выделяемого из панцирей ракообразных | Лит. | Масса | Масштаб | |||
| Разраб. | Уткина С. | ||||||||||
| Провер. | Абдуллин В.Ф. | ||||||||||
| Т. контр. | Лист | Листов | |||||||||
| Рук. | |||||||||||
| Н. контр. | |||||||||||
| Утв. | |||||||||||
Материальный баланс на 1 кг хитозана
В панцире ракообразных содержится 35% хитина, который можно превратить в хитозан, следовательно для получения 1 кг хитозана требуется сырья: 1 кг: 35% как х кг: 100% ® х = 1*100/35 = 2,8 кг.
На деминерализацию 1 кг сырья требуется 5 литров 6% HCl, т.е. на деминерализацию 2,8 кг сырья требуется: 2,8*5 = 14 л.
Поскольку мы используем HCl с концентрацией 36,2% и плотностью r = 1,6 г/см3, то для приготовления 6% раствора требуется:
С1V1 = C2V2
6% * 14 литров = 36,2% * х литров, следовательно требуется 2,3 литров 36,2% -ой HCl и 11,7 литров воды.
М (HCl) = r (HCl 36,2%) * V (HCl)
М (HCl) = 1180 *2,3 = 2714 кг.
После обработки сырья HCl масса панциря уменьшается на 50% ® на депротеинирование поступает:
М = 2,8 – 1,4 = 1,4 кг.
На дерпотеинирование 6% -м NaOH требуется 5 литров на 1 кг.
Следовательно, в перерасчёте на 1,4 кг: 1,4 * 5 = 7 литров.
r (NaOH) при 6% = 1,055 кг/м3, следовательно масса этого раствора составляет 1,055 * 7 = 7,4 кг. Для приготовления 7,4 кг 6% NaOH требуется
7,4 * 100 = х * 6, т.е.0,44 кг
После депротеинирования масса сырья уменьшается до 1,1 кг.
На депротеинирование 1 кг хитина требуется 3 литра 50% -го NaOH, следовательно для деацетилирования 1,26 кг хитина требуется: 3 * 1,26 = 3,78 литра.
r (NaOH) при 50% = 1,525 г/см3
М(NaOH) = r(NaOH 50%) * V(NaOH) ® V(NaOH) = 1525 * 3,78 = 5764,5 кг
После деацетилирования масса хитозана составляет 1 кг.
Заключение
На основании полученных результатов можно сделать вывод, что данная технология получения хитозана является эффективной. Хитозан полученный из панциря морских крабов выгодно отличается от промышленного хитозана высоким уровнем свойств. А именно: степень деацетилирования (СД) равная 87-91% является одним из основных показателей свойств хитозана и чем она больше, тем лучше хитозан при условии достаточно высокой молекулярной массы, она составила 150-300 кДа, что тоже является хорошим результатом. Так же способ отличается высокой эффективностью процессов, низкими трудо - и энергозатратами. Выявлено соответствие ХТЗ из панциря рака техническим условиям на пищевой хитозан, который при этом выгодно отличается от предельно допустимых характеристик, заложенных в ТУ.
Таким образом, разработанная технология обеспечивает получение хитозана высокого качества и из доступного сырья, который способен конкурировать на современном рынке, а также удовлетворить потребности потребителей.
Список используемой литературы
1. Хитин и хитозан. Получение, свойства и применение / под ред.К.Г. Скрябина, Г.А. Вихоревой, В.П. Варламова. – М.: Наука, 2002. – 368 с. – ISBN 5-02-006435-1.
2. Гальбрайх, Л.С. Хитин и хитозан: строение, свойства, применение / Л.С. Гальбрайх // Соровский образовательный журнал. – 2001. – Т.7, № 1. С.51–56.
3. Быкова, В.М. Сырьевые источники и способы получения хитина и хитозана: Хитин, его строение и свойства / В.М. Быкова, С.В. Немцев // Хитин и хитозан. Получение, свойства и применение. – М.: Наука, 2002. – C.7-23.
4. Маслова, Г.В. Влияние вида хитинсодержащего сырья на физико-химические свойства хитиновых биополимеров, полученных с помощью электрохимически активированных / Г.В. Маслова и [др] // Материалы Шестой Междунар. Конф «Новые достижения в исследовании хитина и хитозана», Москва – Щелково, 22-24 октября 2001г. – М.: ВНИРО, 2001. – С.35-38.
5. Куприна, Е.Э. опытно-промышленная установка для получения хитин-минерального комплекса «Хизитэл» электрохимическим способом / Е.Э. Куприна и [др]] // Материалы Восьмой Междунар. конф. «Современные перспективы в исследовании хитина и хитозана», Казань 12-15 июня 2006 г. – М.: ВНИРО, 2006. – С.34-37.
6. Общая химическая технология / под ред. И.П. Мухленова. - М.: Высшая школа, том 1, 1984. – 255 с.
7. Гамзазаде, А.И. Некоторые особенности получения хитозана / А.И. Гамзазаде, А.И. Скляр, С.В. Рогожин // Высокомолекулярные соединения. – 1985. – Т.27А, №6. – С.1179-1184.
8. Пат. 2087483 РФ, МПК 6 С 08 В37/08. Способ получения хитозана/ В.В. Сова, Д.Б. Фрайманд, В.В. Банников, Ф.И. Львович. №93055356/25; Заявлено 21.12.93; Опубл. 20.08.97 // Изобретения. -1997. -№23. -с.92.
9. Пат.2116314 РФ, МПК 6 С08 В37/08. Способ получения хитозана /Г.И. Касьянов, О.И. Квасенков, А.И. Николаев, Е.Е. Касьянова. - №97104789/04; Заявлено 26.03.97. Опубл.27.07.98. // Изобретения. - 1998. -№21. -с.220.
10. Пат.2117673 РФ, МПК 6 С 08 В37/08. Способ получения хитозана/ А.В. Иванов, О.Р. Гартман, А.В. Цветков, Е.Б. Полторацкая // РЖ Химия. -1999. -№7. -7Ф47П.
11. Пат. 2073017 РФ, МПК 6 С 08 В37/08. Способ получения хитозана/ В.В. Банников, Ф.И. Львович, Д.Б. Фрайманд // РЖ Химия. -1998. -№13. -13Ф28П.
12. Пат.2139887 РФ, МПК 6 С 08 В37/08. Способ получения хитозана/ С.И. Шиш, Г.В. Винокурова. - №99104475/04; Заявлено 26.03.98; Опубл.27.07.99 // Изобретения. –1999. -№29. -с.297.
13. Степнова Е.А. биологически активные амфифильные производные хитозана / Е.А. Степнова и [др] // Химические волокна. – 2005. - №6. – С.57-58.
14. Базт, М.Р. Образование амидных связей в карбоксиметиловом эфире хитозана / М.Р. Базт, Г.А. Вихорева, Л.С. Гальбрайх // Химические волокна. – 1990. - №5. – С.5-6.
15. Вихорева, Г.А. Строение и кислотно-основные свойства карбоксиметилового эфира хитозана / Г.А. Вихорева и [др] // Высокомолекулярные соединения. – 1989. – Т.31А. - №5. – С.1003-1007.
16. Гладышев, Д.Ю. Строение и фракционный состав карбоксиметилового эфира хитозана / Д.Ю. Гладышев и [др] // Высокомолекулярные соединения. – 1990. – Т.32Б. - №7. – С.503-505.
17. Чирков, С.Н. Противовирусные свойства хитозана: Хитин, его строение и свойства / С.Н. Чирков // Хитин и хитозан. Получение, свойства и применение. – М.: Наука, 2002. – C.327-338.
18. Озерковская О.Л. Хитозан как элиситор индуцированной устойчивости растений: Хитин, его строение и свойства / О.Л. Озерковская, Н.И. Васюкова, С.В. Зиновьева // Хитин и хитозан. Получение, свойства и применение. – М.: Наука, 2002. – C.339-345.
19. Шамшурин, Д.В. Хроматографические свойства силикагелей, модифицированных хитозаном и его производными / Д.В. Шамшурин, Е.Н. Шаповалова, О.А. Шпигун // Вестник Московского университета. – 2004. – Сер.2. – Химия. – Т.45. - №3. – С.180-185.
20. Горовой, Л.Ф. Сорбционные свойства хитина и его производных: Хитин, его строение и свойства / Л.Ф. Горовой, В.Н. Косяков // Хитин и хитозан. Получение, свойства и применение. – М.: Наука, 2002. – C.217-246.
21. Лопатин, С.В. Хитозан в хроматографии: Хитин, его строение и свойства / С.В. Лопатин // Хитин и хитозан. Получение, свойства и применение. – М.: Наука, 2002. – C.247-253.
22. Роговина, С.З. Исследование целлюлозно-хитозановых смесей, полученных в условиях сдвиговых деформаций / С.З. Роговина и [др] // Высокомолекулярные соединения. – 2000. – Т.42А. - №1. – С.10-15.
23. Алексеев, В.Л. Бессолевые растворы хитозана: термодинамика, структура, баланс межмолекулярных сил / В.Л. Алексеев, Г.А. Евмененко // Высокомолекулярные соединения. – 1999. – Т.41А. - №9. – С.1487-1497.
24. Агеев, В.П. Получение и свойства пленок хитозана и пленок полиэлектролитных комплексов хитозана и карбоксиметилхитина / Е.П. Агеев и [др] // Высокомолекулярные соединения. – 1998. – Т.40А. - №7. – С.1198-1204.
25. Скорикова, Е.Е. Свойства интерполиэлектролитных комплексов хитозана и полиакриловой кислоты / Е.Е. Скорикова и [др] // Высокомолекулярные соединения. – 1996. – Т.38А. - №1. – С.61-65.
26. Сафронова, Т.М. Применение хитозана в производстве пищевых продуктов: Хитин, его строение и свойства / Т.М. Сафронова // Хитин и хитозан. Получение, свойства и применение. – М.: Наука, 2002. – C.346-359.
27. Албулов, А.И. Хитозан в косметике: Хитин, его строение и свойства / А.И. Албулов, А.Я. Самуйленко, М.А. Фролова // Хитин и хитозан. Получение, свойства и применение. – М.: Наука, 2002. – C.360-363.
28. Вихорева, Г.А. Изучение фракционного состава хитозана, полученного твердофазным и суспензионным методами / Г.А. Вихорева и [др] // Высокомолекулярные соединения. – 1996. – Т.38Б, №10. – С.1781-1785.
29. Вольфсон, С.А. Твердофазное деформационное разрушение и измельчение полимерных материалов. Порошковые технологии / С.А. Вольфсон, В.Г. Никольский // Высокомолекулярные соединения. – 1994. – Т.36Б, №6. – С.1040-1056.
30. Акопова, Т.А. Образование хитозана из хитина в условиях сдвиговых деформаций / Т.А. Акопова и [др] // Высокомолекулярные соединения. – 1990. – Т.33Б, №10. – С.735-737.
31. Роговина, С.З. Получение целлюлозно-хитозановых смесей под действием сдвиговых деформаций в присутствии сшивающих агентов / С.З. Роговина и [др] // Высокомолекулярные соединения. – 2000. – Т.42А, №9. – С.1489-1494.
32. Миронов, А.В. Получение гранулированного хитозана / А.В. Миронов и [др] // Химические волокна. – 2005. – №1. – С.26-29.
33. Илларионова, Е.Л. Волокнистые, пленочные и пористые материалы на основе хитозана / Е.Л. Илларионова и [др] // Химические волокна. – 1995. - №6. – С.18-22.
34. Гальбрайх, Л.С. Модифицированные волокнистые и пленочные материалы / Л.С. Гальбрайх // Химические волокна. – 2005. - №5. – С.21-27.
35. Бао Чи-Мин. Использование хитина для производства искусственного волокна / Бао Чи-Мин // Химические волокна. – 1960. - №3. – С.39-41.
36. Кильдеева, Н.Р. Получение материалов медицинского назначения из растворов биосовместимых полимеров / Н.Р. Кильдеева, Л.С. Гальбрайх, Г.А. Вихорева // Химические волокна. – 2005. - №6. – С.21-24.
37. Вихорева, Г.А. Исследование композиций целлюлоза-хитозан. Твердофазная модификация, реология, пленки / Г.А. Вихорева и [др] // Химические волокна. – 2000. - №6. – С.14-18.
38. Будовская, К.Э. Применение новых способов выделения сульфата хитозана для упрощения технологического процесса его получения / К.Э. Будовская и [др] // Химические волокна. – 1995. - №5. – С.31-34.
39. Базт, М.Р. Свойства разбавленных растворов карбоксиметилового эфира хитозана / М.Р. Базт и [др] // Высокомолекулярные соединения. – 1990. – Т.32А. - №4. – С.805-809.
40. Енгибарян, Л.Г. Получение новых водорастворимых производных хитозана / Л.Г. Енгибарян и [др] // Химические волокна. – 2005. - №4. – С.41-44.
41. Васнев, В.А. Синтез гребнеобразных производных хитина и хитозана / В.А. Васнев и [др] // Пластические массы. – 2002. - №10. – С.29-30.
| Программа для поступающих в вузы (ответы) | |
|
Программа по химии для абитуриентов Предмет химии. Явления химические и физические. Атомно-молекулярное учение. Атомы. Молекулы. Молекулярное и ... Отношение полимеров к нагреванию, действию растворов кислот и щелочей. Концентрированные кислоты и концентрированный раствор хлорида цинка также растворяет целлюлозу, но при этом происходит ее частичный распад (гидролиз), сопровождающийся уменьшением ... |
Раздел: Рефераты по химии Тип: реферат |
| Общая и неорганическая химия | |
|
Квантово-механическая модель атома. Квантовые числа. Атомные орбитали. Порядок заполнения орбиталей электронами Теория строения атома основана на ... При изучении свойств растворов электролитов (кислоты, щелочи, соли) было обнаружено, что этим растворам присущи все основные свойства растворов неэлектролитов, такие, как понижение ... Это обусловлено образованием на поверхности металла защитной пленки труднорастворимого сульфата свинца PbS04, который затрудняет контакт металла с раствором кислоты. |
Раздел: Рефераты по химии Тип: учебное пособие |
| Полимераналогичные превращения хитозана | |
|
СОДЕРЖАНИЕ ВВЕДЕНИЕ РЕАКЦИИ ДЕСТРУКЦИИ ХИТОЗАНА ГИДРОЛИЗ ОКИСЛЕНИЕ ЩЕЛОЧНАЯ ДЕСТРУКЦИЯ, НЕ СОПРОВОЖДАЮЩАЯСЯ ОКИСЛЕНИЕМ ДРУГИЕ ТИПЫ ДЕСТРУКЦИИ РЕАКЦИИ ... Глюкозидная связь между элементарными звеньями в молекуле хитозана достаточно устойчива к щелочам и не устойчива к действию кислот. хитозан растворим в концентрированных ... Алкоголят хитозана, не содержащий избытка щелочи, был получен обработкой Хитозана раствором натрия в жидком аммиаке или путем обменной реакции хитозана с алкоголятами натрия. |
Раздел: Рефераты по химии Тип: курсовая работа |
| Разработка источников диффузионного легирования для производства ... | |
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ Херсонский государственный технический университет Кафедра Физической электроники и энергетики ПОЯСНИТЕЛЬНАЯ ... Такое резкое снижение температуры формирования стекловидных пленок из растворов обусловлено применением растворов, в которых будущая твердая фаза находится в состоянии молекулярной ... 2. Группа химически опасных факторов: а) химические жидкости, например, кислоты (HCI, HNO3, HF), щелочи (KOH, NaOH) и другие вещества; б) горючие и легковоспламеняющиеся вещества ... |
Раздел: Промышленность, производство Тип: дипломная работа |
| Понятие о пищевых добавках и их характеристика | |
|
I. ПОНЯТИЕ О ПИЩЕВЫХ ДОБАВКАХ И ИХ ХАРАКТЕРИСТИКА В соответствии с действующим в нашей стране санитарным законодательством под термином "пищевые ... Безусловно допустимая доза бензойной кислоты для человека составляет до 5 мг, условно допустимая - 5 -10 мг на 1 кг массы. Приборы и реактивы: фотоэлектрокалориметр, редукционная колонка с губчатым кадмием, CdSO4 20%, цинк металлический гранулированный, 0,14 н NaOH, ZnSO4 0,45%-ый, 2,5% NH4OH, 0,1 н ... |
Раздел: Рефераты по кулинарии Тип: курсовая работа |